二硫键稳定的IL15-IL15Rα复合物及其应用的制作方法
二硫键稳定的il15-il15r
α
复合物及其应用
技术领域
1.本发明涉及生物技术领域,特别涉及一种二硫键稳定的il15-il15rα复合物及其应用。
背景技术:
2.白介素15即白细胞介素-15(interleukin-15,il-15)是一种具有il2功能的细胞因子,可以刺激免疫细胞(如t细胞、nk细胞)的增殖,并维持这些免疫细胞在血液中的正常生长。但和il2这一免疫细胞因子通常由t细胞/nk细胞刺激后产生不同,il15是由非免疫效应细胞并分布在大批机体组织细胞而分泌的,这些组织细胞包括成纤维细胞、角质化细胞、内皮细胞等。而血液中的单核细胞、巨噬细胞、树突状细胞这些具有抗原加工功能的细胞也可分泌il15(anderson dm.et al.;jbc 270:29862,1995)。血液中这类细胞同时也表达与il15高亲和力结合的il15受体,一旦形成复合物后,可以通过与表达il2/il2ra共享的il2rβ/rγ的免疫细胞结合,从而刺激免疫细胞。这种il15/il15ra可以以可溶性蛋白的形式或以表达在细胞表面的膜结合蛋白的形式刺激t细胞或nk细胞。前者称作正式刺激,后者称作反式刺激,而反式刺激是il15细胞因子的主要刺激形式(dubois s.et al.;immunity,17:537,2002)。
3.鉴于il15/il15ra的反式刺激功能,研究者将这对分子共表达后用于刺激免疫系统。早在2004年miranda carus等使用il15ra-fc融合蛋白中和il15从而抑制风湿性关节炎的t细胞活化(miranda carus et al.;ji 173:1463,2004)。2006年根据上述思路制备出il15/il15ra-fc分子,用于在活体中刺激免疫细胞,最大限度发挥il15的作用(thomas a et al.;ji 177:2006)。mortier证明采用il15ra中的sushi部分和il15结合,形成融合蛋白可结合il15β/γ复合体而发挥作用(mortier e et al.;jbc 281:1612,2006)。
4.虽然早在2004年il15ra的fc融合蛋白就被用于科学研究中,而wong h及其领导的团队通过将il15中的72位的氨基酸n突变为d,使其获得和il15ra-fc更强的亲和力,用于制备出调节免疫功能的广谱药物alt-803,特别是增强t细胞或nk细胞的功能。美国专利us10501043披露了在il15和il15ra-fc蛋白之间突变出二硫键的方式来增加il15和il15ra-fc复合物的稳定性,虽然这些二硫键可使il15和il15ra-fc之间形成二硫键,但最终产物均不优于野生的il15和il15ra-fc复合物,该发明专利最后保护了使用il15及il15ra-fc结合更佳的非二硫键形式的突变(il15三突变d30n/e64q/n65d),用于后续药物的开发。无独有偶,hu等人采用il15与其受体的sushi-fc融合蛋白的复合物为基本结构,设计出数对在il-15和il-15ra的fc融合蛋白间形成新的二硫键的突变体,根据其表达高低、增强nk细胞的增殖能力、是否适合成药、药代动力学以及药理特性,发现il15l52c突变与il15sushi-fc的sushi部分的s40c突变所形成的fc融合蛋白可诱导nk细胞增殖,并可抑制肿瘤细胞生长(hu qy.et al.;sci.rep 8:7675,2018)。
5.鉴于已报道的有价值的经过突变形式获得的il5与il5r二硫键的筛选和验证,均是通过由il5分子与其fc融合蛋白的受体形式而产生的,通常以二聚体形式存在,产生的二
硫键不一定适用于两个单体分子之间形式复合物的需要。
技术实现要素:
6.本发明提供了一种二硫键稳定的il15-il15rα复合物及其应用。
7.第一方面,本发明要求保护一种il15-il15rα复合物突变体。
8.本发明所提供的il15-il15rα复合物突变体由a’)和b’)通过二硫键结合而成:
9.a’)il15rα突变体或者il-15rαsushi结构域的突变体;
10.b’)il15突变体;
11.在所述a’)中,存在位于il15rαsushi结构域上的突变位点a;
12.在所述b’)中,存在突变位点b;
13.所述突变位点a和所述突变位点b处的两个氨基酸的中心碳原子间距离小于所述突变位点a和所述突变位点b处的氨基酸均突变为半胱氨酸,进而形成二硫键。
14.在本发明的具体实施方式中,所述突变位点a和所述突变位点b处的两个氨基酸的中心碳原子间距离小于
15.进一步地,所述突变位点a和所述突变位点b可为如下任一组合:
16.(a1)所述突变位点a为将野生型il15rαsushi结构域的氨基酸序列的第37位的a突变为c(记为sushi-a37c);所述突变位点b为将野生型il15的氨基酸序列的第45位的l突变为c(记为il15-l45c);
17.(a2)所述突变位点a为将野生型il15rαsushi结构域的氨基酸序列的第37位的a突变为c(记为sushi-a37c);所述突变位点b为将野生型il15的氨基酸序列的第46位的e突变为c(记为il15-e46c);
18.(a3)所述突变位点a为将野生型il15rαsushi结构域的氨基酸序列的第38位的g突变为c(记为sushi-g38c);所述突变位点b为将野生型il15的氨基酸序列的第45位的l突变为c(记为il15-l45c);
19.(a4)所述突变位点a为将野生型il15rαsushi结构域的氨基酸序列的第38位的g突变为c(记为sushi-g38c);所述突变位点b为将野生型il15的氨基酸序列的第46位的e突变为c(记为il15-e46c);
20.(a5)所述突变位点a为将野生型il15rαsushi结构域的氨基酸序列的第38位的g突变为c(记为sushi-g38c);所述突变位点b为将野生型il15的氨基酸序列的第48位的q突变为c(记为il15-q48c);
21.(a6)所述突变位点a为将野生型il15rαsushi结构域的氨基酸序列的第38位的g突变为c(记为sushi-g38c);所述突变位点b为将野生型il15的氨基酸序列的第49位的v突变为c(记为il15-v49c);
22.(a7)所述突变位点a为将野生型il15rαsushi结构域的氨基酸序列的第39位的t突变为c(记为sushi-t39c);所述突变位点b为将野生型il15的氨基酸序列的第49位的v突变为c(记为il15-v49c);
23.(a8)所述突变位点a为将野生型il15rαsushi结构域的氨基酸序列的第40位的s突变为c(记为sushi-s40c);所述突变位点b为将野生型il15的氨基酸序列的第49位的v突变为c(记为il15-v49c);
24.(a9)所述突变位点a为将野生型il15rαsushi结构域的氨基酸序列的第42位的l突变为c(记为sushi-l42c);所述突变位点b为将野生型il15的氨基酸序列的第53位的e突变为c(记为il15-e53c)。
25.其中,所述野生型il15rαsushi结构域的氨基酸序列具体如seq id no.1所示;所述野生型il15的氨基酸序列具体如seq id no.7所示。
26.更进一步地,所述il15-il15rα复合物突变体可为如下任一:
27.(a1)由仅带有前文(a1)中所述突变位点a的il-15rαsushi结构域的突变体,和仅带有前文(a1)中所述突变位点b的il-15突变体结合而成;
28.(a2)由仅带有前文(a2)中所述突变位点a的il-15rαsushi结构域的突变体,和仅带有前文(a2)中所述突变位点b的il-15突变体结合而成;
29.(a3)由仅带有前文(a3)中所述突变位点a的il-15rαsushi结构域的突变体,和仅带有前文(a3)中所述突变位点b的il-15突变体结合而成;
30.(a4)由仅带有前文(a4)中所述突变位点a的il-15rαsushi结构域的突变体,和仅带有前文(a4)中所述突变位点b的il-15突变体结合而成;
31.(a5)由仅带有前文(a5)中所述突变位点a的il-15rαsushi结构域的突变体,和仅带有前文(a5)中所述突变位点b的il-15突变体结合而成;
32.(a6)由仅带有前文(a6)中所述突变位点a的il-15rαsushi结构域的突变体,和仅带有前文(a6)中所述突变位点b的il-15突变体结合而成;
33.(a7)由仅带有前文(a7)中所述突变位点a的il-15rαsushi结构域的突变体,和仅带有前文(a7)中所述突变位点b的il-15突变体结合而成;
34.(a8)由仅带有前文(a8)中所述突变位点a的il-15rαsushi结构域的突变体,和仅带有前文(a8)中所述突变位点b的il-15突变体结合而成;
35.(a9)由仅带有前文(a9)中所述突变位点a的il-15rαsushi结构域的突变体,和仅带有前文(a9)中所述突变位点b的il-15突变体结合而成。
36.更加具体地,在本发明的一个实施例中,所述il15-il15rα复合物突变体具体为如下任一:
37.(a1’)由氨基酸序列如seq id no.2所示的il-15rαsushi结构域的突变体,和氨基酸序列如seq id no.8所示的il-15突变体结合而成(对应于实施例中的突变体3745);
38.(a2’)由氨基酸序列如seq id no.2所示的il-15rαsushi结构域的突变体,和氨基酸序列如seq id no.9所示的il-15突变体结合而成(对应于实施例中的突变体3746);
39.(a3’)由氨基酸序列如seq id no.3所示的il-15rαsushi结构域的突变体,和氨基酸序列如seq id no.8所示的il-15突变体结合而成(对应于实施例中的突变体3845);
40.(a4’)由氨基酸序列如seq id no.3所示的il-15rαsushi结构域的突变体,和氨基酸序列如seq id no.9所示的il-15突变体结合而成(对应于实施例中的突变体3846);
41.(a5’)由氨基酸序列如seq id no.3所示的il-15rαsushi结构域的突变体,和氨基酸序列如seq id no.10所示的il-15突变体结合而成(对应于实施例中的突变体3848);
42.(a6’)由氨基酸序列如seq id no.3所示的il-15rαsushi结构域的突变体,和氨基酸序列如seq id no.11所示的il-15突变体结合而成(对应于实施例中的突变体3849);
43.(a7’)由氨基酸序列如seq id no.4所示的il-15rαsushi结构域的突变体,和氨基
酸序列如seq id no.11所示的il-15突变体结合而成(对应于实施例中的突变体3949);
44.(a8’)由氨基酸序列如seq id no.5所示的il-15rαsushi结构域的突变体,和氨基酸序列如seq id no.11所示的il-15突变体结合而成(对应于实施例中的突变体4049);
45.(a9’)由氨基酸序列如seq id no.6所示的il-15rαsushi结构域的突变体,和氨基酸序列如seq id no.12所示的il-15突变体结合而成(对应于实施例中的突变体4253)。
46.第二方面,本发明要求保护一种带有抗原结合域的il15-il15rα复合物突变体。
47.本发明所提供的带有抗原结合域的il15-il15rα复合物突变体由多肽链a和多肽链b结合而成:
48.所述多肽链a可为在前文第一方面中所述的a’)的氨基端和/或羧基端连接抗原结合域后得到的多肽链;
49.所述多肽链b可为在前文第一方面中所述的b’)的氨基端和/或羧基端连接抗原结合域后得到的多肽链;
50.所述多肽链a和所述多肽链b通过所述a’)和所述b’)相结合。
51.在所述多肽链a中,连接于氨基端和羧基端的抗原结合域均可相同也可不同。在所述多肽链b中,连接于氨基端和羧基端的抗原结合域均可相同也可不同。所述多肽链a中连接的抗原结合域和在所述多肽链b中连接的抗原结合域既可相同也可不同。
52.进一步地,所述带有抗原结合域的il15-il15rα复合物突变体可为如下任一:
53.(b1)所述多肽链a为在前文第一方面中所述的il-15rαsushi结构域的突变体的n端连接anticd3(如抗cd3的scfv)后得到的多肽链;且所述多肽链b为在前文第一方面中所述的il-15突变体的n端连接anticd19(如抗cd19的scfv)后得到的多肽链;
54.(b2)所述多肽链a为在前文第一方面中所述的il-15rαsushi结构域的突变体的n端连接anticd19(如抗cd19的scfv),c端连接pd1的胞外区后得到的多肽链;且所述多肽链b为在前文第一方面中所述的il-15突变体的n端连接anticd3(如抗cd3的scfv)后得到的多肽链。
55.更进一步地,所述(b1)可为如下任一(对应实施例2中的9个anticd19-il15/anticd3-sushi相关突变体):
56.(b1)所述多肽链a的氨基酸序列与将seq id no.15所示的核苷酸序列翻译而成的氨基酸序列相同;且所述多肽链b的氨基酸序列与将seq id no.20所示的核苷酸序列翻译而成的氨基酸序列相同;
57.(b2)所述多肽链a的氨基酸序列与将seq id no.15所示的核苷酸序列翻译而成的氨基酸序列相同;且所述多肽链b的氨基酸序列与将seq id no.21所示的核苷酸序列翻译而成的氨基酸序列相同;
58.(b3)所述多肽链a的氨基酸序列与将seq id no.16所示的核苷酸序列翻译而成的氨基酸序列相同;且所述多肽链b的氨基酸序列与将seq id no.20所示的核苷酸序列翻译而成的氨基酸序列相同;
59.(b4)所述多肽链a的氨基酸序列与将seq id no.16所示的核苷酸序列翻译而成的氨基酸序列相同;且所述多肽链b的氨基酸序列与将seq id no.21所示的核苷酸序列翻译而成的氨基酸序列相同;
60.(b5)所述多肽链a的氨基酸序列与将seq id no.16所示的核苷酸序列翻译而成的
氨基酸序列相同;且所述多肽链b的氨基酸序列与将seq id no.22所示的核苷酸序列翻译而成的氨基酸序列相同;
61.(b6)所述多肽链a的氨基酸序列与将seq id no.16所示的核苷酸序列翻译而成的氨基酸序列相同;且所述多肽链b的氨基酸序列与将seq id no.23所示的核苷酸序列翻译而成的氨基酸序列相同;
62.(b7)所述多肽链a的氨基酸序列与将seq id no.17所示的核苷酸序列翻译而成的氨基酸序列相同;且所述多肽链b的氨基酸序列与将seq id no.23所示的核苷酸序列翻译而成的氨基酸序列相同;
63.(b8)所述多肽链a的氨基酸序列与将seq id no.18所示的核苷酸序列翻译而成的氨基酸序列相同;且所述多肽链b的氨基酸序列与将seq id no.23所示的核苷酸序列翻译而成的氨基酸序列相同;
64.(b9)所述多肽链a的氨基酸序列与将seq id no.19所示的核苷酸序列翻译而成的氨基酸序列相同;且所述多肽链b的氨基酸序列与将seq id no.24所示的核苷酸序列翻译而成的氨基酸序列相同。
65.更进一步地,所述(b2)可为:所述多肽链a的氨基酸序列与将seq id no.27所示的核苷酸序列翻译而成的氨基酸序列相同;且所述多肽链b的氨基酸序列与将seq id no.28所示的核苷酸序列翻译而成的氨基酸序列相同(对应实施例5中的trite anti-cd19(3845)突变体)。
66.第三方面,本发明要求保护一种带有抗原结合域和il15-il15rα复合物突变体的嵌合抗原受体。
67.本发明所提供的所述嵌合抗原受体为嵌合抗原受体i或嵌合抗原受体ii。
68.所述嵌合抗原受体i可为将前文第二方面中的所述多肽链a和所述多肽链b通过hinge and tm and ics连接而成的一条完整多肽链。
69.所述嵌合抗原受体ii与前文第二方面中所述的带有抗原结合域的il15-il15rα复合物突变体相比,差别仅在于在所述多肽链a或所述多肽链b的一端顺次连接上了跨膜结构域和胞内信号传导结构域。
70.进一步地,在所述嵌合抗原受体i中,所述多肽链a为在前文第一方面中所述的il-15rα-sushi结构域的突变体的n端连接anti-egfr后得到的多肽链;所述多肽链b为在前文第一方面中所述的所述il-15突变体的n端连接pd1的胞外区后得到的多肽链;所述多肽链a和所述多肽链b通过hinge and tm and ics连接成一条完整多肽链。
71.更进一步地,所述嵌合抗原受体i的氨基酸序列与将seq id no.29所示的核苷酸序列翻译而成的氨基酸序列相同(对应实施例8中的tricar anti-egfr(3845)突变体)。
72.第四方面,本发明要求保护遗传材料或试剂盒。
73.本发明所提供的遗传材料为核酸分子或含有所述核酸分子的重组载体、表达盒、重组菌、重组病毒或重组细胞。
74.所述核酸分子为编码前文所述il15-il15rα复合物突变体、所述带有抗原结合域的il15-il15rα复合物突变体或所述嵌合抗原受体的核酸分子。
75.进一步地,所述核酸分子可为如下(a)或(b):
76.(a)编码前文第二方面中所述带有抗原结合域的il15-il15rα复合物突变体的核
酸分子,可为如下任一:
77.(a-1)编码所述多肽链a的核苷酸序列如seq id no.15所示;且编码所述多肽链b的核苷酸序列如seq id no.20所示;
78.(a-2)编码所述多肽链a的核苷酸序列如seq id no.15所示;且编码所述多肽链b的核苷酸序列如seq id no.21所示;
79.(a-3)编码所述多肽链a的核苷酸序列如seq id no.16所示;且编码所述多肽链b的核苷酸序列如seq id no.20所示;
80.(a-4)编码所述多肽链a的核苷酸序列如seq id no.16所示;且编码所述多肽链b的核苷酸序列如seq id no.21所示;
81.(a-5)编码所述多肽链a的核苷酸序列如seq id no.16所示;且编码所述多肽链b的核苷酸序列如seq id no.22所示;
82.(a-6)编码所述多肽链a的核苷酸序列如seq id no.16所示;且编码所述多肽链b的核苷酸序列如seq id no.23所示;
83.(a-7)编码所述多肽链a的核苷酸序列如seq id no.17所示;且编码所述多肽链b的核苷酸序列如seq id no.23所示;
84.(a-8)编码所述多肽链a的核苷酸序列如seq id no.18所示;且编码所述多肽链b的核苷酸序列如seq id no.23所示;
85.(a-9)编码所述多肽链a的核苷酸序列如seq id no.19所示;且编码所述多肽链b的核苷酸序列如seq id no.24所示;
86.(a-10)编码所述多肽链a的核苷酸序列如seq id no.27所示;且编码所述多肽链b的核苷酸序列如seq id no.28所示;
87.其中,(a-1)至(a-9)对应实施例2中的9个anticd19-il15/anticd3-sushi相关突变体,(a-10)对应实施例5中的triteanticd19(3845)突变体。
88.(b)编码前文第三方面中所述嵌合抗原受体的核酸分子,为编码所述嵌合抗原受体i的核酸分子,其核苷酸序列具体可如seq id no.29所示(对应实施例8中的tricar anti egfr(3845)突变体)。
89.在本发明中,所述细胞可为原核细胞、真核细胞或哺乳动物细胞。所述哺乳动物细胞具体可为人类细胞。所述人类细胞具体可为免疫细胞。所述免疫细胞具体可为t细胞或nk细胞。
90.本发明所提供的试剂盒含有前文所述il15-il15rα复合物突变体、所述带有抗原结合域的il15-il15rα复合物突变体、所述嵌合抗原受体或所述遗传材料。
91.第五方面,本发明要求保护前文所述il15-il15rα复合物突变体、所述带有抗原结合域的il15-il15rα复合物突变体、所述嵌合抗原受体或所述遗传材料在如下任一中的应用:
92.(c1)免疫治疗,或制备用于免疫治疗的产品;
93.(c2)激活免疫细胞,或制备用于激活免疫细胞的产品;
94.(c3)免疫细胞培养与增殖,或制备用于免疫细胞培养与增殖的产品;
95.(c4)免疫检测,或制备用于免疫检测的产品;
96.(c5)抑制或杀伤表达抗原的靶细胞,或制备用于抑制或杀伤表达抗原的靶细胞的
产品。
97.其中,所述免疫细胞具体可为t细胞或nk细胞。
98.本发明通过il15与il15ra的分子结构设计出通过突变而形成的二硫键,以il15和il15rasushi之间氨基酸的中心碳原子间距离最近的氨基酸分子为重要指标进行突变使其形成二硫键,并用各自自行不会形成二聚体的il15及融合蛋白和il5ra融合蛋白(如单链抗体,scfv)共表达后,筛选出合适的突变对二硫键。结果表明选择出的最佳突变对的特征通常以il15氨基酸与il15rasushi氨基酸中心碳原子距离在以下的氨基酸形成。本发明意外发现以前采用il15与il15ra-fc融合蛋白测试的一些不能形成二硫键或形成不稳定的二硫键突变体的,在本发明实验的形式下不但能形成稳定的二硫键,而且可以用来拼接不同功能的蛋白质分子形成具有生物学功能的新的多功能蛋白分子。
附图说明
99.图1为sushi/il15复合体的结构。
100.图2为anticd19-il15/anticd3-sushi蛋白分子基因表达框架。a:anticd19-il15基因表达框架;b:anticd3-sushi基因表达框架。
101.图3为anticd19-il15/anticd3-sushi蛋白分子表达纯化非还原sds-page图。a,泳道1-2:anticd19-il15/anticd3-sushi野生型纯化蛋白;泳道4-5:anticd19-il15/anticd3-sushi的3745突变体纯化蛋白;泳道6-7:anticd19-il15/anticd3-sushi的3845突变体纯化蛋白;泳道3:蛋白marker,分子量自上至下依次为:160kd、120kd、100kd、70kd、50kd、40kd、30kd、25kd。b;泳道2-3:anticd19-il15/anticd3-sushi的3848突变体纯化蛋白;泳道4-5:anticd19-il15/anticd3-sushi的4049突变体纯化蛋白;泳道6-7:anticd19-il15/anticd3-sushi的4253突变体纯化蛋白;泳道1:蛋白marker,分子量自上至下依次为:160kd、120kd、100kd、70kd、50kd、40kd、30kd、25kd。
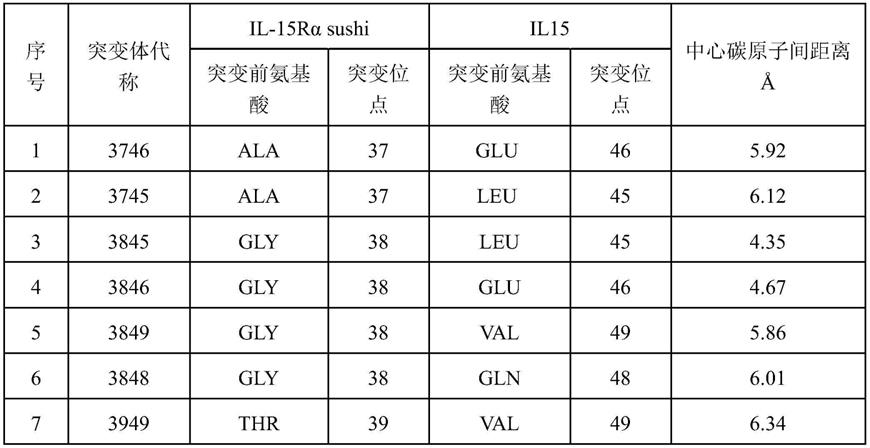
102.图4为anticd19-il15/anticd3-sushi野生型及其3745、3845、3848、4049、4253突变体蛋白分子杀伤结果。a:阴性对照蛋白杀伤malme-3m-cd19-luc和malme-3m-luc;b:anticd19-il15/anticd3-sushi野生型蛋白杀伤malme-3m-cd19-luc和malme-3m-luc;c:anticd19-il15/anticd3-sushi 3745突变体白杀伤malme-3m-cd19-luc和malme-3m-luc;d:anticd19-il15/anticd3-sushi 3845突变体白杀伤malme-3m-cd19-luc和malme-3m-luc;e:anticd19-il15/anticd3-sushi 3848突变体白杀伤malme-3m-cd19-luc和malme-3m-luc;f:anticd19-il15/anticd3-sushi 4049突变体白杀伤malme-3m-cd19-luc和malme-3m-luc;g:anticd19-il15/anticd3-sushi 4253突变体白杀伤malme-3m-cd19-luc和malme-3m-luc。
103.图5为triteanticd19(3845)突变体蛋白分子基因表达框架。a:anticd19-sushi-pd1基因表达框架;b:anticd3-il15基因表达框架。
104.图6为triteanticd19(3845)突变体蛋白分子sds-page图。泳道1-4:triteanticd19(3845)突变体蛋白分子还原sds-page;泳道6-9:triteanticd19(3845)突变体蛋白分子非还原sds-page;泳道5:蛋白marker,分子量自上至下依次为:160kd、120kd、100kd、70kd、50kd、40kd、30kd、25kd。
105.图7为triteanticd19(3845)突变体蛋白分子杀伤结果。a:阴性对照蛋白杀伤
malme-3m-cd19-luc和malme-3m-luc;b:triteanticd19(3845)突变体蛋白杀伤malme-3m-cd19-luc和malme-3m-luc。
106.图8为triteanticd19(3845)突变体对pbmc细胞增殖影响的流式图。a1,day0的pbmc细胞未染色;a2,day0的pbmc细胞cfse染色;b1,day2的pbmc细胞cfse染色添加il2(300iu/ml);b2,day2的pbmc细胞cfse染色添加okt3(100ng/ml);b3,day2的pbmc细胞cfse染色添加il2(300iu/ml)、okt3(100ng/ml);b4,day2的pbmc细胞cfse染色添加trite anticd19(200ng/ml);b5,day2的pbmc细胞cfse染色添加不添加任何蛋白;b6,day2的pbmc细胞未染色添加il2(300iu/ml)、okt3(100ng/ml)。c1,day3的pbmc细胞cfse染色添加il2(300iu/ml);c2,day3的pbmc细胞cfse染色添加okt3(100ng/ml);c3,day3的pbmc细胞cfse染色添加il2(300iu/ml)、okt3(100ng/ml);c4,day3的pbmc细胞cfse染色添加trite anticd19(200ng/ml);c5,day3的pbmc细胞cfse染色添加不添加任何蛋白;c6,day3的pbmc细胞未染色添加il2(300iu/ml)、okt3(100ng/ml)。d1,day5的pbmc细胞cfse染色添加il2(300iu/ml);d2,day5的pbmc细胞cfse染色添加okt3(100ng/ml);d3,day5的pbmc细胞cfse染色添加il2(300iu/ml)、okt3(100ng/ml);d4,day5的pbmc细胞cfse染色添加trite anticd19(200ng/ml);d5,day5的pbmc细胞cfse染色添加不添加任何蛋白;d6,day5的pbmc细胞未染色添加il2(300iu/ml)、okt3(100ng/ml)。e1,day7的pbmc细胞cfse染色添加il2(300iu/ml);e2,day7的pbmc细胞cfse染色添加okt3(100ng/ml);e3,day7的pbmc细胞cfse染色添加il2(300iu/ml)、okt3(100ng/ml);e4,day7的pbmc细胞cfse染色添加trite anticd19(200ng/ml);e5,day7的pbmc细胞cfse染色添加不添加任何蛋白;e6,day7的pbmc细胞未染色添加il2(300iu/ml)、okt3(100ng/ml)。
107.图9为triteanticd19(3845)突变体激活pbmc细胞cd69表达流式图。a,pbmc对照;b,pbmc加入1
×
106/ml的raji-gfp-luc细胞;c,pbmc加入1
×
106/ml的raji-gfp-luc细胞,添加1ng/ml的triteanticd19(3845)突变体蛋白;d,pbmc加入1
×
106/ml的raji-gfp-luc细胞,添加10ng/ml的triteanticd19(3845)突变体蛋白;e,pbmc加入1
×
106/ml的raji-gfp-luc细胞,添加100ng/ml的triteanticd19(3845)突变体蛋白。
108.图10为tricarantiegfr(3845)突变体基因表达框架。
109.图11为tricarantiegfr(3845)-t感染效率检测。a,t细胞阴性对照;b,tricarantiegfr(3845)-t感染效率。
110.图12为tricarantiegfr(3845)-t细胞杀伤实验结果。
具体实施方式
111.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
112.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
113.实施例1、anticd19-il15/anticd3-sushi中sushi/il15双突变体突变选择
114.在蛋白质中形成的二硫键的两个半胱氨酸的中心碳原子间距离多都小于本发明根据il-15rαsushi结构域和il5复合体(以下简称sushi/il15复合体)的结构,如图1所示,选择中心碳原子间距离小于的9对突变,将相应的氨基酸突变为cys。sushi/il15复合体定点突变位点氨基酸序列如表1所示。
115.表1 sushi/il15复合体双突变体突变选择
[0116][0117][0118]
其中,il-15rαsushi氨基酸序列为seq id no.1;
[0119]
il-15rαsushi-a37c氨基酸序列为seq id no.2;
[0120]
il-15rαsushi-g38c氨基酸序列为seq id no.3;
[0121]
il-15rαsushi-t39c氨基酸序列为seq id no.4;
[0122]
il-15rαsushi-s40c氨基酸序列为seq id no.5;
[0123]
il-15rαsushi-l42c氨基酸序列为seq id no.6;
[0124]
il15氨基酸序列为seq id no.7;
[0125]
il15-l45c氨基酸序列为seq id no.8;
[0126]
il15-e46c氨基酸序列为seq id no.9;
[0127]
il15-q48c氨基酸序列为seq id no.10;
[0128]
il15-v49c氨基酸序列为seq id no.11;
[0129]
il15-e53c氨基酸序列为seq id no.12。
[0130]
实施例2、anticd19-il15/anticd3-sushi及其双突变体载体构建
[0131]
1、构建pcdna3.1-anticd19-il15和pcdna3.1-anticd3-sushi表达质粒:合成anticd19-il15(其核苷酸序列为seq id no.13,其中含顺次相连的抗cd19的scfv和野生型il15的编码基因)和anticd3-sushi(其核苷酸序列为seq id no.14,其中含有顺次相连的抗cd3的scfv和野生型il-15rαsushi结构域编码基因)基因,分别在5’端添加hind iii酶切位点,在3’端添加xba i酶切位点(图2为anticd19-il15/anticd3-sushi蛋白分子基因表达框架图)。hind iii和xba i限制性内切酶双酶切pcdna3.1载体和合成基因anticd19-il15和anticd3-sushi,切胶回收pcdna3.1载体及anticd19-il15和anticd3-sushi片段,t4连接酶分别将anticd19-il15和anticd3-sushi片段与pcdna3.1载体连接,连接产物转化trans1-t1感受态。最终得到重组载体pcdna3.1-anticd19-il15和pcdna3.1-anticd3-sushi,并经测序验证正确。
[0132]
2、anticd19-il15/anticd3-sushi双突变体载体构建:合成定点突变引物如表2所
示,以步骤1中得到的重组载体pcdna3.1-anticd19-il15和pcdna3.1-anticd3-sushi为模板,采用表2中相应的引物定点突变扩增得到anticd3-sushi a37c(其核苷酸序列为seq id no.15),anticd3-sushi g38c(其核苷酸序列为seq id no.16),anticd3-sushi t39c(其核苷酸序列为seq id no.17),anticd3-sushi s40c(其核苷酸序列为seq id no.18),anticd3-sushi l42c(其核苷酸序列为seq id no.19);anticd19-il15 l45c(其核苷酸序列为seq id no.20),anticd19-il15 e46c(其核苷酸序列为seq id no.21),anticd19-il15 q48c(其核苷酸序列为seq id no.22),anticd19-il15 v49c(其核苷酸序列为seq id no.23),anticd19-il15 e53c(其核苷酸序列为seq id no.24)。胶回收并纯化,dpn i消化2h,转化trans1-t1感受态。最终得到系列含有相应突变位点的重组载体,并经测序验证正确。
[0133]
表2 sushi/il5双突变体定点突变引物
[0134]
[0135][0136]
实施例3、anticd19-il15/anticd3-sushi及其突变体表达纯化
[0137]
1、37℃、8%co2、120rpm培养293f(invitrogen)至细胞密度为1
×
106cell/ml。
[0138]
2、将实施例2中构建的pcdna3.1-anticd19-il15和pcdna3.1-anticd3-sushi重组
载体使用pei共转染到上述步骤1的细胞中,转染质粒浓度为各0.5mg/l,pei浓度为3mg/l。37℃,8%co2、120rpm培养5-6天。
[0139]
3、4000rpm离心上述步骤2的培养产物,收集培养基上清液,50ml上清液加入100μl capto l beads,常温旋转孵育1h,过柱截留capto l beads,1ml pbs洗涤capto l beads 3次,700μl ph2.6-3.0 0.1mgly-hcl洗脱液(7.5g gly溶于1l蒸馏水中,用1m盐酸调至ph2.6-3.0)洗脱,收集洗脱液。
[0140]
4、非还原sds-page检测收集蛋白(图3),可以看出,得到约50kd和40kd的目的蛋白(与预期大小相符),即为anticd19-il15/anticd3-sushi蛋白的两条肽链,但没有显示更大分子量的条带。
[0141]
5、使用相同的方法表达纯化anticd19-il15/anticd3-sushi的3745、3845、3848、4049、4253突变体蛋白质。非还原sds-page检测收集蛋白(图3),可以看出,均显示有约100kd的目的条带。
[0142]
图3结果显示:未经突变的野生型anticd19-il15/anticd3-sushi复合物中anticd19-il15肽链和anticd3-sushi肽链仅仅是依靠配体-受体间的非共价键结合的,经非还原sds-page检测显示得到约50kd和40kd的目的蛋白,但没有显示更大分子量的条带。而经过突变的anticd19-il15/anticd3-sushi的3745、3845、3848、4049、4253突变体蛋白质两条肽链间会形成二硫键将两条肽链连接在一起,经非还原sds-page检测,两条肽链不分离,均显示了约100kd的anticd19-il15/anticd3-sushi突变体复合物条带。
[0143]
实施例4、anticd19-il15/anticd3-sushi突变体介导t细胞体外杀伤cd19
+
靶细胞实验验证
[0144]
1、将1
×
104靶细胞malme-3m-cd19-luc(将来自于atcc的malme-3m细胞中转染cd19抗原(其核酸序列为seq id no.25)与luc基因(其核酸序列为seq id no.26),使其表达cd19抗原与luc基因,得到细胞malme-3m-cd19-luc)(100μl)和malme-3m-luc(将来自于atc的malme-3m细胞中转染luc基因(其核酸序列为seq id no.26)(100μl)铺中于96孔板内,37℃、5%co2培养18-20h。
[0145]
2、逐级稀释实施例3得到的目的蛋白anticd19-il15/anticd3-sushi及其突变体3745、3845、3848、4049、4253突变体蛋白质至浓度为50、5、0.5、0.05、0.005ng/μl;
[0146]
实验组:分别向50μl的1
×
105的t细胞(正常人外周血密度梯度离心,取富含单个核细胞的白膜层,100ng/m lokt3,300iu/ml il2刺激14天)中加入50、5、0.5、0.05、0.005ng实施例3得到的目的蛋白anticd19-il15/anticd3-sushi及其突变体3745、3845、3848、4049、4253突变体蛋白质,37℃孵育1-2h,得到与抗体孵育好的t细胞。
[0147]
阴性对照组:对该靶细胞无杀伤作用的双特异性对照抗体(negtive)(antiwt1-sushi-ucht1/pd1-il5蛋白其氨基酸序列为seq id no.30),向50μl的1
×
105的t细胞中分别加入50、5、0.5、0.05、0.005ng对照抗体,37℃孵育1-2h。
[0148]
3、将与抗体孵育好的t细胞50μl加入铺有靶细胞的96孔板中,37℃、5%co2培养20-24h。
[0149]
4、每孔加入50μl 2%triton裂解液,反复吹匀,静置5-10min,使细胞完全裂解,取50μl裂解液置于黑色96孔板中,加入50μl底物(300μg/ml luc水溶液与2mg/ml atp水溶液按照体积比为3:1混合)吹吸混匀,迅速测其荧光值。
anticd19(3845)突变体蛋白,okt3不补加。
[0165]
结果如图8所示。可以看出,triteanticd19(3845)突变体可以刺激pbmc细胞增殖与活化。其效果与添加okt3和il2实验组的相当。
[0166]
实施例7、triteanticd19(3845)突变体对pbmc细胞激活影响验证
[0167]
cd69是c-型凝集素受体家族的成员,也是nk细胞信号传导基因复合体家族的一员。它是t淋巴细胞激活后最早表达的表面抗原,当其表达后,可作为共刺激信号促进t细胞进一步的活化和增殖。cd69还可在nk细胞、巨噬细胞、中性和嗜酸性粒细胞上经诱导表达。
[0168]
1、将pbmc(正常人外周血密度梯度离心,取富含单个核细胞的白膜层)细胞5
×
106个重悬于4.5ml培养基中,将pbmc细胞悬液分装于24孔板中,每孔0.9ml,铺5个孔。向实验组四个孔中分别加入100μl的1
×
106/ml的raji-gfp-luc(将来自于atcc的raji细胞中转染gfp基因(其核酸序列为seq id no.31)和luc基因(其核酸序列为seq id no.26),使其表达gfp与luc基因,得到细胞raji-gfp-luc)细胞,同时添加0ng/ml、1ng/ml、10ng/ml、100ng/ml的实施例5中所得的triteanticd19(3845)突变体蛋白,阴性对照加入100μl培养基。
[0169]
2、37℃、5%co2培养24h,对照组与实验组各取500μl细胞悬液,1000rpm离心5min,弃去上清,加入50μl pbs溶液重悬。向对照组与实验组细胞悬液中加入2μl的anticd69 apc抗体,室温孵育30min。用600μl pbs溶液300g、5min离心漂洗2次。用200μl pbs重选,进行流式检测。
[0170]
结果如图9所示。可以看出,经triteanticd19(3845)突变体和肿瘤细胞刺激后,可以诱导pbmc细胞表面的cd69的表达,对pbmc细胞进行活化。
[0171]
实施例8、sushi/il5(3845)突变体在tricar-t中的应用
[0172]
1、构建tricarantiegfr(3845)突变体:核苷酸序列为seq id no.29(其中含有顺次相连的抗egfr的scfv、il-15rαsushi-g38c结构域、铰链区-跨膜区-胞内共刺激信号(hinge and tm and ics)、pd1的胞外区和il15-l45c的编码基因),参照实施例2的方法将这个片段构建到pcdna3.1载体中,得到tricarantiegfr(3845)质粒。tricarantiegfr(3845)突变体阅读框如图10所示。
[0173]
2、tricarantiegfr(3845)载体慢病毒包装与细胞感染
[0174]
1)将293t过夜培养至70%-80%密度,用于转染;将pcmv-vsv-g、pcmv-δr 8.91(pcmv-vsv-g与pcmv-δr 8.91为addgene产品,用于提供病毒外壳蛋白)和tricarantiegfr(3845)质粒按照各质粒质量比pcmv-vsv-g∶pcmv-δr 8.91∶tricarantiegfr(3845)=1∶3∶4,共同混合得到共转染质粒40μg;
[0175]
2)取两个15ml离心管分别标记管1、管2,管1加入上述步骤1)的共转染质粒并补充无血清dmem至1ml,管2加入1mg/ml的pei水溶液(pei为sigma产品货号gf70215825)120μl并补充无血清dmem至1ml,分别充分混匀后将管1漩涡振荡,同时将管2中pei逐滴加入管1中,得到质粒-pei混合液,将质粒-pei混合液在室温静置30min;将质粒-pei混合液加入20ml含10%fbs dmem,充分混匀后,加入到用于转染的293t中,切勿将细胞悬起,将转染后的细胞置于37℃、co2孵箱中过夜培养24h。将细胞培养液弃去,重新加入20ml含10%fbs dmem,并加入丁酸钠至终浓度10mm,37℃、co2孵箱过夜培养。
[0176]
3)48h、72h收集2次细胞培养上清,4000rpm,离心10min,0.45um滤器过滤上清,得到病毒原液。病毒原液添加1/5体积的质量百分含量为40%peg水溶液,混匀后4℃放置过
夜。第二天离心,4℃,2000g,45分钟,弃上清后用病毒原液1/30体积的t细胞完全培养基重悬病毒沉淀,得到30倍浓缩的tricarantiegfr(3845)病毒悬液。
[0177]
4)6
×
105的t细胞(t细胞为从健康献血者抽取的外周血中梯度离心分离pbmc并使用100ng/ml okt3、300iu il2刺激培养48h)分别用30倍的tricarantiegfr(3845)病毒重悬感染并添加8μg/ml polybrane(sigma,h9268-5g)、300iu il2转移到24孔板一个孔中,32℃,300g离心90分钟后转移到二氧化碳培养箱培养24h后重复感染,继续培养24h换液,37℃,co2孵箱继续培养48h后检测效率。
[0178]
5)分别取2
×
105个培养7天的t细胞和tricarantiegfr(3845)-t细胞,分别加入1.5μl pe conjugated anti-hil-15(r&d,货号ic2471p)冰上孵浴30min。离心去上清,用600μl pbs溶液300g、5min离心漂洗2次。用200ulpbs重选,进行流式检测。
[0179]
结果如图11所示。可以看出,tricarantiegfr(3845)在t细胞中表达效率约为6%(8.29%-2.34%)。
[0180]
3、tricarantiegfr(3845)-t杀伤egfr
+
细胞系验证。
[0181]
1)将1
×
104靶细胞u251-luc(u251细胞中转染luc基因(其核酸序列为seq id no.26),使其表达luc基因,得到细胞u251-luc)(100μl)铺中于96孔平板内,37℃、5%co2培养18-20h。
[0182]
2)按照效应细胞与靶细胞个数比为5:1、10:1、20:1比例分别加入效应细胞t细胞和tricarantiegfr(3845)-t细胞100μl/孔,37℃、5%co2培养20-24h。阴性对照只添加100μl的t细胞培养基。
[0183]
3)每孔加入50μl 2%triton裂解液,反复吹匀,静置5-10min,使细胞完全裂解,取50μl裂解液置于黑色96孔板中,加入50μl底物(300ug/ml luc水溶液与2mg/ml atp水溶液按照体积比为3:1混合)吹吸混匀,迅速测其荧光值。
[0184]
计算杀伤效率:杀伤效率={(阴性对照荧光值-实验组荧光值)/阴性对照荧光值}*100%。
[0185]
结果如图12所示。可以看出,tricarantiegfr(3845)-t可对egfr阳性肿瘤细胞进行体外杀伤。
[0186]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1