一种黑曲霉葡萄糖氧化酶基因的高效表达方法与流程
1.本发明属于基因工程领域,具体涉及一种黑曲霉葡萄糖氧化酶基因的高效表达方法。
背景技术:
2.葡萄糖氧化酶(glucose oxidase,god,ec 1.1.3.4)是一种重要的工业用酶,在有氧条件下,god能够专一性的将葡萄糖氧化生成葡萄糖酸和过氧化氢。god在食品、传感器、医学领域以及畜牧行业中均具有广泛的应用。在食品中,god作为抗氧化剂和绿色抗菌剂能够有效抑制好氧菌生长,延长食品货架期;在医学领域,god已被广泛用于口腔护理和美白,也被用于建立h2o2氧化应激模型进行病理研究。god的另外一个重要的应用是葡萄糖的酶生物传感器,原理是将god固定于电极上,用电子传递介质来提高酶的氧化还原活性中心与电极表面的电子传递,将酶促反应中反应物的消耗或是产物的生成转换为电信号从而记录下来。
3.god在动物养殖业中也有着广泛的应用。研究表明,在饲料中添加god能够降低消化道ph值、提高消化酶活性和营养物质的消化率、改善肠道形态结构。god还能够消耗氧气创造利于有益厌氧菌生存的肠道环境,产生的h2o2能够抑制大肠杆菌、沙门氏菌等肠道病原菌繁殖,维持肠道微生态系统平衡。god还能缓解氧化应激、使畜禽保持健康、提高母畜繁殖性能,进而提高畜禽的生产性能并改善畜产品的品质。
4.多种动植物和微生物均能产生god,目前god主要由曲霉和青霉生产。目前,god已经能工业化生产,但由于饲料工业的特殊性(如高温制粒),开发耐热性好的god具有非常重要的意义。
技术实现要素:
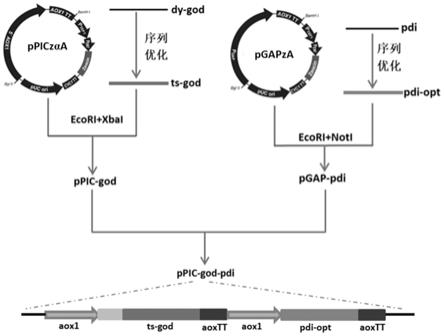
5.为解决现有技术中存在的问题,本发明提供一种黑曲霉葡萄糖氧化酶基因的高效表达方法,按照先后顺序包括以下步骤:
6.(1)取黑曲霉dy-2015斜面菌种,接种灭菌的pda培养基培养,收集菌丝体,置于液氮中研磨,取细粉,加入缓冲液,溶解后,离心,取上清液,抽提,上清液加naac,再加无水乙醇,混匀后置于冰上,离心,沉淀用冰冷乙醇洗涤两次,置于超净工作台中吹干,用20μl灭菌水溶解,用nanodrop2000测定dna浓度;
7.(2)设计引物,f:5
’‑
atgcagactctccttgtgag-3’;r:5
’‑
tcactgcatggaagcataatg-3’,以步骤1提取的黑曲霉dy-2015基因组dna为模板,进行pcr扩增;
8.(3)根据毕赤酵母密码子偏好性,优化黑曲霉dy-2015的葡萄糖氧化酶基因dy-god,用高频率密码子替代低频率密码子,调整密码子适应指数指数在0.8以上,为了后续基因工程操作方便,在序列中剔除了ecori、bamhi、bglii、xba i和sac i等限制性内切酶酶切位点,并修改可能的提前终止序列,优化后的基因命名为ts-god,并连接于毕赤酵母表达载体ppiczaa的多克隆位点ecori和xba i,连接产物转化大肠杆菌top10感受态细胞,经过含
抗生素zeocin的lb平板筛选,获得重组表达载体ppic-god;
9.(4)从ncbi下载蛋白质二硫键异构酶基因pdi序列通过在线软件优化设计后进行全合成,连接于pgapza表达载体的ecori和not i酶切位点,构建好的载体命名为pgap-pdi,pgap-pdi质粒用bglii和bamhi双酶切,回收大片段,与bamhi单酶切的ppic-god载体连接,转化大肠杆菌top10感受态细胞,经过抗生素zeocin筛选,获得重组质粒,串联表达载体命名为ppic-god-pdi;
10.(5)取重组质粒用线性化然后用pcr产物纯化试剂盒纯化,线性化的质粒溶于灭菌ddh2o中电泳检查线性化质粒纯度,并用nanodrop2000测定浓度,接种毕赤酵母x33单菌落于10mlypd培养基中,30℃、250rpm振荡培养12hr,转接50mlypd中,继续培养至对数生长期,10,000rpm离心5min,用灭菌水和1m冰冷山梨醇洗涤,制备毕赤酵母x33感受态细胞,将线性化dna与80μl感受态细胞混匀,置于电击杯中,2000v、5ms电击,电击后,立即加入1ml冰冷的1m山梨醇,30℃恢复培养3hr,转化后的细胞涂布于含zeocin的ypds平板培养基,30℃培养3-4d;
11.(6)采用邻-联茴香胺分光光度法,在god的作用下,葡萄糖和氧反应,生成的过氧化氢和无色的还原型邻联茴香胺在辣根过氧化物酶的作用下,生成水和红色的氧化型邻联茴香胺,通过测定反应中颜色的变化进而计算出葡萄糖氧化酶的活性;
12.(7)挑取单菌落,接种5mlypd液体培养基,28℃250rpm振荡培养24h,转接到500mlypd培养基,相同条件下培养12h,将种子液接种到30升发酵罐中,发酵罐中含有10l已灭菌基础培养基,30℃400rpm培养,基础培养基培养24h后,发酵液相对溶氧浓度上升接近100%,表明碳源耗尽,开始补料阶段,补料为50%灭菌甘油,待湿菌重达到300g/l以上时,停止补料,使菌体饥饿1-2h,以耗尽碳源。然后开始甲醇诱导阶段,每升培养基每min流加甲醇0.2ml,3h以后提高到每min流加甲醇0.5ml,每升甲醇中添加ptm1微量盐4.35ml、0.35gα-酮戊二酸、10mm精氨酸。发酵过程中通过氨水调节ph值,确保ph在5.5~6.0之间。通过转速调节,确保相对溶氧在20%以上。每12h测定湿菌重和酶活性的变化。
13.优选的是,pda培养基:去皮马铃薯200g,加水800ml,煮沸30min,过滤,上清液加葡萄糖20g,定容到1l,高压灭菌;lb培养基:2%胰蛋白胨、1%酵母提取物、1%nacl,ph7.0;低盐lb培养基:2%胰蛋白胨、1%酵母提取物、0.5%nacl,ph7.0;ypd培养基:1%酵母提取物、2%蛋白胨、2%葡萄糖,固体平板另外加1.5%琼脂。ypds培养基:1%酵母提取物、2%蛋白胨、2%葡萄糖、1.5%琼脂、1m山梨醇。
14.在上述任一方案中优选的是,步骤(2)的扩增条件为:95℃30s、58℃20s、72℃120s,35个循环。
15.在上述任一方案中优选的是,所述黑曲霉葡萄糖氧化酶基因序列:
16.[0017][0018]
在上述任一方案中优选的是,所述黑曲霉葡萄糖氧化酶氨基酸序列:
[0019][0020]
黑曲霉葡萄糖氧化酶优化基因序列ts-god:
[0021]
[0022][0023]
pdi基因序列:
[0024]
[0025][0026]
pdi优化基因序列pdi-opt:
[0027][0028]
本发明提供了一种黑曲霉葡萄糖氧化酶基因的高效巴斯德毕赤酵母表达方法,为了提高重组酶的正确折叠,在工程菌中通过串联载体构建,引入了蛋白质二硫键异构酶pdi基因,帮助蛋白质折叠,提高酶的表达活性。
附图说明
[0029]
图1为表达载体构建流程图;
[0030]
图2为不同温度下,god的相对活性;
[0031]
图3为不同ph值条件下,god的相对活性;
[0032]
图4为80℃保温不同时间后god的残余活性。
具体实施方式
[0033]
为了更进一步了解本发明的发明内容,下面将结合具体实施例详细阐述本发明。
[0034]
1、试验材料和试剂:
[0035]
1.1菌株和载体:
[0036]
本发明从黑曲霉dy-2015(aspergillus niger)中克隆到1条葡萄糖氧化酶基因dy-god。巴斯德毕赤酵母表达载体ppiczaa、pgapza及菌株x-33购自invitrogen公司。
[0037]
1.2工具酶及其他生化试剂:
[0038]
phusion dna聚合酶购自neb公司、限制性内切酶及连接酶购自takara公司,zeocin购自invitrogen公司,其他生化试剂为国产分析纯。
[0039]
1.3培养基:
[0040]
pda培养基:去皮马铃薯200g,加水800ml,煮沸30min,过滤,上清液加葡萄糖20g,定容到1l,高压灭菌;
[0041]
lb培养基:2%胰蛋白胨、1%酵母提取物、1%nacl,ph7.0;
[0042]
低盐lb培养基:2%胰蛋白胨、1%酵母提取物、0.5%nacl,ph7.0;
[0043]
ypd培养基:1%酵母提取物、2%蛋白胨、2%葡萄糖,固体平板另外加1.5%琼脂。
[0044]
ypds培养基:1%酵母提取物、2%蛋白胨、2%葡萄糖、1.5%琼脂、1m山梨醇。
[0045]
实施例1:黑曲霉dy-2015基因组dna提取
[0046]
取黑曲霉dy-2015斜面菌种,接种灭菌的pda培养基,30℃250rpm培养48hr,10,000rpm离心10min收集菌丝体。置于液氮中研磨,取0.5g细粉,加入1ml te缓冲液(10mm tris-hcl,ph 8.0,1mm edta),溶解后,10,000rpm离心5min,取上清液,用酚/仿(苯酚:氯仿:异戊醇=25:24:1)抽提两次;上清液加1/10体积naac(ph5.2),再加2倍体积冰冷的无水乙醇,混匀后置于冰上20min,13,000rpm离心20min,沉淀用1ml 75%冰冷乙醇洗涤两次,置于超净工作台中吹干,用20μl灭菌水溶解,用nanodrop2000测定dna浓度。
[0047]
实施例2:黑曲霉dy-2015葡萄糖氧化酶基因god克隆
[0048]
根据ncbi报道的黑曲霉葡萄糖氧化酶基因序列设计引物,f:5
’‑
atgcagactctccttgtgag-3’;r:5
’‑
tcactgcatggaagcataatg-3’。以实施例1提取的黑曲霉dy-2015基因组dna为模板,进行pcr扩增,扩增体系如表1所示。扩增条件为:95℃30s、58℃20s、72℃120s,35个循环,扩增结束后,扩增产物用1%琼脂糖凝胶电泳检测,并送北京擎科新业生物技术有限公司测序。序列分析软件为dnaman6.0。
[0049]
表1、葡萄糖氧化酶基因扩增反应体系
[0050][0051]
实施例3:god基因序列优化设计
[0052]
根据毕赤酵母密码子偏好性,优化黑曲霉dy-2015的葡萄糖氧化酶基因dy-god,通过在线软件优化设计,用高频率密码子替代低频率密码子,调整密码子适应指数(codon adaptation index,cai值)指数在0.8以上。为了后续基因工程操作方便,在序列中剔除了ecori、bamhi、bglii、xba i和sac i等限制性内切酶酶切位点,并修改可能的提前终止序列(连续富含at序列)。优化后的基因命名为ts-god。优化后的序列ts-god在北京擎科新业生物科技公司进行全基因序列合成,并连接于毕赤酵母表达载体ppiczaa的多克隆位点ecori和xbai,连接产物转化大肠杆菌top10感受态细胞,经过含抗生素zeocin(终浓度0.25μg/ml)的lb平板筛选,获得重组表达载体ppic-god。
[0053]
实施例4:二硫键异构酶pdi基因合成与串联表达载体构建
[0054]
从ncbi下载蛋白质二硫键异构酶基因pdi序列(登录号:m62815.1),通过在线软件)优化设计后进行全合成,连接于pgapza表达载体的ecori和not i酶切位点,构建好的载体命名为pgap-pdi。pgap-pdi质粒用bglii和bamhi双酶切,回收大片段,与bamhi单酶切的ppic-god载体连接,转化大肠杆菌top10感受态细胞,经过抗生素zeocin(终浓度0.25μg/ml)筛选,获得重组质粒。串联表达载体命名为ppic-god-pdi。
[0055]
实施例5:god重组菌株构建
[0056]
取重组质粒ppic-god-pdi 10μg,用sac i线性化(反应体系如表2),然后用pcr产物纯化试剂盒纯化,线性化的质粒溶于10μl灭菌ddh2o中电泳检查线性化质粒纯度,并用nanodrop2000测定浓度。接种毕赤酵母x33单菌落于10ml ypd培养基中,30℃、250rpm振荡培养12hr,转接50ml ypd中,继续培养至对数生长期,10,000rpm离心5min,用灭菌水和1m冰冷山梨醇洗涤,制备毕赤酵母x33感受态细胞。将线性化dna与80μl感受态细胞混匀,置于电击杯中,2000v、5ms电击,电击后,立即加入1ml冰冷的1m山梨醇,30℃恢复培养3hr,转化后的细胞涂布于含zeocin(终浓度100-500μg/ml)的ypds平板培养基,30℃培养3-4d。
[0057]
表2、重组表达载体的线性化酶切
[0058]
试剂体积(μl)ppic-god-pdi20(10μg)saci510x缓冲液10ddh2o65总体积100
[0059]
实施例6:重组god酶活测定
[0060]
采用邻-联茴香胺分光光度法。在god的作用下,葡萄糖和氧反应,生成的过氧化氢和无色的还原型邻联茴香胺在辣根过氧化物酶的作用下,生成水和红色的氧化型邻联茴香胺。通过测定反应中颜色的变化进而计算出葡萄糖氧化酶的活性。
[0061]
实施例7:重组菌株发酵工艺
[0062]
挑取单菌落,接种5ml ypd液体培养基,28℃250rpm振荡培养24hr,转接到500ml ypd培养基,相同条件下培养12hr。将种子液接种到30升发酵罐中,发酵罐中含有10l已灭菌基础培养基(培养基每升含有:甘油40g、磷酸20g、caso4·
2h2o 0.93g、mg2so44.0 g、(nh4)2so41.65 g、koh 3.37g、谷氨酸1.74g、精氨酸1.45g、ptm1微量盐4.35ml),30℃400rpm培养。基础培养基培养24h后,发酵液相对溶氧浓度上升接近100%,表明碳源耗尽,开始补料阶段,补料为50%灭菌甘油(每升含ptm1微量盐4.35ml、谷氨酸1.74g、精氨酸1.45g)。待湿菌重达到300g/l以上时,停止补料,使菌体饥饿1-2h,以耗尽碳源。然后开始甲醇诱导阶段,每升培养基每min流加甲醇0.2ml,3h以后提高到每min流加甲醇0.5ml。每升甲醇中添加ptm1微量盐4.35ml、0.35gα-酮戊二酸、10mm精氨酸。发酵过程中通过氨水调节ph值,确保ph在5.5~6.0之间。通过转速调节,确保相对溶氧在20%以上。每12h测定湿菌重和酶活性的变化。
[0063]
实施例8:重组god性质测定
[0064]
1、god最适催化温度的测定:
[0065]
在10~70℃,分别测定酶的活性,以最高酶活性为100%,计算不同温度下酶的相对活性,绘制不同温度下酶的相对活性曲线,如图2所示,从图中可见,god在50℃时酶的催化活性最高,在20~60℃之间,酶都具有较好的催化活性。
[0066]
2、god最适催化ph值的测定:
[0067]
配制ph1.5-9.0的缓冲液,分别稀释酶液和底物,然后在50℃测定酶的活性,酶活最高的ph值设定为100%相对酶活,其他ph值的酶活与之想比较,绘制相对酶活曲线,如图3所示,从图中可见,最适催化ph值为6.0,在ph3.0~7.0之间,酶的相对催化活性都在60%以上。
[0068]
3、god耐热性测定:
[0069]
将酶液在80℃处理不同时间,然后在50℃和ph6.0的条件下测定酶的残余活性,以未处理的酶活为100%,绘制酶耐热性曲线,如图4所示。
[0070]
黑曲霉葡萄糖氧化酶基因序列:
[0071][0072]
黑曲霉葡萄糖氧化酶氨基酸序列:
[0073][0074][0075]
黑曲霉葡萄糖氧化酶优化基因序列ts-god:
[0076][0077]
pdi基因序列:
[0078]
[0079][0080]
pdi优化基因序列pdi-opt:
[0081][0082][0083]
本领域技术人员不难理解,本发明的一种黑曲霉葡萄糖氧化酶基因的高效表达方
法包括上述本发明说明书的发明内容和具体实施方式部分以及附图所示出的各部分的任意组合,限于篇幅并为使说明书简明而没有将这些组合构成的各方案一一描述。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1