一种产细菌素植物乳杆菌及其在青贮饲料中的复配应用
1.本发明属于青贮饲料加工技术领域,具体涉及一种产细菌素植物乳杆菌及其在青贮饲料中的复配应用。
背景技术:
2.随着人口增加和生活水平不断提高,人们对肉蛋奶的需求大幅度增长。畜牧业的快速发展使得优质饲草的需求量逐年增加。青贮是饲草保存常用的一种方式。然而豆科或木本饲料等原料水分和蛋白含量高,青贮过程有害菌易大量繁殖。传统上认为,只要在青贮过程中乳酸菌发酵产生乳酸等有机酸,从而保持较低的ph值和厌氧条件,就可以保证青贮无致病菌。但越来越多的研究表明,即使青贮后期ph降低,大肠杆菌在较低的ph下也能增殖,与乳酸菌竞争可溶性糖等营养物质,从而减缓青贮进程,造成饲料品质下降甚至腐败。因此,需要研究其他能快速抑制青贮酸性条件下繁殖的有害菌的替代方法,加快发酵进程,以确保优质、安全的青贮饲料生产。
3.乳酸菌作为安全的发酵促进剂,常用来添加制备青贮饲料。乳酸菌细菌素是乳酸菌生长代谢产生有抑菌活性的蛋白或多肽类物质,具有抑菌谱广、安全、无毒、高效等特点。产细菌素乳酸菌已被提出作为抑制青贮中以及牛瘤胃中腐败微生物的替代品。然而,前人的研究多是对青贮中革兰氏阳性菌的抑制,不适用于青贮过程中的主要有害菌-大肠杆菌等革兰氏阴性菌的抑制。
技术实现要素:
4.本发明所要解决的技术问题是如何抑制青贮饲料中的有害菌生长或如何提高青贮饲料的利用率或如何提高青贮饲料的青贮品质。
5.为了解决上述技术问题,本发明首先提供了复合菌剂。
6.所述复合菌剂的活性成分由植物乳杆菌(lactobacillus plantarum)cau-pl28和植物乳杆菌(lactobacillus plantarum)cau-s7组成。所述植物乳杆菌cau-pl28在中国微生物菌种保藏管理委员会普通微生物中心的登记入册编号为cgmcc no.20503;所述植物乳杆菌cau-s7在中国微生物菌种保藏管理委员会普通微生物中心的登记入册编号为cgmcc no.20502。
7.植物乳杆菌cau-pl28和植物乳杆菌cau-s7的生物学特性均为革兰氏染色阳性杆菌,葡萄糖同型发酵,生育温域宽(5-45℃可正常生长),耐酸性强(在ph 3.0可以正常生长),能够在nacl浓度≤6.5%的环境中生长,可利用七叶灵、纤维二糖、麦芽糖、甘露醇、水杨苷、山梨醇、蔗糖、棉子糖等碳源。植物乳杆菌cau-s7生长速率高(mrs培养基培养24小时,od
620nm
》2.00),产酸速度快(mrs培养基培养24小时,ph可降到4.0以下),在纯培养和青贮条件下高产乳酸。植物乳杆菌cau-pl28和植物乳杆菌cau-s7的生理生化特征如表1所示,其碳源发酵实验如表2所示。植物乳杆菌cau-pl28具有序列表中seq id no.1所示的16s rdna。植物乳杆菌cau-s7具有序列表中seq id no.2所示的16s rdna。
8.所述植物乳杆菌cau-pl28和植物乳杆菌cau-s7是从构树青贮饲料中分离得到的。所述植物乳杆菌cau-pl28产细菌素,所产细菌素对革兰氏阳性菌和革兰氏阴性菌均有抑制作用。
9.所述植物乳杆菌(lactobacillus plantarum)cau-pl28和所述植物乳杆菌(lactobacillus plantarum)cau-s7的菌落形成单位数量比可为1:1-3:1。
10.所述植物乳杆菌(lactobacillus plantarum)cau-pl28和所述植物乳杆菌(lactobacillus plantarum)cau-s7的菌落形成单位数量比可为1:1。
11.上述复合菌剂的活性成分可为植物乳杆菌cau-pl28和/或植物乳杆菌cau-s7的代谢物。上述复合菌剂的活性成分还可含有其他生物成分或非生物成分。上述复合菌剂的其他活性成分本领域技术人员可根据菌剂的效果确定。
12.所述复合菌剂还可包括载体。所述载体可为固体载体或液体载体。所述固体载体为矿物材料、生物材料;所述矿物材料可为草炭、粘土、滑石、高岭土、蒙脱石、白碳、沸石、硅石和硅藻土中的至少一种;所述生物材料为各类作物的秸秆、松壳、稻草、花生壳、玉米粉、豆粉、淀粉、草炭和动物的粪便中的至少一种;所述液体载体可为水;所述菌剂中,植物乳杆菌cau-pl28和/或植物乳杆菌cau-s7的代谢物可以以被培养的活细胞、活细胞的发酵液、细胞培养物的滤液或细胞与滤液的混合物的形式存在。所述菌剂的剂型可为多种剂型,如液剂、乳剂、悬浮剂、粉剂、颗粒剂、可湿性粉剂或水分散粒剂。
13.根据需要,所述复合菌剂中还可添加表面活性剂(如吐温20、吐温80等)、粘合剂、稳定剂(如抗氧化剂)、ph调节剂等。
14.上文中,所述植物乳杆菌cau-pl28和/或植物乳杆菌cau-s7的代谢物可为植物乳杆菌cau-pl28和/或植物乳杆菌cau-s7的发酵液。植物乳杆菌cau-pl28和/或植物乳杆菌cau-s7的发酵液可按照如下方法制备:在液体发酵培养基中培养植物乳杆菌cau-pl28和/或植物乳杆菌cau-s7,收集发酵液(含有植物乳杆菌cau-pl28和/或植物乳杆菌cau-s7、以及分泌到液体培养基内的物质),该发酵液即为植物乳杆菌cau-pl28和/或植物乳杆菌cau-s7的代谢物。
15.上文所述复合菌剂可具有提高青贮饲料品质和/或抑制青贮饲料中的有害菌生长的功能。
16.所述提高青贮饲料品质可为下述a1)-a6)中的全部或部分:
17.a1)降低青贮饲料的ph值;
18.a2)提高青贮饲料的乳酸含量;
19.a3)提高青贮饲料的乳酸/乙酸比值;
20.a4)降低青贮饲料的氨态氮含量;
21.a5)降低青贮饲料的非蛋白氮含量;
22.a6)提高青贮饲料的粗蛋白含量。
23.所述抑制青贮饲料中的有害菌生长可为抑制青贮饲料的下述b1)-b5)中的一种、两种、三种、四种或五种有害菌的繁殖速度:
24.b1)大肠杆菌;
25.b2)李斯特氏菌;
26.b3)芽孢杆菌;
27.b4)假单胞菌;
28.b5)沙门氏菌;
29.上文中,所述青贮饲料由青贮植物发酵而成。
30.上文所述的植物乳杆菌(lactobacillus plantarum)cau-pl28和/或所述植物乳杆菌(lactobacillus plantarum)cau-s7也属于本发明的保护范围。
31.植物乳杆菌cau-s7和/或植物乳杆菌cau-pl28的培养物也属于本发明的保护范围。所述植物乳杆菌cau-s7和/或植物乳杆菌cau-pl28的培养物是将植物乳杆菌cau-s7和/或植物乳杆菌cau-pl28在微生物培养基中培养得到的物质(如含有植物乳杆菌cau-s7和/或植物乳杆菌cau-pl28、以及分泌到液体培养基内的物质即发酵液,或如含有植物乳杆菌cau-s7和/或植物乳杆菌cau-pl28、以及分泌到固体培养基内的物质)。
32.为了解决上述技术问题,本发明还提供了上文所述的复合菌剂或上文所述的植物乳杆菌cau-pl28或上文所述的植物乳杆菌cau-s7在制备提高青贮饲料品质和/或抑制青贮饲料中的有害菌生长的产品中的应用。
33.所述提高青贮饲料品质和/或抑制青贮饲料中的有害菌生长的产品可为微生态制剂或饲料。
34.所述提高青贮饲料品质可为下述a1)-a6)中的全部或部分:
35.a1)降低青贮饲料的ph值;
36.a2)提高青贮饲料的乳酸含量;
37.a3)提高青贮饲料的乳酸/乙酸比值;
38.a4)降低青贮饲料的氨态氮含量;
39.a5)降低青贮饲料的非蛋白氮含量;
40.a6)提高青贮饲料的粗蛋白含量。
41.所述抑制青贮饲料中的有害菌生长为抑制青贮饲料的下述b1)-b5)中的一种、两种、三种、四种或五种有害菌的繁殖速度:
42.b1)大肠杆菌;
43.b2)李斯特氏菌;
44.b3)芽孢杆菌;
45.b4)假单胞菌;
46.b5)沙门氏菌;
47.上文所述微生态制剂或饲料也属于本发明的保护范围。所述微生态制剂或饲料含有上文所述的复合菌剂、上文所述的植物乳杆菌(lactobacillus plantarum)cau-pl28或/和所述植物乳杆菌(lactobacillus plantarum)cau-s7。
48.上文所述发酵可为在15-45℃,厌氧发酵40-60天。
49.本发明从构树青贮中分离筛选得到了一株高产乳酸、耐酸并生长速度快的植物乳杆菌cau-s7,以及一株产细菌素植物乳杆菌cau-pl28,并单一或复配添加至青贮材料中进行发酵。实验证明,构树原料在经过植物乳杆菌cau-s7和植物乳杆菌cau-pl28复配发酵后,青贮饲料的大肠杆菌生长速度显著下降,乳酸含量和乳酸/乙酸比值显著增加,ph值、氨态氮及非蛋白氮含量均显著下降,粗蛋白含量显著提升。尤其是经过植物乳杆菌cau-s7和cau-pl28复配发酵后,进一步快速抑制青贮饲料的大肠杆菌增殖,降低青贮饲料的ph值,加
速发酵过程,提高青贮速率;非蛋白氮含量降低了8.37%,氨态氮含量降低了29.22%,粗蛋白提高了8.63%,即显著降低了蛋白降解,有效保存了构树营养,可广泛使用。使用植物乳杆菌cau-s7和cau-pl28复配制备的复合菌剂添加剂青贮效果较好,且成本低、安全、易于利用。
50.保藏说明
51.菌种名称:植物乳杆菌
52.拉丁名:lactobacillus plantarum
53.菌株编号:cau-pl28
54.保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
55.保藏机构简称:cgmcc
56.地址:北京市朝阳区北辰西路1号院3号
57.保藏日期:2020年08月07日
58.保藏中心登记入册编号:cgmcc no.20503
59.菌种名称:植物乳杆菌
60.拉丁名:lactobacillus plantarum
61.菌株编号:cau-s7
62.保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
63.保藏机构简称:cgmcc
64.地址:北京市朝阳区北辰西路1号院3号
65.保藏日期:2020年08月07日
66.保藏中心登记入册编号:cgmcc no.20502
附图说明
67.图1为cau-pl28不同发酵上清液对大肠杆菌的抑菌圈。1,原发酵上清液;2,ph=7.0发酵上清液;3,加入过氧化氢酶发酵上清液;4,加入蛋白酶k发酵上清液;5,对照。
68.图2为植物乳杆菌cau-pl28不同发酵上清液液对大肠杆菌体外抑制作用。
69.图3为构树青贮动态发酵过程中大肠杆菌的数量。
具体实施方式
70.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
71.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
72.下述实施例中所述培养基的配置:
73.液体mrs培养基按照如下方法配置:蛋白胨10.0g,牛肉粉5.0g,酵母粉4.0g,葡萄糖20.0g,乙酸钠5.0g,柠檬酸三铵2.0g,吐温80 1.0ml,磷酸氢二钾2.0g,硫酸镁0.2g,硫酸锰0.05g,用蒸馏水定容至1000ml,ph值为6.2。配好后的培养基在高压蒸汽灭菌锅中于121
℃灭菌15min。mrs固体培养基是在上述液体mrs培养基中加入琼脂后再灭菌得到的固体培养基。
74.实施例一、植物乳杆菌cau-pl28和cau-s7的分离与鉴定
75.1、植物乳杆菌的分离
76.采用稀释平板法分离植物乳杆菌:无菌条件下称取构树青贮料20g,置于装有180ml无菌蒸馏水的锥形瓶中,摇匀,即得到稀释10倍的样品悬液,然后按同样的10倍稀释法直接连续稀释至10-6
。选取合适稀释度,取0.1ml均匀涂布在mrs固体培养基平板上,于30℃恒温箱中培养48h,进行平板计数。依据菌落大小、形态和颜色等特征,挑取典型菌落,进行革兰氏染色镜检和过氧化氢酶试验。凡是革兰氏染色阳性、过氧化氢酶试验阴性的菌株即可初步确定为乳酸菌,将其在mrs培养基上划线纯化两次,接种到mrs固体斜面培养基,4℃冰箱中保存备用。
77.2、产广谱细菌素植物乳杆菌cau-pl28的获得
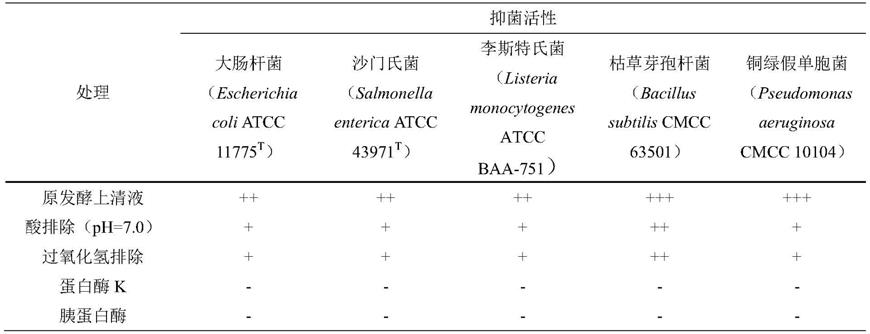
78.初筛:
79.采用牛津杯双层平板法:含1.6%琼脂的营养培养基冷却至50℃左右,按每平皿10ml倾倒在无菌培养皿中;制备含0.8%琼脂的指示菌培养基,冷却至40℃左右,按1%的接种量加入指示菌(escherichia coli atcc 11775
t
,salmonella enterica atcc 43971
t
,listeria monocytogenes atcc baa-751,bacillus subtilis cmcc 63501,pseudomonas aeruginosa cmcc 10104)菌悬液作为上层培养基,倾倒5ml上层培养基于含1.6%琼脂培养基的平板中冷却,然后用无菌镊子将牛津杯轻轻放置于平板上,将步骤1中分离的乳酸菌的无细胞发酵上清液加入牛津杯中,置于37℃培养条件下培养24h后观察抑菌圈的出现,选取牛津杯周围有明显抑菌圈的菌株作为初筛菌株进行复筛试验。
80.复筛:
81.(1)酸作用的排除
82.挑取初筛菌株,制备初筛菌株的无细胞发酵上清液,测上清液的p h值,用2mol/l naoh调发酵上清液ph值至7.0,用牛津杯双层平板法检测其抑菌活性。
83.(2)过氧化氢作用的排除
84.将酸排除后依然有抑菌作用的乳酸菌菌株的无细胞发酵上清液ph调至7.0,按照过氧化氢酶终浓度为1.0mg/ml加入到发酵上清液中,37℃水浴2h,用牛津杯双层平板法检测其抑菌活性。
85.(3)蛋白酶解检测
86.挑取过氧化氢排除后依然有透明圈的乳酸菌制备其无细胞发酵上清液,调发酵上清液ph至7.0,按100μg/m l加入胰蛋白酶和蛋白酶k,37℃水浴2h,酶解后,用牛津杯双层平板法检测其抑菌活性。
87.通过酸排除和过氧化氢排除后依然产生透明圈、而蛋白酶解后透明圈消失的菌株被认为有产细菌素的能力。筛选到产细菌素对6种指示菌均有抑制作用的乳酸菌(见表1)。得到一株菌株编号为cau-pl28的菌株,即为本技术的植物乳杆菌(lactobacillus plantarum)cau-pl28,cgmcc no.20503(以下简称植物乳杆菌cau-pl28)。cau-pl28对青贮中的主要有害菌大肠杆菌的抑菌圈见图1,后续测定其发酵上清液对大肠杆菌体外抑制能力。
88.表1植物乳杆菌cau-pl28的抑菌活性
[0089][0090]
注:+,抑菌圈直径:8.00-12.00mm;++,12.00-16.00mm;+++,16.00-20.00mm;-,表示无明显抑菌圈(直径≤8.0mm);抑菌圈直径包含牛津杯外径(7.80mm)。
[0091]
3、产酸能力强、生长快植物乳杆菌cau-s7的获得
[0092]
分别于30℃恒温箱中培养24h后测定步骤1中分离的乳酸菌的培养菌液的ph和吸光光度值。筛选出在24h内产酸能力强(ph《4.00)及生长快(od
620nm
》2.00)的乳酸菌。得到一株菌株编号为cau-s7的菌株,即为本技术的植物乳杆菌(lactobacillus plantarum)cau-s7 cgmcc no.20502,以下简称植物乳杆菌cau-s7,之后进行生理生化指标测定。
[0093]
4、植物乳杆菌cau-pl28和cau-s7的生理生化特性
[0094]
对植物乳杆菌cau-pl28和cau-s7进行革兰氏染色、葡萄糖产气、过氧化氢酶试验、生育温度(5、15、35、40℃)和生育ph(3.0、3.5、4.0、4.5、9.0)、发酵碳源、发酵24h内的ph值等生理生化实验。
[0095]
生理生化试验方法如下:
[0096]
(1)革兰氏染色参照东秀珠主编的《常见细菌系统鉴定手册》。
[0097]
(2)植物乳杆菌生长ph调节使用2mol/l naoh和2mol/l hcl。
[0098]
(3)葡萄糖产气试验:将实验菌株接种在mrs培养基上并在厌氧培养箱培养48h,挑取单菌落接种于含有5ml mrs液体培养基(ph6.5)的试管中(杜氏小管倒扣在试管内),放置于普通恒温培养箱37℃培养48h,观察并记录结果,产生气泡的记为阳性,不产生气泡的则为阴性。
[0099]
(4)过氧化氢酶测定试验:将实验菌株接种在mrs培养基上并在厌氧培养箱中培养48h,挑取单菌落涂布在滴加了3%(w/w)过氧化氢溶液的培养皿上,观察是否有气泡产生,产生气泡的为过氧化氢酶阳性,不产生气泡的则为阴性。
[0100]
(5)糖发酵使用北京路桥技术股份有限公司生产的乳酸杆菌生化鉴定套装分析。对于革兰氏阳性,过氧化氢酶阴性的实验菌株,采用含有8种碳源的生化鉴定套装,对照为一支麦氏浊度比浊管,试验方法依据说明书进行,37℃恒温培养48h,记录试验结果。
[0101]
结果表明,植物乳杆菌cau-pl28和cau-s7均为革兰氏阳性,同型发酵的杆菌,在5-45℃和ph3.0-9.0条件下皆可生长,具有较强耐酸性。其中cau-s7发酵24h ph降到4.0以下(表2),说明植物乳杆菌cau-s7产酸快,可发酵大多数糖类(表3)。
[0102]
表2植物乳杆菌cau-pl28和cau-s7的菌落形态及生理生化特性
[0103][0104]
注:-,不生长;+,正常生长。
[0105]
表3植物乳杆菌cau-pl28和cau-s7的糖源发酵实验结果
[0106][0107]
注:+,正常生长。
[0108]
5、植物乳杆菌发酵上清液对大肠杆菌体外抑制能力的检测
[0109]
将乳酸菌上清液和大肠杆菌进行试管混合共同培养。
[0110]
大肠杆菌(escherichia coli atcc 11775
t
)菌液的制备方法如下:将大肠杆菌菌落加入到nb营养液体培养基内37℃培养24小时,调整od
600nm
为1.0,所得即为大肠杆菌(escherichia coli atcc 11775
t
)菌液。
[0111]
植物乳杆菌cau-pl28的无细胞发酵上清液原液(简称原发酵液)的制备方法如下:
[0112]
将植物乳杆菌cau-pl28菌落加入到mrs肉汤培养基内30℃厌氧培养24小时,12000rpm离心10min,收集上清液即为植物乳杆菌cau-pl28的无细胞发酵上清液。
[0113]
ph=7.0的发酵上清液(简称排酸发酵液):将植物乳杆菌cau-pl28的无细胞发酵上清液用2mol/l naoh调至ph为7.0,所得即为排酸发酵液。
[0114]
ph=7.0且含有1.0mg/ml过氧化氢酶的发酵上清液(简称排过氧化氢发酵液):将植物乳杆菌无细胞发酵上清液用2mol/l naoh调至ph为7.0,加入终浓度为1.0mg/ml的过氧化氢酶,37℃水浴2h,所得即为排过氧化氢发酵液。
[0115]
在含有1%的大肠杆菌(escherichia coli atcc 11775
t
)菌液的nb营养液体培养基内按照5:3的体积比例分别接入植物乳杆菌cau-pl28的无细胞发酵上清液原液(简称原发酵液)、ph=7.0的发酵液(简称排酸发酵液)、ph=7.0且含有1.0mg/ml过氧化氢酶的发酵液(简称排过氧化氢发酵液)。每4h取样,以加入1%的大肠杆菌菌液的nb营养液体培养基为对照(ck),测定600nm条件下的光密度值。以共培养时间为横坐标,光密度值为纵坐标,绘制乳酸菌发酵液对大肠杆菌体外抑制能力。
[0116]
植物乳杆菌cau-pl28发酵液对大肠杆菌体外抑制作用如图2所示。接种大肠杆菌后可以看出ck、排酸发酵液(图2中加入cau-pl28发酵上清液(排酸发酵液)所示)和排过氧化氢发酵液(图2中加入cau-pl28发酵上清液(排过氧化氢发酵液)所示)3种处理的大肠杆
菌都进入了对数生长期,但是加入排酸发酵液和排氧化氢发酵液的处理与ck比生长缓慢,并在4h时比ck提前进入稳定期。而直接加入原发酵液的处理(图2中加入cau-pl28发酵上清液所示)始终处于较低od值(≤0.1)。说明cau-pl28原发酵液可以明显抑制大肠杆菌的生长,在排除酸的干扰和过氧化氢干扰后,仍可有效抑制大肠杆菌,这进一步说明了cau-pl28产生了可抑制大肠杆菌等革兰氏阴性菌的细菌素。
[0117]
6、形态学鉴定
[0118]
将处于对数生长期,且菌落大小稳定的植物乳杆菌cau-pl28和cau-s7进行单菌落状态描述,主要包括菌落的大小、颜色、透明度、菌落表面状态、菌落边缘状态。结果表明菌株植物乳杆菌cau-pl28和cau-s7菌落形态学特征均为:圆形,表面光滑,细密、颜色乳白,不透明。cau-pl28菌体大小为0.6-0.8
×
0.9-1.0毫米;cau-s7菌体大小为1.0-1.2
×
1.5-1.8毫米。
[0119]
7、分子鉴定
[0120]
将植物乳杆菌cau-pl28和植物乳杆菌cau-s7分别在mrs固体培养基上30℃培养并纯化,挑取单菌进行菌落pcr。引物选用细菌的16s rdna基因扩增的通用引物(由华大基因科技有限公司提供):27f:5
’‑
agagtttgatcctggctcag-3’,1492r:5
’‑
ggttaccttgttacgactt-3’。pcr反应体系(50μl):
[0121]
premix taq25μl27f(20μm)0.5μl1492r(20μm)0.5μlddh2o24μl菌落单菌落
[0122]
反应条件:
[0123][0124]
扩增产物送美吉生物科技有限公司测序,测得cau-pl28和cau-s7的16s rdna序列分别为序列表中seq id no.1和seq id no.2所示,将其在ncbi上进行序列比对,结合菌株的生理生化数据,最终确定cau-pl28和cau-s7均属于植物乳杆菌。
[0125]
鉴于上述形态、生理生化特征分析和16s rdna序列同源性分析结果,将cau-pl28和cau-s7鉴定为植物乳杆菌(lactobacillus plantarum),并已于2020年08月07日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),cau-pl28的保藏编号为cgmcc no.20503,cau-s7的保藏编号为cgmcc no.20502。
[0126]
实施例二、植物乳杆菌cau-pl28和植物乳杆菌cau-s7单一或复配添加到青贮饲料中的应用效果
[0127]
1、青贮饲料的制备(以木本饲料构树为例)
811column,shimadzu,日本),检测器:spd-m10avp,流动相:3mmol l-1
高氯酸,流速1ml min-1
,柱温50℃,检测波长210nm,进样量5μl。分别以乳酸、乙酸和丙酸为标准品根据标准品的保留时间定性和采用标准曲线法(外标法)进行定量分析。
[0144]
试验所得数据用excel软件处理,并用sas 9.0软件中的单因素方差分析程序对数据进行方差分析。构树青贮后发酵品质如表4所示。与ck和gfg对照处理组相比,单独添加植物乳杆菌cau-s7(s7处理组)可显著降低构树青贮的ph(p<0.05),提高乳酸含量(p<0.05)和乳酸/乙酸比值(p<0.05),即提高了构树青贮品质。与s7处理组相比,将植物乳杆菌cau-s7和cau-pl28复配添加后(s7+pl28处理组)进一步降低了构树青贮的ph(p<0.05),提高了乳酸/乙酸比值(p<0.05)。经过复配添加植物乳杆菌发酵后,构树的ph值下降了4.7%,乳酸含量提高了21.7%,乳酸/乙酸比值提高了47.35%。
[0145]
表4构树青贮后发酵品质
[0146][0147]
注:ck,无添加对照;gfj,商业菌株;每列数据具有相同字母尾标的代表无显著性差异,无相同字母则有显著性差异。nd代表未检测到。
[0148]
6、青贮饲料粗蛋白和非蛋白氮组分的测定
[0149]
构树青贮饲料开袋后经烘箱65℃烘干48h,过40目筛粉碎,采用凯氏定氮法,使用foss kj2300型全自动定氮仪测定并计算粗蛋白含量。非蛋白氮含量测定方法如下:
[0150]
(1)称取0.5g粉碎样品置于125ml锥形瓶中。
[0151]
(2)加入50ml预冷的蒸馏水,放置30分钟。
[0152]
(3)加入10ml1%三氯乙酸溶液,放置20-30分钟。
[0153]
(4)采用定量滤纸重力过滤。
[0154]
(5)使用三氯乙酸溶液冲洗两次。用预冷的蒸馏水冲洗两次。
[0155]
(6)将滤纸和残渣转入消化管测定氮含量,以滤纸为空白对照。
[0156]
(7)总氮减去残渣中的氮即为非蛋白氮含量。
[0157]
氨态氮含量利用苯酚-次氯酸钠比色法测定。
[0158]
构树青贮后蛋白组分含量见表5。试验所得数据用excel软件处理,并用spss17.0软件中的单因素方差分析程序对数据进行方差分析和多重比较。与ck和gfg对照处理组相比,单独添加植物乳杆菌cau-s7(s7处理组)可显著提高粗蛋白含量(p《0.05),与ck相比,单独添加植物乳杆菌cau-s7(s7处理组)可显著降低氨态氮含量(p《0.05)。与s7处理组相比,复配添加植物乳杆菌cau-s7和cau-pl28后(s7+pl28处理组)进一步降低了非蛋白氮含量(p《0.05)和氨态氮含量(p《0.05)。经过复配添加植物乳杆菌发酵后,构树的粗蛋白提高了8.63%,非蛋白氮含量降低了8.37%,氨态氮含量降低了26.49%,因此,复配添加植物乳杆菌cau-s7和cau-pl28显著降低了蛋白降解。
[0159]
表5构树青贮后粗蛋白和非蛋白氮组分含量
[0160][0161]
注:ck,无添加对照;gfj,商业菌株;每列数据具有相同字母尾标的代表无显著性差异,无相同字母则有显著性差异。
[0162]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1