一种用于检测植物番茄斑萎病毒的crDNA、crRNA、试剂盒和方法与流程
一种用于检测植物番茄斑萎病毒的crdna、crrna、试剂盒和方法
技术领域
1.本发明涉及分子生物学技术领域,特别涉及一种用于检测植物番茄斑萎病毒的crdna、crrna、试剂盒和方法。
背景技术:
2.由病毒引起的植物病害已在全球范围内造成巨大的经济损失。因此,迫切需要建立一种更高效,灵敏的病毒检测方法,以防止病毒病大面积流行发生。当前,植物病毒诊断的策略主要包括基于核酸的检测方法和基于抗原抗体的检测方法。基于核酸的检测方法也叫分子生物学检测,主要包括聚合酶链式扩增反应(polymerase chain reaction,pcr),实时荧光定量pcr(qrt-pcr),依赖核酸序列的扩增法(nucleic acid sequence-based amplification,nasba),高通量测序等。现有的用于植物病毒的核酸检测方法灵敏且快速,但反应条件严苛,需要昂贵的仪器,在实验室条件下较易完成,但在实际生产实践及检疫中难以实现大面积推广与应用。抗原抗体检测法是基于抗原与相应抗体之间所发生的特异性结合反应,并以某种方式表现出反应强度信号的检测方法。基于抗原抗体的检测方法主要为酶联免疫吸附法(elisa),elisa用酶作标记物或指示剂进行抗原和抗体定性、定量、定位测定的技术,广泛用于病毒的诊断和鉴定。在酶联免疫吸附法原理的基础上,还形成许多与elisa相关的检测方法如直接elisa、间接elisa,双抗夹心elisa、斑点elisa法等。尽管基于抗原-抗体反应的病毒检测方法无需昂贵的仪器即可完成常见病毒的检测,但是在检测某些新的检疫性病毒的情况下,方法建立过程中会浪费大量时间和金钱。除传统方法外,等温扩增技术(例如重组酶聚合酶扩增(rpa)和环介导等温扩增(lamp))也越来越多地用于病毒检测。等温扩增技术不需要昂贵的设备,但在等温扩增的条件下可能会产生假阳性结果。
3.最近的研究表明,作为重要的基因编辑工具规律间隔成簇短回文重复序列clustered regularly interspaced short palindromic repeats(crispr)和crispr相关的(cas)系统已被用作进行与病毒诊断有关的研究。在crispr/cas系统中,单个crispr rna(crrna)指导单个蛋白效应子(cas蛋白)靶向,切割和编辑特定核苷酸序列。crispr/cas13系统独特的rna靶向机制可用于病毒检测。张峰团队开发了基于cas13的sherlock(specific high sensitivity enzymatic reporter unlocking)平台,以检测寨卡病毒(zikv)和登革热病毒(denv),并且该检测方法的高灵敏度用于识别病毒特定株系。sherlock系统通过重组酶聚合酶的扩增来扩增一条含有crispr系统靶序列的核酸。crispr系统切割探针的两端带有荧光基团和淬灭基团,并且在短时间内产生的荧光信号强度变化将区分阳性样品。基于crispr/cas系统已用于检测病原体:病毒(新型冠状病毒sars-cov-2,甲型禽流感(h7n9),非洲猪瘟病毒(asfv),埃博拉病毒(ebola virus),苹果相关病毒),真菌,原核细菌。基于crispr/cas的检测系统已在实际检测情况中显示出巨大的潜力。基于crispr/cas系统的检测不仅用于检测致病性病原物。该系统在分子诊断和表观遗传学中同样发挥了重要作用,如检测单核苷酸多态性(snp),mrna,环状rna和dna甲基化程度等。
4.因此,有必要开发一种更高效、灵敏的基于crispr/cas13系统的植物病毒的检测试剂盒和方法。
技术实现要素:
5.本发明目的是提供一种用于检测植物番茄斑萎病毒的crdna、crrna、试剂盒和方法,特异性强,灵敏度高,最低检测极限达到10拷贝/ul。
6.在本发明的第一方面,提供了一种用于检测植物番茄斑萎病毒的crdna,所述crdna的核苷酸序列如seq id no.1所示。
7.在本发明的第二方面,提供了一种用于检测植物番茄斑萎病毒的crrna,所述crrna的核苷酸序列如seq id no.2所示。
8.在本发明的第三方面,提供了一种用于检测植物番茄斑萎病毒的试剂盒,含有所述crdna或者所述的crrna、以及cas13a蛋白和荧光探针。
9.进一步地,所述荧光探针的核苷酸序列如seq id no.3所示,所述荧光探针的序列的5’端均标记有荧光基团,3’端标记均有猝灭基团;所述荧光基团包括fam、vic、hex、trt、cy3、cy5、rox、joe和texas red中的一种,所述猝灭基团包括tamra、dabcyl、mgb、bhq-1、bhq-2和bhq-3中的一种;
10.或者所述荧光探针的序列的3’端标记有生物素,5’端标记的有fam、vic、hex、trt、cy3、cy5、rox、joe和texas red中的一种。
11.作为优选方案,所述试剂盒还包括dna酶抑制剂,起到防止dna降解的作用。
12.进一步地,所述试剂盒还包括rpa等温扩增体系,所述rpa等温扩增体系包括rpa等温扩增引物对:primer a,核苷酸序列如seq id no.4所示,primer b,核苷酸序列如seq id no.5所示。结合rpa等温扩增和crispr/cas系统中cas13a介导的附带切割活性。
13.作为以上实施方式之一,所述试剂盒为液体试剂盒时,将所述检测体系孵育后借助荧光检测仪或荧光分光光度计测定荧光值。具体地,将扩增产物、cas13a/crrna复合物溶液,加入荧光探针和无酶水孵育后荧光检测仪测定荧光值。采用荧光检测机器时所述荧光探针序列的5’端均标记有荧光基团,3’端标记均有猝灭基团;所述荧光基团包括fam、vic、hex、trt、cy3、cy5、rox、joe和texasred中的一种,所述猝灭基团包括tamra、dabcyl、mgb、bhq-1、bhq-2和bhq-3中的一种。在本发明一个具体的实施例中,具体采用ssrna探针(所述荧光探针的核苷酸序列如seq id no.3所示);每个基于crispr/cas13的检测系统均在37℃进行,使用酶标仪在485nm激发波长和529nm发射波长下监控荧光强度,每30s读取一次荧光强度,共设置45个荧光强度动力学循环。
14.作为以上实施方式之一,所述检测试剂盒为胶体金检测试剂盒时;所述胶体金检测试剂盒包括所述的检测试剂以及胶体金载体,所述胶体金载体包括底板,粘合在所述底板上且依次搭接的样品垫、结合垫、层析基质和吸水垫;所述结合垫上涂有单克隆抗体包被的胶体金复合物;所述层析基质上靠近结合垫的一侧设有质控线,靠近吸水垫的一侧设有检测线;所述质控线上涂有链霉亲和素;所述检测控线上涂有捕获抗体。采用胶体金试剂盒检测时,所述荧光探针的序列的5’端或3’端均标记有荧光基团,3’端或5’端标记有生物素。具体地,本发明选用所述荧光探针的序列的3’端标记有生物素,5’端标记的有fam、vic、hex、trt、cy3、cy5、rox、joe和texas red中的一种。
15.所述胶体金检测试剂盒使用时,将扩增产物、cas13a蛋白/crrna复合物溶液,加入荧光探针和无酶水孵育后加入到胶体金试纸条样品检测区。将所述检测体系滴加在所述试剂盒中的样品垫上,并观察质控带、检测带;若在检测带上形成肉眼可见的有色线条,则判断为阳性;否则为阴性。所述胶体金检测试剂盒将crrna组成的检测试(crispr/cas13a检测体系)与rpa等温扩增合为一个步骤,并且以胶体金试纸条的形式呈现检测结果,操作简便、时间短,无需仪器,等温反应即可,具有很强的适用范围和场所,实用性极强。
16.在本发明的第四方面,提供了所述的crdna、所述的crrna、以及所述的试剂盒在用于检测植物番茄斑萎病毒上的用途。
17.在本发明的第五方面,提供了一种检测植物番茄斑萎病毒的方法,所述方法包括:
18.提取待测的植物样品总rna,后通过逆转录获得cdna;以所述cdna为模板扩增获得dna扩增产物;
19.将所述的扩增产物、crrna、cas13a蛋白和荧光探针和无酶水构成的检测反应体系进行检测。
20.进一步地,所述cdna为模板扩增获得dna扩增产物采用rpa等温扩增体系,所述rpa等温扩增体系包括rpa等温扩增引物对:primer a,核苷酸序列如seq id no.4所示,primer b,核苷酸序列如seq id no.5所示。
21.更进一步地,所述cdna为模板扩增获得dna扩增产物采用rpa等温扩增体系包括:10μm,2.4μl primer a,10μm,2.4μl primer b,29.5μlrpa反应buffer,2μltemplate,13.2μl ddh2o。
22.所述检测反应体系包括:cas13a蛋白,100μl检测缓冲液,0.5μl 50u/μl t7 rna聚合酶,1μl50mm atp,1μl 50mm gtp,1μl 50mm ctp,1μl 50mm utp,0.5μl 40u/μl rnase抑制剂,0.5μl,40ng/μl纯化的lwcas13a,0.5μl,10ng/μl crrna,0.5μl 20μmssrna探针。
23.本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
24.本发明提供的一种用于检测植物番茄斑萎病毒的crdna、crrna、试剂盒和方法,具有成本低、可多次重复检测、方法简单、检测速度快、灵敏(最低检测极限达到10拷贝/ul)、特异形的特点,具体地:
25.(1)利用rpa等温扩增反应,并结合crispr/cas13a反应使得其检测病毒的灵敏度高于常规的病毒检测方法rt-pcr。
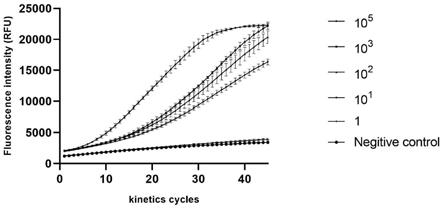
26.(2)所需的检测条件较简单,两步反应均不需要复杂的温度变化和昂贵的仪器来实现。本发明检测时间相对缩短,常规的rt-pcr检测需要至少两个小时来获得检测结果,基于crispr/cas13a的病毒检测可以在1h内完成并获得检测结果,具体地:如果为液体检测试剂盒,反应进行到20-30分钟时,阳性样本的荧光信号明显高于阴性样本,灵敏度可达到10拷贝/ul;如果为胶体金检测试剂盒,可在短时间内通过显色反应检测到是否含有相应的目标核酸:加入扩增产物、crrna、cas13a蛋白和荧光探针和无酶水构成的检测反应体系3-5min,即可通过检测线的有无区分阳性样本和阴性样本,灵敏度可达到10拷贝/ul。
27.(3)本发明提供的病毒检测方法可为植物病毒检疫大量样品提供方法,也可应用于农业方面的病毒快速预测预报。
附图说明
28.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
29.图1为纯化的cas13a蛋白sds-page考马斯亮蓝染色分析:(a)his6-sumo-lwcas13a在16℃ 0.5mm iptg诱导下表达18h;m1:marker 120kda.1.上清液通过his-tag纯化树脂第1次穿流液;泳道2为第2次穿流液;泳道3为第3次穿流液;泳道4为第1非变性洗涤液;泳道5为第2次非变性洗涤液;泳道6为第3次非变性洗涤液;泳道7为第4次非变性洗涤液;泳道8为his6-sumo-lwacas13a第1次非变性洗脱缓冲液;泳道9为his6-sumo-lwacas13a在第2次非变性洗脱缓冲液;泳道10为his6-sumo-lwacas13a在第3次非变性洗脱缓冲液中;泳道11为his6-sumo-lwacas13a在第4次非变性洗脱缓冲液中;
30.图2为不同浓度的rpa反应的质粒模板的在45个动力学循环中的荧光强度,阴性对照使用不含rnase的水代替rpa产物;
31.图3为在每种稀释度下基于crispr/cas13a的检测第15分钟(第30个动力学循环)后产生的荧光信号强度;阴性对照使用不含rnase的水代替rpa产物;
32.图4为利用基于crispr/cas13的检测方法检测10个番茄叶片样品,从第30个动力学循环即可观察到阳性样品的荧光强度值明显高于阴性样品;
33.图5为利用琼脂糖凝胶电泳检测10个番茄样品比较所建立的检测方法的准确性,结果显示与基于crispr/cas13的检测方法所得到的结果相同;
34.图6为利用琼脂糖凝胶电泳检测10个番茄样品比较所建立的检测方法的准确性结果。
具体实施方式
35.下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
36.在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
37.除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买获得或者可通过现有方法获得。
38.下面将结合实施例及实验数据对本技术的一种用于检测植物番茄斑萎病毒的crdna、crrna、试剂盒和方法进行详细说明。
39.实施例1、靶向特异性区域crrna的设计
40.1、靶向特异性区域crrna设计原则
41.由于crispr-cas13a系统是一种新型的靶向dna基因编辑系统,其中cas13a与crrna结合形成监测复合物,crrna的向导区域用互补序列识别目标dna,并且cas13a降解目标dna链,所述crrna设计要求:crrna包括蛋白锚定序列和向导序列,序列格式为:5`-与
cas13a蛋白结合的锚定序列-crrna向导序列-3`,蛋白锚定序列需要根据cas13a蛋白来确定,使其能够与选定的cas13a蛋白匹配并结合;向导序列则与靶向dna中的片段匹配。crrna向导序列不能离起始密码子(atg)太近;长度为22-24个核苷酸。
42.以番茄斑萎病毒tomato spotted wilt virus(tswv)为待检测病毒,基于crispr/cas13a系统的检测区域为tgttgtcttggctatatatcaggatgca如为seq id no.6所示;
43.2、crdna序列的选择
44.所述与cas13a蛋白结合的锚定序列为gatttagactaccccaaaaacgaaggggactaaaac;所述crrna向导序列根据seq id no.6所示序列中位点区域设计;最后得到了如下crdna片段所述crrna的核苷酸序列如seq id no.2所示。
45.3、crrna的获得
46.为了制备crrna,将所得crdna片段分别在t7rna聚合酶(转录反应体系如表2所示)作用下生成rna,回收纯化得到crrna;所述crrna的核苷酸序列如seq id no.1所示。
47.具体地:将具有t7启动子序列的crrna dna引物在dna寡核苷酸(5x)的退火缓冲液(beyotime biotechnology)中以10mm的最终浓度退火。退火反应在95℃下变性2分钟,然后每8秒冷却至0.1℃至25℃。crrna引物如表2所示;
48.表1
[0049][0050]
表2-crrna引物
[0051][0052]
表3
[0053][0054]
实施例2、用于检测植物番茄斑萎病毒的试剂盒和方法
[0055]
1、试剂盒的组成
[0056]
(a)crrna(其序列如seq id no.1所示)或者crdna(其序列如seq id no.2所示)。
[0057]
当试剂盒中为crdna时需要操作者先将crdna片段分别在t7 rna聚合酶作用下生成rna,回收纯化得到crrna(具体步骤见实施例1);
[0058]
(b)一条特异性荧光探针(其序列如seq id no.3所示),所述荧光探针的序列的5’端均标记有荧光基团,3’端标记均有猝灭基团;所述荧光基团包括fam、vic、hex、trt、cy3、cy5、rox、joe和texasred中的一种,所述猝灭基团包括tamra、dabcyl、mgb、bhq-1、bhq-2和bhq-3中的一种);
[0059]
(c)cas13a蛋白、无酶水、dna酶抑制剂;
[0060]
优选地,所述试剂盒还可包括:
[0061]
(d)扩增体系:包括等温扩增引物对(如表4);所述扩增体系还包括逆转录酶(单链变双链),重组酶,dna聚合酶,ssdna结合蛋白等。
[0062]
表4-rpa引物
[0063][0064]
扩增体系所需的其他组分采用购买逆转录等温扩增试剂盒basic;tabas03kit。
[0065]
优选地,为了先将病毒rna逆转录后再rpa等温扩增,所述扩增体系还包括rt逆转录酶。
[0066]
2、用于检测植物番茄斑萎病毒的方法
[0067]
本实施例以番茄斑萎病毒tomato spotted wilt virus(tswv)为待检测病毒,以tswv毒源植物为阳性样本,并用rt-pcr评估该检测方法的准确度。
[0068]
所述方法具体包括以下步骤:
[0069]
(1)步骤s1、提取待测的植物样品总rna,后通过逆转录获得cdna;
[0070]
所述步骤s1具体包括如下:
[0071]
s1-1:采集tswv毒源植物新鲜烟草叶片,立即置于液氮中。液氮预冷研钵至不能手
持,将烟草叶片至于研钵,直至研磨成粉末状,其间不断加入液氮。
[0072]
s1-2:取100mg粉末至于1.5ml离心管,立即加入1ml rna trizol(vazyme),振荡混匀至无肉眼可见颗粒,室温静置5min。
[0073]
s1-3:12000g 4℃离心10min。小心吸取上清(切勿吸取沉淀),转入新的1.5ml离心管中。加入200μl氯仿,盖紧离心管盖,振荡混匀至乳白色。室温静置5min。
[0074]
s1-4:12000g 4℃离心15min。此时匀浆液为三层:无色的上清液(含rna)、中间的白色蛋白层(大部分为dna)及带有颜色的下层有机相。小心吸取上清液(切勿吸取中间白色蛋白层)转移至另一新的1.5ml离心管中。
[0075]
s1-5:加入500μl异丙醇,轻轻上下颠倒5次后,室温静置10min。12000g 4℃离心10min。
[0076]
s1-6:小心弃去上清,加入1ml 75%乙醇,轻轻上下颠倒离心管,7500g 4℃离心5min,弃去上清(切勿触及沉淀)。重复一次。
[0077]
s1-7:打开离心管盖,室温干燥5min,加入100μl rnase-free h2o溶解沉淀。提取的rna置于-80℃中保存。
[0078]
s1-8:cdna的合成,该反应利用vazyme的ⅲrt supermix for qpcr(+gdna wiper)试剂盒进行逆转录过程。
[0079]
s1-9:配制去除基因组dna反应混合液体系,具体体系为:4
×
gdna wiper mix 4μl,rna template 1μl(1μg),rnase-free h2o至16μl;
[0080]
s1-10:移液枪轻轻吹打,短暂离心,使管壁上的溶液收集到管底;42℃,孵育2min;反应结束后,得反应液ⅰ,短暂离心,置于冰上冷却;
[0081]
s1-11:配置反转录体系混合液体系,具体体系为:上述反应液
ⅰꢀ
16μl,5
×
hiscript
ꢀⅲ
qrt supermix 4μl;混匀,短暂离心,使管壁上的溶液收集到管底;37℃孵育15min,85℃孵育5s;反应结束后,cdna置于-20℃中保存。
[0082]
(2)步骤s2、以所述cdna为模板进行rpa等温扩增反应获得dna扩增产物;
[0083]
所述步骤s2具体包括:
[0084]
s2-1:cdna为rpa反应模版,具体体系为:2μl cdna,primer a(10μm)2.4μl,primer b(10μm)2.4μl,rpa反应buffer 29.5μl,dd h2o 13.2μl。引物如表3所示:
[0085]
s2-2:混匀后将反应混合物加入到重组酶聚合酶冻干粉中混匀,加入2.5μl 280mm mgac混合后反应即开始,并置于42℃恒温水浴锅中孵育20分钟。
[0086]
(3)步骤s3、crispr/cas13a体系中的cas13a蛋白用原核表达方式合成,crrna经退火,体外转录,dnase消解,rna提纯。将rpa等温扩增产物加入到crispr/cas13a体系中,检测体系中的荧光强度变化。
[0087]
所述步骤s3具体包括:
[0088]
s3-1:将his6-twinstrep-sumo-hulwcas13a载体质粒5μl加入transetta(de3)感受态细胞中,移液枪捶打混匀,冰浴30min,热激30s,冰浴2min,加入500μllb液体培养基中混匀,37℃ 200rpm培养1h后,5000rpm离心5min,移除500μl上清,剩余菌液捶打混匀均匀涂于amp选择培养基上,挑取阳性克隆扩大培养。
[0089]
s3-2:菌液在lb培养基(含50μg
·
ml-1,amp)中于37℃,200rpm培养过夜。
[0090]
s3-3:取2ml菌液加入200ml lb培养基(含50μg
·
ml-1,amp)中扩大培养,37℃培养
至od600达到0.2-0.6。在15℃静置30分钟后加入iptg至最终浓度为0.2mm,在15℃,200rpm振荡培养24小时进行诱导表达。
[0091]
s3-4:收集培养液至50ml离心管中,4℃ 15000g离心1min,弃上清,收集沉淀。在裂解细菌之前,在裂解液中添加蛋白酶抑制剂(pmsf)至1mm,溶菌酶至终浓度为1μg/ml并混匀,大概600-700mg的细菌沉淀湿重加入3ml非变性裂解液(含100mm的pmsf和溶菌酶30微升),充分重悬菌体;冰水浴30min;
[0092]
s3-5:冰上超声裂解细菌。超声功率200w,5min(此时再用裂解液补充体积至10ml,体积视情况而定,工作2s,间歇2s,总时间2min,工作完成后调整离心管高度,防止冰化探针不在液面下,重复5次,至液体澄清);4℃ 10000g离心30min,收集上清并置于冰上。
[0093]
s3-6:取1ml混合均匀的50%his-tag纯化树脂凝胶,4℃离心(1000g
×
10s)弃去储存液。
[0094]
s3-7:向凝胶中加入0.5ml非变性裂解液混匀以平衡凝胶,4℃离心(1000g
×
10s)弃去液体,再重复重复平衡2次,弃去液体。将约离心后的裂解液的上清液加入其中,4℃在侧摆摇床上缓慢摇动60min;
[0095]
s3-8:将裂解液和his-tag纯化树脂凝胶的混合物装入亲和层析柱空柱管中;将纯化柱底部的盖子打开,在重力作用下使柱内液体流出;
[0096]
s3-9:收集菌液重复过柱2-3次;洗柱10次,每次加入1ml非变性洗涤液;洗脱目的蛋白6-10次,每次用0.5ml非变性洗脱液洗脱。将每次的洗脱液分别收集到不同的离心管中。收集获得的洗脱液即为纯化的蛋白样品。
[0097]
s3-10:为了制备crrna,将具有t7启动子序列的crrna dna引物在dna寡核苷酸(5x)的退火缓冲液(beyotime biotechnology)中以10mm的最终浓度退火。退火反应在95℃下变性2分钟,然后每8秒冷却至0.1℃至25℃;具体见实施例1中的crrna的获得。
[0098]
s3-11:使用体外转录t7试剂盒(takara)转录crrna。将转录反应在42℃下孵育2小时,
[0099]
s3-12:然后通过无rnase的dnase i除去反应中的dna。
[0100]
s3-13:转录物通过rna clean试剂盒(tiansgen)纯化。crrna储存在-80℃。
[0101]
s3-13:检测反应体系:cas13a蛋白,100μl检测缓冲液(20mmol/l hepes,60mmol/l nacl,6mmol/l mgcl2,ph6.8),0.5μl 50u/μl t7 rna聚合酶,1μl50mm atp,1μl 50mm gtp,1μl 50mm ctp,1μl 50mm utp,0.5μl 40u/μl rnase抑制剂,0.5μl纯化的lwcas13a(40ng/μl),0.5μl crrna(10ng/μl),0.5μl 20μmssrna探针。每个基于crispr/cas13的检测系统均在37℃进行,使用酶标仪在485nm激发波长和529nm发射波长下监控荧光强度,每30s读取一次荧光强度,共设置45个荧光强度动力学循环。
[0102]
作为本发明实施例的另一种实施方式,所述试剂盒还可做成胶体金检测试剂盒;
[0103]
胶体金检测试剂盒的组成:检测试剂同实施例2,不同的是本实施例中的特异性荧光探针如seq id no.15-17所示的任意一种探针,所述序列的3’端标记有生物素,5’端标记的有fam、vic、hex、trt、cy3、cy5、rox、joe和texas red中的一种;本实施例中5’端标记的为fam。所述检测试剂盒制备成胶体金检测试剂盒时,所述胶体金检测试剂盒包括底板,粘合在底板上且依次搭接的样品垫、结合垫、硝酸纤维素膜和吸水垫;所述硝酸纤维膜上靠近结合垫的一侧设有质控线,硝酸纤维膜上靠近吸水垫的一侧设有检测线;所述结合垫上涂有
cy5单克隆抗体包被的胶体金;所述质控线上涂有链霉亲和素;所述检测控线上涂有鼠抗。所述底板为pvc板;样品垫为硝酸纤维素膜;结合垫的材料为玻璃纤维素膜;所述吸水垫为吸水滤纸。所述检测试纸由硬质塑料卡包装。
[0104]
胶体金检测试剂盒的制备方法
[0105]
(1)制作颗粒大小合适的胶体金溶液
[0106]
(2)用兔抗cy5单克隆抗体包被胶体金,得到包被后的胶体金溶液;
[0107]
(3)将包被后的胶体金溶液喷于结合垫上,烘干备用;
[0108]
(4)在硝酸纤维膜上检测线位置喷鼠抗溶液;在质控线位置喷链霉亲和素溶液,烘干备用;
[0109]
(5)将样品垫、结合垫、硝酸纤维素膜和吸水垫依次搭接并粘合于底板上,切成检测试纸条,将检测试纸条用硬质塑料卡包装。
[0110]
实验例1、用于检测植物番茄斑萎病毒的试剂盒的性能
[0111]
一、crrna的特异性检测
[0112]
为了确定本方法的检出特异性,利用所建立的监测体系同时对确定含有tswv,pvy,tmv,cmv,tzsv的本氏烟进行检测。
[0113]
如图2结果可知,本发明具有较好的检测特异性,只在tswv存在的情况下,检测体系中的荧光强度才会发生明显的升高。
[0114]
二、crrna的灵敏性试验
[0115]
为了确定本方法的最小检出量,将合成的质粒标准品稀释成105、103、102、101拷贝/μl等4个浓度梯度后作为模板进行检测。
[0116]
图3为不同浓度的rpa反应的质粒模板的在45个动力学循环中的荧光强度,阴性对照使用不含rnase的水代替rpa产物;
[0117]
图4为在每种稀释度下基于crispr/cas13a的检测第15分钟(第30个动力学循环)后产生的荧光信号强度;阴性对照使用不含rnase的水代替rpa产物;
[0118]
如图3,4结果可知,本发明具有较广的检测范围,其最低检测限为10拷贝/μl。
[0119]
应用例1
[0120]
1、不同样本的检测
[0121]
利用基于crispr/cas13的检测方法检测10个番茄叶片样品,检测方法同实施例2;
[0122]
结果如图5所示,表明从第30个动力学循环即可观察到阳性样品的荧光强度值明显高于阴性样品;
[0123]
2、不同方法准确性的比较
[0124]
利用pcr的检测方法验证所建立的检测方法的准确性,利用rpa引物将10个番茄叶片样品cdna进行pcr扩增,扩增产物利用琼脂糖凝胶电泳验证扩增结果。
[0125]
图6为利用琼脂糖凝胶电泳检测10个番茄样品比较所建立的检测方法的准确性,结果显示与基于crispr/cas13的检测方法所得到的结果相同。
[0126]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
[0127]
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他
性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0128]
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
[0129]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1