对氧化还原敏感的蛋白及其制备方法和应用
1.本发明涉及荧光蛋白探针技术领域,尤其涉及对氧化还原敏感的蛋白及其制备方法和应用。
背景技术:
2.氧化还原代谢在生命体的基础特征中占据着极其重要的地位,它参与了体内众多的生命活动和重要事件。氧化还原代谢发生紊乱时不可避免的会干扰细胞正常生理活动甚至导致机体疾病等严重损伤的发生,已经有许多研究表明它与癌症、炎症损伤、肥胖、糖尿病、神经退行性疾病等有着紧密的联系。因此对生物体氧化还原状态的检测很有必要。
3.氧化还原代谢物包括大分子多肽类和小分子物质类。大分子多肽类主要为含有巯基-二硫键的物质,比如谷胱甘肽、谷氧还蛋白以及其他带有活性半胱氨酸残基的蛋白。小分子类主要为活性氧自由基、辅酶及生育酚等物质。本发明涉及到的探针检测的对象主要是巯基-二硫键类氧化还原代谢物。
4.传统的检测氧化还原代谢的方法包括:使用高效液相色谱法、酶法、毛细管酶循环电泳和同位素标记法来检测包括nad(h)和nadp(h)在内的吡啶核苷酸类小分子;使用巯基化学染料标记的方法测定细胞内谷胱甘肽的含量;使用非还原/还原对角线电泳法和凝胶迁移法来检测巯基-二硫键的代谢状态;使用化学探针的方法来检测h2o2等。但是传统方法中的生化方法具有极高的侵入性和破坏性,在处理过程中会造成样品的破碎和人为氧化的引入,导致检测不准;而化学探针在定量、细胞毒性和亚细胞定位等方面仍有很大的局限性。
5.相比于以上方法,遗传编码的探针例如荧光蛋白探针可以通过基因编码的方式结合上不同信号肽,定位到不同细胞结构,可以在活细胞、组织乃至生物体水平,原位、高时空、高分辨、高亮度地实现对多种蛋白酶活性状态、特定分子浓度变化以及多种生理过程的可视化检测。因此,遗传编码的探针很适合用于活细胞水平氧化还原的高时空监测,已经成为氧化还原生物学领域的重要研究工具。
6.一般来讲激发光的波长越短带来的细胞毒性越大,并且在成像时更容易受到生物体高水平自发荧光的影响,给深层组织成像带来困扰。另外,在氧化还原代谢的检测中,使用不同颜色的探针进行单细胞内的多参数分析有助于我们更好的理解氧化还原代谢的区室化特征以及细胞器之间的物质代谢相互作用。深红色的探针不仅可以最大程度避免自发荧光的干扰,而且可以与其他颜色探针在光谱上区分开。因此,本领域需要开发性质优良的红色或深红色氧化还原探针,实现对细胞中氧化还原动态变化的高时空监测。
技术实现要素:
7.本发明的目的在于提供氧化还原敏感的探针,本发明提供的荧光蛋白探针能够实现对氧化还原变化的高灵敏度检测。
8.本发明提供一种对氧化还原敏感的多肽,其具有(1)seq id no:1所示序列并且其
中一个或多个氨基酸残基突变为半胱氨酸,(2)(1)的序列首尾通过连接肽相连并在153和154位之间、169和168位之间、或151和150位之间断开的序列,或(3)与(1)或(2)具有至少90%序列相同性并且保留对氧化还原敏感的功能的变体,所述变体中突变为半胱氨酸的所述一个或多个氨基酸残基相对(1)或(2)的序列未变化。
9.在一个或多个实施方案中,所述连接肽选自g、gs、ggs、ggsg、ggtg、ggtgg、ggsgg、ggsggt、ggtggs。
10.在一个或多个实施方案中,所述的突变为半胱氨酸的所述一个或多个氨基酸残基位于由所述多肽所形成的蛋白的β折叠上。在一个或多个实施方案中,所述一个或多个氨基酸残基是所述多肽的二聚界面和/或β折叠上的氨基酸残基。在一个或多个实施方案中,所述一个或多个氨基酸残基位于由所述多肽所形成的蛋白的β桶状结构表面而且氨基酸的支链朝向β桶外侧。
11.在一个或多个实施方案中,所述一个或多个氨基酸残基选自seq id no:1的第138、139、141、142、144、146、148、157、159、162、163、192、194、196、198、200、202、212、214、216、218、220位氨基酸残基中的一个或多个。
12.在一个或多个实施方案中,所述一个或多个氨基酸残基选自seq id no:1的第157、192、202、220位氨基酸残基中的一个或多个。
13.在一个或多个实施方案中,所述多肽具有seq id no:3-6中任一所示的氨基酸序列,或与其具有至少90%序列相同性并且保留对氧化还原敏感的功能的变体,所述变体中第157、192、202或220位半胱氨酸未变化。具体地,所述变体是seq id no:3的变体,并且其第157位半胱氨酸未变化;所述变体是seq id no:4的变体,并且其第192位半胱氨酸未变化;所述变体是seq id no:5的变体,并且其第202位半胱氨酸未变化;所述变体是seq id no:6的变体,并且其第220位半胱氨酸未变化。
14.在一个或多个实施方案中,所述多肽具有seq id no:2所示序列并且其中对应于(1)中seq id no:1的所述一个或多个氨基酸残基的氨基酸残基突变为半胱氨酸。
15.在一个或多个实施方案中,所述多肽具有seq id no:7-10中任一所示的氨基酸序列,或与其具有至少90%序列相同性并且保留对氧化还原敏感的功能的变体,所述变体中第4、39、49、67位半胱氨酸未变化。具体地,所述变体是seq id no:7的变体,并且其第4位半胱氨酸未变化;所述变体是seq id no:8的变体,并且其第39位半胱氨酸未变化;所述变体是seq id no:9的变体,并且其第49位半胱氨酸未变化;所述变体是seq id no:10的变体,并且其第67位半胱氨酸未变化。
16.在一个或多个实施方案中,所述多肽还包含位于其n端、序列中、和/或c端的其它功能多肽。在一些实施方案中,其他功能多肽可以是与其相连的将多肽定位到不同细胞器(亚细胞定位)的定位序列、用于纯化的标签或者用于免疫印迹的标签,或者能识别感兴趣的靶标的序列,例如氧化还原酶grx、trx等。
17.本发明还提供核酸分子,其包含(1)本文所述多肽或蛋白的编码序列,(2)与(1)具有至少99%、95%、90%、80%、70%或50%序列相同性的序列,(3)(1)或(2)的互补序列或片段,优选所述片段长5-50bp,更优选10-30bp。
18.在一个实施方案中,本发明的核酸分子具有选自以下的序列:(1)seq id no:1-10中任一所示氨基酸序列的编码序列或其互补序列,(2)与(1)具有至少99%、95%、90%、
80%、70%或50%相同性的序列,(3)(1)或(2)的片段。
19.本发明还涉及上述核酸分子的变体,包括编码本发明多肽的片段、类似物、衍生物、可溶性片段和变体的核酸序列或其互补序列。
20.本发明还提供包含本文所述核酸分子的核酸构建物。该核酸分子编码本发明所述多肽。在一个或多个实施方案中,所述核酸分子的序列与表达控制序列操作性连接。在一个或多个实施方案中,所述核酸构建物是克隆载体、表达载体或重组载体。在一些实施方案中,表达载体选自原核表达载体、真核表达载体和病毒载体。
21.本发明还提供了表达本文所述多肽,或包含本文所述核酸分子或核酸构建物的细胞。
22.本发明提供了制备本文所述多肽的方法,包括:提供表达本文所述多肽的细胞,在所述细胞表达的条件下培养所述细胞,和分离所述多肽。
23.本发明还提供制备本文所述多肽的方法,包括以下步骤:1)将编码本文所述多肽的核酸分子纳入核酸构建物;2)将核酸构建物转移到宿主细胞中;3)在适合所述核酸构建物表达的条件下培养所述宿主细胞;4)分离多肽。
24.本发明还提供了包括本文所述多肽或核酸分子或如本文所述方法制备的多肽的检测试剂盒,和检测氧化还原状态所需的其他试剂。
25.本发明还提供检测细胞内或细胞外氧化还原状态的方法,包括:使所述细胞表达或分泌本文所述多肽或孵育本文所述的细胞;任选地加入感兴趣的物质;和检测所述多肽的变化。优选地,所述变化是所述多肽的光学性质的变化,更优选地,所述变化是所述多肽的红色荧光强度的变化。在一个或多个实施方案中,所述多肽的变化指示氧化还原势能升高或不变或降低。在一个或多个实施方案中,所述感兴趣的物质是具有氧化和/或还原性的物质或使细胞的氧化还原状态发生变化的物质。在一个或多个实施方案中,所述感兴趣的物质是化合物和/或细胞。在一个或多个实施方案中,所述感兴趣的物质选自小分子化合物、多肽、蛋白、核酸分子和细胞。
26.本发明还提供检测样品中感兴趣的物质的方法,包括:使本文所述多肽或细胞与样品接触,和检测所述多肽的变化。所述检测可以在体内、体外、细胞内、细胞外、亚细胞或原位进行。优选地,所述变化是所述多肽的光学性质的变化,更优选地,所述变化是所述多肽的红色荧光强度的变化。在一个或多个实施方案中,所述感兴趣的物质是具有氧化和/或还原性的物质或使细胞的氧化还原状态发生变化的物质。在一个或多个实施方案中,所述感兴趣的物质是化合物和/或细胞。在一个或多个实施方案中,所述感兴趣的物质选自小分子化合物、多肽、蛋白、核酸分子和细胞。
27.本文还提供定量样品中感兴趣的物质的方法,包括:使本文所述多肽或细胞与样品接触,和检测所述多肽的变化,和根据所述变化定量样品中的感兴趣的物质。优选地,所述变化是所述多肽的光学性质的变化,更优选地,所述变化是所述多肽的红色荧光强度的变化。在一个或多个实施方案中,所述感兴趣的物质是具有氧化和/或还原性的物质或使细胞的氧化还原电势变化的物质。在一个或多个实施方案中,所述感兴趣的物质是化合物和/或细胞。在一个或多个实施方案中,所述感兴趣的物质选自小分子化合物、多肽、蛋白、核酸分子和细胞。
28.本发明还提供了筛选能引起氧化还原状态改变的物质的方法,包括:使本文所述
多肽或细胞与候选物质接触,检测所述多肽的变化,和根据所述多肽的变化筛选物质。优选地,所述变化是所述多肽的光学性质的变化,更优选地,所述变化是所述多肽的红色荧光强度的变化。在一个或多个实施方案中,所述多肽的变化指示所述物质能引起氧化还原势能升高或降低。在一个或多个实施方案中,所述物质是化合物和/或细胞。在一个或多个实施方案中,所述物质选自小分子化合物、多肽、蛋白、核酸分子和细胞。所述方法可以高通量地筛选物质。
29.本发明还提供了筛选能稳定或加剧氧化还原状态变化的物质的方法,包括:使本文所述多肽或细胞与候选物质和任选的氧化或还原剂接触,检测所述多肽的变化,和根据所述变化筛选物质。优选地,所述变化是所述多肽的光学性质的变化,更优选地,所述变化是所述多肽的红色荧光强度的变化。在一个或多个实施方案中,所述变化相比不含所述候选物质时减弱或增强指示所述物质能稳定或加剧氧化还原状态的变化。
30.本发明还提供了检测物质相互作用的方法,包括:使本文所述多肽与两种或多种候选物质接触,或使本文所述细胞与一种或多种候选物质接触,和检测所述多肽的变化,所述多肽的变化指示所述两种或多种物质之间存在相互作用,或所述细胞与所述一种或多种候选物质存在相互作用。优选地,所述变化是所述多肽的光学性质的变化,更优选地,所述变化是所述多肽的红色荧光强度的变化。优选地,所述相互作用引起所述细胞或所述物质中任意或环境的氧化还原势升高或不变或降低。在一个或多个实施方案中,所述物质是化合物和/或细胞。在一个或多个实施方案中,所述物质选自小分子化合物、多肽、蛋白、核酸分子和细胞。
31.本发明还提供了针对配体筛选化合物的方法,包括:使本文所述多肽或细胞与候选化合物和配体接触,检测所述多肽的变化,和根据所述多肽的变化筛选物质。优选地,所述变化是所述多肽的光学性质的变化,更优选地,所述变化是所述多肽的红色荧光强度的变化。在一个或多个实施方案中,所述多肽的变化指示所述化合物与配体的相互作用,其中所述化合物与配体的相互作用能引起所述化合物和/或配体和/或环境的氧化还原势升高或不变或降低。
32.本发明还提供了本文所述多肽在细胞内/外定位中的应用。在一个或多个实施方案中,所述定位通过检测亚细胞结构的氧化还原变化实现。在一个或多个实施方案中,所述定位是实时定位。
33.本发明的有益效果:本发明提供了一组荧光蛋白探针。本发明通过将荧光蛋白mkate及其环形重排物cpmkate基因的部分核苷酸替换成半胱氨酸,通过蛋白寡聚体结构的变化导致荧光蛋白荧光强度的变化,最后得到对氧化还原敏感的荧光蛋白探针。本发明提供的荧光蛋白探针分子量相对较小且易于成熟,动态变化大,能够通过基因操作的方法在细胞中表达,可在细胞内实现氧化还原的时空特异性检测,省去了耗时的样品处理步骤。同时,本发明获得的荧光蛋白探针具有较长的激发、发射波长,发射光为深红色,不仅可以最大程度避免自发荧光的干扰,而且可以很好的与其他颜色探针在光谱上区分开,非常有助于探针的多色联用和单细胞内的多参数分析。
附图说明
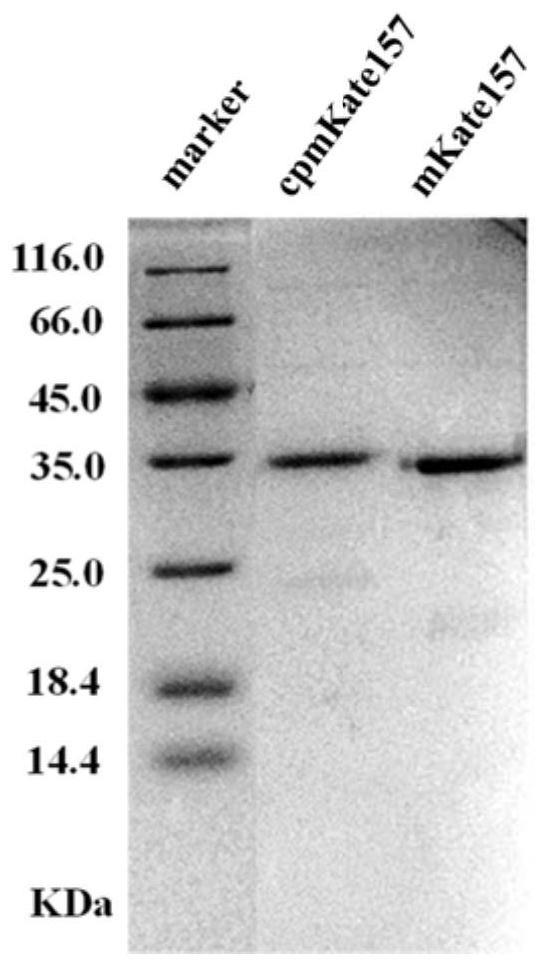
34.图1为实施例6中示例性氧化还原荧光探针的sds-page分析图。
35.图2为实施例2中mkate环化突变体的检测结果图。a,荧光强度;b,还原状态比氧化状态荧光变化倍数。
36.图3为实施例3中含有巯基突变的荧光蛋白mkate及cpmkate突变体的筛选结果图。a,荧光强度;b,还原状态比氧化状态荧光变化倍数。
37.图4为实施例4中能够快速响应的含有巯基突变的mkate及cpmkate突变体对氧化剂的响应结果图。a,mkate;b,cpmkate。
38.图5为实施例5中mkate及cpmkate自身巯基对氧化还原荧光探针影响的结果图。a,mkate,荧光强度;b,mkate,还原状态比氧化状态荧光变化倍数;c,cpmkate,荧光强度;d,cpmkate,还原状态比氧化状态荧光变化倍数。
39.图6为实施例6中示例性氧化还原荧光探针的荧光光谱性质结果图。a,mkate;b,cpmkate。
40.图7为实施例7中示例性氧化还原荧光探针在活细胞内的可逆性检测结果图。a-d,mkate;e-h,cpmkate。
41.图8为实施例8中示例性氧化还原荧光探针在哺乳动物细胞hek293中亚细胞结构定位分析图。
42.图9为实施例9所述的在活细胞水平基于示例性氧化还原荧光探针进行高通量化合物筛选的分析图。
43.图10为实施例10中不同营养条件下示例性氧化还原荧光探针在哺乳动物细胞hek293中的动态检测结果图。a-d,mkate;e-f,cpmkate。
具体实施方案
44.本发明提供了氧化还原敏感的荧光蛋白探针,所述的荧光蛋白为含有半胱氨酸突变的mkate蛋白或cpmkate蛋白。
45.在给出数值或范围时,本文所用术语“约”指该数值或范围在给定数值或范围的20%以内、10%以内和5%以内。
46.本文所用术语“包含”、“包括”和其等同形式包括“含有”以及“由
……
组成”的含义,例如“包含”x的组合物可仅由x组成或可含有其它物质,例如x+y。
47.本文所用术语“氧化还原荧光探针”、“氧化还原敏感的探针”、“氧化还原敏感的多肽”指对氧化还原状态或其变化产生响应的多肽,所述响应包括多肽的化学,生物学,电学或生理学参数的任何响应。本文所述氧化还原敏感的多肽还可包括其功能变体,包括但不限于可以对氧化还原状态或其变化产生响应从而发生与亲本多肽相同或相似变化的变体。氧化还原状态可指氧化还原势能的水平。本发明的探针对氧化还原状态或其变化产生响应而改变荧光强度,将该荧光强度标准化,可获得标准化的氧化还原状态。本发明探针在不同条件下的荧光强度的变化可指示所述不同条件的氧化还原性/状态。
48.本发明所述氧化还原敏感多肽包括但不限于mkate荧光蛋白或其环形重排物cpmkate的一个或多个氨基酸残基突变为半胱氨酸的多肽序列或与其具有至少70%、至少80%、至少90%、至少95%、至少98%、或至少99%以上同源性并且保留氧化还原敏感性的变体。示例性mkate荧光蛋白如seq id no:1所示。示例性cpmkate荧光蛋白如seq id no:2所示。所以,本文所述氧化还原敏感多肽具有(1)seq id no:1所示序列并且其中一个或多
个氨基酸残基突变为半胱氨酸,或(2)(1)的序列首尾通过连接肽相连并在153和154位之间、169和168位之间、或151和150位之间断开的序列,(3)与(1)或(2)具有至少90%序列相同性并且保留对氧化还原敏感的功能的变体,所述变体中突变为半胱氨酸的所述一个或多个氨基酸残基相对(1)或(2)的序列未变化。
49.在本发明中,所述的半胱氨酸是指在蛋白质高级结构中存在的,处在蛋白β折叠上的半胱氨酸。蛋白单体上引入的半胱氨酸性质活泼,具有较强的亲核性,可与多种物质反应形成二硫化物或可逆的二硫键,在这个过程中,蛋白寡聚体结构的空间构象可能会产生动态变化,进一步表现为荧光蛋白荧光强度的变化。本发明所述半胱氨酸突变主要指:对于mkate或cpmkate荧光蛋白的二聚界面和/或β折叠上的氨基酸残基,通过将合适位置的单个氨基酸残基定向突变为半胱氨酸,得到半胱氨酸突变。在本发明中,所述半胱氨酸优选引入到mkate或cpmkate荧光蛋白的β桶状结构表面而且相应位点的氨基酸支链朝外。所述突变产生的突变体为具有mkate或cpmkate荧光蛋白相同功能、但序列不同的变异体。所述半胱氨酸突变能够导致蛋白寡聚体结构变化,最后导致荧光强度发生改变。
50.在本发明所述多肽中,突变为半胱氨酸的一个或多个氨基酸残基选自第138、139、141、142、144、146、148、157、159、162、163、192、194、196、198、200、202、212、214、216、218、220位氨基酸残基中的一个或多个。优选地,突变的一个或多个氨基酸残基选自第157、192、202、220位氨基酸残基中的一个或多个,例如优选为第157位氨基酸残基。相应的荧光蛋白探针分别为mkate157、mkate192、mkate202和mkate220。在一个或多个实施方案中,所述多肽具有seq id no:3-6中任一所示的氨基酸序列,或与其具有至少90%序列相同性并且保留对氧化还原敏感的功能的变体,所述变体中第157、192、202或220位半胱氨酸未变化。
51.在某些实施方式中,本发明所述氧化还原敏感多肽是环形重排的多肽,例如mkate的环形重排物cpmkate。所述环形重排可以是在前段所述多肽的首尾通过连接肽相连并在某些位置断开的序列。本领域知晓从mkate获得cpmkate的可用的断开位置,例如在153和154位之间、169和168位之间或151和150位之间断开的序列,如153和154位之间断开的序列。在一个或多个实施方案中,所述连接肽选自g、gs、ggs、ggsg、ggtg、ggtgg、ggsgg、ggsggt、ggtggs。在某些具体实施方案中,所述氧化还原敏感多肽具有seq id no:2所示序列并且其中对应于seq id no:1的所述一个或多个氨基酸残基的氨基酸残基突变为半胱氨酸。例如,所述氧化还原敏感多肽具有seq id no:2所示序列并且其中对应于seq id no:1的选自第138、139、141、142、144、146、148、157、159、162、163、192、194、196、198、200、202、212、214、216、218、220位氨基酸残基中的一个或多个突变为半胱氨酸。优选地,突变的一个或多个氨基酸残基选自对应于seq id no:1的第157、192、202、220位氨基酸残基中的一个或多个,例如优选为对应于seq id no:1的第157位氨基酸残基。相应的荧光蛋白探针分别为cpmkate157、cpmkate192、cpmkate202和cpmkate220。在一个或多个实施方案中,所述多肽具有seq id no:7-10中任一所示的氨基酸序列,或与其具有至少90%序列相同性并且保留对氧化还原敏感的功能的变体,所述变体中第4、39、49、67位半胱氨酸未变化。
52.本文所述探针可作为基本单元与不影响探针性质的其他蛋白或多肽连接。在一些实施方案中,本文所述氧化还原荧光探针还包含与之融合的其它功能多肽。本文所述其他功能多肽不影响荧光探针的性质。其他功能多肽可位于所述荧光蛋白探针的n端和/或c端和/或序列中。在一些实施方案中,其他功能多肽包括穿膜信号分子、将荧光探针定位到不
同细胞器的多肽、用于纯化的标签、用于免疫印迹的标签。本文所述“细胞器”或“亚细胞结构”包括细胞浆、线粒体、细胞核、内质网、细胞膜等。本领域知晓将探针定位到不同细胞器的信号肽及其序列。在一些实施方案中,用于纯化的标签或者用于免疫印迹的标签包括6组氨酸(6*his)、谷胱甘肽硫转移酶(gst)、flag。本文所述融合多肽中的荧光蛋白探针和其它多肽之间可具有连接肽接头。荧光探针和其它蛋白或多肽之间可具有接头,接头序列可为0个或多个柔性氨基酸组成的短肽链,如g、s、y。
53.提到某多肽或蛋白时,本发明所用术语“变体”或“突变体”包括具有所述多肽或蛋白相同功能、但序列不同的变体。多肽或蛋白的变体可包括:同源序列、保守性变体、等位变体、天然突变体、诱导突变体。这些变体包括但并不限于:在所述多肽或蛋白的序列中缺失、插入和/或取代一个或多个(通常为1-30个,较佳地1-20个,更佳地1-10个,最佳地1-5个)氨基酸,以及在其羧基末端和/或氨基末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸获得的序列。这些变体还可包含与所述多肽或蛋白的序列相同性为至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约98%、至少约99%或100%的多肽或蛋白。不希望受理论限制,氨基酸残基发生改变而不改变多肽或蛋白质的总体构型和功能,即功能保守突变。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变多肽或蛋白的功能。在本领域中,性能相似的氨基酸往往指具有相似侧链的氨基酸家族,在本领域已有明确定义。这些家族包括具有碱性侧链的氨基酸(例如赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(例如天冬氨酸、谷氨酸)、具有不带电荷的极性侧链的氨基酸(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、具有非极性侧链的氨基酸(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、乳酸、苯丙氨酸、甲硫氨酸、色氨酸)、具有β-分支侧链的氨基酸(例如苏氨酸、缬氨酸、异亮氨酸)和具有芳香侧链的氨基酸(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。又比如,在氨基末端和/或羧基末端添加一个或数个氨基酸通常也不会改变多肽或蛋白的功能。对于许多常见已知非遗传性编码氨基酸的保守氨基酸取代本领域已知。其他非编码氨基酸的保守取代可基于其物理性质与遗传上编码的氨基酸的性质的比较来确定。在本文所述变体中,上述已突变为半胱氨酸的一个或多个氨基酸残基未变化。
54.在两种或多种多肽或核酸分子序列中,术语“相同性”或“相同性百分数”指在比较窗口或指定区域上,采用本领域已知方法如序列比较算法,通过手工比对和目测检查来比较和比对最大对应性时,两个或多个序列或子序列相同或其中在指定区域有一定百分数的氨基酸残基或核苷酸相同(例如,至少60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同)。例如,适合测定序列相同性百分数和序列相似性百分数的优选算法是blast和blast 2.0算法,分别可参见altschul(1997)等(altschul,madden et al.1997)和altschul(1990)等(altschul,gish et al.1990)。
55.本领域技术人员公知,在基因克隆操作中因为需要引入酶切位点而在表达的多肽或蛋白末端引入了一个或多个不相干的残基并不影响目的多肽或蛋白的活性。此外,为了构建融合蛋白、促进重组蛋白的表达、获得自动分泌到宿主细胞外的重组蛋白、或利于重组蛋白的纯化,可将一些氨基酸添加至重组蛋白的n-末端、c-末端或该蛋白内的其它合适区域内,例如,包括但不限于,适合的接头肽、信号肽、前导肽、末端延伸、谷胱甘肽s-转移酶(gst)、麦芽糖e结合蛋白、蛋白a、如6his或flag的标签,或xa因子或凝血酶或肠激酶的蛋白
水解酶位点。
56.本文所用术语“功能片段”、“衍生物”和“类似物”是指基本上保持与原始多肽或蛋白(例如本文所述氧化还原敏感的多肽)相同的生物学功能或活性的蛋白。本发明的多肽或蛋白的功能变体、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的蛋白,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的蛋白,或(iii)成熟蛋白与另一个化合物(比如延长蛋白半衰期的化合物,例如聚乙二醇)融合所形成的蛋白,或(iv)附加的氨基酸序列融合到此蛋白序列而形成的蛋白(如分泌序列或用来纯化此蛋白的序列或蛋白原序列,或与抗原igg片段的形成的融合蛋白)。根据本文的教导,这些功能变体、衍生物和类似物属于本领域熟练技术人员公知的范围。所述类似物可以是具有不同于天然l-氨基酸的残基(如d-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的氧化还原敏感多肽并不限于上述列举的代表性蛋白、变体、衍生物和类似物。修饰形式包括:体内或体外的蛋白的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化,如那些在蛋白的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的蛋白。这种修饰可以通过将蛋白暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的蛋白。
57.本发明所述“突变”包括上述氨基酸向半胱氨酸的突变以及变体中的各种突变。本发明对所述突变的方法没有特殊的限定,可以是采用分子生物学的方法,如本发明优选采用反向pcr方法来实现氨基酸的突变,即通过一对特异性的引物与突变位点的蛋白序列两端匹配,这样通过反向pcr扩增就可以产生含有突变位点核苷酸的线性化质粒,之后形成的重组质粒编码产生的蛋白就含有特定突变的氨基酸。或者也可以采用物理诱变或化学诱变方法,如辐射或添加诱变剂。
58.本发明包含编码本发明所述多肽的核酸分子。本发明所用术语“核酸分子”或“核苷酸”或“多核苷酸”或“核酸序列”可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的、编码链或非编码链。提到核酸时,本文所用术语“变体”可以是天然发生的等位变体或非天然发生的变体。这些核苷酸变体包括简并变体、取代变体、缺失变体和插入变体,但不会从实质上改变其编码的蛋白的功能。本发明核酸可包含与所述核酸序列的序列相同性为至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约98%、至少约99%或100%的核苷酸序列。本发明还涉及与上述的序列杂交的核酸片段。如本文所用,“核酸片段”的长度至少含15个核苷酸,较好是至少30个核苷酸,更好是至少50个核苷酸,最好是至少100个核苷酸以上。核酸片段可用于核酸的扩增技术(如pcr),例如引物或探针。
59.本发明荧光探针或融合蛋白的全长序列或其片段通常可以用pcr扩增法、人工合成法或重组法获得。本领域知晓常规pcr、合成法、重组法的步骤和所用试剂。此外,可通过突变pcr或化学合成等方法将突变引入本发明蛋白序列中。
60.本发明也涉及到核酸构建物,该核酸构建物含有本文所述的多核苷酸,以及与这些序列操作性连接的一个或多个调控序列。本发明所述的多核苷酸可以多种方式被操作以
保证所述多肽或蛋白的表达。在将核酸构建物插入载体之前可根据表达载体的不同或要求而对核酸构建物进行操作。利用重组dna方法来改变多核苷酸序列的技术是本领域已知的。
61.在某些实施方案中,所述核酸构建物是载体。载体可以是克隆载体,也可以是表达载体,或者是同源重组载体。本发明的多核苷酸可被克隆入许多类型的载体,例如,质粒、噬菌粒、噬菌体衍生物、动物病毒和粘粒。克隆载体可用于提供本发明蛋白或多肽的编码序列。表达载体可以以细菌载体或病毒载体形式提供给细胞。通常通过可操作地连接本发明的多核苷酸至启动子,并将构建体并入表达载体,实现本发明多核苷酸的表达。该载体对于复制和整合真核细胞可为合适的。在一个或多个实施方案中,克隆载体和表达载体是一种载体,即克隆表达载体。同源重组载体用于将本文所述的表达框整合到宿主基因组中。
62.典型的表达载体包含可用于调节期望核酸序列表达的表达控制序列,与本发明所述的核酸序列或其互补序列操作性连接。本发明所用术语“表达控制序列”指调控目的基因的转录、翻译和表达的可以与目的基因操作性连接的元件,可以是复制起点、启动子、标记基因或翻译控制元件,包括增强子、操纵子、终止子、核糖体结合位点等,表达控制序列的选择取决于所用的宿主细胞。在重组表达载体中,“操作性连接”是指目的的核苷酸序列与调节序列以允许核苷酸序列表达的方式连接。本领域的技术人员熟知能用于构建含本发明融合蛋白编码序列和合适的转录/翻译控制信号的表达载体的方法。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的dna序列可有效连接到表达载体中的适当启动子上,以指导mrna合成。这些启动子的代表性例子有:大肠杆菌的lac或trp启动子;λ噬菌体pl启动子;真核启动子包括cmv立即早期启动子、hsv胸苷激酶启动子、早期和晚期sv40启动子、反转录病毒的ltr和其他一些已知的可控制基因在原核或真核细胞或其病毒中表达的启动子。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
63.在获得重组表达载体后,将该载体转化到宿主细胞中,以产生包括本文所述多肽的蛋白或肽。此种转移过程可用转化或转染等本领域技术人员熟知的常规技术进行。本发明所述的宿主细胞是指能够接收和容纳重组dna分子的细胞,是重组基因扩增的场所,理想的受体细胞应该满足易于获取和增殖两个条件。本发明的“宿主细胞”可包括原核细胞和真核细胞,具体包括细菌细胞、酵母细胞、昆虫细胞和哺乳动物细胞。具体的可为大肠杆菌,链霉菌属,鼠伤寒沙门氏菌的细菌细胞,真菌细胞如酵母,植物细胞,果蝇s2或sf9的昆虫细胞,cho、cos、hek293、hela细胞、或bowes黑素瘤细胞的动物细胞等,其中包括但不限于上述的那些宿主细胞。所述宿主细胞优选各种利于基因产物表达或发酵生产的细胞,此类细胞已为本领域熟知并常用。在本发明实施例中所用的示例性宿主细胞为大肠杆菌bl21-de3菌株。本领域一般技术人员都清楚如何选择适当的载体、启动子、增强子和宿主细胞。本发明所述宿主细胞优选为大肠杆菌细胞。
64.本发明所述的转移到宿主细胞的方法为本领域常规的方法,包括磷酸钙或氯化钙共沉淀、deae-甘露聚糖-介导的转染、脂转染、天然感受态、化学介导的转移或电穿孔。当宿主为原核生物如大肠杆菌时,所述方法优选的为cacl2法或mgcl2法处理,所用的步骤为本领域公知。当宿主细胞是真核细胞时,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
65.本发明在将表达载体转入宿主细胞后,对转入表达载体的宿主细胞进行扩增表达培养,分离得到氧化还原荧光蛋白探针。所述宿主细胞扩增表达培养采用常规的方法即可。
根据所用的宿主细胞种类,培养中所用的培养基可以是各种常规培养基。在适于宿主细胞生长的条件下进行培养。
66.在本发明中,探针在细胞内、细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离或纯化重组的蛋白。本发明对分离所述氧化还原荧光蛋白探针的方法没有特殊限定,采用本领域常规的蛋白的分离方法即可。这些方法是本领域技术人员所熟知的,包括但并不限于:常规的复性处理、盐析方法、离心、渗透破菌、超声处理、超离心、分子筛层析、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。在一个实施方案中,利用his标签的亲和层析法进行探针的分离。
67.本文所述多肽或核酸分子或如本文所述方法制备的多肽可制备为检测试剂盒。所述试剂盒还包含检测氧化还原状态所需的其他试剂。本领域熟知检测细胞内外、物质、环境的氧化还原状态所需的其他试剂
68.本发明还提供了所述氧化还原荧光蛋白探针在亚细胞定位检测、氧化还原势实时动态检测以及高通量化合物筛选中的应用。本发明所述的氧化还原荧光蛋白探针可直接转入细胞中,在氧化还原的检测过程中,不需要耗时的样品处理过程,更加准确。
69.在一个方面,本发明还提供本文所述多肽在细胞内/外物质定位或氧化还原反应定位中的应用以及在氧化还原状态实时动态监测中的应用。所述定位或监测通过检测细胞或亚细胞结构的氧化还原变化实现。例如,所述的氧化还原荧光蛋白探针与细胞不同部位的信号肽连接,转入到细胞中,通过检测细胞中荧光信号的强弱,进行氧化还原状态的检测。
70.在另一个方面,本发明还提供定性和/或定量检测样品中感兴趣的物质的方法,包括:使本文所述多肽或细胞与样品接触,和检测所述多肽光学性质的变化,和任选的根据所述变化定量样品中的感兴趣的物质。本文所述“感兴趣的物质”主要是指具有氧化和/或还原性的物质。所述物质可以是具有氧化和/或还原性的任何化合物和/或细胞。在一个或多个实施方案中,所述物质选自小分子化合物、多肽、蛋白、核酸分子和细胞。本发明还提供了筛选能引起氧化还原势升高或降低的物质的方法,包括:使本文所述多肽或细胞与候选物质接触,检测所述多肽的光学性质的变化,和根据所述光学性质的变化筛选物质,其中所述光学性质的变化指示所述物质能引起氧化还原势升高或降低。本发明还提供了筛选能稳定或加剧氧化还原势变化的物质的方法,包括:使本文所述多肽或细胞与候选物质和任选的氧化或还原剂接触,检测所述多肽的光学性质的变化,和根据所述变化筛选物质,其中所述变化相比不含所述候选物质时减弱或增强指示所述物质能稳定或加剧氧化还原状态的变化。本发明方法便于高通量地筛选物质。所述的氧化还原荧光蛋白探针在进行高通量化合物筛选时,将不同的化合物添加到细胞培养液中,测定氧化还原状态的变化,从而筛选出可以跨膜进入细胞而且对细胞氧化还原状态有影响的化合物。在本发明中所述的氧化还原荧光蛋白探针在氧化还原检测以及高通量化合物筛选中的应用,均是非诊断和治疗目的,不涉及疾病的诊断和治疗。
71.本文所述检测可以在体内、体外、细胞内/细胞外、细胞器内或原位进行。因此,本文所述接触包括多肽与感兴趣的物质在细胞内、细胞外的接触。例如,所述多肽可以与感兴趣的化合物混合;或者,所述多肽可以与穿膜信号分子关联,从而穿过细胞膜进入细胞与感
兴趣的物质接触;或者,所述多肽的编码序列可以如上所述整合入细胞并由细胞表达,从而所述多肽在细胞内与感兴趣的物质接触;或者,所述多肽的编码序列可以与亚细胞定位序列关联,如上所述整合入细胞并由细胞表达,之后进入亚细胞结构与感兴趣的物质接触。又例如,所述多肽可以与细胞混合,在细胞分泌感兴趣的物质时所述多肽与该物质接触;或者,所述多肽的编码序列可以如上所述整合入细胞并由细胞表达、分泌,从而在细胞外与任何来源的感兴趣物质接触;或者,所述多肽的编码序列可以与穿膜信号分子关联,如上所述整合入细胞并由细胞表达、分泌,之后借助穿膜信号分子进入其他细胞与感兴趣的物质接触。
72.在另一个方面,本发明还提供了检测物质相互作用的方法,包括:使本文所述多肽与两种或多种候选物质接触或使本文所述细胞与一种或多种候选物质接触,和检测所述多肽的光学性质的变化,所述多肽的变化指示所述两种或多种物质之间存在相互作用或细胞与一种或多种候选物质存在相互作用。本文所述“相互作用”主要是指能引起细胞或物质中任意或环境的氧化还原势升高或不变或降低的相互作用。例如抗原抗体反应、酶促或非酶促反应、配体与受体的结合、磷酸化。
73.本发明还提供检测细胞内或细胞外氧化还原状态的方法,包括:使所述细胞表达或分泌本文所述多肽或孵育本文所述的细胞;任选地加入感兴趣的物质;和检测所述多肽的光学性质的变化。所述多肽的变化指示氧化还原状态,例如氧化还原势能升高或不变或降低。
74.在本发明中,浓度、含量、百分数和其它数值均可用范围的形式表示。也应理解,使用这种范围形式只是为了方便和简洁,应该被弹性地解读为包括范围上下限所明确提及的数值,还应包括该范围内包括的所有单个数值或子范围。在给出数值或范围时,所用术语“约”指该数值或范围在给定数值或范围的20%以内、10%以内和5%以内。
75.实施例
76.下面结合实施例对本发明提供的探针进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
77.i.实验材料和试剂
78.实施例中主要采用常规的基因工程分子生物学克隆方法和细胞培养以及成像方法等,这些方法是本领域普通技术人员所熟知的,例如:简
·
罗斯凯姆斯等的《分子生物学实验参考手册》,j.萨姆布鲁克,d.w.拉塞尔著,黄培堂等译:《分子克隆实验指南》(第三版,2002年8月,科学出版社出版,北京);费雷谢尼等的《动物细胞培养:基本技术指南》(第五版),章静波,徐存拴等译;j.s.博尼费斯农,m.达索等的《精编细胞生物学实验指南》,章静波等译。
79.实施例中所用的prsetb-mkate质粒由华东理工大学蛋白质实验室构建,pet28a质粒载体购自invitrogen公司。克隆菌株mach1、bl21-de3购自invitrogen公司。引物序列如seq id no:11-38所示。其余材料、试剂和仪器参见cn201810215698.7,其所有内容通过引用纳入本文。
80.ii.分子生物学方法和细胞实验方法
81.ii.1蛋白和活菌的荧光检测
82.蛋白的荧光检测
83.1.纯化的荧光蛋白探针经过sds-page鉴定后,使用测定缓冲液(100mm hepes,100mm nacl,ph 7.4)或者磷酸盐缓冲液pbs稀释探针成终浓度为0.4~1μm的蛋白溶液。用测定缓冲液(100mm hepes,ph 7.4)或者磷酸盐缓冲液pbs将还原剂dtt和氧化剂diamide分别配制成终浓度为20mm和1mm的储液。
84.2.取50μl 0.4μm的蛋白溶液,37℃温育5min,分别加入还原剂dtt和氧化剂diamide混匀后至终浓度为0.2μm,利用多功能荧光酶标仪测定蛋白在590nm下的光吸收。
85.3.取50μl 0.4μm的蛋白溶液,37℃温育5min,分别加入还原剂dtt和氧化剂diamide混匀后测定蛋白在590nm荧光激发后645nm发射的荧光强度。对样品的荧光激发、发射测定利用多功能荧光酶标仪完成。
86.活菌的荧光检测
87.1.探针蛋白在大肠杆菌中诱导表达完成后,4000rpm离心5min收菌并弃去上清,使用hepes缓冲液等体积重悬菌体进行洗涤。洗涤后再次收菌并弃去上清,加入适量的hepes缓冲液重悬菌体,最好用枪头轻轻吹打或涡旋来确保菌体混合均匀。
88.2.取100μl于96孔透明平底板中,用酶标仪在600nm处测定菌液的od值,将不同的样品统一到od
600
为0.2的浓度来检测。
89.3.将稀释后浓度一致的样品铺板到96孔不透明的黑板中,37℃温育5min,分别加入还原剂dtt和氧化剂diamide进行检测。
90.ii.2哺乳动物细胞的转染和荧光检测
91.1.将paav为基础的荧光蛋白探针质粒通过转染试剂lipofectamine2000(invitrogen)转染到hek293细胞中,置于37℃,5%co2的细胞培养箱中培养。待外源基因充分表达24~36h后进行荧光检测。
92.2.诱导表达完成后,将贴壁的hek293细胞,用pbs冲洗三次,置于hbss溶液中进行荧光显微镜检测。
93.ii.3其余实验
94.实施例所涉其他实验过程参见cn201810215698.7,其所有内容通过引用纳入本文。
95.实施例1:pet28a-mkate质粒的构建
96.以prsetb-mkate为模板扩增mkate基因,pcr产物凝胶电泳回收后用bamhi和noti双酶切,同时对pet28a载体进行相同的双酶切。使用t4 dna连接酶连接后,将连接产物转化入感受态trans 5α,转化的trans 5α涂布于lb平板(卡那霉素100μg/ml),置于37℃培养过夜。将生长trans 5α转化子进行质粒抽提后,进行pcr鉴定。阳性质粒经过测序正确后进行后续的质粒构建。
97.pet28a-mkate质粒的构建引物:seq id no:11-14。
98.实施例2:mkate环化突变体的质粒构建及选择
99.在本实施例中,我们选择169/168、151/150、154/153三组位点构建环形重排的cpmkate突变体。以pet28a-mkate为模板,分别扩增1-168和169-231,1-150和151-231,1-153和154-231短片段,并使用重叠pcr的方法将它们通过柔性连接肽进行连接,进一步扩增重排后的长基因片段。将pcr产物凝胶电泳回收后用bamhi和noti双酶切,同时对pet28a载体进行相同的双酶切。使用t4 dna连接酶连接后,将连接产物转化入感受态trans 5α,转化
的trans 5α涂布于lb平板(卡那霉素100μg/ml),置于37℃培养过夜。将生长trans 5α转化子进行质粒抽提后,进行pcr鉴定。pet28a-cpmkate169/168、pet28a-cpmkate151/150、pet28a-cpmkate154/153质粒的构建引物:seq id no:15-22。
100.阳性质粒测序正确后将重组质粒转化到感受态bl21(de3)中诱导表达并比较它们的荧光强度以及它们对于氧化剂和还原剂的响应。将结果归一化到mkate,具体的检测结果如图2所示。
101.检测结果显示三个重组环化突变体中169/168和151/150位点的突变体荧光亮度均弱于mkate,154/153位点的突变体荧光亮度基本与mkate一致。mkate自身对氧化还原的有1.5倍左右的响应,169/168位点的突变体对氧化还原的响应稍高于mkate,151/150和154/153位点的突变体对氧化还原的响应基本与mkate一致。综合来看选择mkate和mkate在154/153位点的环化突变体进行后续的质粒构建。
102.实施例3:pet28a-mkate和pet28a-cpmkate154/153不同位点半胱氨酸引入的质粒构建和检测
103.在本实施例中,我们以pet28a-mkate和pet28a-cpmkate154/153为基础质粒根据mkate的晶体结构选择了138、139、141、142、144、146、148、157、159、162、163、192、194、196、198、200、202、212、214、216、218、220共22个半胱氨酸引入位点。其中氧化还原响应比较大的位点有157、192、202和220,点突变所用的引物:seq id no:23-30。
104.通过设计合适的引物再利用pcr产生含有半胱氨酸突变的mkate和cpmkate154/153核酸片段,将线性化片段的5’端使用pnk酶进行磷酸化处理后,在peg 4000和t4连接酶的作用下连接形成重组质粒。质粒测序正确后将重组质粒转化到感受态bl21(de3)中诱导表达,在活菌水平比较它们的荧光强度以及它们在氧化剂diamide和还原剂dtt孵育后荧光强度的变化。具体的检测结果如图3所示。
105.结果显示这些突变体中对氧化还原响应比较大的样品有mkate157,mkate192,mkate202,mkate220,cpmkate157,cpmkate192,cpmkate202和cpmkate220(序列如seq id no:3-10所示)。综合荧光亮度和变化倍数,cpmkate157的性质最好,mkate157次之。其中,cpmkate157在活菌水平较其他样品在氧化和还原两种状态下荧光强度变化最大达到5倍,mkate157的荧光变化倍数最大达到4倍。由于cpmkate154/153和mkate蛋白自身有约1.5倍的响应,因此cpmkate157和mkate157各自以mkate标准化后的荧光变化倍数分别约为3倍、2.5倍。
106.实施例4:157,192,202,220四个位点的荧光探针的氧化动力学检测
107.在本实施例中,我们选择157,192,202,220四个位点的荧光探针:mkate157,mkate192,mkate202,mkate220,cpmkate157,cpmkate192,cpmkate202和cpmkate220(seq id no:3-10)对氧化响应的动力学特征做进一步研究。
108.将探针质粒转化到感受态bl21(de3)中诱导表达,菌液统一稀释到od600 0.2后使用90μl菌液加10μl化合物的体系在读取初始荧光值后迅速加入终浓度为300μm的氧化剂diamide并记录荧光值的变化过程。具体的检测结果如图4所示。
109.结果显示这些突变体在加入氧化剂后荧光值表现为立即下降,基于cpmkate的突变体响应速度均比基于mkate的突变体快,其中响应最快、变化最大的为cpmkate157,它在5min左右可以反应完全,荧光变化最大可达5倍。同时,结果说明mkate的这些突变体蛋白在
大肠杆菌内主要为还原状态,因此在微环境的氧化还原势升高时能够通过荧光强度的变化对其进行指示。
110.实施例5:mkate和cpmkate154/153自身半胱氨酸对探针的影响
111.在本实施例中,我们对mkate和cpmkate154/153自身带有的半胱氨酸对探针的影响进行了分析。
112.mkate和cpmkate154/153自身带有四个半胱氨酸残基,分别对应mkate蛋白的26位、114位、172位和222位。在氧化还原的检测中,荧光蛋白自身的半胱氨酸残基很有可能会带来干扰或是参与了探针的响应,为了探究这四个半胱氨酸对探针性质的影响,我们基于mkate157,mkate192,mkate202,mkate220,cpmkate157,cpmkate192,cpmkate202和cpmkate220分别做了c26a-c114m-c172v-c222s、c26a-c114m-c172v和c26a-c114m的组合突变。点突变所用的引物:seq id no:31-38。
113.组合突变的质粒测序正确后将重组质粒转化到感受态bl21(de3)中诱导表达,在活菌水平比较它们的荧光强度以及它们在氧化剂diamide和还原剂dtt孵育后荧光强度的变化倍数。具体的检测结果如图5所示。
114.结果显示:(1)mkate和cpmkate154/153组合突变体的变化趋势是一致的,但是后者整体的变化更大。(2)192位点突变探针的c26a/c114m/c172v/c222s和c26a/c114m/c172v组合突变体的变化倍数受到明显影响;192位点的c26a/c114m组合突变体的变化倍数基本不受影响。(3)220位点突变探针和202位点突变探针的组合突变结果与192位点类似。(4)157位点突变探针的c26a/c114m/c172v/c222s和c26a/c114m/c172v组合突变体的变化倍数受到较大影响;157位点突变探针的c26a/c114m组合突变体的变化倍数基本不受影响。(5)综合荧光亮度、动态变化,性质最优的为保留四个半胱氨酸的cpmkate157,其次为保留四个半胱氨酸的mkate157。
115.综上,我们认为157、192、202和220四个位点的突变体对氧化还原刺激做出的响应与蛋白二聚或寡聚有关,而mkate自身的172位、222位半胱氨酸因处在二聚界面上也参与并强化了这一过程。
116.实施例6:mkate157和cpmkate157探针的性质
117.本实施例中,我们选择对氧化还原响应最大的突变体mkate157和cpmkate157做性质的进一步研究。
118.首先,将纯化的mkate157和cpmkate157及mkate和cpmkate154/153通过sds-page电泳鉴定大小在35kda附近,其中cpmkate157因中间多了一段连接肽在蛋白大小稍大于mkate157。它们的大小符合pet28a-mkate和pet28a-cpmkate表达出的含his-tag纯化标签的蛋白质大小。蛋白的sds-page结果如图1所示。
119.随后,我们将纯化的mkate157和cpmkate157探针蛋白分别用终浓度为1mm的氧化剂diamide和终浓度为10mm的还原剂dtt在37℃孵育处理30min后,使用荧光分光光度计进行荧光光谱的测定。测定激发光谱时,固定发射在660nm处,在400nm至630nm的激发范围记录激发光谱;测定发射光谱时,固定激发在560nm处,在590nm至730nm的发射范围记录发射光谱。纯化的mkate157和cpmkate157探针的荧光光谱性质结果如图6所示。mkate157和cpmkate157的光谱和野生型的mkate类似,同时氧化状态和还原状态下的光谱不会发生迁移,只有荧光强度的改变。值得注意的是,mkate157和cpmkate157在蛋白上加入氧化剂和还
原剂处理的变化倍数稍小于在活菌中的变化倍数,说明本发明涉及到的氧化还原探针更适合用于活细胞环境。
120.实施例7:荧光探针在活细胞内的可逆性检测
121.在本实施例中我们选择157,192,202,220四个位点的荧光探针(mkate157,mkate192,mkate202,mkate220,cpmkate157,cpmkate192,cpmkate202和cpmkate220)对它们在活细胞内的可逆性进行研究。
122.将以上变化较好的8个探针质粒转化到感受态bl21(de3)中诱导表达,菌液统一稀释到od
600
为0.2后铺板到96孔全黑板中,先加入氧化剂diamide读取并记录荧光值的变化,再加入还原剂dtt读取并记录荧光值的变化。具体的检测结果如图7所示。根据检测结果可以看出,这8个探针在加入氧化剂后荧光表现为不同程度的下降,大约在5min左右达到最大变化,其中cpmkate157和mkate157的变化最大。当这8个探针受到氧化影响荧光下降到最大时加入还原剂,它们的荧光表现为立即恢复,说明本发明涉及到的氧化还原探针的响应是可逆的。
123.实施例8:荧光探针的亚细胞结构定位
124.在本实施例中,我们使用不同的定位信号肽与示例性氧化还原荧光探针cpmkate157的c端或n端进行融合。
125.将融合了不同定位信号肽的探针质粒转染hek293细胞36小时后,使用pbs冲洗之后,置于hbss溶液中使用倒置荧光显微镜的561nm激发器进行荧光检测。我们发现氧化还原荧光探针cpmkate157通过与不同的特异定位信号肽融合能够定位到细胞浆、线粒体、内质网、细胞膜、细胞核等亚细胞结构中。结果如图8所示,不同的亚细胞结构中都显示有荧光,并且荧光的分布和强度各不相同。
126.实施例9:活细胞水平基于探针进行高通量化合物筛选
127.本实施例中,我们将示例性氧化还原荧光探针cpmkate157表达在hela细胞的胞浆中进行高通量化合物筛选。
128.将经过转染cpmkate157基因的hela细胞,使用pbs冲洗之后,置于hbss溶液中处理1小时后,使用10μm的不同化合物孵育处理1小时。使用酶标仪记录590nm激发645nm发射处的荧光强度变化。以未用任何化合物处理的样品为标准。结果如图9所示,我们发现使用1200种化合物处理的细胞中,绝大部分的化合物对细胞氧化还原势的影响极小。其中,有24种化合物可以导致细胞产生比较明显的氧化应激,造成氧化还原势升高;有18种化合物可以导致细胞产生比较明显的还原应激,造成氧化还原势降低。
129.实施例10:不同营养条件下荧光探针在哺乳动物细胞中的动态监测
130.在本实施例中,我们在不同的营养条件下使用示例性氧化还原荧光探针mkate157、cpmkate157对哺乳动物细胞hek293中的氧化还原状态进行实时监测。
131.在检测缓冲液中添加或不加25mm葡萄糖来改变细胞的营养条件(有糖或无糖),外源添加氧化剂(200μm diamide)或还原剂(10mm dtt)来调控细胞内的氧化还原状态,使用多功能酶标仪对样品的荧光值进行检测。检测的结果如图10所示,首先实验结果表明本发明的探针能够实时检测哺乳动物细胞内的氧化还原动态变化;另外结果表明在富营养(有糖)条件下hek293细胞有更强的维持氧化还原稳态的能力,受到氧化刺激引起的探针荧光降低可在15-20分钟左右恢复,而在营养匮乏(无糖)的条件下hek293细胞受到氧化应激造
成的探针荧光降低难以恢复。
132.由以上实施例可知,本发明提供的氧化还原荧光蛋白探针,蛋白分子量小且易于成熟,荧光动态变化大,并且能够通过基因操作的方法在细胞中表达,可在细胞内实现氧化还原的时空特异性检测,省去了耗时的处理样品步骤。另外,本发明提供的荧光蛋白探针能够进行高通量的化合物筛选。
133.其它实施方式
134.以上所述仅是本发明的优选实施方案。然而应理解,对于本技术领域的技术人员来说,在不脱离本发明的构思和原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1