PD-L1单结构域抗体及其用途的制作方法
本申请属于生物
技术领域:
,一般而言涉及抗体。更具体地,本申请涉及特异性识别pd-l1的单结构域抗体、其制备方法及其用途。
背景技术:
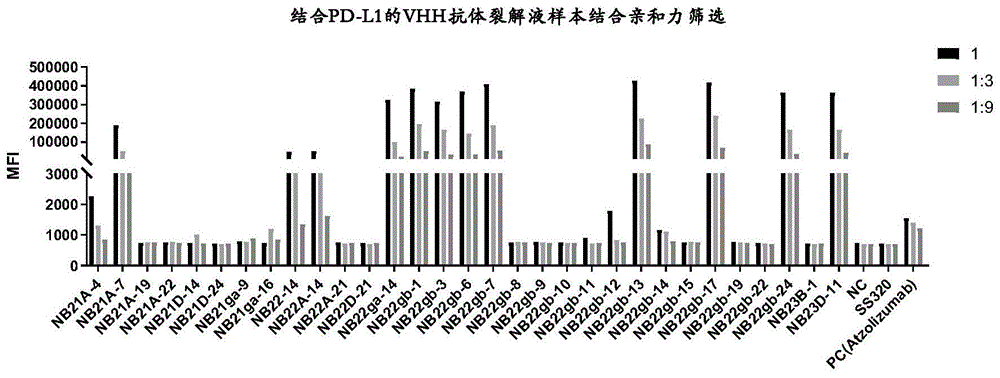
:免疫检查点是免疫系统中起到抑制作用的调控分子,包括ctla-4、pd-1、lag-3、tim-3等,目前基于ctla-4和pd-1这两个免疫检查点已经有多个抗体药物上市。pd-1(programmeddeath1,程序性死亡受体1),是一种重要的免疫抑制分子,其最初是从凋亡的小鼠t细胞杂交瘤2b4.11克隆出来。以pd-1为靶点的免疫调节对抗肿瘤、抗感染、抗自身免疫性疾病及器官移植存活等均有重要的意义。pd-1的主要配体为pd-l1和pd-l2,其中pd-l1在介导肿瘤细胞逃逸过程中扮演着重要作用,其高表达于肿瘤细胞和一些抗原递呈细胞,且表达量可以被多种细胞因子如ifn-γ、tgf-β等诱导。在肿瘤微环境中,pd-l1的表达上调通过pd-1信号通路可直接抑制t细胞的抗肿瘤反应,介导肿瘤细胞的免疫逃逸。单结构域抗体简称单域抗体(singledomainantibody,sdab),是含单个抗体重链可变区结构域的抗体。类似igg抗体,它能够选择性结合特定的抗原,但单域抗体的分子量却远小于igg抗体。目前第一个单域抗体是由骆驼科动物中发现的重链抗体改造而来的(hamers-castermanc,atarhoucht,muyldermanss,robinsong,hamersc,songaeb,bendahmann,hamersr(1993)naturallyoccurringantibodiesdevoidof1ightchains.nature363(6428):446-448.);这些骆驼科动物中发现的重链抗体也被称为vhh片段。目前,对单域抗体的大多数研究基于重链可变结构域。单域抗体具有许多优点。例如,它们具有较高的溶解度、良好的热稳定性和组织渗透性,有些单域抗体由于分子内二硫键的存在还可耐受木瓜蛋白酶等的降解作用;此外单域抗体可以在酵母、植物和哺乳动物细胞等多种表达宿主中产生,且表达量较高,使得其具有极高的成本效益。(harmsenmm,dehaardhj(2007)properties,production,andapplicationsofcamelidsingle-domainantibodyfragments.applmicrobiolbiotechnol77(1):13-22.)。单域抗体凭借其众多的优点,使其在各种生物技术和医疗领域具有良好的应用前景。目前ablynx公司的第一个单域抗体药物已经获批上市。目前针对pd-l1靶点的上市抗体药物还不多,因此,仍然需要研发新的特异性识别pd-l1的单结构域抗体用于癌症的免疫治疗,使其具有更低的毒副作用和更佳的临床药效。技术实现要素:本发明的目的是提供一种新的特异性识别pd-l1的单结构域抗体,与本领域现有的抗pd-l1抗体相比,所述特异性识别pd-l1的单结构域抗体具有更低的毒副作用和更佳的临床药效,能够更有效地治疗癌症。总的来说,本发明提供一种特异性识别pd-l1的单结构域抗体,在下文中也称为pd-l1单结构域抗体、纳米抗体形式的pd-l1抗体、pd-l1纳米抗体或pd-l1的vhh抗体,以上术语可以互换使用。本申请还提供了构建和筛选所述pd-l1单结构域抗体的方法,编码所述pd-l1单结构域抗体的核酸分子、用于表达pd-l1单结构域抗体的载体和宿主细胞以及包含所述pd-l1单结构域抗体的组合物或试剂盒。本申请的pd-l1单结构域抗体能够通过调节免疫系统治疗多种癌症,因此能够用于制备治疗癌症的药剂。具体而言,本发明提供纳米抗体形式的pd-l1抗体以及其人源化改造或成药性改造后的衍生分子,在保持高亲和力、低分子量等优势的同时,进行免疫原性修饰和翻译后修饰位点改造,改善了成药性,具有极大的治疗优势。在一些方面,本发明提供分离的纳米抗体形式的pd-l1单结构域抗体。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段特异性结合pd-l1。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区包含如下的cdr1、cdr2和cdr3:(i)包含seqidno:1所示氨基酸序列的cdr1;包含与seqidno:1具有至少80%、85%、90%、95%或99%同一性的氨基酸序列的cdr1;或包含与seqidno:1相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的cdr1;(ii)包含seqidno:2所示氨基酸序列的cdr2;包含与seqidno:2具有至少80%、85%、90%、95%或99%同一性的氨基酸序列的cdr2;或包含与seqidno:2相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的cdr2;和(iii)包含seqidno:3所示氨基酸序列的cdr3;包含与seqidno:3具有至少80%、85%、90%、95%或99%同一性的氨基酸序列的cdr3;或包含与seqidno:3相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的cdr3。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区包含如下的cdr1、cdr2和cdr3:(i)如式rtdx1ninx2mh所示的cdr1,其中x1为r或s;x2为t或g;(ii)如式tifidx3nti所示的cdr2,其中,x3为g或l;和(iii)如seqidno:3所示的cdr3。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区包含:(i)seqidno:1所示的cdr1;(ii)seqidno:2所示的cdr2;和(iii)seqidno:3所示的cdr3。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区包含:(i)seqidno:4所示的cdr1;(ii)seqidno:5所示的cdr2;和(iii)seqidno:3所示的cdr3。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),其中所述重链可变区还包含框架区(在下文中简称为fr区),所述fr区包含fr1、fr2、fr3和fr4,并且与cdr1、cdr2和cdr3在所述重链可变区上间隔排列形成从n端到c端为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4的结构。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区还包含fr区,其中所述fr区包含如下的fr1、fr2、fr3和fr4:(a)包含seqidno:14所示的fr1;包含与seqidno:14具有至少90%、95%或99%同一性的氨基酸序列的fr1;或包含与seqidno:14相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr1;(b)包含seqidno:15所示的fr2;包含与seqidno:15具有至少90%、95%或99%同一性的氨基酸序列的fr2;或包含与seqidno:15相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr2;(c)包含seqidno:16所示的fr3;包含与seqidno:16具有至少90%、95%或99%同一性的氨基酸序列的fr3;或包含与seqidno:16相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr3;和(d)包含seqidno:17所示的fr4;包含与seqidno:17具有至少90%、95%或99%同一性的氨基酸序列的fr4;或包含与seqidno:17相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr4。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区还包含fr区,其中所述fr区包含如下的fr1、fr2、fr3和fr4:(a)包含seqidno:18所示的fr1;包含与seqidno:18具有至少90%、95%或99%同一性的氨基酸序列的fr1;或包含与seqidno:18相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr1;(b)包含seqidno:19所示的fr2;包含与seqidno:19具有至少90%、95%或99%同一性的氨基酸序列的fr2;或包含与seqidno:19相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr2;(c)包含seqidno:20所示的fr3;包含与seqidno:20具有至少90%、95%或99%同一性的氨基酸序列的fr3;或包含与seqidno:20相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr3;和(d)包含seqidno:21所示的fr4;包含与seqidno:21具有至少90%、95%或99%同一性的氨基酸序列的fr4;或包含与seqidno:21相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr4。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区还包含fr区,其中所述fr区包含如下的fr1、fr2、fr3和fr4:(a)包含seqidno:22所示的fr1;包含与seqidno:22具有至少90%、95%或99%同一性的氨基酸序列的fr1;或包含与seqidno:22相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr1;(b)包含seqidno:15所示的fr2;包含与seqidno:15具有至少90%、95%或99%同一性的氨基酸序列的fr2;或包含与seqidno:15相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr2;(c)包含seqidno:16所示的fr3;包含与seqidno:16具有至少90%、95%或99%同一性的氨基酸序列的fr3;或包含与seqidno:16相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr3;和(d)包含seqidno:17所示的fr4;包含与seqidno:17具有至少90%、95%或99%同一性的氨基酸序列的fr4;或包含与seqidno:17相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr4。在一些优选的实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区还包含fr区,其中所述fr区包含如下的fr1、fr2、fr3和fr4:(a)seqidno:14所示的fr1;(b)seqidno:15所示的fr2;(c)seqidno:16所示的fr3;和(d)seqidno:17所示的fr4。在一些优选的实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区还包含fr区,其中所述fr区包含如下的fr1、fr2、fr3和fr4:(a)seqidno:18所示的fr1;(b)seqidno:19所示的fr2;(c)seqidno:20所示的fr3;和(d)seqidno:21所示的fr4。在一些优选的实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区还包含fr区,其中所述fr区包含如下的fr1、fr2、fr3和fr4:(a)seqidno:22所示的fr1;(b)seqidno:15所示的fr2;(c)seqidno:16所示的fr3;和(d)seqidno:17所示的fr4。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区包含seqidno:10、11、12、13中任一种氨基酸序列。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区由seqidno:10、11、12、13中任一种氨基酸序列组成。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段的重链可变区(vh)包含与seqidno:10、11、12、13中任一种具有至少80%、85%、90%、95%或99%同一性并且保留特异性结合pd-l1的能力的氨基酸序列。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段的重链可变区(vh)包含与seqidno:10、11、12、13中任一种相比具有一处或多处氨基酸的添加、缺失和/或取代并且保留特异性结合pd-l1的能力的氨基酸序列。在一些优选的实施方案中,所述一处或多处氨基酸的添加、缺失和/或取代(例如,保守性取代)不超过五处,优选地不超过三处。在一些实施方案中,所述pd-l1单结构域抗体为骆驼源抗体、人源化抗体或成药性改造后的抗体。在一些优选的实施方案中,本发明提供人源化的pd-l1单结构域抗体,其包含具有seqidno:11或12所示氨基酸序列的vh。在一些优选的实施方案中,本发明提供人源化的pd-l1单结构域抗体,其包含由seqidno:11或12所示氨基酸序列组成的vh。在一些优选的实施方案中,本发明提供成药性改造后的pd-l1单结构域抗体,其包含具有seqidno:13中所示氨基酸序列的vh。在一些优选的实施方案中,本发明提供成药性改造后的pd-l1单结构域抗体,其包含由seqidno:13中所示氨基酸序列组成的vh。在一些实施方案中,所述pd-l1单结构域抗体或其抗原结合片段与另一分子融合,所述另一分子是例如免疫球蛋白(例如igg)的fc结构域、抗体、抗体的抗原结合片段、抗体-药物偶联物、抗体样分子、抗体样分子的抗原结合片段或荧光蛋白。在一些优选的实施方案中,所述抗体或其抗原结合片段与人igg(如人igg1或人igg4)的fc结构域融合。在一些方面,本发明涉及分离的核酸分子,其包含编码如本文所公开的pd-l1单结构域抗体或其抗原结合片段的核苷酸序列。在一些方面,本发明涉及包含编码如本文所公开的pd-l1单结构域抗体或其抗原结合片段的核酸分子的表达载体。在一些方面,本发明涉及包含如本文所公开的表达载体的宿主细胞。在一些实施方案中,所述宿主细胞为细菌细胞、真菌细胞或哺乳动物细胞。在一些方面,本发明涉及药物组合物,其包含如本文所公开的pd-l1单结构域抗体或其抗原结合片段,以及药学上可接受的载体。在一些方面,本发明涉及用于制备pd-l1单结构域抗体或其抗原结合片段的方法,其包括在宿主细胞中表达抗体或其抗原结合片段并从宿主细胞分离抗体或抗原结合片段。在一些方面,本发明涉及调节受试者的免疫应答的方法,其包括向受试者施用如本文所公开的pd-l1单结构域抗体或其抗原结合片段,使得受试者中的免疫应答受到调节。在一些实施方案中,所述受试者为患有与pd-l1相关的疾病的人或哺乳动物。具体地,所述受试者可能患有下述疾病,但不限于此:肾细胞癌、非小细胞肺癌、膀胱癌、尿路上皮癌、微卫星不稳定型实体瘤等。在一些方面,本发明涉及用于治疗或预防与pd-l1相关的疾病的方法,其中包括向患有所述与pd-l1相关的疾病的患者或有患有所述与pd-l1相关的疾病的倾向的受试者施用有效量的如本文所公开的pd-l1单结构域抗体或其抗原结合片段或施用有效量的包含如本文所公开的pd-l1单结构域抗体或其抗原结合片段的药物组合物。在一些方面,本发明涉及治疗可以通过消除、抑制或降低pd-l1活性而被改善、减缓、抑制或预防的任何疾病或病症的方法。在另一些方面,本发明的方法还涉及通过联合疗法治疗或预防与pd-l1相关的疾病(例如,癌症)的方法,所述方法包括向受试者施用有效量的本文所述的pd-l1单结构域抗体或其抗原结合片段和一种或多种其它药物。在一些实施方案中,本文公开的方法还包括向受试者联合施用有效量的第二药物,其中本文公开的pd-l1单结构域抗体或其抗原结合片段是第一药物。在一个实施方案中,第二药物是用于治疗相关疾病的化疗剂、放疗剂或者生物大分子药物。在一个实施方案中,该生物大分子药物例如是通过t细胞识别攻击肿瘤细胞的各种单克隆抗体药,例如利妥昔单抗、西妥昔单抗与曲妥珠单抗。如本文所用的表述“第二药物”并不意味着它是指第一药物之外的唯一药物。因此,第二药物不必是一种药物,而可以是构成或包含多于一种这类药物。在一些实施方案中,受试者或个体是哺乳动物,例如,小鼠或人,优选地是人。在一些方面,本发明涉及如本文所公开的pd-l1单结构域抗体或其抗原结合片段在制备用于治疗或预防与pd-l1相关的疾病的药物中的用途。在一些实施方案中,所述与pd-l1相关的疾病选自,但不限于肾细胞癌、非小细胞肺癌、膀胱癌、尿路上皮癌或微卫星不稳定型实体瘤等。在一些方面,本发明涉及使用如本文所公开的pd-l1单结构域抗体或其抗原结合片段的试剂盒或装置和相关方法,以及如本文所公开的药物组合物,其可用于治疗与pd-l1相关的疾病,例如,癌症。为此,本发明优选提供可用于治疗此类病症的制品,其包含含有如本文所公开的pd-l1单结构域抗体或其抗原结合片段的容器以及用于使用如本文所公开的pd-l1单结构域抗体或其抗原结合片段来治疗、改善或预防与pd-l1相关的疾病或其进展或复发的说明材料。本发明还涵盖本文所述的任何实施方案的任意组合。本文所述的任何实施方案或其任何组合适用于本文所述的发明的任何和所有pd-l1单结构域抗体或其抗原结合片段、方法和用途。综上所述,本发明涉及以下实施方案:1.一种分离的单结构域抗体或其抗原结合片段,其特异性结合pd-l1,所述分离的单结构域抗体或其抗原结合片段包含重链可变区(vh),所述重链可变区包含如下的cdr1、cdr2和cdr3:(i)包含seqidno:1所示氨基酸序列的cdr1;包含与seqidno:1具有至少80%、85%、90%、95%或99%同一性的氨基酸序列的cdr1;或包含与seqidno:1相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的cdr1;(ii)包含seqidno:2所示氨基酸序列的cdr2;包含与seqidno:2具有至少80%、85%、90%、95%或99%同一性的氨基酸序列的cdr2;或包含与seqidno:2相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的cdr2;和(iii)包含seqidno:3所示氨基酸序列的cdr3;包含与seqidno:3具有至少80%、85%、90%、95%或99%同一性的氨基酸序列的cdr3;或包含与seqidno:3相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的cdr3。2.根据实施方案1所述的分离的单结构域抗体或其抗原结合片段,其中所述重链可变区包含如下的cdr1、cdr2和cdr3:(i)如式rtdx1ninx2mh所示的cdr1,其中x1为r或s;x2为t或g;(ii)如式tifidx3nti所示的cdr2,其中x3为g或l;和(iii)如seqidno:3所示的cdr3。3.根据实施方案1所述的分离的单结构域抗体或其抗原结合片段,其中所述重链可变区包含:(i)seqidno:1所示的cdr1;(ii)seqidno:2所示的cdr2;和(iii)seqidno:3所示的cdr3。4.根据实施方案1所述的分离的单结构域抗体或其抗原结合片段,其中所述重链可变区包含:(i)seqidno:4所示的cdr1;(ii)seqidno:5所示的cdr2;和(iii)seqidno:3所示的cdr3。5.根据实施方案1所述的分离的单结构域抗体或其抗原结合片段,其中所述重链可变区还包含fr区,所述fr区包含fr1、fr2、fr3和fr4,并且与cdr1、cdr2和cdr3在所述重链可变区上间隔排列形成从n端到c端为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4的结构。6.根据实施方案5所述的分离的单结构域抗体或其抗原结合片段,其中所述fr区包含如下的fr1、fr2、fr3和fr4:(a)包含seqidno:14所示氨基酸序列的fr1;包含与seqidno:14具有至少90%、95%或99%同一性的氨基酸序列的fr1;或包含与seqidno:14相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr1;(b)包含seqidno:15所示氨基酸序列的fr2;包含与seqidno:15具有至少90%、95%或99%同一性的氨基酸序列的fr2;或包含与seqidno:15相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr2;(c)包含seqidno:16所示氨基酸序列的fr3;包含与seqidno:16具有至少90%、95%或99%同一性的氨基酸序列的fr3;或包含与seqidno:16相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr3;和(d)包含seqidno:17所示氨基酸序列的fr4;包含与seqidno:17具有至少90%、95%或99%同一性的氨基酸序列的fr4;或包含与seqidno:17相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr4。7.根据实施方案5所述的分离的单结构域抗体或其抗原结合片段,其中所述fr区包含如下的fr1、fr2、fr3和fr4:(a)包含seqidno:18所示氨基酸序列的fr1;包含与seqidno:18具有至少90%、95%或99%同一性的氨基酸序列的fr1;或包含与seqidno:18相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr1;(b)包含seqidno:19所示氨基酸序列的fr2;包含与seqidno:19具有至少90%、95%或99%同一性的氨基酸序列的fr2;或包含与seqidno:19相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr2;(c)包含seqidno:20所示氨基酸序列的fr3;包含与seqidno:20具有至少90%、95%或99%同一性的氨基酸序列的fr3;或包含与seqidno:20相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr3;和(d)包含seqidno:21所示氨基酸序列的fr4;包含与seqidno:21具有至少90%、95%或99%同一性的氨基酸序列的fr4;或包含与seqidno:21相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr4。8.根据实施方案5所述的分离的单结构域抗体或其抗原结合片段,其中所述fr区包含如下的fr1、fr2、fr3和fr4:(a)包含seqidno:22所示氨基酸序列的fr1;包含与seqidno:22具有至少90%、95%或99%同一性的氨基酸序列的fr1;或包含与seqidno:22相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr1;(b)包含seqidno:15所示氨基酸序列的fr2;包含与seqidno:15具有至少90%、95%或99%同一性的氨基酸序列的fr2;或包含与seqidno:15相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr2;(c)包含seqidno:16所示氨基酸序列的fr3;包含与seqidno:16具有至少90%、95%或99%同一性的氨基酸序列的fr3;或包含与seqidno:16相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr3;和(d)包含seqidno:17所示氨基酸序列的fr4;包含与seqidno:17具有至少90%、95%或99%同一性的氨基酸序列的fr4;或包含与seqidno:17相比具有不超过2个(如0个、1个、2个)氨基酸的添加、缺失和/或取代的差异的氨基酸序列的fr4。9.根据实施方案1所述的分离的单结构域抗体或其抗原结合片段,其中所述重链可变区包含选自seqidno:10、11、12和13中的任一种氨基酸序列或由选自seqidno:10、11、12和13中的任一种氨基酸序列组成。10.根据实施方案1所述的分离的单结构域抗体或其抗原结合片段,其中所述重链可变区包含与seqidno:10、11、12和13中任一种具有至少80%、85%、90%、95%或99%同一性并且保留特异性结合pd-l1的能力的氨基酸序列。11.根据实施方案1所述的分离的单结构域抗体或其抗原结合片段,其中所述重链可变区包含与seqidno:10、11、12和13中任一种相比具有一处或多处氨基酸的添加、缺失和/或取代并且保留特异性结合pd-l1的能力的氨基酸序列。12.根据实施方案1所述的分离的单结构域抗体或其抗原结合片段,其中所述分离的抗体为骆驼源抗体、人源化抗体或成药性改造的抗体。13.根据实施方案1-12中任一项所述的分离的单结构域抗体或其抗原结合片段,所述抗体或其抗原结合片段与另一分子融合,所述另一分子是免疫球蛋白(例如igg)的fc结构域、抗体、抗体的抗原结合片段、抗体-药物偶联物、抗体样分子、抗体样分子的抗原结合片段或荧光蛋白。14.根据实施方案13所述的分离的单结构域抗体或其抗原结合片段,所述抗体或其抗原结合片段与人igg(例如人igg1或人igg4)的fc结构域融合。15.一种分离的核酸分子,其包含编码如实施方案1-12任一项中所定义的分离的单结构域抗体或其抗原结合片段的核苷酸序列。16.一种载体,其包含实施方案15的核酸分子。17.一种宿主细胞,其包含实施方案16的载体。18.一种药物组合物,其包含至少一种如实施方案1-12任一项中所定义的单结构域抗体或其抗原结合片段和药学上可接受的载体。19.一种制备如实施方案1-12任一项中所定义的单结构域抗体或其抗原结合片段的方法,其包括以下步骤:-在实施方案17的宿主细胞中表达如实施方案1-12任一项中所定义的单结构域抗体或其抗原结合片段;和-从所述宿主细胞分离所述单结构域抗体或其抗原结合片段。20.根据实施方案1-12中任一项所定义的单结构域抗体或其抗原结合片段在制备用于预防或治疗受试者中与pd-l1相关的疾病的药物中的用途。21.根据实施方案20所述的用途,其中所述受试者为小鼠或人,优选为人。22.根据实施方案20所述的用途,其中所述与pd-l1相关的疾病选自肾细胞癌、非小细胞肺癌、膀胱癌、尿路上皮癌或微卫星不稳定型实体瘤。23.一种用于预防或治疗受试者中与pd-l1相关的疾病的试剂盒,其包含容器,所述容器包含至少一种如实施方案1-12任一项中所定义的抗体或其抗原结合片段。附图说明图1显示结合pd-l1的vhh抗体裂解液样本结合亲和力筛选的结果。图2显示抗pd-l1候选抗体分子的封闭实验筛选的结果。图3显示候选抗体分子细胞结合实验验证的结果:(a)同种型对照(即人igg1),(b)nb22d-21,(c)nb22gb-10,(d)阳性对照kn035。图4显示nb22d-21分子的特异性结合反应实验验证结果。图5显示nb22d-21分子的混合淋巴细胞反应实验验证结果。图6显示nb22d-21分子及其经人源化改造后的衍生分子的结合实验验证结果,其中同种型对照(isotype)为人igg1。图7显示nb22d-21分子及其经人源化改造后的衍生分子的人鼠交叉反应实验结果,其中同种型对照(isotype)为人igg1。图8显示人源化改造后的衍生分子nb22d-21-huvh1的人鼠交叉反应实验的流式峰图结果:(a)对照分子kn035,(b)nb22d-21-huvh1。图9显示nb22d-21分子及其人源化改造分子的结合封闭实验结果,其中同种型对照(isotype)为人igg1。图10显示显示成药性改造后的分子在pd-l1-cho上的阻断活性,其中同种型对照(isotype)为人igg1。图11显示成药性改造后的分子在混合淋巴细胞反应中ifn-γ(a)和il-2(b)分泌的结果。图12显示候选抗体分子的序列比对,其中用方框框出cdr序列。序列表概述本申请附带有包含许多核苷酸和氨基酸序列的序列表。下表a、b和c提供了所包含的序列的概述。具体实施方式本领域技术人员应该理解,本发明不限于本文中描述的特定方法学、实施方案和试剂,因为这些是示例性说明。还应理解本文中使用的术语仅为了描述具体实施方案,而并不意图限制本发明的范围,本发明的范围仅由所附权利要求书限定。除非另外定义,本文中使用的所有技术和科学术语与本发明所属领域中普通技术人员通常的理解具有相同的含义。此外,除非上下文另有要求,单数形式的术语应包括复数形式,复数形式的术语应包括单数形式。更具体地,如在本说明书和所附权利要求中所使用的,除非上下文另外明确指出,否则单数形式“一种”和“这种”包括复数指示物。因此,例如,提及“一种抗体”包括多种抗体。定义为了更好地理解本发明,相关术语的定义和解释提供如下。术语“约”在与数字数值联合使用时意为涵盖具有比指定数字数值小5%的下限和比指定数字数值大5%的上限的范围内的数字数值。术语“抗体”在本文中以最广意义使用并且涵盖多种抗体结构物,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们显示出所需的抗原结合活性即可。完整抗体通常将包含至少两条全长重链和两条全长轻链,但在某些情况下可包括较少的链,例如骆驼科动物中天然存在的抗体可仅包含重链。如本文所用的术语“抗原结合部分”指与靶抗原特异性结合的部分。该术语包括能够与靶抗原特异性结合的抗体以及其他天然分子(例如受体,配体)或合成分子(例如,darpin)。在一个优选的实施方案中,本发明抗体的抗原结合部分是抗体片段。术语“全长抗体”、“完好抗体”和“完整抗体”在本文中可互换地用来指一种抗体,所述抗体具有基本上与天然抗体结构相似的结构或具有含有fc区的重链。如本文所用,术语“单克隆抗体”或“单克隆抗体组合物”指具有单一氨基酸组成的抗体分子的制备物,而不指其产生的方法。单克隆抗体或其抗原结合片段可以例如通过杂交瘤技术、重组技术、噬菌体展示技术、合成技术例如cdr嫁接、或此类或其它本领域已知的技术的组合来产生。如本文所用,术语“pd-1”是指程序性细胞死亡蛋白,其属于免疫球蛋白超家族并且作为共抑制性受体发挥作用以负调节免疫系统。pd-1是cd28/ctla-4家族的成员,并且具有两种已知的配体,包括pd-l1和pd-l2。pd-1的替代名称或同义词包括pdcd1,pd1,cd279和sleb2等。在ncbi登录号:np_005009.2下公开了人pd-1的代表性氨基酸序列,并且在ncbi登录号nm_005018.3下显示了编码人pd-1的代表性核酸序列。如本文所用,术语“pd-l1”是指程序性细胞死亡配体1(pd-l1,参见例如freeman等人.(2000)j.exp.med.192:1027)。pd-l1的替代名称或同义词包括pdcd1l1,pdl1,b7h1,cd274和b7-h等。人pd-l1的代表性氨基酸序列在ncbi登录号np_054862.1中公开,编码人pd-l1的代表性核酸序列显示在ncbi登录号:nm_014143.4下。pd-l1在胎盘、脾脏、淋巴结、胸腺、心脏、胎儿肝脏中表达,并且也在许多肿瘤或癌细胞中发现。pd-l1结合其受体pd-1或b7-1,其在活化的t细胞、b细胞和骨髓细胞上表达。pd-l1和其受体的结合诱导信号转导以抑制tcr介导的细胞因子产生和t细胞增殖的激活。因此,pd-l1在特定事件(例如妊娠,自身免疫疾病,组织同种异体移植物)期间抑制免疫系统中起主要作用,并且被认为允许肿瘤或癌细胞绕过免疫检查点并逃避免疫应答。如本文所用,术语“结合”和“特异性结合”指抗体或抗原结合部分在体外测定法中,优选地在采用纯化的野生型抗原的生物光干涉测量(fortebio)中与抗原表位结合。在某些实施方案中,在抗体或抗原结合部分优选地识别蛋白质和/或大分子的复杂混合物中其靶抗原时,将抗体或抗原结合部分称作特异性结合抗原。取决于其重链恒定区的氨基酸序列,将抗体以“类”划分:iga、igd、ige、igg和igm,并且这些类别中的几种可以进一步划分成亚类,如,igg1、igg2、igg3和igg4、iga1以及iga2。对应于不同抗体类的重链恒定区分别称作[image]δ、ε、γ和μ。可以在全部五个抗体类中找到的轻链恒定区(cl)称作κ和λ。在全长轻链和重链内,通常可变区和恒定区由约12个或更多个氨基酸的“j”区连接,且重链还包括约10个以上氨基酸的“d”区。参见例如fundamentalimmunology,ch.7(paul,w.编辑,第二版,ravenpress,n.y.(1989))(其为所有目的以其整体在此引作参考)。每一轻链/重链对的可变区通常形成抗原结合位点。术语“可变区”或“可变结构域”是指参与抗体与抗原结合的抗体重或轻链的结构域。天然抗体的重链和轻链的可变结构域通常具有相似的结构,其中每个结构域包含四个保守的框架区(fr)和三个互补决定区。(参见,例如,kindt等kubyimmunology,6thed.,w.h.freemanandco.91页(2007))。单个vh或vl结构域可以足以给予抗原结合特异性。此外,可以使用来自与特定抗原结合的抗体的vh或vl结构域来分离结合所述抗原的抗体,以分别筛选互补vl或vh结构域的文库。参见,例如,portolano等,j.immunol.150:880-887(1993);clarkson等,nature352:624-628(1991)。可变区通常表现出由三个高变区连接的相对保守的构架区(fr)的相同的一般结构,所述高变区也被称为互补决定区或cdr。通常通过构架区定位(align)来自每对的两条链的cdr,所述cdr使得抗体可结合特异性表位。两条轻链和重链可变区从n-末端到c-末端通常包含结构域fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。“抗体片段”是指不同于完整抗体的分子,其包含完整抗体的部分,所述部分结合完整抗体结合的抗原。“亲和力”是指分子(例如抗体)的单一结合位点与其结合配偶体(例如抗原)之间全部非共价相互作用总和的强度。除非另有说明,在用于本文时,“结合亲和力”指反映结合对的成员(例如抗体与抗原)之间1∶1相互作用的内在结合亲和力。分子x对其配偶体y的亲和力通常可用解离常数(kd)来表述。亲和力可通过本领域知道的常用方法来测量,包括现有技术已知以及本文中所描述的那些。如本文所用的术语“ec50”,也被称为“半数有效浓度”,是指在特定的暴露时间后诱导在基线和最大值之间的50%的应答的药物、抗体或毒剂的浓度。在本申请的上下文中,ec50的单位为“nm”。“人抗体”指具有这样的氨基酸序列的抗体,所述氨基酸序列对应于这样抗体的氨基酸序列,所述抗体由人或人细胞生成或来源于非人来源,其利用人抗体库或其它人抗体编码序列。人抗体的这种定义明确排除包含非人抗原结合残基的人源化抗体。“人共有框架”是指这样的框架,即在选择人免疫球蛋白vl或vh框架序列中,其代表最常出现的氨基酸残基。一般而言,对人免疫球蛋白vl或vh序列的选择是从可变结构域序列的亚型中选择。一般而言,该序列的亚型是如kabat等,sequencesofproteinsofimmunologicalinterest,第五版,nihpub1ication91-3242,bethesdamd(1991),1-3卷中的亚型。在一个实施方案中,对于vl,该亚型是如kabat等(见上文)中的亚型κi。在一个实施方案中,对于vh,该亚型是如kabat等(见上文)中的亚型iii。“人源化”抗体是指包含来自非人hvr的氨基酸残基和来自人fr的氨基酸残基的嵌合抗体。在一些实施方案中,人源化抗体将包含基本上所有的至少一个、通常两个可变结构域,其中所有或基本上所有的hvr(例如,cdr)对应于非人抗体的那些,并且所有或基本上所有的fr对应于人抗体的那些。人源化抗体任选可以包含至少一部分的来源于人抗体的抗体恒定区。抗体(例如非人抗体)的“人源化形式”是指已经进行了人源化的抗体。术语“保守取代”是指一个氨基酸被同一类别内的另一氨基酸取代,例如一个酸性氨基酸被另一酸性氨基酸取代,一个碱性氨基酸被另一碱性氨基酸取代,或一个中性氨基酸被另一中性氨基酸取代。示例性的取代如下表d所示:表d.示例性的取代原残基示例性的取代保守取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlvsasn(n)gln;his;asp,lys;argglnasp(d)glu;asnglucys(c)ser;alasergln(q)asn;gluasnglu(e)asp;glnaspgly(g)alaalahis(h)asn;gln;lys;argargile(i)leu;val;met;ala;phe;正亮氨酸leuleu(l)正亮氨酸;ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)trp;leu;val;ile;ala;tyrtyrpro(p)a1aa1aser(s)thrthrthr(t)val;sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;ala;正亮氨酸leu氨基酸可以按照常见侧链的性质进行分组:(1)疏水性:正亮氨酸,met,ala,val,leu,ile;(2)中性亲水性:cys,ser,thr,asn,gln;(3)酸性:asp,glu;(4)碱性:his,lys,arg;(5)影响链取向的残基:gly,pro;(6)芳族的:trp,tyr,phe。非保守性取代需要将这些类别中之一的成员交换为另一类。一种类型的取代变体包括取代母体抗体(例如人源化抗体)的一个或多个高变区残基。一般地,关于进一步研究所选择的得到的一种或多种变体相对于母体抗体具有某些生物学特性的改进(例如,改善)(例如,提高的成药性、减少的免疫原性),和/或将具有母体抗体基本上保留的特定生物学特性。一种示例性的取代变体是成药性改造的抗体,其可以便利地产生,例如,使用基于噬菌体的成药性改造技术,诸如本文所述的那些技术。简言之,将一个或多个hvr残基突变,并且将变体抗体展示在噬菌体上,并针对特定的生物学活性(例如,成药性)进行筛选。相对于参比多肽序列的“百分比(%)氨基酸序列同一性”定义为在将所述序列进行比对(并在必要时导入空位)以获取最大百分比序列同一性,且不将任何保守取代视为序列同一性的部分之后,候选序列中的氨基酸残基与参比多肽序列中的相同氨基酸残基的百分比。可使用本领域各种方法进行序列比对以便测定百分比氨基酸序列同一性,例如,使用公众可得到的计算机软件如blast、blast-2、align或megalign(dnastar)软件。本领域技术人员可以决定测量比对的适宜参数,包括对所比较的序列全长获得最大比对所需的任何算法。当在本申请中提到序列同一性的百分比时,若未另外特别指出,这些百分比相对于较长序列的全长计算。相对于较长序列的全长计算适用于核酸序列和多肽序列两者。术语“有效量”、“治疗有效量”指本发明的抗体或抗原结合片段的量或剂量,其以单一或多次剂量施用患者后,在治疗的受试者中产生预期效果,这包括受试者病症的改善(例如,一个或多个症状的改善)和/或症状进展的延迟等。“有效量”、“治疗有效量”也可以指足够降低pd-l1信号传导的量。有效量可以由作为本领域技术人员的主治医师通过考虑以下多种因素来容易地确定:诸如哺乳动物的物种;它的大小、年龄和一般健康;涉及的具体疾病;疾病的程度或严重性;个体患者的应答;施用的具体抗体;施用模式;施用制剂的生物利用率特征;选择的给药方案;和任何伴随疗法的使用。本文所用术语“阻断”表示存在本发明的抗体时减少pd-l1的信号传递。pd-l1介导的信号传递阻断指本发明的pd-l1单结构域抗体存在时pd-l1信号传递水平低于pd-l1的对照水平(即不存在抗体时的pd-l1信号传递水平),降低的幅度大于或等于5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%。可使用多种标准技术测量pd-l1信号传递水平,如作为非限制性实施例,测量下游基因激活和/或响应pd-l1激活的荧光素酶报告试验。本领域技术人员应理解可使用多种试验测量pd-l1信号传递水平,包括例如可商购获得的试剂盒。术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可交换地使用且是指其中引入外源核酸的细胞,包括这种细胞的后代。宿主细胞包括“转化体”和“转化的细胞”,其包括初级转化的细胞和来源于其的后代,而不考虑传代的数目。后代在核酸含量上可能与亲本细胞不完全相同,而是可以包含突变。本文中包括与在最初转化的细胞中筛选或选择的具有相同功能或生物学活性的突变体后代。术语“载体”当在本文中使用时是指能够增殖与其相连的另一个核酸的核酸分子。该术语包括作为自我复制核酸结构的载体以及结合到已经引入其的宿主细胞的基因组中的载体。一些载体能够指导与其可操作相连的核酸的表达。这样的载体在本文中被称为“表达载体”。“个体”或“受试者”包括哺乳动物。哺乳动物包括但不限于,家养动物(例如,牛,羊,猫,狗和马),灵长类动物(例如,人和非人灵长类动物如猴),兔,羊驼,以及啮齿类动物(例如,小鼠和大鼠)。在一些实施方案中,个体或受试者是人。实施例通过参考以下实施例将更容易地理解本文一般地描述的本发明,这些实施例是以举例说明的方式提供的,并且不旨在限制本发明。本领域技术人员应该理解,除非另外注明,以下实施例中所用的试剂、质粒、细胞等均为可商购获得的产品。实施例1稳定表达pd-l1的细胞株的构建在本实施例中本发明人分别构建了表达人pd-l1、猴pd-l1、鼠pd-l1的cho-s细胞,并制备了罗氏公司的对照抗体。1.1对照抗体制备全基因合成对照抗体-atezolizumab(罗氏)的轻链和重链基因序列(基因合成供应方:通用生物),对照抗体表达采用的是expicho瞬转表达系统(购自赛默飞世尔),培养基为expichotmexpressionmedium(gibco,a29100-01),转染试剂盒为expifectaminetmchotransfectionkit(gibco,a29129)。具体方法如下:通过分子克隆构建atezolizumab抗体轻链和重链基因的expicho表达质粒,转染前一天将expicho细胞(购自gibcoa29127)进行传代,在25ml细胞培养物体系内,将构建好的质粒25μg(含有质量比为2∶1的轻链编码基因、重链编码基因的质粒混合物)与转染试剂混合之后滴加入25mlexpicho细胞培养物中,充分混匀,于37℃表达18-22小时后,根据试剂盒内说明添加补料培养基,补料后,细胞置于32℃培养,转染后第5天,添加第二次补料,并将细胞置于32℃培养,10-12天之后,将表达好的细胞混悬液高速离心取上清,所得上清经0.22μm滤膜过滤后采用proteina/g亲和层析柱亲和纯化方法进行纯化,用100mm甘氨酸盐(ph3.0)洗脱目的蛋白,接着用1mtris-hcl中和至ph7.0。小量取样后经sds-page鉴定后分装、入库冻存。对照抗体kn035(氨基酸序列见序列表seqidno:9)的制备方法如下:全基因合成对照抗体kn035全基因序列,通过分子克隆构建kn035抗体基因的expicho表达质粒,转染前一天将expicho细胞(购自gibcoa29127)进行传代,在25ml细胞培养物体系内,将构建好的质粒25μg与转染试剂混合后,按照上述对照抗体-atezolizumab制备的方法进行转染,并表达出抗体。1.2稳定细胞株的构建分别构建表达人pd-l1(gi号:np_054862.1)、鼠pd-l1(gi号:np_068693)和恒河猴pd-l1(gi号:abo33163.1)全长蛋白的重组载体质粒,采用电转法将构建好的质粒导入cho-s细胞(购自赛默飞世尔)和a375黑色素瘤细胞株(atcc,crl-1619)中。通过筛选分别得到以上三种物种pd-l1蛋白的高表达cho-s细胞株以及高表达人pd-l1的a375细胞株(pd-l1-a375)。1.2.1表达人pd-1和pd-l1胞外域蛋白的质粒构建分别通过基因合成合成出含有人pd-l1、鼠pd-l1和恒河猴pd-l1全长蛋白基因序列的表达载体,连接后导入大肠杆菌,挑取大肠杆菌单克隆后测序得到正确的质粒克隆,进行质粒抽提并再次测序。1.2.2表达pd-1和pd-l1蛋白的cho-s细胞株构建1.2.2.1电转使用cd-cho无血清培养基(gibco,10743029)培养维持cho-s细胞,电转前一天将细胞传代至5×106/ml,第二天使用电转试剂盒(invitrogen,neontmkit,mpk10096)和电转仪(invitrogen,neontmtransfectionsystem,mp922947)将构建好的质粒分别导入cho-s细胞中。将电转后的细胞加入3mlcd-cho培养基中,放置于37℃二氧化碳培养箱中培养48小时。1.2.2.2细胞铺板与培养将电转后的cho-s细胞按2000个细胞/孔铺板96孔细胞培养板,加入终浓度30μm/mll-蛋氨酸亚砜亚胺(l-methioninesulfoximine,msx)(millipore,gss-1015-f),保持体积为细胞培养体积为100μl/孔和1×gs补充物(sigma,58672c),放置于37℃二氧化碳培养箱中培养,10天后补充加入含30μmmsx和1×gs补充物的培养基50μl。1.2.2.3克隆鉴定与细胞扩培将长出的克隆挑取,转移至24孔细胞培养板中培养。利用facs方法对细胞株进行鉴定,选择表达量高的克隆进行扩培和冻存。相关facs鉴定方法如下:1)首先收集空cho-s细胞及各个克隆cho-s细胞2×105个,300g离心去上清,将细胞用配制好的200μlfacs缓冲液(1×pbs+2%fbs)重悬在96-孔圆底板中;2)将96孔圆底板300g离心5min,去上清;3)向对应孔中加入抗pd-l1抗体稀释液或阴性对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μlfacs缓冲液并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)加入pe标记的抗-人iggfc流式抗体(abcam,ab98596),用排枪将细胞吹匀并放置于4℃孵育30分钟;7)300g离心去上清,加入facs缓冲液并重悬细胞;8)重复步骤7)两次,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测。1.2.3表达pd-l1的a375细胞株制备以1.2.2.1中电转cho-s细胞同样的方法制备a375细胞株的pd-l1高表达细胞株(pd-l1-a375),用于a375细胞株的动物模型构建。实施例2动物免疫与血清效价检测2.1动物免疫购买pd-l1(np_054862.1)胞外域蛋白(义翘神州,10084-h05h)免疫2只羊驼(南昌大佳科技)。每只羊驼每次免疫500μg,每2周免疫一次,共免疫4次。2.2血清效价检测待羊驼免疫结束后取羊驼血清进行免疫效价检测。免疫效价测定是通过elisa方法测定免疫血清针对重组蛋白pd-l1(义翘神州,10084-h05h)的结合能力,并根据结合抗体的效价进行免疫效果的判定。具体方法如下所述:2.2.1抗原包被:在免疫效价测定的前一天,将抗原重组蛋白pd-l1用pbs稀释至终浓度2μg/ml,获得稀释液。将30μl获得的稀释液加入到elisa板中,4℃包被过夜。在免疫效价测定当日用pbs润洗三遍,后用含有5%脱脂牛奶的pbst室温封闭两小时,再用pbs润洗三遍。2.2.2血清稀释:在另外一块稀释板上将未经免疫接种的阴性血清和免疫后血清用pbs进行稀释,首孔200倍稀释,然后后续7个孔采用3倍梯度稀释。2.2.3抗体反应:稀释好的血清加入到第一块elisa板中,37℃孵育1h,pbs洗两遍后以1∶5000加入二抗羊抗骆驼科igg抗体(购自南京金斯瑞)。2.2.4显色读数:pbs清洗上述二抗3次后,加入显色液显色5分钟,加入终止液后,通过酶标仪(moleculardevices,spectermax190)在od450下读板,结果见表1。表1.不同稀释比例下的elisa显色实验结果稀释比例阴性血清nsy004nsy0051∶20000.2092.5822.1631∶40000.1332.2862.2161∶80000.0931.9232.1311∶160000.0521.8171.8681∶320000.0541.3371.2181∶640000.0481.0480.7921∶1280000.0420.7610.5871∶2560000.0480.4040.473其中,nsy004和nsy005两列分别为两只羊驼免疫后的血清稀释不同倍数后的elisa显色实验结果,阴性血清为未免疫的羊驼血清elisa实验结果。根据表1的结果,可见两只羊驼的免疫效价igg效价均达到了256000,免疫效果较好,可用于下一步的外周血免疫抗体库构建。实施例3羊驼免疫库构建及初步筛选动物免疫结束后,取羊驼新鲜血液50ml,通过ficoll-paque密度梯度分离液(ge,17144003s)分离外周血单核细胞(peripheralbloodmononuclearcell,pbmc),进行抗人pd-l1抗体噬菌体羊驼免疫库构建。具体方法如下:将采集的羊驼血用pbs以1∶1(v/v)的比例稀释,取ficoll-paque密度梯度分离液15ml缓缓加入50ml离心管中,将离心管倾斜并沿管壁缓慢加入稀释好的羊驼血30ml,使得两种液体保持清晰的分离界面。4℃离心20min,保持加速度为升3降0。离心之后,整个液面分为四层,上层为血浆混合物,下层为红细胞和粒细胞,中层为ficoll-paqueplus,在上、中层交界处有以pbmc为主的白色狭窄带,即pbmc细胞层。小心使用移液枪吸取中间的pbmc细胞转移至新的50ml离心管中。用pbs润洗两遍,4℃,1500rpm水平离心10min,最后用1.5mlpbs重悬,并通过显微镜计数。将分离的pbmc细胞提取rna,通过反转录试剂盒(takara,6210a)将提取的rna反转录成cdna。由于羊驼抗体的分子形式不同于普通抗体,其不含轻链而且重链不含chi,因此首先在vh前端和ch2上通过设计普通引物,pcr得到两个不同大小的片段,通过割胶回收较小的目的片段。然后通过比对常见的vhh所有种系(germline)的氨基酸序列,设计出两端分别含有ncoi和noti酶切位点的germline特异性简并引物,从而以回收产物为模板扩增所有的vhh基因,最后通过双酶切和连接将目的抗体基因片段插入至噬菌体展示用载体上,需要指出的是的,该表达载体上vhh基因的c端融合在噬菌体表达载体中的giii基因。连接产物通过回收试剂盒(omega,d6492-02)回收,最后通过电转仪(bio-rad,micropulser)转化至感受态大肠杆菌ss320中,并涂布于氨苄抗性的2-yt固体平板。为了计算库容,通过取10μl库的菌液进行10倍梯度稀释,每个稀释梯度取2μl点在平板上,计算在平板上形成的克隆来计算所有电转化形成的总克隆数,即库容量。此免疫库库容量为1×109。基于此库容容量,取10倍于库容的菌量(约20od)加入到新鲜的2-yt液体培养基中,调整培养基的加入用量使得菌液稀释液初始od值为0.05。置于37℃,220rpm培养至对数生长期,此时以50倍于细菌数的数量加入vscm13辅助噬菌体,充分混匀,静置30min,然后在220rpm条件下培养1h,通过10000rpm离心5min后置换至羧苄青霉素/卡那霉素双抗性2-yt培养基中,并于30℃,220rpm培养过夜。次日,13000g离心10min,其上清通过加入20%peg/nacl溶液,沉淀得到羊驼免疫抗体库对应的噬菌体,经pbs润洗一次之后,用于目标靶点pd-l1抗体筛选。噬菌体筛选使用的是重组pd-l1蛋白,采用磁珠筛选和免疫管筛选两种方法,具体方法如下所述。3.1磁珠筛选基于将生物素标记的重组pd-l1蛋白结合到卵白素偶联的磁珠(购自赛默飞世尔,货号:11205d)上进行筛选,首先用生物素标记重组人pd-l1蛋白(生物素标记方法见roche公司的生物素蛋白标记试剂盒说明书,货号:11418165001),将生物素标记的pd-l1蛋白和磁珠孵育,使得pd-l1蛋白结合于磁珠上。将结合有pd-l1抗原的磁珠和具有纳米抗体展示的噬菌体库室温孵育2小时,经pbst洗涤6-8次后,去除非特异性吸附的噬菌体,加入胰蛋白酶(gibco)轻轻混匀20min,以洗脱特异性结合人pd-l1蛋白的纳米抗体展示噬菌体。接着将洗脱的噬菌体侵染对数期的ss320菌体(lucigen,mc1061f),并将噬菌体侵染的ss320菌体涂布于羧苄青霉素抗性平板,37℃过夜培养,第二天收集菌体。采用ss320菌体制备噬菌体,制备方法详见如上文库噬菌体制备方法。最终得到的噬菌体继续用于第二轮的筛选,在第二轮筛选结束时采用胰蛋白酶方式进行洗脱。将第二轮筛选得到的噬菌体用于第三轮筛选,在第三轮筛选结束时采用胰蛋白酶进行洗脱。如此反复,通过每轮随机挑选的10个克隆进行序列分析。结果显示,经过3轮的筛选后得到的单克隆噬菌体,测序后的单克隆,不同克隆的基因序列出现重复,证明序列富集明显。3.2免疫管筛选免疫管筛选是基于将抗原包被在免疫管表面,筛选和目的抗原结合的抗体展示噬菌体。筛选前一天提前使用重组人pd-l1蛋白包被免疫管,将结合有pd-l1抗原的免疫管和具有纳米抗体展示的噬菌体库室温孵育2小时,经pbst洗涤6-8次后,去除非特异性吸附的噬菌体,加入胰蛋白酶(gibco)轻轻混匀20min,以洗脱特异性结合人pd-l1蛋白的纳米抗体展示噬菌体。接着将洗脱的噬菌体侵染对数期的ss320菌体(lucigen,mc1061f),并将噬菌体侵染的ss320菌体涂布于羧苄青霉素抗性平板,37℃过夜培养,第二天收集菌体。采用ss320菌体制备噬菌体,制备方法详见如上文库噬菌体制备方法。最终得到的噬菌体继续用于第二轮的筛选。在第二轮筛选结束时采用trypsin方式进行洗脱。将第二轮筛选得到的噬菌体用于第三轮筛选,在第三轮筛选结束时采用trypsin方式进行洗脱。如此反复,通过每轮随机挑选的10个克隆进行测序后并进行序列分析。结果显示,经过3轮的筛选,测序后的单克隆,不同克隆的基因序列出现重复,证明序列富集明显。对两种不同筛选方法获得的噬菌体库进行单克隆筛选,分别挑取磁珠筛选和免疫管筛选的第三轮产物中的阳性克隆。具体方法如下:筛选前一天将重组人pd-l1蛋白包被到96孔elisa板上,第二天于96孔板中制备诱导噬菌体上清,通过噬菌体elisa筛选针对人pd-l1重组蛋白的阳性克隆,后挑取所有阳性克隆测序分析,将序列唯一的克隆制备裂解液,制备方法如下:前一天将该克隆的菌液以1∶100接种50ml,37℃恒温摇床振荡培养14h,10000g常温离心5min,使用1mlph9.0含有benzonase核酸酶的tris-hcl缓冲液重悬细菌,冰上裂解30min,4℃10000g离心10min,收集上清即得到阳性克隆裂解液。将制备好的阳性克隆裂解液进一步在流式水平上验证,筛选到特异性识别人pd-l1的候选抗体。流式水平验证方法如下:1)首先收集培养好的人pd-l1-cho细胞,300g离心去上清,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106个/ml;2)将pd-l1-cho细胞以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体裂解液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μlfacs缓冲液并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)加入pe标记的流式抗体(金斯瑞),用排枪将细胞吹匀并放置于4℃孵育30分钟;7)300g离心去上清,加入facs缓冲液并重悬细胞;8)重复步骤7)两次,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测。抗pd-l1vhh裂解液样本结合亲和力筛选的结果显示在图1中。从图1可以看出,所示的克隆号的vhh分子对表达pd-l1的cho细胞都有一定的亲和力。由于本检测实验只是定性和半定量,无法确认哪一个克隆号的vhh抗体分子亲和力比较好,需要进行进一步实验确认。将制备好的阳性克隆裂解液进一步在流式水平上进行阻断筛选,筛选到特异性识别人pd-l1并阻断其与pd-1蛋白结合的候选抗体。流式水平验证方法如下:1)首先收集培养好的人pd-l1-cho细胞,300g离心去上清,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106/ml;2)将pd-l1-cho细胞以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释获得的浓度梯度分别为1∶1、1∶5和1∶25的候选抗体裂解液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)向对应孔中加入pd-1-fc蛋白稀释液(1μg/ml)100μl,重悬细胞并将细胞放置于4℃孵育30分钟;7)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;8)重复步骤7)两次,300g离心去上清;9)加入pe标记的抗-人iggfc流式抗体(abcam),用排枪将细胞吹匀并放置于4℃孵育30分钟;10)300g离心去上清,加入facs缓冲液并重悬细胞;11)重复步骤10)两次,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测。抗pd-l1抗体候选分子的封闭实验筛选结果如图2所示,通过elisa和facs等方法的初步筛选,可见筛选到的抗体序列制备的抗体裂解液中含有对pd-l1结合到pd1上的反应有封闭效果的抗体,本发明人筛选到10个有良好亲和力及阻断活性的候选分子。实施例4嵌合vhh-fc抗体的产生和表达将筛选获得的阳性vhh候选抗体与人igg1fc段融合,采用阳性vhh基因序列的c端连接到人igg1fc段基因序列的n端的方式构建融合表达载体,将该融合表达载体质粒转化expicho细胞,诱导表达得到融合了fc片段的vhh-fc嵌合抗体蛋白。抗体表达采用的是expicho瞬转表达系统,培养基为(gibco,a29100-01),转染试剂盒为(gibco,a29129)。具体方法如下:转染前一天将expicho细胞进行传代,在25ml体系内,将构建好的质粒25μg与转染试剂混合之后滴加入25mlexpicho细胞培养物中,充分混匀,于37℃表达18-22小时后,根据试剂盒内说明添加补料培养基,补料后,细胞置于32℃培养,转染后第5天,添加第二次补料,并将细胞置于32℃培养,10-12天之后,将表达好的细胞混悬液高速离心取上清,所得上清经0.22μm过滤后采用proteina/g亲和纯化方法进行纯化,用100mm甘氨酸盐(ph3.0)洗脱目的蛋白,接着用1mtris-hcl中和。实施例5嵌合vhh-fc抗体细胞水平的亲和活性验证对获得的vhh-fc候选抗体进行评价,采用facs方法检测其与细胞上pd-l1蛋白的结合活性,具体方法如下:1)收集培养好的人pd-l1-cho细胞,300g离心去上清,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106个/ml;2)将pd-l1-cho细胞以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)加入pe标记的抗-人iggfc流式抗体(abcam,ab98596),用排枪将细胞吹匀并放置于4℃孵育30分钟;7)300g离心去上清,加入facs缓冲液并重悬细胞;8)重复步骤10)两遍,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测。如表2所示,通过facs实验,本发明人筛选到2个有高亲和力的纳米抗体候选分子,亲和力均高于或与对照抗体相似。表2.抗体的ec50克隆编号ec50(μg/ml)nb22d-210.39nb22gb-100.39kn035(对照)0.39atezolizumab(对照)0.83实施例6嵌合vhh-fc抗体阻断pd-1的活性验证对获得的vhh-fc候选抗体进行评价,采用facs方法检测其对pd-1/pd-l1的阻断活性,具体方法如下:1)收集培养好的人pd-l1-cho细胞,300g离心去上清,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106/ml;2)将pd-l1-cho细胞以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)向对应孔中加入生物素标记的pd-1-fc蛋白稀释液(1μg/ml)100μl,重悬细胞并将细胞放置于4℃孵育30分钟;7)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μlfacs并使用排枪重悬细胞;8)重复步骤7)两次,300g离心去上清;9)加入pe标记的链霉抗生物素蛋白(streptavidin,ebioscience,12-4317-87),用排枪将细胞吹匀并放置于4℃孵育30分钟;10)300g离心去上清,加入facs缓冲液并重悬细胞;11)重复步骤10)两遍,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)上机检测。如表3所示,通过facs实验,本发明人验证了实施例5中克隆编号为nb22d-21和nb22gb-10的2个纳米抗体候选分子同时拥有高阻断活性,其阻断活性均高于对照抗体或与对照抗体相似。表3.抗体的ic50克隆编号ic50(μg/ml)nb22d-210.41nb22gb-100.54kn035(对照)0.39atezolizumab(对照)0.86实施例7嵌合vhh-fc抗体阻断cd80的活性验证对获得的vhh-fc候选抗体进行评价,采用facs方法检测其对cd80/pd-l1的阻断活性,具体方法如下:1)收集培养好的人pd-l1-cho细胞,300g离心去上清,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106/ml;2)将pd-l1-cho细胞以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)向对应孔中加入生物素标记的cd80蛋白稀释液(1μg/ml)100μl,重悬细胞并将细胞放置于4℃孵育30分钟;7)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;8)重复步骤7)两次,300g离心去上清;9)加入pe标记的链霉抗生物素蛋白(ebioscience,12-4317-87),用排枪将细胞吹匀并放置于4℃孵育30分钟;10)300g离心去上清,加入facs缓冲液并重悬细胞;11)重复步骤10)两次,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测。如表4所示,通过facs实验,本发明人验证了实施例5中克隆编号为nb22d-21和nb22gb-10的2个纳米抗体候选分子同时拥有高阻断活性,其阻断活性均高于对照抗体或与对照抗体相似。表4.抗体的ic50克隆编号ic50(μg/ml)nb22d-210.7081nb22gb-100.7651kn035(对照)0.6307atezolizumab(对照)0.9077实施例8嵌合vhh-fc抗体在肿瘤细胞上的结合活性为了评价vhh-fc候选抗体在人黑色素瘤细胞系a375细胞(atcc,crl-1619)上的结合活性,采用facs方法检测其与细胞上pd-l1蛋白的结合活性,具体方法如下:1)用含0.25%edta的trypsin消化a375细胞,收集细胞300g离心去上清,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106个/ml;2)将a375细胞以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)向对应孔中加入各个候选抗体和对照抗体稀释液(1μg/ml)100μl,重悬细胞并将细胞放置于4℃孵育30分钟;7)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;8)重复步骤7)两次,300g离心去上清;9)加入pe标记的抗-生物素(anti-biotin)流式抗体(abcam),用排枪将细胞吹匀并放置于4℃孵育30分钟;10)300g离心去上清,加入facs缓冲液并重悬细胞;11)重复步骤10)两次,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测,检测结果如图3所示。从图3可以看出,克隆编号为nb22d-21和nb22gb-10的2个纳米抗体候选分子在人黑色素瘤细胞系a375细胞上的结合活性与对照抗体相当。实施例9嵌合vhh-fc抗体结合鼠、猴pd-l1的活性验证为了评价vhh-fc候选抗体与猴、鼠pd-l1的交叉结合活性,采用facs方法检测其与细胞上pd-l1蛋白的结合活性,具体方法如下:1)收集培养的小鼠pd-l1-cho细胞和猴pd-l1-cho细胞,300g离心去培养基,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106/ml;2)分别将小鼠pd-l1-cho细胞和猴pd-l1-cho细胞以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)向对应孔中加入生物素标记的pd-1-fc蛋白稀释液(1μg/ml)100μl,重悬细胞并将细胞放置于4℃孵育30分钟;7)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;8)重复步骤7)两次,300g离心去上清;9)加入pe标记的抗-生物素(anti-biotin)流式抗体(abcam),用排枪将细胞吹匀并放置于4℃孵育30分钟;10)300g离心去上清,加入facs缓冲液并重悬细胞;11)重复步骤10)两次,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测。人鼠交叉反应检测结果显示克隆编号为nb22d-21的纳米抗体候选分子有一定的鼠pd-l1结合活性。人猴交叉反应的检测结果参见表5,从中可以看出,克隆编号为nb22d-21和nb22gb-10的2个纳米抗体候选分子均有很好的识别猴pd-l1的活性。表5.ec50值克隆编号ec50(μg/ml)nb22d-210.25nb22gb-100.20kn035(对照)0.21atezolizumab(对照)0.33实施例10嵌合vhh-fc抗体结合pd-l1的特异性检测为了确认候选分子结合pd-l1蛋白的特异性,采用elisa法检测候选分子结合b7家族其他蛋白的活性,具体方法如下:实验前一天向elisa板中加入30μl终浓度为2μg/ml的b7-h1(即,pdl1)、b7-h2、b7-h3、b7-h4、b7-dc(以上蛋白均购自义翘神州公司,货号分别为10084-hnah、11559-h08h、11188-h08h、10738-h08h、10292-h08h-b)等蛋白稀释液,4℃孵育过夜;第二天使用pbst润洗elisa板3遍,随后加入150μl5%pbsm封闭elisa板,常温孵育2小时;再用pbst洗板3遍,接着将30μl候选抗体和对照抗体的稀释液加入elisa板中,常温孵育1小时;用pbst洗板3遍,加入1:7000稀释的抗-人iggfc-hrp二抗,每孔30μl,常温孵育30分钟;用pbst洗板6遍后加入tmb显色,最后加入2mhcl终止反应,通过酶标仪(moleculardevices,spectermax190)在450nm波长下读值,其结果显示在表6和图4中。抗体分子的特异性结合反应实验验证结果如表6和图4所示。表6.候选分子结合pd-l1蛋白的特异性克隆/蛋白b7-h1b7-h2b7-h3b7-h4b7-dcnb22d-21+n/an/an/an/anb22-gb-10+n/an/an/an/akn035+n/an/an/an/aatezolizumab+n/an/an/an/a+:表示检出结合活性;n/a:表示未检出结合活性。从表6和图4的结果可以看出,克隆编号为nb22d-21和nb22gb-10的2个纳米抗体候选分子对b7-h1以外的b7家族分子没有结合活性,只对b7-h1有结合活性,这个结合特异性与对照抗体一致。实施例11嵌合vhh-fc抗体的体外生物学活性验证为了确认候选分子在体外刺激t细胞激活的能力,本发明人在体外建立了混合淋巴细胞反应体系,具体方法如下:使用美天旎分选试剂盒(miltenyibiotec,130-050-201)体外分选cd14阳性的单核细胞和cd4阳性t细胞,体外使用100ng/mlil-4和100ng/mlgm-csf诱导培养7天将单核细胞诱导成为树突状细胞(dendriticcell,dc),再将cd4阳性t细胞与dc以10∶1的细胞数比例混合,向细胞中加入梯度稀释的候选抗体和对照抗体,37℃细胞培养箱中培养5天,培养72小时后取细胞上清,pbs稀释后使用il-2elisa试剂盒检测培养上清中的il-2分泌量;培养5天后取细胞上清,pbs稀释后使用ifn-γelisa试剂盒检测培养上清中的ifn-γ分泌量。通过检测il-2的分泌量,本发明人得到抗体分子的混合淋巴细胞反应测试验证结果,其如图5所示。从图5可以看出,本发明的纳米抗体候选分子可以激活免疫反应。实施例12抗体人源化改造为了降低分子在体内的免疫原性,本发明人对候选分子进行了人源化设计。分别使用discoverystudio和antibodymodeling,采用同源建模方法建模,选取5-10个最优结构解,loop区域一般使用同源建模方法建模,如cdr氨基酸序列比对结果显示低于50%同一性,则使用从头建模方法搭建cdr3结构模型。使用pdbblast调取序列最接近的10个抗体晶体结构模型(结构分辨率高于2.5埃),对比自动建模模型,选取最优的结构模型。本发明人对nb22d-21分子进行了抗体人源化改造,得到了两个人源化的分子,这两个人源化改造后的分子编号分别为nb22d-21-huvh1和nb22d-21-huvh2。实施例13人源化改造后的衍生分子结合人pd-l1-cho细胞为了检测人源化对分子结合人pd-l1抗原活性的影响,本发明人用facs对候选分子及其人源化改造后的衍生分子进行了检测。1)收集培养好的人pd-l1-cho细胞,300g离心去上清,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106个/ml;2)将pd-l1-cho细胞以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)加入pe标记的抗-人iggfc流式抗体(abcam,ab98596),用排枪将细胞吹匀并放置于4℃孵育30分钟;7)300g离心去上清,加入facs缓冲液并重悬细胞;8)重复步骤7)两次,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测,结果如图6所示。从图6可以看出,人源化后得到的衍生分子(即,nb22d-21-huvh1和nb22d-21-huvh2)与人pd-l1结合的亲和力和其母本分子(即,nb22d-21)相似。实施例14人源化改造后的衍生分子结合鼠pd-l1-cho细胞为了检测人源化对分子结合鼠pd-l1抗原交叉活性的影响,本发明人用facs对候选分子进行了检测。1)收集培养好的鼠pd-l1-cho细胞,300g离心去上清,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106个/ml;2)将鼠pd-l1-cho细胞以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)加入pe标记的抗-人iggfc流式抗体(abcam,ab98596),用排枪将细胞吹匀并放置于4℃孵育30分钟;7)300g离心去上清,加入facs缓冲液并重悬细胞;8)重复步骤7)两次,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测,结果参见图7和图8。从图7可以看出,人源化改造后得到的衍生分子中,nb22d-21-huvh1与鼠pd-l1结合的亲和力要优于母本分子(即,nb22d-21)。具体而言,从图7可以看出,相对于母本分子nb22d-21以及对照分子kn035,人源化改造后得到的衍生分子nb22d-21-huvh1具有非常好的结合鼠pd-l1蛋白的活性;选取其中kn035和nb22d-21-huvh1的流式峰图(如图8所示),从中可以清楚地看出:分别使用20μg/ml的kn035和nb22d-21-huvh1结合鼠pd-l1过表达细胞,facs检测数据表明kn035不能识别cho细胞表面的鼠pd-l1(图8a),而nb22d-21-huvh1能够很好地识别cho细胞表面的鼠pd-l1(图8b)(注:每个图中间的分界线为设定的荧光强度阈值位置)。实施例15人源化改造后的衍生分子阻断pd-1的活性验证对人源化后获得的衍生分子进行评价,采用facs方法检测其对pd-1/pd-l1的阻断活性,具体方法如下:1)收集培养好的人pd-l1-cho细胞,300g离心去上清,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106/ml。2)将pd-l1-cho细胞以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)向对应孔中加入生物素标记的pd-1-fc蛋白稀释液(1μg/ml)100μl,重悬细胞并将细胞放置于4℃孵育30分钟;7)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μlfacs并使用排枪重悬细胞;8)重复步骤7)两次,300g离心去上清;9)加入pe标记的链霉抗生物素蛋白(streptavidin,ebioscience,12-4317-87),用排枪将细胞吹匀并放置于4℃孵育30分钟;10)300g离心去上清,加入facs缓冲液并重悬细胞;11)重复步骤10)两次,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测,结果如图9所示。从图9可以看出,人源化改造后得到的衍生分子(即,nb22d-21-huvh1和nb22d-21-huvh2)阻断pd-1蛋白结合pd-l1的活性与其母本分子(即,nb22d-21)和阳性对照kn035相当。实施例16nb22d-21分子在a375小鼠肿瘤模型中的药效验证为了确认候选抗体分子在体内抑制肿瘤生长的活性,本发明人建立了基于过表达人pd-l1的人黑色素瘤a375细胞系的小鼠模型,具体方法如下:选取6周龄左右、大小和体重相似的nod-scid小鼠,将小鼠分为对照组和候选抗体组及阳性对照抗体组3组,每组8只。体外培养人黑色素瘤细胞系pd-l1-a375(实施例1制得),将1×107个pd-l1-a375细胞与5×106个pbmc细胞混合,尾静脉注射入小鼠体内,记为第0天。第2天向每组小鼠体内注射5mg/ml或10mg/ml的候选抗体或对照抗体,此后每7天给药一次,连续给药6次。第7天开始每周记录小鼠体重及肿瘤大小,直至肿瘤生长至1500mm3。实施例17人源化分子的成药性改造为了优化分子的成药性,避免潜在翻译后修饰位点对蛋白质折叠、活性以及功能的影响,本发明人对人源化改造后获得的抗体衍生分子nb22d-21-huvh2进行了成药性改造设计。成药性改造采用点突变对潜在翻译后修饰位点进行随机突变,构建成药性改造抗体库,并利用噬菌体展示技术对成药性改造后的分子进行筛选。获得单克隆后制备vhh裂解液,并采用facs检测克隆在pd-l1-cho上的阻断活性。通过初步筛选,本发明人得到10个成药性改造后的变体分子:sy01-d21-3、sy01-d21-4、sy01-d21-5、sy01-d21-6、sy01-d21-8、sy01-d21-17、sy01-d21-21、sy01-d21-24、sy01-d21-38和sy01-d21-47(在图10中分别简写为3、4、5、6、8、17、21、24、38和47,母本分子为nb22d-21-huvh2,简写为d21-vh2,同种型对照(isotype)为人igg1),通过进一步筛选,本发明人获得了5个可能优于母本的克隆,分别是sy01-d21-4、sy01-d21-8、sy01-d21-17、sy01-d21-24、sy01-d21-47。实验结果如图10所示,从其细胞裂解液的定性/半定量结果可以看出,sy01-d21-4、sy01-d21-8、sy01-d21-17和sy01-d21-24这4个成药性改造候选分子的阻断活性均与母本分子nb22d-21-huvh2相似。另外,由于sy01-d21-47的细胞表达量不高,因此未选用该克隆进行后续检测。实施例18成药性候选克隆的全长构建及样品生产将筛选获得的阳性vhh候选抗体sy01-d21-4、sy01-d21-8、sy01-d21-17和sy01-d21-24与人igg1fc段融合,采用阳性vhh基因序列的c端连接到人igg1fc段基因序列的n端的方式构建融合表达载体,将该融合表达载体质粒转化expicho细胞,诱导表达得到融合了fc片段的4种vhh-fc嵌合抗体蛋白,分别称为nb22d-21-4、nb22d-21-8、nb22d-21-17和nb22d-21-24。抗体表达采用的是expicho瞬转表达系统,培养基为(gibco,a29100-01),转染试剂盒为(gibco,a29129)。具体方法如下:转染前一天将expicho细胞进行传代,在25ml体系内,将构建好的质粒25μg与转染试剂混合之后滴加入25mlexpicho细胞培养物中,充分混匀,于37℃表达18-22小时后,根据试剂盒内说明添加补料培养基,补料后,细胞置于32℃培养,转染后第5天,添加第二次补料,并将细胞置于32℃培养,10-12天之后,将表达好的细胞混悬液高速离心取上清,所得上清经0.22μm过滤后采用proteina/g亲和纯化方法进行纯化,用100mm甘氨酸盐(ph3.0)洗脱目的蛋白,接着用1mtris-hcl中和。实施例19成药性改造后的候选抗体结合人和猴pd-l1的活性验证对成药性改造后获得的4个vhh-fc候选抗体进行评价,采用facs方法检测其与细胞上人及猴pd-l1蛋白的结合活性,具体方法如下:1)收集培养好的人和猴pd-l1-cho细胞,300g离心去上清,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106个/ml;2)将人和猴pd-l1-cho细胞分别以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)加入pe标记的抗-人iggfc流式抗体(abcam,ab98596),用排枪将细胞吹匀并放置于4℃孵育30分钟;7)300g离心去上清,加入facs缓冲液并重悬细胞;8)重复步骤10)两遍,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测。如表7所示,比较4个候选分子在人和猴pd-l1-cho上的结合活性,本发明人筛选到2个对人和猴pd-l1均有较高亲和力的纳米抗体候选分子nb22d-21-4以及nb22d-21-24。表7.抗体的ec50实施例20成药性改造后的候选抗体阻断pd-1的活性验证对获得的vhh-fc候选抗体进行评价,采用facs方法检测其对pd-1/pd-l1的阻断活性,具体方法如下:1)收集培养好的人pd-l1-cho细胞,300g离心去上清,将细胞用配制好的facs缓冲液重悬,计数并将细胞悬液密度调整为2×106/ml;2)将pd-l1-cho细胞以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)两次,300g离心去上清;6)向对应孔中加入生物素标记的pd-1-fc蛋白稀释液(1μg/ml)100μl,重悬细胞并将细胞放置于4℃孵育30分钟;7)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μlfacs并使用排枪重悬细胞;8)重复步骤7)两次,300g离心去上清;9)加入pe标记的链霉抗生物素蛋白(streptavidin,ebioscience,12-4317-87),用排枪将细胞吹匀并放置于4℃孵育30分钟;10)300g离心去上清,加入facs缓冲液并重悬细胞;11)重复步骤10)两遍,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)上机检测。如表8所示,通过facs实验,本发明人验证了实施例19中克隆编号为nb22d-21-4以及nb22d-21-24的2个纳米抗体候选分子同时拥有高阻断活性,其阻断活性均高于nb22d-21-huvh2抗体。表8.抗体的ic50克隆编号ic50(μg/ml)nb22d-21-huvh21.00nb22d-21-40.30nb22d-21-240.20实施例21成药性改造后的候选抗体结合pd-l1的特异性检测为了确认成药性改造后的候选分子结合pd-l1蛋白的特异性,采用facs法检测候选分子结合细胞的特异性,具体分为两部分,第一部分具体方法如下:1)收集培养好的jurkat和raji细胞,300g离心去上清,将细胞用配制好的facs缓冲液(缓冲液成分:1*pbs+5%fbs+2%bsa)重悬,计数并将细胞悬液密度调整为2×106个/ml;2)将jurkat和raji细胞分别以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)四次,300g离心去上清;6)加入pe标记的抗-人iggfc流式抗体(abcam,ab98596),用排枪将细胞吹匀并放置于4℃孵育30分钟;7)300g离心去上清,加入facs缓冲液并重悬细胞;8)重复步骤10)两遍,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测。如下表9,根据facs检测结果,本发明人将阳性和阴性分别用“+”(表示有结合)和“-”(表示无结合)表示,根据表9可知,在nb22d-21-4及nb22d-21-24克隆中,前者在两种细胞上均没有非特异性结合,而后者均有较高的非特异性结合,且对照抗体没有显示出非特异性结合。表9.抗体的非特异性结合克隆/细胞jurkatrajinb22d-21-huvh2--nb22d-21-4--nb22d-21-24++kn035(对照)--atezolizumab(对照)--第二部分实验中,本发明人利用facs方法对nb22d-21-4克隆结合b7家族蛋白的特异性进行了检测,具体方法如下:1)收集培养好的b7-h2,b7-h4,b7-h5细胞,300g离心去上清,将细胞用配制好的facs缓冲液(缓冲液成分:1*pbs+5%fbs+2%bsa)重悬,计数并将细胞悬液密度调整为2×106个/ml;2)将b7-h2,b7-h4,b7-h5细胞分别以100μl每孔加入96孔圆底板,300g离心去上清;3)向对应孔中加入梯度稀释的候选抗体稀释液和对照抗体稀释液,用排枪将细胞吹匀并放置于4℃孵育30分钟;4)将孵育后的细胞混合液300g离心去上清,向对应孔中加入200μl并使用排枪重悬细胞;5)重复步骤4)四次,300g离心去上清;6)加入pe标记的抗-人iggfc流式抗体(abcam,ab98596),用排枪将细胞吹匀并放置于4℃孵育30分钟;7)300g离心去上清,加入facs缓冲液并重悬细胞;8)重复步骤10)两遍,向孔中加入facs缓冲液,每孔200μl,重悬细胞,通过流式细胞仪(beckman,cytoflexaoo-1-1102)检测。如下表10,根据facs检测结果,本发明人将阳性和阴性分别用“+”(表示有结合)和“-”(表示无结合)表示,根据表10可知,nb22d-21-4在多种细胞上均没有非特异性结合,且对照抗体没有显示出非特异性结合。表10.抗体与b7家族蛋白的特异性克隆/细胞b7-h2b7-h3b7-h4b7-h5nb22d-21-huvh2----nb22d-21-4----kn035(对照)----实施例22nb22d-21-4抗体的体外mlr活性验证为了确认候选分子在体外刺激t细胞激活的能力,本发明人在体外建立了混合淋巴细胞反应体系,具体方法如下:使用美天旎分选试剂盒(miltenyibiotec,130-050-201)体外分选cd14阳性的单核细胞和cd4阳性t细胞,体外使用100ng/mlil-4和100ng/mlgm-csf诱导培养7天将单核细胞诱导成为树突状细胞(dendriticcell,dc),再将cd4阳性t细胞与dc以10∶1的细胞数比例混合,向细胞中加入梯度稀释的候选抗体和对照抗体,37℃细胞培养箱中培养5天,培养72小时后取细胞上清,pbs稀释后使用il-2elisa试剂盒检测培养上清中的il-2分泌量;培养5天后取细胞上清,pbs稀释后使用ifn-γelisa试剂盒检测培养上清中的ifn-γ分泌量。通过检测ifn-γ和il-2的分泌量,本发明人得到抗体分子的混合淋巴细胞反应测试验证结果,其如图11所示。从图11可以看出,本发明的纳米抗体候选分子nb22d-21-4可以激活免疫反应。本领域技术人员将进一步认识到,在不脱离其精神或中心特征的情况下,本发明可以以其他具体形式来实施。由于本发明的前述描述仅公开了其示例性实施方案,应该理解的是,其他变化被认为是在本发明的范围内。因此,本发明不限于在此详细描述的特定实施方案。相反,应当参考所附权利要求来指示本发明的范围和内容。序列表<110>三优生物医药(上海)有限公司<120>pd-l1单结构域抗体及其用途<130>idc206025<160>26<170>patentinversion3.5<210>1<211>10<212>prt<213>人工序列<220><223>cdr1<400>1argthraspserasnileasnglymethis1510<210>2<211>9<212>prt<213>人工序列<220><223>cdr2<400>2thrilepheileaspglyasnthrile15<210>3<211>8<212>prt<213>人工序列<220><223>cdr3<400>3aspvalserglytyrglyargala15<210>4<211>10<212>prt<213>人工序列<220><223>cdr1<400>4argthraspargasnileasnthrmethis1510<210>5<211>9<212>prt<213>人工序列<220><223>cdr2<400>5thrilepheileaspleuasnthrile15<210>6<211>10<212>prt<213>人工序列<220><223>cdr1<400>6glyphethrpheserargargcyslysala1510<210>7<211>10<212>prt<213>人工序列<220><223>cdr2<400>7lysileleuthrthrserglyserthrtyr1510<210>8<211>19<212>prt<213>人工序列<220><223>cdr3<400>8aspserphegluaspprothrcysthrleuvalthrserserglyala151015pheglntyr<210>9<211>128<212>prt<213>人工序列<220><223>kn035的vh<400>9glnvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheserargarg202530cyslysalatrppheargglnalaproglylysgluarggluargval354045alalysileleuthrthrserglyserthrtyrleualaaspserval505560lysglyargphethrileserargaspasnserlysasnthrvaltyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaalaaspserphegluaspprothrcysthrleuvalthrserser100105110glyalapheglntyrtrpglyglnglythrleuvalthrvalserser115120125<210>10<211>116<212>prt<213>人工序列<220><223>nb22d-21的vh<400>10gluvalglnvalglngluserglyglyglyleuvalglnalaglygly151015serleuargleusercysalahisserargthraspserasnileasn202530glymethistrptyrargglnalaproglylysglnargasptrpval354045glythrilepheileaspglyasnthrilevalthraspservallys505560glyargphethrileserargaspasnalalysasnthrleutyrleu65707580glnmetasnthrleulysprogluaspthralavaltyrphecysala859095alaaspvalserglytyrglyargalatrpglyglnglythrglnval100105110thrvalserser115<210>11<211>116<212>prt<213>人工序列<220><223>nb22d-21-huvh2的vh<400>11gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserargthraspserasnileasn202530glymethistrptyrargglnalaproglylysglyargglutrpval354045glythrilepheileaspglyasnthrilevalthraspservallys505560glyargphethrileserargaspasnalalysasnthrleutyrleu65707580glnmetasnthrleuargalagluaspthralavaltyrtyrcysala859095alaaspvalserglytyrglyargalatrpglyglnglythrthrval100105110thrvalserser115<210>12<211>116<212>prt<213>人工序列<220><223>nb22d-21-huvh1的vh<400>12gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalahisserargthraspserasnileasn202530glymethistrptyrargglnalaproglylysglyargglutrpval354045glythrilepheileaspglyasnthrilevalthraspservallys505560glyargphethrileserargaspasnalalysasnthrleutyrleu65707580glnmetasnthrleuargalagluaspthralavaltyrtyrcysala859095alaaspvalserglytyrglyargalatrpglyglnglythrthrval100105110thrvalserser115<210>13<211>116<212>prt<213>人工序列<220><223>nb22d-21-4的vh<400>13gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserargthraspargasnileasn202530thrmethistrptyrargglnalaproglylysglyargglutrpval354045glythrilepheileaspleuasnthrilevalthraspservallys505560glyargphethrileserargaspasnalalysasnthrleutyrleu65707580glnmetasnthrleuargalagluaspthralavaltyrtyrcysala859095alaaspvalserglytyrglyargalatrpglyglnglythrthrval100105110thrvalserser115<210>14<211>25<212>prt<213>人工序列<220><223>fr1<400>14gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalahisser2025<210>15<211>14<212>prt<213>人工序列<220><223>fr2<400>15trptyrargglnalaproglylysglyargglutrpvalgly1510<210>16<211>39<212>prt<213>人工序列<220><223>fr3<400>16valthraspservallysglyargphethrileserargaspasnala151015lysasnthrleutyrleuglnmetasnthrleuargalagluaspthr202530alavaltyrtyrcysalaala35<210>17<211>11<212>prt<213>人工序列<220><223>fr4<400>17trpglyglnglythrthrvalthrvalserser1510<210>18<211>25<212>prt<213>人工序列<220><223>fr1<400>18gluvalglnvalglngluserglyglyglyleuvalglnalaglygly151015serleuargleusercysalahisser2025<210>19<211>14<212>prt<213>人工序列<220><223>fr2<400>19trptyrargglnalaproglylysglnargasptrpvalgly1510<210>20<211>39<212>prt<213>人工序列<220><223>fr3<400>20valthraspservallysglyargphethrileserargaspasnala151015lysasnthrleutyrleuglnmetasnthrleulysprogluaspthr202530alavaltyrphecysalaala35<210>21<211>11<212>prt<213>人工序列<220><223>fr4<400>21trpglyglnglythrglnvalthrvalserser1510<210>22<211>25<212>prt<213>人工序列<220><223>fr1<400>22gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaser2025<210>23<211>25<212>prt<213>人工序列<220><223>fr1<400>23glnvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaser2025<210>24<211>14<212>prt<213>人工序列<220><223>fr2<400>24trppheargglnalaproglylysgluarggluargvalala1510<210>25<211>39<212>prt<213>人工序列<220><223>fr3<400>25leualaaspservallysglyargphethrileserargaspasnser151015lysasnthrvaltyrleuglnmetasnserleuargalagluaspthr202530alavaltyrtyrcysalaala35<210>26<211>11<212>prt<213>人工序列<220><223>fr4<400>26trpglyglnglythrleuvalthrvalserser1510当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1