一种新甘精胰岛素原及其制备甘精胰岛素的方法与流程
本发明涉及一种新甘精胰岛素原及其制备甘精胰岛素的方法,属于重组蛋白制备
技术领域:
。
背景技术:
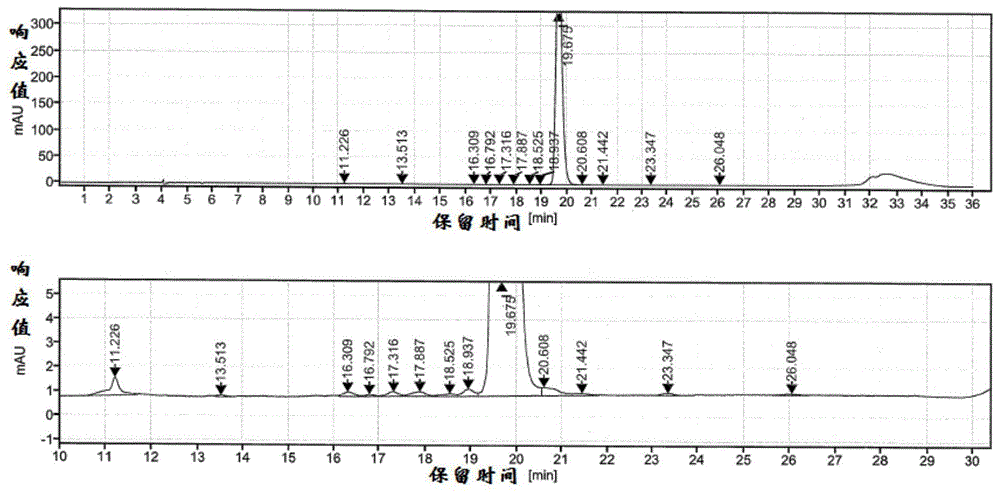
:胰岛素是一种调节动物体内葡萄糖代谢的激素。这种激素是由a链和b链2条肽链组成,a链有21个氨基酸和b链有30个氨基酸,共51个氨基酸。其中a7(cys)-b7(cys),a20(cys)-b19(cys)4个半胱氨酸形成2个二硫键,连接a链和b链。在a链中有a6(cys)和a11(cys)形成的链内二硫键。糖尿病的特点是由于胰岛素缺乏和/或肝葡萄糖产量的增加而导致血糖水平升高,胰岛素是机体内唯一降低血糖的激素。胰岛素类似物发展的总体目标是模拟生理性的胰岛素分泌,从而改善1型和2型糖尿病患者的血糖控制(bergerm.acomment.diabetesresclinpract.6:s25–s31,1989;sanliogluad等人,clinicalutilityofinsulinandinsulinanalogs.islets5(2):67-78,2013)。近期的胰岛素类似物(天然胰岛素的类似物)包括由基因工程或生物化学反应在天然胰岛素分子上额外附加氨基酸残基或者替换氨基酸残基,或对其他功能组的修饰。这些修饰通过改变胰岛素分子的药理学、药代动力学和药效动力学特性,改变了生物药效率的速度,如门冬胰岛素、甘精胰岛素、赖脯胰岛素等。甘精胰岛素(美国专利us5656722)是一种长效作用的胰岛素类似物。在a21处用甘氨酸取代门冬氨酸,在b链的c末端添加两个精氨酸残基,是为了让甘精胰岛素在注射时形成沉淀物(六聚体-微晶体)。甘精胰岛素的等电点从ph5.4提高至ph6.7,使分子在酸性ph下是水溶性的,最终导致甘精胰岛素六聚体缓慢地解离成单体。在中性ph皮下区域,六聚体的形成导致胰岛素从注射部位缓慢,无峰值溶解和吸收,提供持续24-26小时长的持续作用时间。甘精胰岛素的延长作用降低了峰值效应,降低了低血糖的风险。与nph中性精蛋白锌胰岛素相比,甘精胰岛素显示出较低的严重低血糖发生率(sanliogluadetal.,clinicalutilityofinsulinandinsulinanalogs.islets5(2):67-78,2013)。人胰岛素是重组dna技术产生的第一个蛋白类药物。1978年,人胰岛素在实验室中首次成功表达;1982年,重组人胰岛素被批准作为治疗药物。重组人胰岛素的前体蛋白由遗传修饰的生物合成,并通过蛋白酶水解切割生成活性胰岛素。几乎所有在公开销售的胰岛素类似物都是用基因工程技术从胰岛素人类基因中改良出来的,并在大肠杆菌或酵母中产生。对于使用转基因大肠杆菌的方法,有一种方法是在大肠杆菌中分别表达胰岛素的a链和b链,然后在体外混合磺化的a链和b链形成链间二硫键(rich,d.h.等人,piercechemicalcompany,rockford.pp.721-728,1981.和frank,b.h.等人,piercechemicalcompany,rockford.pp.729-738,1981)。然而,该方法存在缺点,因为它需要两个单独的发酵过程并形成正确的二硫键。磺化的a链和b链之间形成的不正确的二硫键会导致胰岛素的低产率。专利cn103981242a中涉及了一种使用铜/锌超氧化物歧化酶sod作为融合肽生产胰岛素的方法。该融合肽由64个氨基酸组成,其中第一位氨基酸为met,最后一位氨基酸为arg;同时,融合肽链中的半胱氨酸残基均被丝氨酸残基取代。该专利中sod融合肽片段的氨基酸序列如下所示:matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglteglhgfhvhefgdntagstsagpr(seqidno:1)。该sod片段中有5个lys残基,为胰蛋白酶的天然切割位点。在后续的酶切过程中,容易产生错切杂质,导致产率和纯度较低。一种在c-肽区域中不具有保守的二元基氨基酸末端序列的胰岛素原的使用方法也被报道。例如,美国专利us6777207所涉及的胰岛素原肽结构体,它是由缩短的c-肽(长度不超过15个氨基酸残基)组成,其具有作为甘氨酸-精氨酸或甘氨酸-赖氨酸的两个末端氨基酸,其连接至a-羧基末端的链。与天然人胰岛素的全长30个氨基酸的b链相反,所述胰岛素原构建体含有29个氨基酸的b链。这种缩短的b链和缩短的c-肽在人胰岛素生产中的潜在影响尚不清楚,但是需要通过收率较低的转肽反应将b30位置的氨基酸连接上去。该专利中讲述的宿主细胞是酵母,没有证据表明该构建体可用于大肠杆菌。由于酵母表达体系的发酵周期较长会使其表达效率降低且成本升高,现在急需设计一种更高效和更完善的新型甘精胰岛素原的结构序列,以及由该结构序列制备甘精胰岛素的工艺,解决现有技术中存在的上述问题。技术实现要素:本发明公开一种能够有效改善重组甘精胰岛素制备工艺的新甘精胰岛素原及其制备甘精胰岛素的方法。本发明设计的甘精胰岛素原的结构包括一个n末端融合肽序列(定点突变后的sod)和具有a21修饰的胰岛素a链以及含两个精氨酸残基的全长人胰岛素b链。与天然人胰岛素相比,甘精胰岛素a链的a21位氨基酸用甘氨酸取代天冬酰胺,并且在b链的羧基末端添加两个精氨酸残基。所述甘精胰岛素原的结构采用“0c肽”策略,即b链和a链之间没有c肽序列。将该甘精胰岛素原在大肠杆菌中表达,再与融合肽一起在正确的复性条件下进行复性,再通过用胰蛋白酶酶切实现融合肽与甘精胰岛素分子的分离,从而得到甘精胰岛素。本发明设计的甘精胰岛素原在有定点突变后的sod片段融合肽存在的情况下,可以有效地折叠成其天然结构,提高甘精胰岛素的发酵产量。甘精胰岛素原在有合适的蛋白酶酶切位点存在时,增加c肽序列可能会导致酶切后c肽残留,并影响纯化及收率。本发明中,新发明的甘精胰岛素原采用“0c肽”策略,可有效避免酶切后c肽的残留,并使酶切转化步骤中的质量损失最小化。本发明的第一个目的是提供一种新的甘精胰岛素原,其氨基酸序列具有如下结构:r-r1-(b1-b32)-(a1-a20)-a21其中:r-r1为融合肽序列,r的氨基酸序列为:matx1avsvlkgdgpvqgiinfeqx2esngpvkvwgsix3glteglhgfhvhefgdntagstsagp;x1为脯氨酸pro(p)或组氨酸his(h);x2为脯氨酸pro(p)或组氨酸his(h);x3为脯氨酸pro(p)或组氨酸his(h);r1为精氨酸arg(r)或赖氨酸lys(k);b1-b32为在天然人胰岛素的b链b1-b30的b30位c-末端后增加了两个精氨酸arg残基(r);a1-a20为具有20个氨基酸的胰岛素a链;a21是甘氨酸(g)。在一种实施方式中,r的氨基酸序列如matpavsvlkgdgpvqgiinfeqpesngpvkvwgsipglteglhgfhvhefgdntagstsagp(seqidno:2);或mathavsvlkgdgpvqgiinfeqhesngpvkvwgsihglteglhgfhvhefgdntagstsagp(seqidno:3)所示。在一种实施方式中,融合肽序列的c端通过一个赖氨酸残基或者精氨酸残基与b1-b32相连接。在一种实施方式中,a1-a20的氨基酸序列为giveqcctsicslyqlenyc(seqidno:4)。在一种实施方式中,b1-b30的氨基酸序列为fvnqhlcgshlvealylvcgergffytpkt(seqidno:5)。在一种实施方式中,用两个精氨酸残基延长b链,使b1-b32的氨基酸序列为fvnqhlcgshlvealylvcgergffytpktrr。在一种实施方式中,甘精胰岛素原中(b1-b32)-(a1-a20)-a21的氨基酸序列为:fvnqhlcgshlvealylvcgergffytpktrrgiveqcctsicslyqlenycg(seqidno:6)在一种实施方式中,甘精胰岛素原r-r1-(b1-b32)-(a1-a20)-a21的氨基酸序列为seqidno:7、seqidno:8、seqidno:9和seqidno:10中的任意一种:matpavsvlkgdgpvqgiinfeqpesngpvkvwgsipglteglhgfhvhefgdntagstsagpkfvnqhlcgshlvealylvcgergffytpktrrgiveqcctsicslyqlenycg(seqidno:7);matpavsvlkgdgpvqgiinfeqpesngpvkvwgsipglteglhgfhvhefgdntagstsagprfvnqhlcgshlvealylvcgergffytpktrrgiveqcctsicslyqlenycg(seqidno:8);mathavsvlkgdgpvqgiinfeqhesngpvkvwgsihglteglhgfhvhefgdntagstsagpkfvnqhlcgshlvealylvcgergffytpktrrgiveqcctsicslyqlenycg(seqidno:9);mathavsvlkgdgpvqgiinfeqhesngpvkvwgsihglteglhgfhvhefgdntagstsagprfvnqhlcgshlvealylvcgergffytpktrrgiveqcctsicslyqlenycg(seqidno:10)。本发明的第二个目的是提供编码甘精胰岛素原的dna。在一种实施方式中,所述dna具有seqidno:11~14任一所示的核苷酸序列。在一种实施方式中,所述seqidno:11、seqidno:12、seqidno:13和seqidno:14分别编码seqidno:7、seqidno:8、seqidno:9和seqidno:10所示的氨基酸序列。本发明第三方面提供含有所述dna的表达载体。在一种实施方式中,所述表达载体包括但不限于pet系列质粒。本发明的第四个目的是提供表达所述甘精胰岛素原的非植物细胞,包括但不限于真核细胞或原核细胞。在一种实施方式中,所述细胞表达所述编码甘精胰岛素原的dna,或引入了所述表达载体。在一种实施方式中,所述微生物细胞包括但不限于大肠杆菌、枯草芽孢杆菌、酿酒酵母细胞。在一种实施方式中,所述细胞包括哺乳动物细胞或昆虫细胞。在一种实施方式中,所述细胞为原核细胞,包括但不限于大肠杆菌、枯草杆菌,或者是任何更适合重组蛋白表达的改良品种,如大肠杆菌dh5a、k12jm107、w3110、bl21(de3)、rosetta或其它菌株。在一种实施方式中,所述细胞为重组大肠杆菌,含有携带甘精胰岛素原编码基因的pet28a质粒。本发明的第四方面是提供一种生产甘精胰岛素的方法,利用所述重组大肠杆菌发酵生产甘精胰岛素。在一种实施方式中,所述方法是将重组大肠杆菌接种于bfm培养基中,于35~37℃下发酵至少20h。在一种实施方式中,所述bfm培养基含有磷酸氢二铵、氯化铵、磷酸二氢钾、七水硫酸镁、一水柠檬酸、葡萄糖、酵母粉和微量元素。在一种实施方式中,所述接种是接种重组大肠杆菌种子液。在一种实施方式中,所述种子液经过两级发酵;第一级发酵是在lb培养基中,于35~37℃发酵6~10h获得一级种子液;再将一级种子液以0.2%的接种量转接至bfm培养基中,培养6~10h获得二级种子液。在一种实施方式中,所述方法还对发酵后的甘精胰岛素酶切、复性和纯化。在一种实施方式中,所述方法包括如下步骤:(1)将所述重组大肠杆菌培养、发酵,表达甘精胰岛素原;(2)包涵体释放和溶解,以及甘精胰岛素原的复性;(3)用柠康酐修饰重折叠的甘精胰岛素原;(4)采用胰蛋白酶酶切步骤(3)修饰后的甘精胰岛素原,通过酸性水解得到甘精胰岛素;(5)甘精胰岛素的纯化;(6)甘精胰岛素的沉淀、洗涤、溶解、过滤和冻干。在一种实施方式中,所述步骤(2)采用溶菌酶处理和高压均质。在一种实施方式中,所述步骤(2)在15-25℃和ph10.0-11.6条件下稀释复性。在一种实施方式中,所述步骤(3)向复性的甘精胰岛素原中加入柠康酐。在一种实施方式中,所述步骤(4)通过胰蛋白酶酶切转化修饰后的含有权利要求1所述序列的甘精胰岛素原,去除所述的融合肽,得到b29位赖氨酸被柠康酐残基修饰的甘精胰岛素。在一种实施方式中,所述步骤(4)在ph1.5~2.5酸性水解除去柠康酐残基,得到甘精胰岛素。在一种实施方式中,所述步骤(5)使用离子交换色谱法纯化甘精胰岛素,以获得高纯度的甘精胰岛素;在一种实施方式中,所述步骤(5)使用制备型hplc色谱进一步纯化甘精胰岛素以获得更高纯度的甘精胰岛素;在一种实施方式中,还对高纯度的甘精胰岛素经过结晶和干燥形成最终的甘精胰岛素原料药。在一种实施方式中,将上述优化的基因连接到合适的载体,如ptac表达质粒系列、pgex系列或pet系列,优选pet系列质粒,更优选质粒pet-28a;该质粒可转染k12jm109工程菌或k12w110工程菌以形成表达克隆。在另一个优选的实施方案中,表达质粒转染到bl21(de3)工程菌中。在一种实施方式中,所述重组大肠杆菌通过摇瓶或发酵罐培养至适当浓度,然后诱导甘精胰岛素原的表达。在一种实施方式中,将含有甘精胰岛素原的包涵体的细胞通过溶菌酶处理和高压均质化进行裂解;分离的包涵体由含有洗涤剂或低浓度离液剂的溶液洗涤,并用高ph缓冲溶液溶解。在一个实施方式中,溶解缓冲液的ph值为11.6-12.4,溶解缓冲液含有tris、edta和l-半胱氨酸;所述tris的浓度为10-50mm,edta的浓度为0.05-1.0mm,l-半胱氨酸的浓度为0.25-5.0mm。在一个实施方式中,tris的浓度为20-30mm;edta的浓度为0.05-0.25mm,l-半胱氨酸的浓度为0.25-1.0mm;ph为11.8-12.2。在一种实施方式中,溶解缓冲液的温度为10-30℃,或15-25℃;包涵体溶解时间为10-120min,或10-60min。在一个实施方式中,溶解缓冲液的ph值为10.0-11.6,或为10.8-11.4;溶液的温度约10-25℃,或15-20℃;总蛋白的浓度为1-10g/l,或1-7g/l;复性持续时间为12-48h,或为24-36h。在一种实施方式中,酶切前采用保护试剂修饰甘精胰岛素原;所述保护试剂可以是易于与b29-lys的γ-nh2基团反应的亲电试剂,例如酸酐,包括但不限于乙酸酐,柠檬酸酐或柠康酐。在一个实施方式中,向甘精胰岛素原中加入过量摩尔比的柠康酐;可选地,对于甘精胰岛素原,加入10倍或更多摩尔量的柠康酐;或加入20倍或更多摩尔量的柠康酐。在一个实施方式中,加入保护试剂修饰的反应温度为15-25℃,ph为8.0-9.0,持续时间2-8h。在一种实施方式中,修饰完成后可加入乙醇胺中和过量的柠康酐,乙醇胺的体积为柠康酐的40%-80%,终止时间为10-30min。在一个实施方式中,将复性溶液的蛋白浓度调节为1-7g/l。向复性溶液中加入按体积计0.2%柠康酐并将ph调节至8.5,在20℃下反应4小时;修饰完成后,加入修饰所用柠康酐体积60%的乙醇胺进行中和,ph调节为9.0,中和30min。将终浓度为220u/g蛋白的胰蛋白酶(优选牛胰蛋白酶)加入到柠康酸修饰的甘精胰岛素原中,将ph调节至9.0,并在20℃下消化24小时以获得具有柠康酸残基的甘精胰岛素。通过hplc-rp(c18)监测该过程。一旦酶切反应结束,通过加入盐酸并调节ph2.0-2.5可以终止酶切反应。让溶液在该低ph值下保持24小时,以水解b29-lys上的柠康酸残基,得到甘精胰岛素。在一种实施方式中,将复性液的蛋白浓度调节为4g/l后,直接向复性的蛋白质溶液中加入按体积计0.05%柠康酐,将ph调节至8.5,在20℃下反应2小时。修饰完成后,加入修饰所用柠康酐体积的60%的乙醇胺进行中和,ph调节为9.4,中和15min。然后将终浓度为0.063mg/g蛋白的胰蛋白酶加入到柠康酸修饰的甘精胰岛素中,将ph调节至9.0,并在20℃下反应24小时以获得具有柠康酸残基的甘精胰岛素。通过hplc-rp(c18)监测该过程。一旦酶切反应完成,通过加入盐酸并调节ph2.0-2.5以终止反应。让溶液在该低ph值下保持12小时,通过水解去除b29-lys上的柠康酸残基,得到甘精胰岛素。在一种实施方式中,在胰蛋白酶酶解后,加入终浓度为1-10mm的锌离子,并且调节ph为5.5-6.5,使得甘精胰岛素形成沉淀并析出,通过适当的方法对甘精胰岛素进行纯化,从而获得最终甘精胰岛素产品。在一种实施方式中,使用制备的rp-hplc与磷酸二氢铵缓冲体系进行一步纯化,其中磷酸氢二铵的浓度为0.05-0.3m,或0.05-0.2m;ph值在2.0-5.0的范围内;有机改性剂可以是乙醇,甲醇或乙腈;在有机溶剂的线性浓度梯度中,甘精胰岛素被洗脱。在一种实施方式中,使用制备的rp-hplc和tris-hcl缓冲体系进行最终纯化,其中tris浓度为0.02-0.3m,或0.02-0.2m;ph值在7.0-9.0的范围内;有机改性剂可以是乙醇,甲醇或乙腈;在有机溶剂的线性浓度梯度中,甘精胰岛素被洗脱。在一种实施方式中,从rp-hplc洗脱的甘精胰岛素利用等电点沉淀法进行沉淀,收集沉淀。收集到的沉淀用0-1.5%的氯化钠溶液进行重悬洗涤,并将洗涤后离心得到的湿固体用40-200mm的盐酸溶液进行溶解,并且将甘精胰岛素的浓度调节为20-40mg/ml,调节ph至3.0-5.0,过滤后滤液冷冻干燥,制备获得以晶体或固化的api形式存在的甘精胰岛素原料药。本发明还要求保护所述方法在制备甘精胰岛素或含甘精胰岛素的药物中的应用。有益效果:本发明以定点突变后的sod片段为融合肽并采用“0c肽”策略,可以获得较高发酵产量,将甘精胰岛素的发酵产率提高了75%及以上,最高提高了78%;本发明通过“0c肽”策略,避免了c肽残基的残留,减少酶转化步骤的质量损失,本专利申请中减少错误的重折叠和错误的酶切过程造成的杂质,提高最终产品的产量和纯度,主峰色谱纯度达到99.4以上,最大单杂≤0.16%,其中较佳实施例中主峰色谱纯度高达99.9%,最大单杂控制在0.05%以下;主峰色谱纯度相对对比例提高了7%,最大单杂含量相对对比例由2.15%降低到≤0.16%,明显降低一个数量级。本发明的制备方法中通过牛胰蛋白酶进行酶切处理,相比于猪胰蛋白酶,酶切转化率可以提高16%。因此,制备高质量甘精胰岛素的生产成本可以大大降低。附图说明图1是根据本发明的实施例8中,采用基因序列seqidno:11构建后的菌株纯化液相色谱图。图2是根据本发明的实施例9中,采用基因序列seqidno:12构建后的菌株纯化液相色谱图。图3是根据本发明的实施例10中,采用基因序列seqidno:13构建后的菌株纯化液相色谱图。图4a、4b和4c是根据实施例1~5,采用基因序列seqidno:10构建后的菌株wcb01复性后的液相色谱图谱。图5a、5b和5c是根据对比例1~2采用基因序列seqidno:15构建后的菌株wcb02复性后的液相色谱图谱。图6是对比例3采用基因序列seqidno:16构建后的菌株wcb03复性后的液相色谱图谱。图7是对比例4采用基因序列seqidno:17构建后的菌株wcb04复性后的液相色谱图谱。图8是对比例5采用基因序列seqidno:18构建后的菌株wcb05复性后的液相色谱图谱。图9a是根据实施例6采用基因序列seqidno:10构建后的菌株wcb01纯化后的液相色谱图谱。图9b是根据对比例2及实施例6,采用基因序列seqidno:15构建后的菌株wcb02纯化后的液相色谱图谱。图10a是根据实施例6采用牛胰蛋白酶对甘精胰岛素原的酶切效果的液相色谱图谱。图10b是根据对比例7,采用猪胰蛋白酶对甘精胰岛素原的酶切效果的液相色谱图谱。具体实施方式下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1:新甘精胰岛素原的结构设计设计如式i所示的甘精胰岛素原蛋白序列:r-r1-(b1-b32)-(a1-a20)-a21改良后的甘精胰岛素原的序列采用“0c肽”策略,即b链和a链间没有氨基酸序列。n端先导氨基酸序列可以增强表达,保护甘精胰岛素原,防止被大肠杆菌降解。其中,融合肽r-r1中r的氨基酸序列为mathavsvlkgdgpvqgiinfeqhesngpvkvwgsihglteglhgfhvhefgdntagstsagp(如seqidno:3所示)。该融合肽氨基酸序列的c端通过精氨酸或赖氨酸残基连接到甘精胰岛素的b链,最终融合肽通过胰蛋白酶裂解被除去。实施例2:构建含有新甘精胰岛素原编码基因的重组质粒按照实施例1的方法设计新甘精胰岛素原的序列:新甘精胰岛素原中(b1-b32)-(a1-a20)-a21的序列为seqidno:6。其中,甘精胰岛素原带融合肽的全序列为seqidno:10。为了确保在大肠杆菌中有效表达seqidno:10所示的融合蛋白质,对遗传密码子进行了优化。优化后的基因序列如seqidno:14所示,其含有一个5’ncoi位点(ccatgg)和1个3’hindiii位点(aagctt)。通过商业cro公司化学合成seqidno:14的dna片段,将该dna片段用ncoi和hindiii限制酶裂解,插入到用相同的限制性内切酶裂解的pet-28a表达载体中,通过连接酶连接,形成pet-pig-1表达载体。实施例3:构建表达新甘精胰岛素原的重组大肠杆菌将实施例2构建的的重组表达载体pet-pig-1转染到大肠杆菌bl21(de3)感受态细胞中。通过卡那霉素抗性筛选阳性克隆并用dna测序进行确认。对阳性克隆在37℃温度条件下进行培养和扩增,然后无菌培养基和甘油加入细胞中。将1ml的细胞培养液转入无菌的安瓿中,并在-80℃进行保存,形成甘精胰岛素原工作种子库(wcb01)。实施例4:甘精胰岛素原融合蛋白的表达将实施例3得到的wcb01按0.2%的接种量接种于mlb培养基(含15g/l酵母粉和5g/l氯化钠)中,37℃、250rpm条件下培养6-14h,得到一级种子液。将一级种子液按0.2%的接种量接种于bfm培养基(含6g/l磷酸氢二铵,4g/l氯化铵,13.5g/l磷酸二氢钾,1.39g/l七水硫酸镁,2.8g/l一水柠檬酸,8g/l葡萄糖,3g/l酵母粉和1ml/l微量元素溶液(含10g/l七水合硫酸亚铁,1.1g/l氯化锌,1.0g/l五水合硫酸铜,0.4g/l四水合氯化锰,0.2g/l硼酸,2.7g/l氯化钙和0.2g/l钼酸钠)进一步培养8-16h得到二级种子液。然后按照体积比1:10接种到发酵罐bfm培养基中,生长温度30-39℃、生长溶氧10-50%和生长ph6.0-7.3条件下连续培养12-18h,直到发酵液的od600为100-200,往发酵罐中加入终浓度为0.1-1.0mmiptg诱导甘精胰岛素原进行表达,其他生长条件不变。连续诱导8-16h,通过离心机收集菌体。将含有甘精胰岛素原的包涵体的菌体用25mmtris,10mmedta,ph为8.0的缓冲液进行重悬,控制菌体浓度为200g/l。菌体通过溶菌酶处理和高压均质进行裂解,对菌体裂解液进行离心收集包涵体沉淀,去除上清。用25mmtris,1m尿素,1%吐温20,ph为8.0的洗涤液对包涵体进行洗涤。洗涤完成后,用25mmtris,0.1mmedta和0.5mml-半胱氨酸缓冲液重悬包涵体,调节ph为12.0,在15℃下溶解50min。溶解后的溶液命名为包涵体溶解液。实施例5:甘精胰岛素原的复性将实施例4制备的wcb01的包涵体溶解液用1μm的pp滤芯过滤,将温度控制为20℃,调节ph为11.0,然后进行复性32h得到复性的甘精胰岛素原。实施例6:酶切转化和纯化制备甘精胰岛素(一)酶切制备甘精胰岛素复性完成后,加入复性液按体积计0.2%的柠康酐进行修饰。调节复性液的ph为8.5,搅拌修饰2h。修饰完成后,添加修饰所用的柠康酐量60%的乙醇胺中和过量的柠康酐,ph调节为9.4,中和15min。然后直接加入终浓度为0.063mg牛胰蛋白酶/g蛋白的牛胰蛋白酶,调节ph为9.0,在20℃下酶切24h。去除融合肽,获得带柠康酐修饰的甘精胰岛素。酶切工程用rp-hplc(c18)进行监控。当酶切结束后,通过盐酸调节ph为2.0终止酶切反应。并在ph2.0下保持12h,水解b29位被柠康酐修饰的赖氨酸,获得甘精胰岛素。水解完成后,加入终浓度为3mm的氯化锌,调节ph为6.0,使甘精胰岛素形成絮状沉淀。(2)甘精胰岛素的纯化将步骤(1)酶切和水解后的甘精胰岛素沉淀用体积分数为3%的乙酸进行溶解,溶解ph值为3.5。溶解的甘精胰岛素作为样品加载到阳离子层析柱上,用缓冲液平衡。甘精胰岛素可以被30%的异丙醇,1.0m氯化钠线性梯度洗脱。阳离子层析纯化后,用终浓度为3mm的氯化锌,调节ph7.3,使甘精胰岛素形成絮状沉淀。再重复上述操作2次。将阳离子层析纯化的甘精胰岛素加载到反相制备层析柱上。用0.1m磷酸二氢铵与乙腈按照9:1混合后调节ph为3.5得到的溶液平衡层析柱。洗脱缓冲液是ph为3.5的0.1m磷酸氢二铵和10%乙腈的混合溶液与60%的乙腈按照不同比例混合后得到的溶液。甘精胰岛素通过洗脱缓冲液的线性梯度洗脱下来。获得的甘精胰岛素洗脱液的中甘精胰岛素的纯度为97%。第一次反相层析纯化后,用终浓度为3mm的氯化锌,调节ph7.3,使甘精胰岛素形成絮凝沉淀。甘精胰岛素沉淀用3%的乙酸进行溶解,溶解ph值为3.5。溶解的甘精胰岛素作为样品加载到反相制备层析柱上。用0.05mtris与乙腈按照9:1混合后调节ph为8.5得到的溶液平衡层析柱。洗脱缓冲液是ph为8.5的0.05mtris和10%乙腈的混合溶液与60%乙腈按照不同比例混合得到的溶液。甘精胰岛素通过洗脱缓冲液的线性梯度洗脱下来,经测定,甘精胰岛素洗脱液中的甘精胰岛素纯度为99.9%。第二次反相层析纯化后,用100mm的盐酸溶液调节ph7.3,甘精胰岛素形成絮凝沉淀。将收集的沉淀物用0.3%氯化钠溶液(ph7.0)重悬洗涤3次,离心得到甘精胰岛素湿固体。实施例7甘精胰岛素原料药的制备用100mm盐酸水溶液溶解实施例6制备的甘精胰岛素湿固体,直至浓度为30mg/ml,调节ph4.0,用0.22μmpes滤膜过滤,将过滤后的甘精胰岛素溶液转移至冷冻干燥机中,冷冻干燥程序的设定参数如下:1)进料前搁板制冷:设定温度-30℃;2)制冷控制:设定温度-30℃,设定时间240min,持续时间240min;3)捕水器制冷:设定温度-50℃,持续时间为10min;4)预抽真空:预抽真空0.2000mbar,设定报警真空0.5000mbar,报警真空持续时间10s;5)一次干燥:设定温度-10℃,设定时间240min,持续时间3600min,设定真空0.1800mbar;6)解析干燥:设定温度25℃,设定时间480min,持续时间240min,设定真空0.1800mbar。经上述处理后得到最终的甘精胰岛素原料药,纯度为99.9%以上。实施例8甘精胰岛素的制备具体实施方式同实施例2~6,区别在于,甘精胰岛素原带融合肽的全序列如seqidno:7所示,编码该甘精胰岛素原带融合肽的基因序列如seqidno:11所示。构建的重组大肠杆就在相同条件下发酵生产的甘精胰岛素原融合蛋白表达量为5.8g/l,纯化后的产品经hplc检测,获得99.42%的高主峰色谱纯度以及0.16%的最大单杂色谱纯度(具体见图1和表1)。表1为色谱检测到的主要峰面积及保留时间#保留时间峰面积%峰面积111.22612.930.16213.5130.790.01316.3093.220.04416.7921.100.01517.3163.260.04617.8874.050.05718.5252.180.03818.9374.830.06919.6757828.7399.42实施例9甘精胰岛素的制备具体实施方式同实施例2~6,区别在于,甘精胰岛素原带融合肽的全序列如seqidno:8所示,编码该甘精胰岛素原带融合肽的基因序列如seqidno:12所示。构建的重组大肠杆就在相同条件下发酵生产的甘精胰岛素原融合蛋白表达量为6.1g/l,纯化后的产品经hplc检测,获得99.59%的高主峰色谱纯度以及0.14%的最大单杂色谱纯度(具体见图2和表2)。表2色谱检测到的主要峰面积及保留时间实施例10甘精胰岛素的制备具体实施方式同实施例2~6,区别在于,甘精胰岛素原带融合肽的全序列如seqidno:9所示,编码该甘精胰岛素原带融合肽的基因序列如seqidno:13所示。构建的重组大肠杆就在相同条件下发酵生产的甘精胰岛素原融合蛋白表达量为6.0g/l,纯化后的产品经hplc检测,获得99.80%的高主峰色谱纯度以及0.09%的最大单杂色谱纯度(具体见图3和表3)。表3色谱检测到的主要峰面积及保留时间#保留时间峰面积%峰面积118.41061050.09217.71519160.03321.611683202399.80428.36716900.02529.13124050.04629.8498130.01729.9997370.01对比例1:构建未经优化的甘精胰岛素原的重组大肠杆菌具体实施方式同实施例2~3,区别在于,将融合肽r-r1中的氨基酸序列替换为matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglteglhgfhvhefgdntagstsagpr(seqidno:1),编码seqidno:1的整个氨基酸序列的dna片段相应调整为:5’-atggcgacgaaagccgtgagcgtgctgaagggcgacggcccagtgcagggcatcatcaatttcgagcagaaagaaagtaatggaccagtgaaggtgtggggaagcattaaaggactgactgaaggcctgcatggattccatgttcatgagtttggagataatacagctggctctaccagtgcaggtccgaaatttgtgaaccagcatctgtgcggcagccatctggtggaagcgctgtatctggtgtgcggcgaacgcggcttcttttataccccgaaaacccgccgcggcattgtggaacagtgctgcaccagcatttgcagcctgtatcagctggaaaattattgcggctaa-3’(seqidno:22)。使甘精胰岛素原带融合肽的全序列为matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglteglhgfhvhefgdntagstsagpkfvnqhlcgshlvealylvcgergffytpktrrgiveqcctsicslyqlenycg(seqidno:15);然后用ncoi和hindiii限制酶将编码上述氨基酸序列的核苷序列与质粒pet-28a酶切处理,将酶切后的片段与载体连接,获得重组表达载体pet-pig-2。将重组表达载体pet-pig-2转化至大肠杆菌bl21(de3)感受态细胞中。通过卡那霉素抗性筛选阳性克隆并用dna测序进行确认。对阳性克隆进行培养和扩增,然后无菌培养基和甘油加入细胞中。将1ml的细胞培养液转入无菌的安瓿中,并在-80℃进行保存,形成甘精胰岛素原工作种子库(wcb02)。对比例2:甘精胰岛素原融合蛋白的表达将对比例1得到的重组菌wcb02按照实施例4所述方法进行三批次的培养,并处理得到包涵体溶解液,随后按照实施例5所述方法进行复性。利用hplc分别检测通过发酵wcb01和wcb02得到的甘精胰岛素原复性前体的产量,三组平行实验的结果如表4所示。wcb01复性液相色谱图谱如图4a、4b和4c所示,相关数据如表4a、4b和4c所示;wcb02复性液相色谱图谱如图5a、5b和5c所示,相关数据如表5a、5b和5c所示。表4不同甘精胰岛素序列表达后甘精胰岛素原复性前体产量表1结果显示,使用定点突变的sod片段作为融合肽以及采用“0c肽”策略的优选序列seqidno:10,可以获得更有效的表达以及更为稳定的高发酵产量,具体是将甘精胰岛素的发酵产率提高了75%及以上,最高提高了78%。表4a色谱检测到的主要峰面积及保留时间#保留时间峰面积%峰面积15.98137280.0226.67028630.0237.336962940.6248.800309230.2059.653633460.4169.981145920.09710.447153490.10811.440957580.62911.8771322920.861012.2072174221.411113.066624623540.401213.486227219414.691314.046243634415.761414.8684726853.061515.5273706602.401616.6696589394.261717.2301682421.091817.7399175775.931918.5017359844.762019.5462709811.752120.3241416620.922221.023983370.64表4b色谱检测到的主要峰面积及保留时间表4c色谱检测到的主要峰面积及保留时间表5a色谱检测到的主要峰面积及保留时间#保留时间峰面积%峰面积17.153434020.5028.547104010.1239.409289850.34410.14131610.04511.207314080.37611.584591710.69711.962472340.55812.828352542040.98913.249125673914.611013.820151173217.571114.6462790643.241215.2402059732.391316.4543704984.311417.5105528346.431518.3002642903.071618.8931195831.391719.3381377761.601820.046886281.031920.821425190.492021.517233440.27表5b色谱检测到的主要峰面积及保留时间表5c色谱检测到的主要峰面积及保留时间#保留时间峰面积%峰面积17.19720580.0327.5869600.0137.62710390.0148.390173990.2258.93514310.0269.296301560.3879.673238830.30810.15966890.09910.51340250.051010.86424500.031111.120392850.501211.560644450.821311.9181419481.811412.827372681247.461513.260116968114.901613.830119271015.191714.1723637604.631814.6672410463.071915.3811023181.302015.673454850.582115.92749700.062216.170361410.462316.5092155232.742416.941459120.582517.322321540.412617.5821669072.132717.837677830.862818.4391048291.34对比例3含有1个突变的融合肽序列的甘精胰岛素原的表达调整实施例1的策略设计编码甘精胰岛素的序列,并在宿主细胞中表达,使甘精胰岛素原含有在seqidno:15的基础上进行了1个定点突变的融合肽r序列,氨基酸序列设计为:matkavsvlkgdgpvqgiinfeqkesngpvkvwgsihglteglhgfhvhefgdntagstsagprfvnqhlcgshlvealylvcgergffytpktrrgiveqcctsicslyqlenycg(seqidno:16);编码该氨基酸序列的核苷酸序列如seqidno:19所示;按照实施例5中所述方法进行复性。利用hplc检测菌株发酵得到的甘精胰岛素原复性前体的产量,结果显示,相同条件下的甘精胰岛素原复性前体产量为1.9g/l。复性液相色谱图谱分别如图6所示,相关数据如表6所示。表6色谱检测到的主要峰面积及保留时间#保留时间峰面积%峰面积17.100315300.5828.48169660.1339.372146810.2749.75621090.04510.12537950.07610.47536080.07711.172250350.46811.546420060.77911.889772711.421012.789193900035.641113.21181493514.981213.77561326011.271314.1442313464.251414.5731605252.951515.227965281.771616.4063050685.611717.4454591768.441818.1862868125.271919.2071808333.322019.945509050.942120.343480360.882220.867300120.552321.435152930.282422.23316490.03对比例4含有2个突变的融合肽序列的甘精胰岛素原的表达调整实施例1的策略设计编码甘精胰岛素的序列,并在宿主细胞中表达,使甘精胰岛素原含有在seqidno:15的基础上进行了2个定点突变的融合肽r序列,氨基酸序列分别设计为:matkavsvlkgdgpvqgiinfeqhesngpvkvwgsihglteglhgfhvhefgdntagstsagprfvnqhlcgshlvealylvcgergffytpktrrgiveqcctsicslyqlenycg(seqidno:17);编码该氨基酸序列的核苷酸序列如seqidno:20所示;按照实施例5中所述方法进行复性。利用hplc分别检测菌株发酵得到的甘精胰岛素原复性前体的产量,结果显示,相同条件下的甘精胰岛素原复性前体产量为2.2g/l。复性液相色谱图谱如图7所示,相关数据分别如表7所示。表7色谱检测到的主要峰面积及保留时间对比例5含有c肽的甘精胰岛素原的表达调整实施例1的策略设计编码甘精胰岛素的序列,并在宿主细胞中表达,使甘精胰岛素原含有“c肽”(ear),氨基酸序列设计为:mathavsvlkgdgpvqgiinfeqhesngpvkvwgsihglteglhgfhvhefgdntagstsagprfvnqhlcgshlvealylvcgergffytpktrreargiveqcctsicslyqlenycg(seqidno:18);编码该氨基酸序列的核苷酸序列如seqidno:21所示.按照实施例5中所述方法进行复性。利用hplc检测菌株发酵得到的甘精胰岛素原复性前体的产量,结果如下表8所示。复性液相色谱图谱如图8所示,相关数据如表9所示。表8不同甘精胰岛素序列表达后甘精胰岛素原复性前体产量表6结果显示,使用定点突变1个或者2个位点的融合肽序列以及采用“c肽”(rea)策略的融合肽序列获得的发酵产量远远低于wcb01的产量表9色谱检测到的主要峰面积及保留时间对比例6:复性、酶切转化和纯化将对比例2制备的包涵体溶解液分别按照实施例5的条件进行复性。然后按照实施例6中的方法对复性后的样品进行修饰、酶切以及纯化。重组菌wcb01和对比例2的重组菌wcb02的样品纯化后的液相色谱图谱分别如图9a和图9b所示,相关数据分别如表10a和10b所示。结果显示,使用定点突变3个氨基酸的sod片段作为融合肽以及采用“0c肽”策略的菌株(wcb01),可以获得99.93%的高主峰色谱纯度以及0.05%的最大单杂色谱纯度。与此同时,使用未突变的sod片段作为融合肽的菌株(wcb02)的主峰和最大单杂的色谱纯度分别为92.25%和2.15%。使用突变的sod片段以及采用“0c肽”策略,虽然主峰纯度提高了一点,但是最大单杂含量明显降低一个数量级,避免c-肽残基的残留,减少酶切转化的质量损失和错切杂质。表10a色谱检测到的主要峰面积及保留时间#保留时间峰面积%峰面积119.960600565899.93221.68130110.05329.27911810.02表10b色谱检测到的主要峰面积及保留时间对比例7:利用猪胰蛋白酶的酶切转化按照实施例4中的酶切方法利用猪胰蛋白酶对实施例3制备的wcb01复性后的溶液进行酶切转化。分别利用猪胰蛋白酶和牛胰蛋白酶的酶切转化的液相色谱图谱分别如图10a和图10b所示,相关数据分别如表11a和11b所示。图10a中出峰时间为20.447min的主峰面积为9569627mau*min,图10b中出峰时间为20.730min的主峰面积为11142487mau*min。结果显示,使用牛胰蛋白酶相对猪胰蛋白酶,酶切转化率可以提高16%;因为产物浓度与峰面积存在正比关系,转化率根据如下公式计算得到(11142487-9569627)/9569627=16%。表11a色谱检测到的主要峰面积及保留时间表11b色谱检测到的主要峰面积及保留时间虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。sequencelisting<110>美药星(南京)制药有限公司<120>一种新甘精胰岛素原及其制备甘精胰岛素的方法<130>baa200814a<160>22<170>patentinversion3.3<210>1<211>64<212>prt<213>人工序列<400>1metalathrlysalavalservalleulysglyaspglyprovalgln151015glyileileasnphegluglnlysgluserasnglyprovallysval202530trpglyserilelysglyleuthrgluglyleuhisglyphehisval354045hisglupheglyaspasnthralaglyserthrseralaglyproarg505560<210>2<211>63<212>prt<213>人工序列<400>2metalathrproalavalservalleulysglyaspglyprovalgln151015glyileileasnphegluglnprogluserasnglyprovallysval202530trpglyserileproglyleuthrgluglyleuhisglyphehisval354045hisglupheglyaspasnthralaglyserthrseralaglypro505560<210>3<211>63<212>prt<213>人工序列<400>3metalathrhisalavalservalleulysglyaspglyprovalgln151015glyileileasnphegluglnhisgluserasnglyprovallysval202530trpglyserilehisglyleuthrgluglyleuhisglyphehisval354045hisglupheglyaspasnthralaglyserthrseralaglypro505560<210>4<211>20<212>prt<213>homosapiens<400>4glyilevalgluglncyscysthrserilecysserleutyrglnleu151015gluasntyrcys20<210>5<211>30<212>prt<213>homosapiens<400>5phevalasnglnhisleucysglyserhisleuvalglualaleutyr151015leuvalcysglygluargglyphephetyrthrprolysthr202530<210>6<211>53<212>prt<213>人工序列<400>6phevalasnglnhisleucysglyserhisleuvalglualaleutyr151015leuvalcysglygluargglyphephetyrthrprolysthrargarg202530glyilevalgluglncyscysthrserilecysserleutyrglnleu354045gluasntyrcysgly50<210>7<211>117<212>prt<213>人工序列<400>7metalathrproalavalservalleulysglyaspglyprovalgln151015glyileileasnphegluglnprogluserasnglyprovallysval202530trpglyserileproglyleuthrgluglyleuhisglyphehisval354045hisglupheglyaspasnthralaglyserthrseralaglyprolys505560phevalasnglnhisleucysglyserhisleuvalglualaleutyr65707580leuvalcysglygluargglyphephetyrthrprolysthrargarg859095glyilevalgluglncyscysthrserilecysserleutyrglnleu100105110gluasntyrcysgly115<210>8<211>117<212>prt<213>人工序列<400>8metalathrproalavalservalleulysglyaspglyprovalgln151015glyileileasnphegluglnprogluserasnglyprovallysval202530trpglyserileproglyleuthrgluglyleuhisglyphehisval354045hisglupheglyaspasnthralaglyserthrseralaglyproarg505560phevalasnglnhisleucysglyserhisleuvalglualaleutyr65707580leuvalcysglygluargglyphephetyrthrprolysthrargarg859095glyilevalgluglncyscysthrserilecysserleutyrglnleu100105110gluasntyrcysgly115<210>9<211>117<212>prt<213>人工序列<400>9metalathrhisalavalservalleulysglyaspglyprovalgln151015glyileileasnphegluglnhisgluserasnglyprovallysval202530trpglyserilehisglyleuthrgluglyleuhisglyphehisval354045hisglupheglyaspasnthralaglyserthrseralaglyprolys505560phevalasnglnhisleucysglyserhisleuvalglualaleutyr65707580leuvalcysglygluargglyphephetyrthrprolysthrargarg859095glyilevalgluglncyscysthrserilecysserleutyrglnleu100105110gluasntyrcysgly115<210>10<211>117<212>prt<213>人工序列<400>10metalathrhisalavalservalleulysglyaspglyprovalgln151015glyileileasnphegluglnhisgluserasnglyprovallysval202530trpglyserilehisglyleuthrgluglyleuhisglyphehisval354045hisglupheglyaspasnthralaglyserthrseralaglyproarg505560phevalasnglnhisleucysglyserhisleuvalglualaleutyr65707580leuvalcysglygluargglyphephetyrthrprolysthrargarg859095glyilevalgluglncyscysthrserilecysserleutyrglnleu100105110gluasntyrcysgly115<210>11<211>354<212>dna<213>人工序列<400>11atggcgacgccggccgtgagcgtgctgaagggcgacggcccagtgcagggcatcatcaat60ttcgagcagccggaaagtaatggaccagtgaaggtgtggggaagcattccgggactgact120gaaggcctgcatggattccatgttcatgagtttggagataatacagctggctctaccagt180gcaggtccgaaatttgtgaaccagcatctgtgcggcagccatctggtggaagcgctgtat240ctggtgtgcggcgaacgcggcttcttttataccccgaaaacccgccgcggcattgtggaa300cagtgctgcaccagcatttgcagcctgtatcagctggaaaactattgcggctaa354<210>12<211>354<212>dna<213>人工序列<400>12atggcgacgccggccgtgagcgtgctgaagggcgacggcccagtgcagggcatcatcaat60ttcgagcagccggaaagtaatggaccagtgaaggtgtggggaagcattccgggactgact120gaaggcctgcatggattccatgttcatgagtttggagataatacagctggctctaccagt180gcaggtccgcggtttgtgaaccagcatctgtgcggcagccatctggtggaagcgctgtat240ctggtgtgcggcgaacgcggcttcttttataccccgaaaacccgccgcggcattgtggaa300cagtgctgcaccagcatttgcagcctgtatcagctggaaaactattgcggctaa354<210>13<211>354<212>dna<213>人工序列<400>13atggcgacgcatgccgtgagcgtgctgaagggcgacggcccagtgcagggcatcatcaat60ttcgagcagcatgaaagtaatggaccagtgaaggtgtggggaagcattcatggactgact120gaaggcctgcatggattccatgttcatgagtttggagataatacagctggctctaccagt180gcaggtccgaaatttgtgaaccagcatctgtgcggcagccatctggtggaagcgctgtat240ctggtgtgcggcgaacgcggcttcttttataccccgaaaacccgccgcggcattgtggaa300cagtgctgcaccagcatttgcagcctgtatcagctggaaaactattgcggctaa354<210>14<211>354<212>dna<213>人工序列<400>14atggcgacgcatgccgtgagcgtgctgaagggcgacggcccagtgcagggcatcatcaat60ttcgagcagcatgaaagtaatggaccagtgaaggtgtggggaagcattcatggactgact120gaaggcctgcatggattccatgttcatgagtttggagataatacagctggctctaccagt180gcaggtccgcggtttgtgaaccagcatctgtgcggcagccatctggtggaagcgctgtat240ctggtgtgcggcgaacgcggcttcttttataccccgaaaacccgccgcggcattgtggaa300cagtgctgcaccagcatttgcagcctgtatcagctggaaaactattgcggctaa354<210>15<211>117<212>prt<213>人工序列<400>15metalathrlysalavalservalleulysglyaspglyprovalgln151015glyileileasnphegluglnlysgluserasnglyprovallysval202530trpglyserilelysglyleuthrgluglyleuhisglyphehisval354045hisglupheglyaspasnthralaglyserthrseralaglyprolys505560phevalasnglnhisleucysglyserhisleuvalglualaleutyr65707580leuvalcysglygluargglyphephetyrthrprolysthrargarg859095glyilevalgluglncyscysthrserilecysserleutyrglnleu100105110gluasntyrcysgly115<210>16<211>117<212>prt<213>人工序列<400>16metalathrlysalavalservalleulysglyaspglyprovalgln151015glyileileasnphegluglnlysgluserasnglyprovallysval202530trpglyserilehisglyleuthrgluglyleuhisglyphehisval354045hisglupheglyaspasnthralaglyserthrseralaglyproarg505560phevalasnglnhisleucysglyserhisleuvalglualaleutyr65707580leuvalcysglygluargglyphephetyrthrprolysthrargarg859095glyilevalgluglncyscysthrserilecysserleutyrglnleu100105110gluasntyrcysgly115<210>17<211>117<212>prt<213>人工序列<400>17metalathrlysalavalservalleulysglyaspglyprovalgln151015glyileileasnphegluglnhisgluserasnglyprovallysval202530trpglyserilehisglyleuthrgluglyleuhisglyphehisval354045hisglupheglyaspasnthralaglyserthrseralaglyproarg505560phevalasnglnhisleucysglyserhisleuvalglualaleutyr65707580leuvalcysglygluargglyphephetyrthrprolysthrargarg859095glyilevalgluglncyscysthrserilecysserleutyrglnleu100105110gluasntyrcysgly115<210>18<211>120<212>prt<213>人工序列<400>18metalathrhisalavalservalleulysglyaspglyprovalgln151015glyileileasnphegluglnhisgluserasnglyprovallysval202530trpglyserilehisglyleuthrgluglyleuhisglyphehisval354045hisglupheglyaspasnthralaglyserthrseralaglyproarg505560phevalasnglnhisleucysglyserhisleuvalglualaleutyr65707580leuvalcysglygluargglyphephetyrthrprolysthrargarg859095glualaargglyilevalgluglncyscysthrserilecysserleu100105110tyrglnleugluasntyrcysgly115120<210>19<211>354<212>dna<213>人工序列<400>19atggcgacgaaagccgtgagcgtgctgaagggcgacggcccagtgcagggcatcatcaat60ttcgagcagaaagaaagtaatggaccagtgaaggtgtggggaagcattcatggactgact120gaaggcctgcatggattccatgttcatgagtttggagataatacagctggctctaccagt180gcaggtccgaaatttgtgaaccagcatctgtgcggcagccatctggtggaagcgctgtat240ctggtgtgcggcgaacgcggcttcttttataccccgaaaacccgccgcggcattgtggaa300cagtgctgcaccagcatttgcagcctgtatcagctggaaaattattgcggctaa354<210>20<211>354<212>dna<213>人工序列<400>20atggcgacgaaagccgtgagcgtgctgaagggcgacggcccagtgcagggcatcatcaat60ttcgagcagcatgaaagtaatggaccagtgaaggtgtggggaagcattcatggactgact120gaaggcctgcatggattccatgttcatgagtttggagataatacagctggctctaccagt180gcaggtccgaaatttgtgaaccagcatctgtgcggcagccatctggtggaagcgctgtat240ctggtgtgcggcgaacgcggcttcttttataccccgaaaacccgccgcggcattgtggaa300cagtgctgcaccagcatttgcagcctgtatcagctggaaaattattgcggctaa354<210>21<211>363<212>dna<213>人工序列<400>21atggcgacgcatgccgtgagcgtgctgaagggcgacggcccagtgcagggcatcatcaat60ttcgagcagcatgaaagtaatggaccagtgaaggtgtggggaagcattcatggactgact120gaaggcctgcatggattccatgttcatgagtttggagataatacagctggctctaccagt180gcaggtccgcggtttgtgaaccagcatctgtgcggcagccatctggtggaagcgctgtat240ctggtgtgcggcgaacgcggcttcttttataccccgaaaacccgccgcgaagcccgcggc300attgtggaacagtgctgcaccagcatttgcagcctgtatcagctggaaaactattgcggc360taa363<210>22<211>354<212>dna<213>人工序列<400>22atggcgacgaaagccgtgagcgtgctgaagggcgacggcccagtgcagggcatcatcaat60ttcgagcagaaagaaagtaatggaccagtgaaggtgtggggaagcattaaaggactgact120gaaggcctgcatggattccatgttcatgagtttggagataatacagctggctctaccagt180gcaggtccgaaatttgtgaaccagcatctgtgcggcagccatctggtggaagcgctgtat240ctggtgtgcggcgaacgcggcttcttttataccccgaaaacccgccgcggcattgtggaa300cagtgctgcaccagcatttgcagcctgtatcagctggaaaattattgcggctaa354当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1