人抗IL-33中和单克隆抗体的制作方法
本申请是申请日为2014年12月26日、发明名称为“人抗il-33中和单克隆抗体”的中国发明专利申请no.201480071117.7(pct申请号为pct/jp2014/084695)的分案申请。本申请的发明涉及人抗il-33中和单克隆抗体及与该抗体竞争性结合的抗体,以及含有这些抗体的细胞因子表达抑制剂、及il-33相关疾病的治疗、预防或减轻用医药组合物。
背景技术:
:白细胞介素-33(il-33)是属于被认为在炎症性状态中发挥作用的白细胞介素-1家族的细胞因子。il-33在上皮细胞、血管内皮细胞的核内恒定地表达,由于感染、物理的·化学的压力导致的组织损伤而伴随细胞破坏被释放,作为警报素发挥作用。另外,也可能存在il-33的表达由于脂多糖等的刺激上升并被分泌的机理。被释放至细胞外的il-33通过与在细胞上表达的il-33受体结合,能够细胞内信号激活。il-33受体在各种免疫系细胞、上皮细胞等中表达,在这些细胞中,产生了il-33诱导性的细胞内信号转导。il-33被认为通过在il-33受体表达免疫系细胞内诱导源于th2细胞、肥大细胞、嗜酸性细胞、嗜碱性细胞、nk(自然杀伤,naturalkiller)t细胞、2型固有淋巴细胞的th2细胞因子(il-4、il-5、il-6、il-13等)的产生而诱导过敏性炎症(哮喘、特应性皮炎、花粉症、过敏性休克等)(非专利文献1:tatsukuniohnoetal.,allergy,2012,vol.67,p1203)。另外,有报道暗示表达il-33受体的免疫系细胞中的肥大细胞、巨噬细胞中,il-33刺激诱导了il-1β、il-6、tnf(tumornecrosisfactor)-α的产生,这一现象与自身抗体诱导关节炎(类风湿性关节炎的典型病症)的发病相关(非专利文献2:damoxuetal.,journalofimmunology,2010,vol.184,p2620)。还提示了il-33的拮抗剂对于急性肾损伤有效(非专利文献3:aliakcayetal.,journalofamericansocietynephrology,2011,vol.22,p2057)。就人而言,在各种炎症性疾病(类风湿性关节炎、哮喘、系统性硬化症、肝纤维化、肺纤维化等的纤维化、牛皮癣、溃疡性结肠炎、克罗恩氏病、多发性硬化症、强直性脊柱炎等)中确认到了il-33的表达上升,il-33被认为与各种疾病的发病·维持相关(非专利文献4:yasushimatsuyamaetal.,journalofrheumatology,2010,vol.37,p18;非专利文献5:davidpre′fontaineetal.,journalofallergyandclinicalimmunology,2010,vol.125,p752;非专利文献6:koichiyanabaetal.,clinicalrheumatology,2011,vol.30,p825;非专利文献7:a.l.rankinetal.,journalofimmunology,2010,vol.184,p1526;非专利文献8:tamarmchedlidzeetal.,immunity,2013,vol.39,p357;非专利文献9:liang-anhuetal.,asianpacificjournalofcancerprevention,2013,vol.14,p2563;非专利文献10:lucapastorellietal.,proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,2010,vol.107,p8017)。这样,由于已知il-33与各种疾病、尤其是炎症性疾病相关,il-33的激动剂、拮抗剂的开发持续至今(专利文献1至4)。其中,从其特异性、作用强度的观点考虑,针对il-33的抗体一直备受瞩目。但是,关于迄今为止开发的抗体,已知未确定表位的小鼠抗体(专利文献1)、或利用半胱天冬酶确定il-33的切割位点从而确定活性型为非切割il-33,并将含有该切割位点的区域(序列表中序列号226的残基155至残基198)作为表位的抗体(专利文献2)、市售的山羊多克隆抗体。2014年1月10日,anaptysbio公司在该公司的主页报道了使用独有的体细胞高频突变技术(shm-xel)平台成功制备了针对il-33的治疗用开发候补抗体anb020(非专利文献11:hamzasuria,’anaptysbioannouncesdevelopmentofnovelanti-il-33therapeuticantibody’,[online],2014,[retrievedon11january2014],retrievedfrominternet<url:http://www.anaptysbio.com/anti-il-33/>)。另外,murphy等人使用导入了人抗体的可变区基因的小鼠即velocimmune小鼠取得了20种人抗il-33单克隆抗体(专利文献5)。但是,该抗体的表位未被公开,另外,20种人抗il-33单克隆抗体的框架区的氨基酸序列和人生殖细胞系的氨基酸序列有2个以上氨基酸残基不同。因此,将这些抗体施予至人时,针对该抗体的免疫反应被诱发,由于人抗人免疫球蛋白抗体(haha)的诱导,存在作用效果的降低、诱发炎症、其他的副作用的问题。先行技术文献专利文献专利文献1:国际公开第2005/079844号专利文献2:国际公开第2008/132709号专利文献3:国际公开第2011/031600号专利文献4:国际公开第2008/144610号专利文献5:国际公开第2014/164959号非专利文献非专利文献1:tatsukuniohnoetal.,allergy,2012,vol.67,p120非专利文献2:damoxuetal.,journalofimmunology,2010,vol.184,p2620非专利文献3:aliakcayetal.,journalofamericansocietynephrology,2011,vol.22,p2057非专利文献4:yasushimatsuyamaetal.,journalofrheumatology,2010,vol.37,p18非专利文献5:davidpre′fontaineetal.,journalofallergyandclinicalimmunology,2010,vol.125,p752非专利文献6:koichiyanabaetal.,clinicalrheumatology,2011,vol.30,p825非专利文献7:a.l.rankinetal.,journalofimmunology,2010,vol.184,p1526非专利文献8:tamarmchedlidzeetal.,immunity,2013,vol.39,p357非专利文献9:liang-anhuetal.,asianpacificjournalofcancerprevention,2013,vol.14,p2563非专利文献10:lucapastorellietal.,proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,2010,vol.107,p8017非专利文献11:hamzasuria,’anaptysbioannouncesdevelopmentofnovelanti-il-33therapeuticantibody‘,[online],2014,[retrievedon11january2014],retrievedfrominternet∶<url:http://www.anaptysbio.com/anti-il-33/>技术实现要素:近年来,逐渐阐明了il-33和疾病的关系,需求具有il-33的拮抗剂作用的抗il-33中和单克隆抗体。抗il-33中和单克隆抗体的作用与其抗体所结合的表位的区域密切相关。由于il-33伴随细胞破坏被释放至细胞外,因此,被源于溶酶体的蛋白质分解酶等切割的可能性高,可能会产生所谓成熟型il-33、以及衍生自成熟型il-33的、具有il-33的活性的大量片段。在片段含有由该连续氨基酸序列组成的表位时,较之与由不连续的氨基酸序列组成的表位结合的单克隆抗体,与由il-33的连续氨基酸序列组成的表位结合的单克隆抗体与该片段的1个连续氨基酸序列牢固地结合从而阻碍了该片段和il-33受体的结合等,故而有利。但是,依然难易确定用于生成具有期望的拮抗剂作用的il-33单克隆抗体的、上述由连续氨基酸序列组成的表位。作为与由il-33的连续氨基酸序列组成的表位结合的抗il-33中和单克隆抗体,期望施予至人等时的抗原性低。如果是人抗体,则期望施予至人时抗原性低,以及框架区为人生殖细胞系的氨基酸序列或其组合的氨基酸序列。但是,将shm-xel平台等应用于人抗体基因文库中所含有的人抗体时,不仅在互补性决定区,在框架区也会引入氨基酸序列的突变。另外,用人il-33蛋白质免疫导入了人抗体基因的小鼠并取得人抗il-33中和单克隆抗体时,也无法防止在该抗il-33中和单克隆抗体的框架区中产生氨基酸序列的突变。因此,依然难易取得框架区的氨基酸序列为人生殖细胞系的氨基酸序列或其组合的氨基酸序列的、针对il-33的分离人单克隆抗体。为解决上述课题,本发明人进行了深入研究,结果发现,与被认为是现有的优选表位的、存在于155~198位的表位牢固地结合的抗体几乎不具有拮抗剂作用,另一方面,由存在于101位~154位或199位~270位的连续氨基酸序列组成的表位、特别是由存在于111~130位、131~150位、231~250位、或251~270位的连续氨基酸序列组成的表位从与该表位结合的抗体的拮抗剂作用的观点考虑是重要的,从而完成了本发明。此外,本发明人从人抗体文库中分离了人抗il-33中和单克隆抗体,进而通过仅在其互补性决定区中导入突变而确定了结合性高、物性好的互补性决定区。由此,成功取得了与人il-33结合、将其功能中和的人抗体,所述人抗体的生殖细胞系的框架区的氨基酸序列中不含有突变。因此,本发明涉及以下的发明:[1]一种单克隆抗体,其与下述表位结合,所述表位由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成。[2]如项目1所述的抗体,其中,由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位是由序列表中序列号226的111位~130位、131位~150位、231位~250位或251位~270位中所含有的连续氨基酸序列组成的表位。[3]如项目1或2所述的抗体,其中,由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位是由包含选自p118、i119、t120、y122、l123、r124、s125、l126、s127、y129、n130、d131、q132、s133、t135、a137、l138、e139、s142、y143、e144、i145、y146、e148、d149、l150、d244、n245、h246、k266、l267、s268及e269的氨基酸的氨基酸序列组成的表位。[4]如项目1~3中任一项所述的抗体,其中,由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位是由序列表中序列号226的111位~130位、131位~150位、231位~250位或251位~270位中所含有的连续氨基酸序列组成的表位。[5]如项目1~4中任一项所述的抗体,其中,由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位是由序列表中序列号226的138位~147位或139位~147位中所含有的连续氨基酸序列组成的表位。[6]如项目1~5中任一项所述的抗体,其中,与由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位结合的单克隆抗体是il-33的拮抗剂。[7]如项目1~6中任一项所述的抗体,其中,与由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位结合的单克隆抗体阻碍il-33受体与il-33的结合。[8]一种用于治疗、预防或减轻il-33相关疾病的医药组合物,所述组合物含有项目1~7中任一项所述的抗体。[9]一种细胞因子表达抑制剂,所述抑制剂含有项目1~7中任一项所述的抗体。[10]如项目9所述的抑制剂,所述抑制剂抑制tnf-α、ifn-γ、il-1β、il-4、il-5、il-6或il-13的表达。[11]如项目9或10所述的抑制剂,所述抑制剂抑制ifn-γ、il-5、il-6或il-13的表达。[12]一种表位,其选自由以下表位组成的组:1)项目1~5中任一项中所记载的表位;2)由下述氨基酸序列组成的表位,所述氨基酸序列是对1)所述的表位的由连续氨基酸组成的序列取代、缺失、或添加1个或多个氨基酸而得的;3)由下述氨基酸序列组成的表位,所述氨基酸序列与1)所述的表位的由连续氨基酸组成的序列具有至少90%的序列同一性。[13]一种抗体,所述抗体是使用项目12所述的表位生成或筛选而得的。[14]如项目1~7中任一项所述的抗体,其中,与由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位结合的单克隆抗体为嵌合抗体、人源化抗体或人抗体。[15]如项目14所述的抗体,其中,框架区的氨基酸序列为人生殖细胞系的框架区的氨基酸序列或其组合的氨基酸序列。[16]如项目15所述的抗体,其中,轻链框架区1的氨基酸序列为序列表中序列号317的残基1至残基22,轻链框架区2的氨基酸序列为序列表中序列号317的残基36至残基50,轻链框架区3的氨基酸序列为序列表中序列号317的残基58至残基89,以及,轻链框架区4的氨基酸序列为序列表中序列号401的残基3至残基12,并且,重链框架区1的氨基酸序列为序列表中序列号367的残基1至残基30、或序列表中序列号368的残基1至残基30,重链框架区2的氨基酸序列为序列表中序列号367的残基36至残基49、或序列表中序列号368的残基36至残基49,重链框架区3的氨基酸序列为序列表中序列号367的残基67至残基98、或序列表中序列号368的残基67至残基98,以及,重链框架区4的氨基酸序列为序列表中序列号407的残基5至残基15。[17]如项目15或16所述的抗体,其中,轻链框架区1的氨基酸序列为序列表中序列号317的残基1至残基22,轻链框架区2的氨基酸序列为序列表中序列号317的残基36至残基50,轻链框架区3的氨基酸序列为序列表中序列号317的残基58至残基89,以及,轻链框架区4的氨基酸序列为序列表中序列号401的残基3至残基12,并且,重链框架区1的氨基酸序列为序列表中序列号367的残基1至残基30,重链框架区2的氨基酸序列为序列表中序列号367的残基36至残基49,重链框架区3的氨基酸序列为序列表中序列号368的残基67至残基98,以及,重链框架区4的氨基酸序列为序列表中序列号407的残基5至残基15。[18]分离的人抗il-33中和单克隆抗体,其中,轻链互补性决定区1(lcdr1)、轻链互补性决定区2(lcdr2)、轻链互补性决定区3(lcdr3)、重链互补性决定区1(hcdr1)、重链互补性决定区2(hcdr2)及重链互补性决定区3(hcdr3)各自的氨基酸序列的组合选自表1中c1至c30所示的组合。[表1]表1以下的序列号表示序列表中的序列号lcdr1lcdr2lcdr3hcdr1hcdr2hcdr3c1序列号1序列号11序列号22序列号43序列号51序列号65c2序列号1序列号11序列号23序列号43序列号52序列号65c3序列号2序列号11序列号23序列号44序列号52序列号65c4序列号2序列号11序列号23序列号44序列号53序列号65c5序列号2序列号11序列号23序列号43序列号54序列号65c6序列号2序列号11序列号24序列号45序列号52序列号65c7序列号2序列号11序列号23序列号46序列号52序列号65c8序列号3序列号12序列号25序列号47序列号55序列号66c9序列号4序列号12序列号26序列号47序列号56序列号67c10序列号4序列号13序列号27序列号47序列号56序列号67c11序列号5序列号12序列号28序列号47序列号56序列号67c12序列号4序列号12序列号29序列号47序列号56序列号67c13序列号6序列号14序列号30序列号47序列号56序列号67c14序列号7序列号14序列号31序列号47序列号56序列号67c15序列号4序列号15序列号32序列号47序列号56序列号67c16序列号6序列号16序列号33序列号48序列号57序列号68c17序列号4序列号17序列号34序列号49序列号58序列号69c18序列号6序列号18序列号35序列号47序列号59序列号70c19序列号6序列号19序列号36序列号47序列号56序列号71c20序列号6序列号20序列号26序列号47序列号56序列号66c21序列号6序列号18序列号37序列号47序列号60序列号72c22序列号6序列号20序列号38序列号47序列号56序列号73c23序列号8序列号20序列号27序列号49序列号56序列号68c24序列号9序列号20序列号39序列号47序列号60序列号73c25序列号4序列号21序列号34序列号47序列号61序列号74c26序列号10序列号19序列号40序列号47序列号62序列号75c27序列号4序列号18序列号41序列号50序列号56序列号76c28序列号6序列号20序列号42序列号47序列号63序列号77c29序列号2序列号11序列号23序列号43序列号64序列号65c30序列号6序列号20序列号40序列号47序列号64序列号78[19]如项目18所述的人抗il-33中和单克隆抗体,其中,轻链互补性决定区1(lcdr1)、轻链互补性决定区2(lcdr2)、轻链互补性决定区3(lcdr3)、重链互补性决定区1(hcdr1)、重链互补性决定区2(hcdr2)及重链互补性决定区3(hcdr3)各自的氨基酸序列的组合选自表1中c1至c28所示的组合。[20]如项目18或19所述的人抗il-33中和单克隆抗体,其中,轻链互补性决定区1(lcdr1)、轻链互补性决定区2(lcdr2)、轻链互补性决定区3(lcdr3)、重链互补性决定区1(hcdr1)、重链互补性决定区2(hcdr2)及重链互补性决定区3(hcdr3)各自的氨基酸序列的组合包含选自表1中c1、c8、c15、c17及c18所示的组合的氨基酸序列。[21]如项目18~20中任一项所述的人抗il-33中和单克隆抗体,其中,抗体框架区的氨基酸序列为生殖细胞系框架区的氨基酸序列或其组合的氨基酸序列。[22]如项目18~21中任一项所述的人抗il-33中和单克隆抗体,其中,轻链框架区1的氨基酸序列为序列表中序列号317的残基1至残基22,轻链框架区2的氨基酸序列为序列表中序列号317的残基36至残基50,轻链框架区3的氨基酸序列为序列表中序列号317的残基58至残基89,以及,轻链框架区4的氨基酸序列为序列表中序列号401的残基3至残基12,并且,重链框架区1的氨基酸序列为序列表中序列号367的残基1至残基30或序列表中序列号368的残基1至残基30,重链框架区2的氨基酸序列为序列表中序列号367的残基36至残基49或序列表中序列号368的残基36至残基49,重链框架区3的氨基酸序列为序列表中序列号367的残基67至残基98或序列表中序列号368的残基67至残基98,以及,重链框架区4的氨基酸序列为序列表中序列号407的残基5至残基15。[23]如项目18~22中任一项所述的人抗il-33中和单克隆抗体,轻链可变区及重链可变区各自的氨基酸序列的组合选自表2中v1至v30所示的组合。[表2]表2以下的序列号表示序列表中的序列号组合轻链可变区重链可变区v1序列号79序列号105v2序列号80序列号106v3序列号81序列号107v4序列号81序列号108v5序列号81序列号109v6序列号82序列号110v7序列号81序列号111v8序列号83序列号112v9序列号84序列号113v10序列号85序列号113v11序列号86序列号113v12序列号87序列号113v13序列号88序列号113v14序列号89序列号113v15序列号90序列号113v16序列号91序列号114v17序列号92序列号115v18序列号93序列号116v19序列号94序列号117v20序列号95序列号118v21序列号96序列号119v22序列号97序列号120v23序列号98序列号121v24序列号99序列号122v25序列号100序列号123v26序列号101序列号124v27序列号102序列号125v28序列号103序列号126v29序列号81序列号127v30序列号104序列号128[24]如项目23所述的人抗il-33中和单克隆抗体,其中,轻链可变区及重链可变区各自的氨基酸序列的组合选自表2中v1至v28所示的组合。[25]如项目23或24所述的人抗il-33中和单克隆抗体,轻链可变区及重链可变区各自的氨基酸序列的组合选自表2中v1、v8、v15、v17及v18所示的组合。[26]如项目18~25中任一项所述的人抗il-33中和单克隆抗体,其中,轻链为λ链。[27]如项目18~26中任一项所述的人抗il-33中和单克隆抗体,其中,人抗il-33中和单克隆抗体为igg。[28]如项目18~27中任一项所述的人抗il-33中和单克隆抗体,其中,抗原为人il-33及猴il-33。[29]一种核酸分子,所述核酸分子编码项目18~28中任一项所述的人抗il-33中和单克隆抗体的蛋白质部分。[30]如项目29所述的核酸分子,编码轻链互补性决定区1(lcdr1)、轻链互补性决定区2(lcdr2)、轻链互补性决定区3(lcdr3)、重链互补性决定区1(hcdr1)、重链互补性决定区2(hcdr2)及重链互补性决定区3(hcdr3)各自的氨基酸序列的核酸序列的组合选自表3中cn1至cn30所示的组合。[表3]表3以下的序列号表示序列表中的序列号组合lcdr1lcdr2lcdr3hcdr1hcdr2hcdr3cn1序列号129序列号140序列号156序列号181序列号191序列号209cn2序列号129序列号140序列号157序列号181序列号192序列号209cn3序列号130序列号140序列号157序列号182序列号192序列号209cn4序列号130序列号140序列号157序列号182序列号193序列号209cn5序列号130序列号140序列号157序列号181序列号194序列号209cn6序列号130序列号140序列号158序列号183序列号192序列号209cn7序列号130序列号140序列号157序列号184序列号192序列号209cn8序列号131序列号141序列号159序列号185序列号195序列号210cn9序列号132序列号141序列号160序列号185序列号196序列号211cn10序列号132序列号142序列号161序列号185序列号196序列号211cn11序列号133序列号143序列号162序列号185序列号196序列号211cn12序列号132序列号141序列号163序列号185序列号196序列号211cn13序列号134序列号144序列号164序列号185序列号196序列号211cn14序列号135序列号144序列号165序列号185序列号196序列号211cn15序列号132序列号145序列号166序列号185序列号196序列号211cn16序列号134序列号146序列号167序列号186序列号197序列号212cn17序列号132序列号147序列号168序列号187序列号198序列号213cn18序列号134序列号148序列号169序列号185序列号199序列号214cn19序列号134序列号149序列号170序列号185序列号200序列号215cn20序列号134序列号150序列号171序列号185序列号200序列号216cn21序列号134序列号148序列号172序列号185序列号201序列号217cn22序列号134序列号150序列号173序列号185序列号200序列号218cn23序列号136序列号151序列号174序列号188序列号202序列号219cn24序列号137序列号151序列号175序列号189序列号203序列号220cn25序列号138序列号152序列号176序列号189序列号204序列号221cn26序列号139序列号153序列号177序列号189序列号205序列号222cn27序列号138序列号154序列号178序列号190序列号206序列号223cn28序列号134序列号155序列号179序列号185序列号207序列号224cn29序列号130序列号140序列号157序列号181序列号208序列号209cn30序列号134序列号155序列号180序列号185序列号208序列号225[31]一种载体,所述载体含有项目29或30所述的核酸分子。[32]一种宿主细胞,所述宿主细胞含有项目31所述的载体。[33]一种制造项目18~28中任一项所述的人抗il-33中和单克隆抗体的方法,所述方法中,对项目32所述的宿主细胞加以培养来进行制造。[34]一种细胞因子表达抑制剂,所述抑制剂含有项目18~28中任一项所述的人抗il-33中和单克隆抗体。[35]如项目34所述的抑制剂,所述抑制剂抑制tnf-α、ifn-γ、il-1β、il-4、il-5、il-6或il-13的表达。[36]如项目34或35所述的抑制剂,所述抑制剂抑制ifn-γ、il-5、il-6或il-13的表达。[37]一种医药组合物,所述组合物含有项目18至28中任一项所述的人抗il-33中和单克隆抗体。[38]如项目37所述的医药组合物,用于对il-33相关疾病的预防、治疗或减轻。[39]如项目38所述的医药组合物,所述il-33相关疾病选自由哮喘、特应性皮炎、花粉症、过敏性休克、鼻窦炎(包括嗜酸细胞性鼻窦炎)、克罗恩氏病、溃疡性结肠炎、关节炎、系统性红斑狼疮、天疱疮、类天疱疮、硬皮病、强直性脊柱炎、肝纤维化(包括原发性胆汁性肝硬化)、肺纤维化、慢性阻塞性肺疾病(copd)、急性肾损伤、血管炎及癌症组成的组。[40]抗il-33中和单克隆抗体,所述抗体与项目20或25所述的抗体竞争性结合il-33。[41]一种用于治疗患有il-33相关疾病的患者、预防、或减轻il-33相关疾病的方法,所述方法包括将项目1~7及18~28中任一项所述的抗体施予至对象。[42]如项目41所述的方法,所述il-33相关疾病选自由哮喘、特应性皮炎、花粉症、过敏性休克、鼻窦炎(包括嗜酸细胞性鼻窦炎)、克罗恩氏病、溃疡性结肠炎、关节炎、系统性红斑狼疮、天疱疮、类天疱疮、硬皮病、强直性脊柱炎、肝纤维化(包括原发性胆汁性肝硬化)、肺纤维化、慢性阻塞性肺疾病(copd)、急性肾损伤、血管炎及癌症组成的组。[43]项目1~7及18~28中任一项所述的抗体的用途,其用于制造用于治疗、预防、或减轻il-33相关疾病的医药。[44]如项目43所述的用途,所述il-33相关疾病选自由哮喘、特应性皮炎、花粉症、过敏性休克、鼻窦炎(包括嗜酸细胞性鼻窦炎)、克罗恩氏病、溃疡性结肠炎、关节炎、系统性红斑狼疮、天疱疮、类天疱疮、硬皮病、强直性脊柱炎、肝纤维化(包括原发性胆汁性肝硬化)、肺纤维化、慢性阻塞性肺疾病(copd)、急性肾损伤、血管炎及癌症组成的组。[45]如项目1~7及18~28中任一项所述的抗体的用途,其用于治疗、预防、或减轻il-33相关疾病。[46]如项目45所述的用途,所述il-33相关疾病选自由哮喘、特应性皮炎、花粉症、过敏性休克、鼻窦炎(包括嗜酸细胞性鼻窦炎)、克罗恩氏病、溃疡性结肠炎、关节炎、系统性红斑狼疮、天疱疮、类天疱疮、硬皮病、强直性脊柱炎、肝纤维化(包括原发性胆汁性肝硬化)、肺纤维化、慢性阻塞性肺疾病(copd)、急性肾损伤、血管炎及癌症组成的组。[47]一种治疗需要抑制细胞因子表达的患者、预防、或减轻相关疾病的方法,所述方法包括将项目1~7及18~28中任一项所述的抗体施予至该对象。[48]如项目47所述的方法,所述细胞因子为tnf-α、ifn-γ、il-1β、il-4、il-5、il-6或il-13。[49]项目1~7及18~28中任一项所述的抗体的用途,其用于细胞因子表达抑制剂的制造。[50]如项目49所述的用途,所述细胞因子为tnf-α、ifn-γ、il-1β、il-4、il-5、il-6或il-13。本发明的与表位结合的单克隆抗体由于与由连续氨基酸序列组成的表位结合,因此,即使在il-33被分解及片段化的情况下,通过与1个连续氨基酸序列牢固地结合,中和作用也能容易地发挥。本发明的单克隆抗体在施予至人时不易诱导针对抗体的框架区及/或互补性决定区的人抗人免疫球蛋白抗体(haha)。只要不被haha阻碍,il-33中和效果即会在生物体内持续。另外,只要不引发由与haha结合而导致的炎症,即为安全的抗体。本发明的单克隆抗体由于能够与人il-33に结合并中和其功能,因此,能够作为针对il-33相关疾病的新型诊断、预防、治疗或减轻药利用。附图说明图1是说明il-33蛋白质的各结构域及切割位点的图。图2是表示各抗体针对人il-33蛋白质(残基112至残基270)及各部分肽片段(pep11~26)的结合活性的图。图3是建模表示成熟型人il-33(残基117至残基270)(图中记为“s117-t270”)和人st2(hst2)的复合体的立体结构的图。图4是在图3的立体结构模型中,仅表示了人il-33的pep12表位的一部分(序列表中序列号226的117位~130位)(图中记载为「s117-n130」,以下记载相同)和人st2的图。图5是在图3的立体结构模型中,仅表示了人il-33的pep14表位和人st2的图。图6是在图3的立体结构模型中,仅表示了人il-33的pep24表位和人st2的图。图7是在图3的立体结构模型中,仅表示了人il-33的pep26表位和人st2的图。图8是基于炎症相关指标(脾脏质量、血清中il-5浓度、血中嗜酸性细胞数、血中嗜碱性细胞数、血中嗜中性细胞数、血清中iga浓度、血清中ige浓度)表示人抗il-33中和单克隆抗体a25-3h04对于由人il-33的腹腔内施予诱导的炎症的作用的图。图9是是基于炎症相关指标(脾脏质量、血清中il-5浓度、血中嗜酸性细胞数、血中嗜碱性细胞数、血中嗜中性细胞数、血清中iga浓度、血清中ige浓度)表示人抗il-33中和单克隆抗体a10-1c04、a23-1a05、a25-2c02及a26-1f02对于由人il-33的腹腔内施予诱导的炎症的作用的图。图10是表示人抗il-33中和单克隆抗体(a23-1a05、a25-3h04、a26-1f02、a10-1c04、a25-2c02)的小鼠血浆中浓度推移的图。图11是表示人抗il-33中和单克隆抗体(a10-1c04、a23-1a05)的猴血清中浓度推移的图。具体实施方式为了便于理解本发明,以下对本发明使用的用语进行说明。[表位]本发明中,所谓表位,是指抗体识别的抗原的一部分。本发明中,表位涉及抗体的识别所必需的由连续氨基酸组成的序列。[结合]本发明中,所谓单克隆抗体与表位“结合”,是指单克隆抗体与作为表位的肽结合而形成1个复合体。单克隆抗体和表位的结合基于离子结合、氢键结合、疏水结合、范德华力等,但不限于此。使用例如本说明书记载的肽阵列扫描(peptidearrayscanning)、kinexa能够调查单克隆抗体是否与表位结合。[抗体]本发明中“抗体”这一用语采用最广泛的含义,只要呈现期望的特异性结合性能即可,包括单克隆抗体、多克隆抗体。本发明中的抗体可以是小鼠抗体、人抗体、大鼠抗体、兔抗体、山羊抗体、骆驼抗体等源于任意的动物的抗体。[单克隆抗体]本发明的抗体中,单克隆抗体是指设计上的氨基酸序列中仅由单一克隆(单一分子种类)组成的抗体群的抗体。单克隆抗体包括嵌合抗体、人源化抗体、人抗体、多特异性抗体、及人工抗体、以及这些抗体的功能改造抗体、以及这些抗体的偶联抗体、以及这些抗体的片段。本发明的单克隆抗体可以使用杂交瘤法、噬菌体展示法(phagedisplay)、及基因工程手法等任意的已知手法生成。[嵌合抗体]所谓嵌合抗体,是指轻链、重链、或这二者由非人源的可变区和人源的恒定区构成的抗体。[人源化抗体]所谓人源化抗体,是指由非人源抗体的互补性决定区和源于人抗体的框架区组成的可变区以及源于人抗体的恒定区组成的抗体。[人抗体]所谓人抗体,是指轻链、重链均源于人的抗体。根据重链的恒定区的差异,人抗体包括具有γ重链的igg(包括igg1、igg2、igg3及igg4)、具有μ重链的igm、具有α重链的iga(包括iga1、iga2)、具有δ重链的igd、或具有ε重链的ige。另外,原则上,作为轻链,含有κ链与λ链中的任一种。[多特异性抗体]所谓多特异性抗体,是指具有2个以上不同的抗原特异性、且具有2个以上独立的抗原识别位点的非对称的抗体,可以举出具有2个的抗原特异性的双特异性抗体、具有3个抗原特异性的三特异性抗体等。本发明的多特异性抗体识别的1个以上的抗原为il-33分子。[人工抗体]所谓人工抗体,是指例如蛋白质支架这样不具有抗体的结构但具有与抗体同样的功能的人工抗体。作为蛋白质支架,利用人丝氨酸蛋白抑制剂的kunitz结构域、人纤维连接蛋白(fibronectin)的细胞外结构域、锚蛋白(ankyrin)、脂质运载蛋白等,如果改变支架上的靶结合位点的序列,则可以生成与本发明的表位结合的蛋白质支架(cliffordmintzet.albioprocessinternational,2013,vol.11(2),pp40-48)。[功能改造抗体]本申请中,所谓功能改造抗体,是指通过主要改造抗体的fc区域的氨基酸、糖链,调节抗体具有的抗原结合功能以外的细胞毒性、补体激活功能、血中半衰期等的抗体。[偶联抗体]本申请中,所谓偶联抗体,是指将聚乙二醇(peg)等非肽性聚合物、放射性物质、毒素、低分子化合物、细胞因子、白蛋白、酶等的抗体以外的功能分子与抗体化学性结合或通过基因工程结合而成的抗体。[片段]本申请中,所谓抗体的片段,是指含有抗体的一部分的蛋白质,其能够与抗原结合。作为抗体的片段的例子,可以举出fab片段、fv片段、f(ab’)2片段、fab’片段、或scfv。另外,这些抗体的片段可以与聚乙二醇(peg)等非肽性聚合物、放射性物质、毒素、低分子化合物、细胞因子、白蛋白、酶等的抗体以外的功能分子化学性结合或通过基因工程结合。[il-33]il-33是属于il-1家族的细胞因子,人il-33由序列表中序列号226所示的270个氨基酸组成。il-33在n末端侧具有染色质结合结构域,在c末端侧具有持有12个的β折叠股(β-strand)、分子量为18kda的类il-1细胞因子结构域,还在95位及109位具有组织蛋白酶g切割位点、在99位具有弹性蛋白酶切割位点,及在178位具有半胱天冬酶切割位点(图1)。il-33被认为在细胞发生坏死的过程中,被源于溶酶体等的弹性蛋白酶、组织蛋白酶g、或蛋白酶3等的酶切割,成为包括成熟型il-33、例如il-33(残基95至残基270)(将序列表中序列号226的距n末端为95位至270位的氨基酸序列表示的il-33记为“il-33(残基95至残基270)”。以下记载相同)、il-33(残基99至270)、il-33(残基109至残基270)、il-33(残基112至残基270位)等的各种片段,细胞因子作为发挥作用。另一方面,细胞死亡为凋亡时,在凋亡的过程中被激活的半胱天冬酶导致il-33在178位被切割,成为非活性型il-33、例如il-33(残基179至残基270)。il-33具有作为细胞因子被释放至细胞外时,与il-33受体结合,在该il-33受体表达细胞中使细胞内信号转导开始的功能。被il-33诱导的信号转导没有限制,有nf-κb途径和mapkks途径,最终引发各种细胞因子、趋化因子、炎症介质的产生。作为被il-33诱导的细胞因子的例子,可以举出tnf-α、il-1β、ifn-γ、il-3、il-4、il-5、il-6、il-13等,特别地,ifn-γ、il-5、il-6、及il-13被诱导。作为被il-33诱导的趋化因子的例子,可以举出cxcl2、ccl2、ccl3、ccl6、ccl17、ccl24等。作为被il-33诱导的炎症介质的例子,可以举出pgd2、ltb4等。被il-33诱导的细胞因子、趋化因子、炎症介质与免疫系细胞的迁移、细胞因子产生、脱粒相关,引发炎症。本发明中,il-33如果与后述的il-33受体结合发挥作用,则il-33指全长il-33或其活性型片段中的任一者,可以是它们的衍生体或者突变体。另外,人il-33也可以是源于其他的生物的il-33。其中优选序列表中序列号226的氨基酸序列表示的人il-33。il-33结合的il-33受体由st2和il-1racp(il-lreceptoraccessoryprotein)的异源二聚体构成。il-33受体中,特异性识别il-33的结合位点は存在于st2的细胞外结构域。il-33的受体在各种免疫系细胞(th2细胞、肥大细胞、嗜酸性细胞、嗜碱性细胞、巨噬细胞、树突细胞、nk细胞、nkt细胞、2型固有淋巴细胞(固有辅助细胞)、nuocyte、ih2(2型固有辅助细胞,innatehelpertype2)细胞等)、上皮细胞等中表达,但不限于这些细胞。[il-33相关疾病]本申请中,所谓il-33相关疾病,是指由于il-33被过量地释放至细胞外而被诱发的疾病,il-33相关疾病可以利用能够阻碍il-33的功能的药剂预防、治疗或减轻。作为il-33相关疾病,可以举出例如哮喘、特应性皮炎、花粉症、过敏性休克、鼻窦炎(包括嗜酸细胞性鼻窦炎)、克罗恩氏病、溃疡性结肠炎、关节炎、系统性红斑狼疮、天疱疮、类天疱疮、硬皮病、强直性脊柱炎、肝纤维化(包括原发性胆汁性肝硬化)、肺纤维化、慢性阻塞性肺疾病(copd)、急性肾损伤、血管炎及癌症。[框架区]所谓框架区,是指免疫球蛋白分子的可变区中除了互补性决定区以外的部分。就框架区而言,在轻链、重链中分别具有4个框架区(框架区1、框架区2、框架区3及框架区4)。本申请中,免疫球蛋白分子的框架区基于卡巴特(kabat)的编号系统(kabat等,1987,sequencesofproteinsofimmunologicalinterest,usdepartmentofhealthandhumanservices,nih,usa)决定。[生殖细胞系]所谓生殖细胞系,是指精子、卵子等这一类的生殖细胞,除非特别说明,则指人的生殖细胞系。和产生抗体的b淋巴球不同,生殖细胞的免疫球蛋白的基因未发生突变。因此,记载为“生殖细胞系的框架区的氨基酸序列”时,指免疫球蛋白的框架区的氨基酸序列中未产生突变的氨基酸序列,记载为“生殖细胞系的框架区的氨基酸序列的组合的氨基酸序列”时,指4个框架区中的1个以上的框架区的氨基酸序列为其他的生殖细胞系的框架区的氨基酸序列。对于人免疫球蛋白的轻链可变区的基因而言,κ链分为vκ片段和jκ片段,及λ链分为vλ片段和jλ片段,vκ片段和vλ片段中存在框架区1至框架区3,jκ片段和jλ片段中存在框架区4。人免疫球蛋白的重链可变区的基因分为vh片段、dh片段、jh片段,vh片段中存在框架区1至框架区3,jh片段中存在框架区4。人免疫球蛋白的vκ、vλ、vh、jκ、jλ、jh的各片段的生殖细胞系的氨基酸序列示于表4。[表4-1]表4以下的序列号表示序列表中的序列号片段生殖细胞系名称序列号vκvκ1-5序列号278vκvκ1-6序列号279vκvκ1-8序列号280vκvκ1-9序列号281vκvκ1-12、vκ1d-12序列号282vκvκ1-16序列号283vκvκ1-17序列号284vκvκ1-27序列号285vκvκ1-33、vκ1d-33序列号286vκvκ1-39、vκ1d-39序列号287vκvκ1d-8序列号288vκvκ1d-13序列号289vκvκ1d-16序列号290vκvκ1d-17序列号291vκvκ1d-43序列号292vκvκ1-nl1序列号293vκvκ2-24序列号294vκvκ2-28、vκ2d-28序列号295vκvκ2-30序列号296vκvκ2-40、vκ2d-40序列号297vκvκ2d-26序列号298vκvκ2d-29序列号299vκvκ2d-30序列号300vκvκ3-11序列号301vκvκ3-15、vκ3d-15序列号302vκvκ3-20序列号303vκvκ3d-7序列号304vκvκ3d-11序列号305vκvκ3d-20序列号306vκvκ3-nl1序列号307vκvκ3-nl2序列号308vκvκ3-nl3序列号309[表4-2]vκvκ3-nl4序列号310vκvκ3-nl5序列号311vκvκ4-1序列号312vκvκ5-2序列号313vλvλ1-36序列号314vλvλ1-40序列号315vλvλ1-44序列号316vλvλ1-47序列号317vλvλ1-51序列号318vλvλ2-8序列号319vλvλ2-11序列号320vλvλ2-14序列号321vλvλ2-18序列号322vλvλ2-23序列号323vλvλ3-1序列号324vλvλ3-9序列号325vλvλ3-10序列号326vλvλ3-12序列号327vλvλ3-16序列号328vλvλ3-19序列号329vλvλ3-21序列号330vλvλ3-22序列号331vλvλ3-25序列号332vλvλ3-27序列号333vλvλ4-3序列号334vλvλ4-60序列号335vλvλ4-69序列号336vλvλ5-37序列号337vλvλ5-39序列号338vλvλ5-45序列号339vλvλ5-52序列号340vλvλ6-57序列号341vλvλ7-43序列号342vλvλ7-46序列号343vλvλ8-61序列号344[表4-3]vλvλ9-49序列号345vλvλ10-54序列号346vhvh1-2序列号347vhvh1-3序列号348vhvh1-8序列号349vhvh1-18序列号350vhvh1-24序列号351vhvh1-45序列号352vhvh1-46序列号353vhvh1-58序列号354vhvh1-f序列号355vhvh1-69序列号356vhvh2-5序列号357vhvh2-26序列号358vhvh2-70序列号359vhvh3-7序列号360vhvh3-9序列号361vhvh3-11序列号362vhvh3-13序列号363vhvh3-15序列号364vhvh3-20序列号365vhvh3-21序列号366vhvh3-23序列号367vhvh3-30、vh3-30-3序列号368vhvh3-33序列号369vhvh3-43序列号370vhvh3-48序列号371vhvh3-49序列号372vhvh3-53序列号373vhvh3-64序列号374vhvh3-66序列号375vhvh3-72序列号376vhvh3-73序列号377vhvh3-74序列号378vhvh3-d序列号379[表4-4]vhvh3-nl1序列号380vhvh4-4序列号381vhvh4-28序列号382vhvh4-30-2序列号383vhvh4-30-4序列号384vhvh4-31序列号385vhvh4-34序列号386vhvh4-39序列号387vhvh4-59序列号388vhvh4-b序列号389vhvh4-61序列号390vhvh5-a序列号391vhvh5-51序列号392vhvh6-1序列号393vhvh7-4-1序列号394jκjκ1序列号395jκjκ2序列号396jκjκ3序列号397jκjκ4序列号398jκjκ5序列号399jλjλ1序列号400jλjλ2、jλ3序列号401jλjλ6序列号402jλjλ7序列号403jhjh1序列号404jhjh2序列号405jhjh3序列号406jhjh4序列号407jhjh5序列号408jhjh6序列号409[人单克隆抗体]所谓人单克隆抗体,是指具有源于人的生殖细胞系的免疫球蛋白的序列可变区及恒定区的单克隆抗体。本申请中,人单克隆抗体的可变区可以是和其他的人单克隆抗体的可变区的一部分或全部的重组体,从该重组体中不影响抗体的结合性的观点考虑,可以在框架区和互补性决定区的分解处发生重组,从不提高免疫原性的观点考虑,框架区1至框架区4的框架区的各区域可以和其他的人单克隆抗体的框架区1至框架区4的框架区的各区域发生重组。此外,本发明中人单克隆抗体可以是人单克隆抗体的突变体,为了能在维持或改善对于抗原的结合性的同时降低免疫原性,优选含有在人单克隆抗体的互补性决定区中存在突变的互补性决定区的氨基酸序列、和在框架区中没有突变的生殖细胞系的框架区的氨基酸序列的人单克隆抗体。[分离]所谓分离的抗体的“分离”,是指被鉴定且被分离、及/或从自然状态下的成分中回收。自然状态下的杂质为能够阻碍其抗体的诊断性或治疗性使用的物质,可以举出酶、激素及其他的蛋白质性或非蛋白质性的溶质。一般而言,为了分离抗体,利用至少1个纯化工序纯化即可,可以将经过至少1个纯化工序纯化而得的抗体称为“分离的抗体”。[中和]本申请中,所谓“中和”是指能够与目的靶标结合,并且,能够阻碍该靶标的任一种功能的作用。即,“抗il-33中和单克隆抗体”是指其对于il-33的结合导致被il-33多肽に诱导的生物活性的阻碍的单克隆抗体。il-33的生物学活性的阻碍包括il-6等il-33诱导性细胞因子的产生的阻碍,但不限于此。il-33的生物学活性的指标可以通过本领域中已知的数种invitro或invivo分析中的1种或其以上进行评价。需要说明的是,记载为“人抗il-33中和单克隆抗体”时,指与il-33结合并阻碍il-33的任一种功能的人单克隆抗体。[拮抗剂]本申请中,所谓“拮抗剂”指对于目的靶标具有中和作用的物质的统称。即,“il-33的拮抗剂”是能够与il-33结合、并阻碍il-33的任一种功能的物质,包括例如抗il-33中和单克隆抗体。[互补性决定区]互补性决定区是指免疫球蛋白分子的可变区中形成抗原结合位点的区域,也被称为超变区,指每个免疫球蛋白分子中氨基酸序列的变化特别大的部分。互补性决定区在轻链、重链上分别存在3个互补性决定区(互补性决定区1、互补性决定区2及互补性决定区3)。本申请中,免疫球蛋白分子的互补性决定区基于卡巴特(kabat)的编号系统(kabat等,1987,sequencesofproteinsofimmunologicalinterest,usdepartmentofhealthandhumanservices,nih,usa)决定。[竞争性结合]本发明中,所谓“竞争性结合”单克隆抗体,是指利用本说明书记载的表面等离子共振(spr)法进行测定时,由于该单克隆抗体的存在,与il-33的结合以显著的差异降低。本发明中,所谓“竞争性结合抗il-33中和单克隆抗体”包括嵌合抗体、人源化抗体、人抗体、多特异性抗体、及人工抗体、以及这些抗体的功能改造抗体、以及这些抗体的偶联抗体、以及这些抗体的片段。以下,对本发明的实施方式进行说明。需要说明的是,以下的实施方式是用于说明本发明的示例,本发明不仅限于这些实施方式。本发明涉及与il-33的表位结合的单克隆抗体。与该表位结合的单克隆抗体由于能够中和人il-33的活性,因此,该表位优选为序列表中序列号226所示的人il-33的101位~154位或199位~270位中所含有的氨基酸序列,更优选为序列表中序列号226的111位~130位(pep12)、131位~150位(pep14)、231位~250位(pep24)或251位~270位(pep26)所含有的氨基酸序列。il-33常在被释放至细胞外时被切割。il-33的初级序列上分离的氨基酸残基基于蛋白质的折叠等形成表位时,由于il-33的切割,折叠崩坏,或构成该表位的分离的氨基酸残基从片段消失,有时会导致和该片段的亲和性明显减少。因此,抗il-33单克隆抗体的结合表位优选为连续氨基酸序列。为了使与表位结合的单克隆抗体发挥中和作用,例如,需要阻碍il-33的与il-33受体的结合。因此,本发明中,理想情况是,优选的表位不仅位于il-33蛋白质的表面上,还与il-33受体接近地存在。因此,本发明人如后述的实施例中记载的那样,基于非专利文献11中所示的结晶结构解析的数据进行立体结构建模,确定了含有与构成最接近的il-33受体的原子之间的原子间距离为以内的il-33的原子(界面原子)的氨基酸。作为含有界面原子的氨基酸,可以举出pep12的p118(将序列表中序列号226的118位的脯氨酸残基记为“p118”。后文记载相同。)、i119、t120、y122、l123、r124、s125、l126、s127、y129、n130、pep14的d131、q132、s133、t135、a137、l138、e139、s142、y143、e144、i145、y146、e148、d149、l150、pep24的d244、n245、h246、pep26的k266、l267、s268、e269。作为与能够中和il-33的单克隆抗体特异性结合的功能性表位,优选为具有含有界面原子的氨基酸表位。与功能性表位特异性结合的单克隆抗体的中和作用被认为取决于存在于功能性表位中的界面原子的数、界面原子在立体结构中的位置等,但本发明不被该理论限制。作为本发明的优选方式,可以举出下述单克隆抗体:所述单克隆抗体中,由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位是由序列表中序列号226的111位~130位(pep12)、131位~150位(pep14)、231位~250位(pep24)或251位~270位(pep26)的连续氨基酸序列组成的表位。作为本发明的更优选方式,可以举出所述表位是由序列表中序列号226的138位~147位或139位~147位的连续氨基酸序列组成的表位的单克隆抗体。本发明人使用与pep14结合的2种单克隆抗体研究了构成表位的最小限度的氨基酸序列,结果,作为il-33的表位,确定了序列表中序列号226的138~147位及139~147位的连续氨基酸序列。因此,本发明涉及由序列表中序列号226的138~147位及139~147位的连续氨基酸序列组成的表位。通过elisa法、免疫沈降法、表面等离子共振(spr)法、kinexa法等该
技术领域:
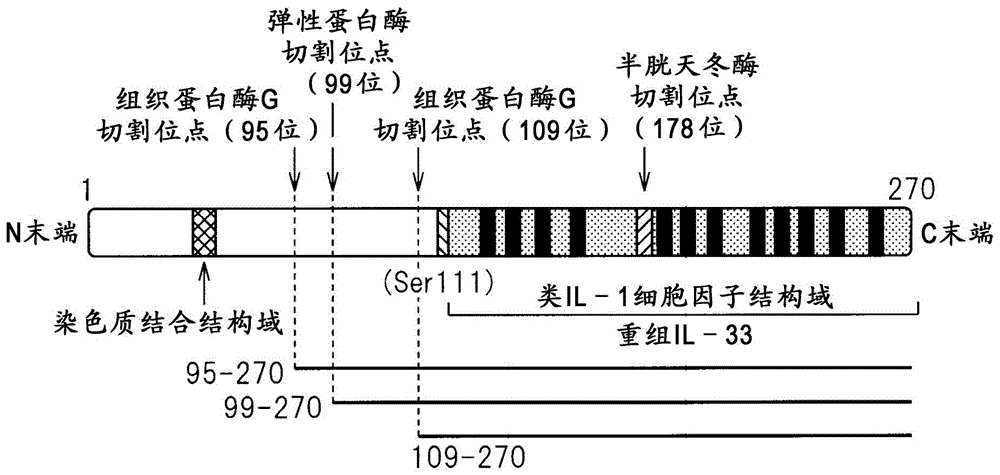
中通常实施的方法,可以调查单克隆抗体是否是与本发明的表位结合的单克隆抗体。例如,利用了spr法的本申请实施例中记载的肽阵列扫描法中,用本发明的表位肽进行试验时,可以将单克隆抗体与表位的结合作为ru值的显著增加进行测定。另外,虽然利用了kinexa法的本申请实施例に中记载的方法可以测定解离常数(kd),但优选为对于表位肽的解离常数低,优选为例如10μm以下、1μm以下、100nm以下、10nm以下、1nm以下、100pm以下、10pm以下。本发明的另一方式涉及含有本发明的单克隆抗体的医药组合物,所述单克隆抗体与由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位结合。另外,还涉及包括施予本发明的单克隆抗体的il-33相关疾病的诊断、治疗、预防或减轻方法,以及,本发明的单克隆抗体的用于il-33相关疾病的诊断、治疗、预防或减轻用医药的制造的用途。作为il-33相关疾病的例子,没有限制,可以举出哮喘、特应性皮炎、荨麻疹、花粉症、过敏性休克、鼻窦炎(包括嗜酸细胞性鼻窦炎)、过敏性脑脊髓炎、嗜酸性细胞增多症、风湿性多肌痛、风湿性心脏病、多发性硬化症、关节炎(例如,类风湿性关节炎、幼年型关节炎、牛皮癣性关节炎、变形性关节病、赖特(reiter′s)综合症等)、系统性红斑狼疮(包括盘状狼疮)、天疱疮、类天疱疮、牛皮癣、强直性脊柱炎、肝炎(例如,自身免疫性肝炎、慢性活动型肝炎等)、炎性肠疾病(例如,溃疡性结肠炎、克罗恩氏病、麸胶敏感性肠病等)、干燥综合症(sjogren′ssyndrome)、自身免疫性溶血性贫血、自身免疫性炎症性眼病、自身免疫性新生儿血小板减少症、自身免疫性嗜中性细胞减少、自身免疫性卵巢炎及睾丸炎、自身免疫性血小板减少症、自身免疫性甲状腺炎、多发性肌炎、皮肌炎、重症肌无力症、肾上腺素激动剂耐性、斑形脱发症(alopeciagreata)、抗磷脂症、肾上腺的自身免疫疾病(例如,自身免疫性爱迪生氏病(addison′sdisease)等)、乳糜泻-皮肤炎(celiacsprue-dermatitis)、慢性疲劳免疫功能紊乱症(cfids)、冷凝集素病、特发性混合型球蛋白血症症、纤维肌痛-纤维肌炎、肾小球肾炎(例如,iga肾病(nephrophathy)等)、格雷夫斯病(graves′disease)、甲状腺功能亢进症(即,桥本甲状腺炎)、特发性血小板减少性紫癜(itp)、混合性结缔组织病、1型或免疫介导性糖尿病、恶性贫血、多发性软骨膜炎(polychrondritis)、自身免疫多腺体综合症、全身肌强直综合症(stiff-mansyndrome)、白癜风、结节病、多内分泌腺病综合症(polyendocrinopathy)、其他的内分泌腺不全、动脉硬化、肝纤维化(例如,原发性胆汁性肝硬化等)、肺纤维化(例如,突发性肺纤维化等)、慢性阻塞性肺疾病(copd)、硬皮病(包括crest综合症、雷诺(raynaud)现象等)、肾小管间质性肾炎、致密物沉积病、急性肾损伤、心肌炎、心肌病、神经炎(例如,吉兰-巴雷综合症(guillain-barrésyndrome)等)、结节性多动脉炎、心切开术综合症(cardiotomysyndrome)、慢性炎症性脱髓鞘性多发性神经病、iga神经病、扁平苔癣、美尼尔综合症、心肌梗死后(post-mi)、葡萄膜炎、葡萄膜炎眼炎(uveitisopthalmia)、血管炎、原发性无丙种球蛋白血症、癌症(例如,脑瘤、喉头癌、口唇口腔癌、下咽头癌、甲状腺癌、食道癌、乳腺癌、肺癌、胃癌、肾上腺皮质癌、胆管癌、胆囊癌、肝癌、胰腺癌、膀胱癌、大肠癌、子宫癌、卵巢癌、前列腺癌、睾丸癌、慢性淋巴细胞性白血病、慢性髓细胞性白血病、ewing肉瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、黑色素瘤、间皮瘤、多发性骨髓瘤等)、对来自免疫系统的排斥呈现抗性的感染(例如,重症急性呼吸综合症(sars))、伴随强毒性流感感染症的致死性细胞因子风暴、以及坏血病,可以优选地举出哮喘、特应性皮炎、花粉症、过敏性休克、鼻窦炎(包括嗜酸细胞性鼻窦炎)、克罗恩氏病、溃疡性结肠炎、关节炎、系统性红斑狼疮、天疱疮、类天疱疮、硬皮病、强直性脊柱炎、肝纤维化(包括原发性胆汁性肝硬化)、肺纤维化、慢性阻塞性肺疾病(copd)、急性肾损伤、血管炎及癌症等。本发明的另一方式涉及细胞因子、趋化因子或炎症介质的表达抑制剂,所述表达抑制剂含有与由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位结合的单克隆抗体。被本发明的细胞因子、趋化因子或炎症介质的表达抑制剂抑制的细胞因子是被il-33诱导的细胞因子,例如,可以举出tnf-α、ifn-γ、il-1β、il-3、il-4、il-5、il-6、il-13等。另外,被该抑制剂抑制的趋化因子是被il-33诱导的趋化因子,例如,可以举cxcl2、ccl2、ccl3、ccl6、ccl17、ccl24等出。被该抑制剂抑制的炎症介质是被il-33诱导的炎症介质,例如,可以举出pgd2、ltb4等。本发明的特别优选方式为含有抗il-33单克隆抗体的ifn-γ、il-5、il-6或il-13的表达抑制剂,更优选为il-6的产生抑制剂。本发明的另一方式涉及抗il-33单克隆抗体结合的表位。本发明中,表位涉及由抗体的识别所必需的6~20的氨基酸组成的序列。其他的方式中,可以包含被识别的序列的周围的氨基酸或立体结构上的附近的氨基酸,进而构成表位,但优选为不含有不连续的氨基酸序列的连续氨基酸序列。因此,构成本发明的表位的连续氨基酸序列的氨基酸残基数至少为5,优选为至少6,更优选为至少7,更优选为至少8,更优选为至少9。此外,从发挥更充分的抗原性的观点考虑,为至少10,更优选为15,更优选为至少20。另一方面,如果表位中所含有的序列变长,则会产生含有多个被抗体识别的部分的可能性,在这样的情况下,可能无法生成或筛选具有期望的中和作用的抗体。因此,从确保与本发明的表位结合抗体发挥期望的中和作用的观点考虑,表位序列的长度优选为30以下,更优选为20以下,更优选为15以下。作为表位中所含有的连续氨基酸序列的残基数,为选自例如5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、及20个中之一的残基数。表位在不使其抗原性变化的范围内,可以导入1个或多个氨基酸突变、即氨基酸取代、缺失或插入。导入被突变的数量优选为5以下,更优选为3以下,最优选为1。此外,可以对表位添加修饰,例如原本的蛋白质具有的糖链等修饰、末端修饰等。另外,其他的方式中,在不使其抗原性变化的范围内,可以是由相对于本发明中被识别表位的由连续氨基酸组成的序列而言具有至少90%,更优选为至少95%,更优选为至少97%,进一步优选为至少98%,最优选为99%的序列同一性的氨基酸序列组成的表位。将表位肽用作例如诱饵(bait)时,可以添加组氨酸、生物素等标记,用作疫苗时,可以与klh等载体蛋白质结合。此处,所谓与鉴定的比较多肽序列相关的“百分比(%)序列同一性”定义如下:在为了使序列对齐、得到最大的百分比序列同一性而根据必要导入间隙,并不将任何保守性置换认作序列同一性的一部分后,和识别的比较多肽序列的氨基酸残基相同的候选序列(candidatesequence)中的氨基酸残基的百分比。以测定百分比氨基酸序列同一性为目的比较可以通过本领域技术人员的技能范围的各种方法、例如使用blast、blast-2、align、或megalign(dnastar)软件这样能够公开获得的电脑软件来实现。本领域技术人员可以适当决定用于比较序列的合适的参数,其包括为了实现相对于被比较序列的全长而言最大程度的比较所需的任意的算法。但是,此处为了实现该目的,%氨基酸序列同一性值通过在成对比较中使用序列比较电脑程序blast而得到。在可以将blast用于氨基酸序列比较的情况中,被提供的氨基酸序列a的、与被提供的氨基酸序列b的%氨基酸序列同一性如下计算:分率x/y的100倍此处,x为在序列比较程序blast对序列a及b的比较中判定为一致的氨基酸残基的数量,y为b的总氨基酸残基数。可知,氨基酸序列a的长度与氨基酸序列b的长度不同时,a相对于b的%氨基酸序列同一性与b相对于a的%氨基酸序列同一性不同。除非另有特别说明,此处的所有%氨基酸序列同一性值均如正上方图中所示,使用blast电脑程序得到。本发明发现的表位是il-33的中和抗体与之特异性结合的功能性表位。因此,通过利用本发明的功能性表位,能够高效地取得例如新型的具有il-33拮抗剂作用的抗体。即,通对于针对全长il-33或成熟型il-33的单克隆抗体群筛选与本发明的功能性表位结合的抗体,能够取得具有拮抗剂作用的单克隆抗体。因此,本发明的另一方式中,本发明还涉及利用了il-33的功能性表位的具有拮抗剂作用的抗体的筛选方法。更具体而言,通过噬菌体展示技术等从天然抗体文库中富集具有il-33拮抗剂作用的抗体的克隆时,首先,以全长或成熟型il-33蛋白质作为诱饵,进行文库筛选,富集与il-33表面上的各种表位结合的抗体克隆,继而以本发明中发现的功能性表位肽作为诱饵进行文库筛选,由此,能够高效地筛选与功能性表位特异性结合的具有il-33的拮抗剂作用的抗体。本实施例中,本发明人针对确定了与长度为20残基的表位的结合性的单克隆抗体群,变更使用抗体浓度,研究了il-33拮抗剂活性。由此,决定了适于生成或筛选具有拮抗剂作用的抗体的表位。根据该结果可知,明确地确认到与选自由序列表中序列号226的111~130位(pep12)、131~150位(pep14)、231~250位(pep24)及251~271位(pep26)组成的组的表位结合的抗体的拮抗剂作用伴随抗体浓度而增加,因此,上述表位是适于生成或筛选具有拮抗剂作用的抗体的功能性表位。因此,本发明的一个方式中,涉及下述表位:所述表位含有由选自由序列表中序列号226的111位~130位、131位~150位、231位~250位及251~271位组成的组的区域中的至少6个、优选为至少10个、更优选为至少15个连续氨基酸组成的序列。其他的方式中,本发明涉及选自由序列表中序列号226的111位~130位、131位~150位、231位~250位、及251位~270位组成的组的表位。表位可以使用通常实施的肽合成技术制造。被制造、纯化的表位可以用于动物的免疫、生成针对该表位的抗体。此外,其他的方法中,通过在噬菌体展示法中使用被纯化的表位,可以生成或筛选与该表位结合的单克隆抗体。另外,可以将表位和免疫佐剂一同用作疫苗。本发明涉及与由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位结合的单克隆抗体。单克隆抗体包括嵌合抗体、人源化抗体、人抗体、多特异性抗体、及人工抗体、以及这些抗体的功能改造抗体、以及这些抗体的偶联抗体、以及这些抗体的片段。本发明的单克隆抗体可以使用杂交瘤法、噬菌体展示法、及基因工程手法等任意的已知手法生成。杂交瘤法中,可以通过以下方法生成单克隆抗体:使从用免疫原免疫的动物、尤其是大鼠或小鼠的脾脏或淋巴结中采集的b细胞、和无限增殖化细胞、例如骨髓瘤细胞融合,培育杂交瘤,筛选生成具有期望的结合性的抗体的杂交瘤,并利用被筛选的杂交瘤生成单克隆抗体。另外,通过使用导入了人的抗体基因的小鼠,可以取得人抗体。为了从杂交瘤中取得单克隆抗体,可以采用将该杂交瘤按照通常的方法培养并取得其培养上清的方法、或者将杂交瘤施予至具有适应性的哺乳动物使之增殖并取得其腹水的方法等。前者的方法适于获得高纯度的抗体,另一方面,后者的方法适于抗体的大量生产。制备单克隆抗体的技术使用已知的技术即可,例如,可以基于currentprotocolsinimmunology,wileyandsonsinc.的chapter2的记载生成。噬菌体展示法中,使用目标免疫原筛选从任意的噬菌体抗体文库中选出的噬菌体,选择针对免疫原具有期望的结合性的噬菌体。接着,将噬菌体内所含有的抗体对应序列分离或进行测序,基于被分离的序列或测得的序列信息,构建含有编码单克隆抗体的核酸分子的表达载体。接着,通过培养将该表达载体转化而得的细胞株,可以产生单克隆抗体。作为噬菌体抗体文库,通过使用人抗体文库,可以生成具有期望的结合性的人抗体。基因工程手法中,在编码抗体的基因序列中,将突变导入与互补性决定区(cdr)对应的序列、或其他的序列,将该序列整合至表达载体,将整合后的表达载体转化至宿主细胞,可以生成重组型抗体(例如,参见borrebaeckc.a.k.andlarrickj.w.therapeuticmonoclonalantibodies,publishedintheunitedkingdombymacmillanpublishersltd,1990)。本发明中,出于降低针对人的异种抗原性、或添加其他的功能等目的,可以使用例如嵌合抗体、人源化抗体、多特异性抗体、人工抗体,这些抗体可以使用已知的方法制造。嵌合抗体可以通过以下方法得到:将编码非人源抗体可变区的dna和编码人抗体恒定区的dna连结,将其整合至表达载体并导入宿主,进行生产(参见ep125023、wo92/19759)。使用上述已知的方法,可以得到对于本发明有用的嵌合抗体。人源化抗体可以通过以下方法得到:将非人源抗体的互补性决定区(cdr)和编码其他的部分的人抗体区域dna连结,将其整合至表达载体并导入宿主,进行生产。所谓多特异性抗体,是指具有2个以上不同的抗原特异性、且具有2个以上独立的抗原识别位点的非对称的抗体。双特异性抗体等多特异性抗体可以利用2种以上的单克隆抗体的抗原结合区域,通过基因工程方法制备。本领域中已经确立了该基因工程方法。例如,利用将2种单克隆抗体的抗原结合区域串联地连结的dvd-ig(wu等,naturebiotechnology25(11),1290(2007))的技术、通过改变抗体的fc区域,将与不同的抗原结合的2种抗体的重链组合的art-ig技术(kitazawa等,naturemedicine18(10),1570(2012)),即可以取得期望的双特异性抗体。所谓人工抗体,是指例如蛋白质支架这样不具有抗体的结构但具有与抗体同样的功能的人工抗体。作为蛋白质支架,利用人丝氨酸蛋白抑制剂的kunitz结构域、人纤维连接蛋白(fibronectin)的细胞外结构域、锚蛋白(ankyrin)、脂质运载蛋白等,如果改变支架上的靶结合位点的序列,则可以生成与本发明的表位结合的蛋白质支架(专利文献4,cliffordmintzet.albioprocessinternational,2013,vol.11(2),pp40-48)。通过改变本发明的单克隆抗体的fc区域等的氨基酸序列、糖链,可以调节抗体具有的抗原结合功能以外的细胞毒性、补体激活功能、血中半衰期等(strohl,currentopinioninbiotechnology,2009,vol.20,p685)。这样的功能改造抗体通过例如如下的方法制备。如果将破坏了α1,6-岩藻糖转移酶(fut8)基因的cho细胞用作宿主细胞制造单克隆抗体,则糖链的岩藻糖含量降低,可以得到细胞毒性提高的抗体,如果将导入了fut8基因的cho细胞用作宿主细胞制造单克隆抗体,则可以得到细胞毒性低的抗体(国际公开第2005/035586号、国际公开第2002/31140号、国际公开第00/61739号)。另外,通过改变fc区域的氨基酸残基,可以调节补体激活功能(美国专利第6737056号、美国专利第7297775号、美国专利第7317091号)。此外,通过使用与作为fc受体之一的fcrn的结合提高的fc区域的突变体,可以期待血中半衰期的延长(桥口周平等,生化学,2010,vol.82(8),p710)。这些功能改造抗体可以通过基因工程制造。本发明中使用的单克隆抗体可以是与例如聚乙二醇(peg)等非肽性聚合物、放射性物质、毒素等各种分子结合而成的偶联抗体。这样的偶联抗体可以通过对得到的抗体实施化学性修饰而得到。需要说明的是,该领域中已经确立了化学性修饰方法。本发明中的单克隆抗体也包括这些偶联抗体(d.j.king.,applicationsandengineeringofmonoclonalantibodies.,1998t.j.internationalltd,monoclonalantibody-basedtherapyofcancer.,1998marceldekkerinc;charietal.,cancerres.,1992vol152:127;liuetal.,procnatlacadsciusa.,1996vol93:8681,)。本发明中,除了上述的所有抗体以外,只要具有表位结合性、发挥拮抗剂活性,也可以是单克隆抗体的片段、单克隆抗体的修饰物。例如,作为抗体的片段,可以举出fab片段、fv片段、f(ab’)2片段、fab’片段、或用合适的连接体使h链和l链的fv连结而成的单链fv(scfv)。此外,这些抗体的片段可以与聚乙二醇(peg)等非肽性聚合物、放射性物质、毒素、低分子化合物、细胞因子、白蛋白、酶等的抗体以外的功能分子化学性结合或通过基因工程结合。用于制造单克隆抗体的生产系统可以利用invitro或invivo的生产系统中的任一种。作为invitro的生产系统,可以举出使用真核细胞、例如动物细胞、植物细胞、或真菌细胞的生产系统、使用原核细胞、例如大肠菌、枯草杆菌等细菌细胞的生产系统。作为使用的动物细胞,可以使用哺乳动物细胞、例如cho、cos、骨髓瘤、bhk、hela、vero等通常使用的细胞、昆虫细胞、植物细胞等。作为invivo的生产系统,可以举出使用动物的生产系统、使用植物的生产系统。使用动物时,有使用例如哺乳类动物、昆虫的生产系统等。作为哺乳类动物,可以使用例如山羊、猪、绵羊、小鼠、牛等(vickiglaser,spectrumbiotechnologyapplications,1993)。另外,作为昆虫,可以使用例如桑蚕。使用植物时,可以使用例如烟草。用上述这样的invitro或invivo的生产系统生产单克隆抗体时,可以将编码单克隆抗体重链(h链)或轻链(l链)的dna分别整合至表达载体并同时转化到宿主中,或者也可以将编码h链及l链的dna整合至单一的表达载体,转化至宿主(参见国际公开第wo94/11523号)。可以将得到的单克隆抗体纯化直到均匀。单克隆抗体的分离、纯化使用通常的蛋白质所用的分离、纯化方法即可。例如,合适地选择、组合亲和层析(affinitychromatography)等色谱柱、过滤器、超滤、盐析、透析、sds聚丙烯酰胺凝胶电泳、等电聚焦电泳等,可以分离、纯化单克隆抗体(antibodies:alaboratorymanual.edharlowanddavidlane,coldspringharborlaboratory,1988),但不限于上述方法。作为用于亲和层析的柱,可以举出proteina柱、proteing柱。作为使用例如proteina柱的柱,可以举出hyperd、poros、sepharosef.f.(amershambiosciences)等。本发明的与由序列表中序列号226的101位~154位或199位~270位中所含有的连续氨基酸序列组成的表位结合的单克隆抗体由于施予至人时的抗原性低,因此,优选为嵌合抗体、人源化抗体、人抗体、最优选为人抗体。此外,人抗体中,框架区的氨基酸序列优选为人生殖细胞系的框架区的氨基酸序列或其组合的氨基酸序列。因此,本发明涉及一种人抗il-33中和单克隆抗体,所述抗体的框架区的氨基酸序列是生殖细胞系的框架区的氨基酸序列或其组合的氨基酸序列。该人抗il-33中和单克隆抗体具有下述特征:由于可变区的框架区含有人生殖细胞系框架区的氨基酸序列或其组合的氨基酸序列,因此,这些区域完全不会导致免疫原性,或导致的免疫原性极小,另一方面,所述抗体能够与il-33结合,并阻碍其功能。因此,该抗体被用作医药时,不易诱导人抗人免疫球蛋白抗体(haha),从而在生物体内不受排斥,其结果是,il-33中和效果长,以及,只要不引发由与haha结合导致的炎症,则为安全的抗体。关于人的生殖细胞系中的轻链及重链框架区的氨基酸序列,只要是人的生殖细胞系的框架区的氨基酸序列,则可以使用任何序列。例如,可以使用登录于ncbi等数据库(http://www.ncbi.nlm.nih.gov/igblast/showgermline.cgi)中的人抗体的重链可变区及轻链可变区的框架区的dna序列所编码的氨基酸序列、表4中记载的生殖细胞系的框架区的氨基酸序列。轻链可变区可以是λ链的可变区,也可以是κ链的可变区。作为人生殖细胞系中的轻链及重链框架区,优选为在生物体内的出现频率高的、常用的框架区,作为这样的人重链框架区,可以举出vh3-23、vh3-30、vh4-39、vh4-34等的框架区1、框架区2及框架区3、jh4等的框架区4可以举出。另外,作为在生物体内的出现频率高的人轻链框架区,可以举出vλ1-47、vλ2-14、vκ3-20、vκ1-39等的框架区1、框架区2及框架区3、jλ2等的框架区4。对于重链框架区而言,只要是人重链框架区,可以任意地组合使用,例如,可以选择vh3-23的框架区1及框架区2、和vh3-30的框架区3作为重链框架区使用。另外,轻链框架区也一样,只要是人重链框架区,可以任意地组合使用。本申请中,优选的生殖细胞系的框架区的氨基酸序列为vh3-23、vh3-30、jh4、vλ1-47、jλ2的框架区的氨基酸序列。具体而言,优选为下述框架区:所述框架区中,轻链框架区1的氨基酸序列为序列表中序列号317的残基1至残基22,轻链框架区2的氨基酸序列为序列表中序列号317的残基36至残基50,轻链框架区3的氨基酸序列为序列表中序列号317的残基58至残基89,以及,轻链框架区4的氨基酸序列为序列表中序列号401的残基3至残基12,并且,重链框架区1的氨基酸序列为序列表中序列号367的残基1至残基30或序列表中序列号368的残基1至残基30,重链框架区2的氨基酸序列为序列表中序列号367的残基36至残基49或序列表中序列号368的残基36至残基49,重链框架区3的氨基酸序列为序列表中序列号367的残基67至残基98或序列表中序列号368的残基67至残基98,以及,重链框架区4的氨基酸序列为序列表中序列号407的残基5至残基15,最优选下述框架区:所述框架区中,轻链框架区1的氨基酸序列为序列表中序列号317的残基1至残基22,轻链框架区2的氨基酸序列为序列表中序列号317的残基36至残基50,轻链框架区3的氨基酸序列为序列表中序列号317的残基58至残基89,以及,轻链框架区4的氨基酸序列为序列表中序列号401的残基3至残基12,并且,重链框架区1的氨基酸序列为序列表中序列号367的残基1至残基30,重链框架区2的氨基酸序列为序列表中序列号367的残基36至残基49,重链框架区3的氨基酸序列为序列表中序列号368的残基67至残基98,以及,重链框架区4的氨基酸序列为序列表中序列号407的残基5至残基15。作为本发明的另一方式,涉及分离的人抗il-33中和单克隆抗体,所述抗体的轻链互补性决定区1(lcdr1)、轻链互补性决定区2(lcdr2)、轻链互补性决定区3(lcdr3)、重链互补性决定区1(hcdr1)、重链互补性决定区2(hcdr2)及重链互补性决定区3(hcdr3)各自的氨基酸序列为表1所示的互补性决定区的组合的氨基酸序列。更优选方式中,具有表1所示的c1至c30的互补性决定区的组合的人抗il-33中和单克隆抗体对于il-33、特别是其中与il-33受体结合并发挥活性的成熟型il-33,例如il-33(残基95至残基270)、il-33(残基99至残基270)、il-33(残基109至残基270)、il-33(残基112至残基270)等具有结合性及中和活性。更优选的是,具有表1所示的c1至c30的互补性决定区的组合的人抗il-33中和单克隆抗体对于il-33(残基131至残基150)具有结合性。本发明中,从结合性及/或物性的观点出发,改良的互补性决定区的组合是优选的方案。可以举出下述人抗il-33中和单克隆抗体:特别优选的是,所述抗体的针对人il-33的解离速度常数(koff)的上限值为约3.5×10-5/sec以下,较优选为约2.0×10-5/sec以下,更优选为约1.5×10-5/sec以下,更优选为约1.0×10-5/sec以下,下限值没有特别限定,例如为10-7/sec以上,较优选为10-6/sec以上,更优选为约5×10-6/sec以上。人抗il-33中和单克隆抗体中,更优选针对人il-33的解离常数(kd)低的抗体,可以举出下述人抗il-33中和单克隆抗体:作为所述抗体的解离常数的上限值,例如为10-9m以下,较优选为10-10m以下,更优选为10-12m以下,作为下限值没有特别限定,例如为10-14m以上,更优选为10-13以上。本发明的人抗il-33中和单克隆抗体阻碍在il-33刺激时源于huvec的il-6的产生,其中,优选阻碍效果强的抗体。具体而言,作为本发明的优选方式,可以举出下述人抗il-33中和单克隆抗体:如后述实施例10中记载的那样,通过添加1μg/ml的人抗il-33中和单克隆抗体,被100ng/ml的il-33刺激时,源于huvec的il-6的产生受到阻碍的比例(阻碍率)为约50%以上,较优选为约70%以上,更优选为约90%以上。本发明的人抗il-33中和单克隆抗体阻碍在il-33刺激时源于ku-812细胞的il-5、il-6及/或il-13的产生。其中,优选阻碍效果强的抗体。具体而言,作为本发明的优选方式,可以举出下述人抗il-33中和单克隆抗体:如后述实施例11中记载的那样,通过添加3μg/ml的人抗il-33中和单克隆抗体,被100ng/ml的il-33刺激时,源于ku-812细胞的il-5、il-6及/或il-13的产生受到阻碍的比例(阻碍率)为约30%以上,较优选为约50%以上,更优选为约70%以上。本发明的人抗il-33中和单克隆抗体阻碍在il-33刺激时的源于人末梢血单核细胞的ifn-γ的产生。其中,优选阻碍效果强的抗体。具体而言,作为本发明的优选方式,可以举出下述人抗il-33中和单克隆抗体:如后述实施例12中记载的那样,通过添加10μg/ml的人抗il-33中和单克隆抗体,被10ng/ml的il-33刺激时,源于人末梢血单核细胞的ifn-γ的产生受到阻碍的比例(阻碍率)为约80%以上,较优选为约90%以上,更优选为约95%以上。本发明的人抗il-33中和单克隆抗体抑制将人il-33施予至小鼠时的炎症。其中,优选抗炎症效果强的抗体。具体而言,作为本发明的优选方式,可以举出下述人抗il-33中和单克隆抗体:如后述实施例13中记载的那样,通过将人抗il-33中和单克隆抗体以10mg/kg连续腹腔内施予7天,由0.4μg/个体的人il-33的连续7天的施予导致的脾脏重量、血清中的iga浓度、ige浓度、嗜中性细胞数、嗜碱性细胞数、嗜酸性细胞数及/或血清中的il-5浓度的增加受到抑制的比例为约30%以上,较优选为约50%以上,更优选为约80%以上。此外,本发明的人抗il-33中和单克隆抗体优选抗体的物性优异。其中,优选在利用动态光散射的评价中粒径分布的形状不显示二峰性、凝集性极低的人抗il-33中和单克隆抗体,并优选作为胶体稳定性的指标的相互作用参数(kd)高的抗体,例如,所述参数优选为-12.4ml/g以上,较优选为-10ml/g以上,更优选为-8.5ml/g以上。本发明的人抗il-33中和单克隆抗体优选为热力学稳定性优异的抗体,例如,优选呈现下述热力学稳定性的抗体:所述抗体的免疫球蛋白结构域的折叠崩坏的温度(tm)为65℃以上,优选为68℃以上,较优选为70℃以上,更优选为73℃以上。此外,本发明的人抗il-33中和单克隆抗体优选抗体的稳定性优异。抗体的稳定性可以通过保存稳定性试验、强制氧化试验等通常方法进行测定。作为保存稳定性试验,例如,作为本发明的优选方式,如后述实施例21中记载的那样,于40℃保存4星期时抗体分子的单体的比例优选为90%以上,更优选为95%以上,另外,与人il-33蛋白质的结合活性优选为95%以上,更优选为99%以上。另外,像本申请实施例22中记载的那样,用1%的过氧化氢水溶液于37℃、24小时的条件下强制氧化时,优选使与人il-33蛋白质的结合活性保持80%以上,较优选保持85%以上,更优选保持90%以上。考虑到上述情况,本发明中,选自表1中c1至c28的互补性决定区的组合的人抗il-33中和单克隆抗体是更优选的抗体。另外,作为本发明的更优选方式,可以举出具有特定的互补性决定区的氨基酸序列的组合(表1中c1、c8、c15、c17或c18)人抗il-33中和单克隆抗体。只要确保抗原结合性,通过上述的互补性决定区的氨基酸序列的组合被确定的人抗il-33中和单克隆抗体的可变区中的框架区的氨基酸序列可以是任意的框架区。从降低针对人的免疫原性的观点考虑,框架区的氨基酸序列优选为人生殖细胞系框架区的各氨基酸序列或其组合的氨基酸序列,更优选为人体中常用的生殖细胞系的框架区的氨基酸序列。本发明中,优选的框架区的氨基酸序列如下:轻链框架区1的氨基酸序列为序列表中序列号317的残基1至残基22,轻链框架区2的氨基酸序列为序列表中序列号317的残基36至残基50,轻链框架区3的氨基酸序列为序列表中序列号317的残基58至残基89,以及,轻链框架区4的氨基酸序列为序列表中序列号401的残基3至残基12,并且,重链框架区1的氨基酸序列为序列表中序列号367的残基1至残基30或序列表中序列号368的残基1至残基30,重链框架区2的氨基酸序列为序列表中序列号367的残基36至残基49或序列表中序列号368的残基36至残基49,重链框架区3的氨基酸序列为序列表中序列号367的残基67至残基98或序列表中序列号368的残基67至残基98,以及,重链框架区4的氨基酸序列为序列表中序列号407的残基5至残基15。本发明中,更优选的框架区的氨基酸序列如下:轻链框架区1的氨基酸序列为序列表中序列号317的残基1至残基22,轻链框架区2的氨基酸序列为序列表中序列号317的残基36至残基50,轻链框架区3的氨基酸序列为序列表中序列号317的残基58至残基89,以及,轻链框架区4的氨基酸序列为序列表中序列号401的残基3至残基12,并且,重链框架区1的氨基酸序列为序列表中序列号367的残基1至残基30,重链框架区2的氨基酸序列为序列表中序列号367的残基36至残基49,重链框架区3的氨基酸序列为序列表中序列号368的残基67至残基98,以及,重链框架区4的氨基酸序列为序列表中序列号407的残基5至残基15。因此,本发明中,优选的重链可变区及轻链可变区的氨基酸序列的组合示于例如表2。本发明的优选方式为具有表2中v1至28的可变区的组合的人抗il-33中和单克隆抗体。本发明的更优选方式为具有特定的互补性决定区的氨基酸序列的组合(表2中v1、v8、v15、v17或v18)的人抗il-33中和单克隆抗体。根据重链的恒定区的差异,人免疫球蛋白分子中存在igg(包括igg1、igg2、igg3及igg4)、igm、iga(包括iga1、iga2)、igd或ige,它们各自具有为γ链、μ链、α链、δ链、或ε重链。作为本发明的人抗il-33中和单克隆抗体的恒定区,含有以上全部。另外,轻链根据其在染色体上的位置,存在κ链和λ链,本发明含有这二者。制造抗体医药时,从凝集性的观点考虑,优选为κ链,但从λ链具有和κ链不同的氨基酸序列、且与κ链同样地具备多样性的观点考虑,具有λ轻链的抗体也是有用的。从血中稳定性的观点考虑,本发明的人抗il-33中和单克隆抗体优选为轻链为λ链、重链为γ链的igg,更优选为轻链为λ链,重链为γ1链的igg1。il-33的氨基酸序列由于动物品种的不同而不同,因此,序列表中序列号226所示的人il-33和序列表中序列号227所示的猴il-33在氨基酸序列上存在差异。一般而言,抗体医药的药理试验、安全性试验中,猴被用作实验材料,因此,本发明的人抗il-33中和单克隆抗体优选也与猴il-33结合,更优选以和人il-33相同程度的亲和性与猴il-33结合。特别优选的是,相对于所述人抗il-33中和单克隆抗体针对人il-33的koff,针对猴il-33的koff的比例为约20倍以内,较优选为约10倍以内,更优选为约5倍以内。作为本发明的抗体的片段,可以举出例如fab片段、fv片段、f(ab’)2片段、fab’片段及scfv,这些抗体的片段可以与聚乙二醇(peg)等非肽性聚合物、放射性物质、毒素、低分子化合物、细胞因子、白蛋白、酶等的抗体以外的功能分子结合。对于本发明的人抗il-33中和单克隆抗体而言,通过将其自身与il-33以外的其他具有抗原结合特异性的抗体结合,可以制备双特异性抗体等多特异性抗体。作为il-33以外的其他的抗原,没有限制,可以举出tnf-α、il-6受体、cd3、cd20、α4整合素、blys、thymicstromallymphopoietin、ige、il-1、il-2、il-4、il-5、il-6、il-13、il-17、il-23、il-25等。在本发明的人抗il-33中和单克隆抗体及其抗体的片段中,通过改变其fc区域等,可以取得对细胞毒性、补体激活功能、血中半衰期等功能进行调节的功能改造抗体(设乐研也,药学杂志,2009,vol.129(1),p3;石井明子等,日本药理学杂志,2010,vol.136(5),p280;桥口周平等,生化学,2010,vol.82(8),p710;strohl,currentopinioninbiotechnology,2009,vol.20,p685)。本发明的人抗il-33中和单克隆抗体及其抗体的片段能够结合其他的功能分子,形成偶联抗体,例如,能够与聚乙二醇(peg)等非肽性聚合物、放射性物质、毒素、低分子化合物、白蛋白、细胞因子、酶等功能分子结合,添加新的功能。作为本发明的其他方式,可以举出以下内容:核酸分子,其编码编码框架区为生殖细胞系的氨基酸序列的人抗il-33中和单克隆抗体的蛋白质部分;含有所述核酸分子的载体、含有所述载体的宿主细胞、以及对所述宿主细胞加以培养的人抗il-33中和单克隆抗体的制造方法。本发明的另一方式中,还包括含有上述人抗il-33中和单克隆抗体的组合物。由于il-33引发炎症等,因此,人抗il-33中和单克隆抗体被期待具有il-33相关疾病的诊断、治疗、预防或减轻的用途。因此,本发明的一个方式涉及含有人抗il-33中和单克隆抗体、用于il-33相关疾病的诊断、治疗、预防或减轻的医药组合物。由于il-33诱导细胞因子、趋化因子、炎症介质等,因此,在其他的方式中,还包括细胞因子、趋化因子或炎症介质的表达抑制剂,所述抑制剂含有人抗il-33中和单克隆抗体。被本发明的细胞因子、趋化因子或炎症介质的表达抑制剂抑制的细胞因子是被il-33诱导的细胞因子,例如,可以举出tnf-α、ifn-γ、il-1β、il-3、il-4、il-5、il-6、il-13等。另外,被该抑制剂抑制的趋化因子是被il-33诱导的趋化因子,例如,可以举出cxcl2、ccl2、ccl3、ccl6、ccl17、ccl24等。被该抑制剂抑制的炎症介质是被il-33诱导的炎症介质,例如,可以举出pgd2、ltb4等。本发明的特别优选的方式为含有人抗il-33中和单克隆抗体的ifn-γ、il-5、il-6或il-13的表达抑制剂,更优选为il-6的产生抑制剂。本发明的其他方式涉及含有本发明的单克隆抗体医药组合物。另外,还涉及包括施予本发明的单克隆抗体的il-33相关疾病的诊断、治疗、预防或减轻的方法,以及,涉及本发明的单克隆抗体的制造il-33相关疾病的诊断、治疗、预防或减轻用医药的用途。作为il-33相关疾病的例子,没有限制,可以举出哮喘、特应性皮炎、荨麻疹、花粉症、过敏性休克、鼻窦炎(包括嗜酸细胞性鼻窦炎)、过敏性脑脊髓炎、嗜酸性细胞增多症、风湿性多肌痛、风湿性心脏病、多发性硬化症、关节炎(例如,类风湿性关节炎、幼年型关节炎、牛皮癣性关节炎、变形性关节病、赖特综合症等)、系统性红斑狼疮(包括盘状狼疮)、天疱疮、类天疱疮、牛皮癣、强直性脊柱炎、肝炎(例如,自身免疫性肝炎、慢性活动型肝炎等)、炎性肠疾病(例如,溃疡性结肠炎、克罗恩氏病、麸胶敏感性肠病等)、干燥综合症、自身免疫性溶血性贫血、自身免疫性炎症性眼病、自身免疫性新生儿血小板减少症、自身免疫性嗜中性细胞减少、自身免疫性卵巢炎及睾丸炎、自身免疫性血小板减少症、自身免疫性甲状腺炎、多发性肌炎、皮肌炎、重症肌无力症、肾上腺素激动剂耐性、斑形脱发症(alopeciagreata)、抗磷脂症、肾上腺的自身免疫疾病(例如,自身免疫性爱迪生氏病等)、乳糜泻-皮肤炎、慢性疲劳免疫功能紊乱症(cfids)、冷凝集素病、特发性混合型球蛋白血症症、纤维肌痛-纤维肌炎、肾小球肾炎(例如,iga肾病(nephrophathy)等)、格雷夫斯病、甲状腺功能亢进症(即,桥本甲状腺炎)、特发性血小板减少性紫癜(itp)、混合性结缔组织病、1型或免疫介导性糖尿病、恶性贫血、多发性软骨膜炎(polychrondritis)、自身免疫多腺体综合症、全身肌强直综合症、白癜风、结节病、多内分泌腺病综合症、其他的内分泌腺不全、动脉硬化、肝纤维化(例如,原发性胆汁性肝硬化等)、肺纤维化(例如,突发性肺纤维化等)、慢性阻塞性肺疾病(copd)、硬皮病(包括crest综合症、雷诺现象等)、肾小管间质性肾炎、致密物沉积病、急性肾损伤、心肌炎、心肌病、神经炎(例如,吉兰-巴雷综合症等)、结节性多动脉炎、心切开术综合症(cardiotomysyndrome)、慢性炎症性脱髓鞘性多发性神经病、iga神经病、扁平苔癣、美尼尔综合症、心肌梗死后(post-mi)、葡萄膜炎、葡萄膜炎眼炎(uveitisopthalmia)、血管炎、原发性无丙种球蛋白血症、癌症(例如,脑瘤、喉头癌、口唇口腔癌、下咽头癌、甲状腺癌、食道癌、乳腺癌、肺癌、胃癌、肾上腺皮质癌、胆管癌、胆囊癌、肝癌、胰腺癌、膀胱癌、大肠癌、子宫癌、卵巢癌、前列腺癌、睾丸癌、慢性淋巴细胞性白血病、慢性髓细胞性白血病、ewing肉瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、黑色素瘤、间皮瘤、多发性骨髓瘤等)、对来自免疫系统的排斥呈现抗性的感染(例如,重症急性呼吸综合症(sars))、伴随强毒性流感感染症的致死性细胞因子风暴、以及坏血病,可以优选地举出哮喘、特应性皮炎、花粉症、过敏性休克、鼻窦炎(包括嗜酸细胞性鼻窦炎)、克罗恩氏病、溃疡性结肠炎、关节炎、系统性红斑狼疮、天疱疮、类天疱疮、硬皮病、强直性脊柱炎、肝纤维化(包括原发性胆汁性肝硬化)、肺纤维化、慢性阻塞性肺疾病(copd)、急性肾损伤、血管炎及癌症等。含有本发明的人抗il-33中和单克隆抗体的医药组合物中,除了作为活性成分的人抗il-33中和单克隆抗体及其盐以外,可以含有药理学上允许的载体、稀释剂或者赋形剂。此外,可以含有例如抗炎症性药剂、免疫抑制剂等除了本发明的人抗il-33中和单克隆抗体以外的其他的活性成分,。这样的组合物被作为适于非口服施予或口服的剂型提供,从作为抗体医药使用的观点考虑,优选非口服施予。作为非口服施予,例如,可以举出静脉内、动脉内、皮下、局部、腹腔内、肌内、经鼻、滴眼、经皮、经粘膜、髓膜内、经直肠、肌内、脑内施予等,但不限于这些施予方式。医药组合物可以根据其施予途径而制成合适的剂型,可以是例如注射剂、粉末剂、输液制剂、颗粒剂、片剂、栓剂等任何剂型,从非口服施予的观点考虑,优选注射剂、输液制剂、用时溶解性的粉末剂等。另外,这些制剂可以含有下述成分:用于医药用途的各种辅助剂,即载体、其他的助剂,例如,稳定剂、防腐剂、无痛化剂、乳化剂等添加剂。本发明的人抗il-33中和单克隆抗体可以通过以例如1天、1星期、1月1次或者1年1至7次的间隔持续注入提供,或通过给药提供。给药可以通过静脉内、皮下、局部、口服、经鼻、经直肠、肌内、脑室内、或吸入而提供。优选的用量方案包括避免了严重的不良副作用的最大用量或最高给药频率。每周的总用量通常为约0.05μg/kg体重以上,更常用至少约0.2μg/kg,最常用至少约0.5μg/kg,代表性地使用至少约1μg/kg,更代表性地使用至少约10μg/kg,最具代表性地使用至少约100μg/kg,优选为至少约0.2mg/kg,更优选为至少约1.0mg/kg,最优选为至少约2.0mg/kg,理想为至少约10mg/kg,更理想为至少约25mg/kg,以及,最理想为至少约50mg/kg。本发明的人抗il-33中和单克隆抗体对于用于检测例如il-33相关疾病患者的特定的细胞、组织或血清中的il-33的表达的诊断试验有用。在诊断用途方面,作为典型,人抗il-33中和单克隆抗体优选为标记了能够检测的部分的偶联抗体。作为本发明的其他方式,涉及与下述抗体竞争性结合il-33的抗il-33中和单克隆抗体:所述抗体是含有特定的互补性决定区的氨基酸序列的组合(表1中c1、c8、c15、c17或者c18)或特定的可变区氨基酸序列的组合(表2中v1、v8、v15、v17或者v18)的氨基酸序列的抗il-33中和单克隆抗体。上述那样的与含有特定的互补性决定区的氨基酸序列的组合或特定的可变区氨基酸序列的组合氨基酸序列的人抗il-33中和单克隆抗体竞争性结合il-33的抗il-33中和单克隆抗体可以在利用噬菌体展示等基因工程方法、杂交瘤法等得到抗il-33抗体后,将所得抗体通过例如以下的表面等离子共振(spr)法筛选而取得。通过在固定有抗生物素蛋白的传感芯片上加入(load)作为配体的生物素化的人il-33蛋白质(4μg/ml),固定相当于1300至1600ru的人il-33蛋白质。接着,加入作为被分析物(analyte)的任意的抗il-33抗体(15μg/ml),使其与固定在传感芯片上的人il-33蛋白质结合。通过多次重复上述操作,实现传感芯片上的人il-33蛋白质的全部的分子均结合有任意的抗il-33抗体的状态(饱和状态),求出饱和状态下的结合量(饱和结合量1)。使用本发明的含有特定的互补性决定区的氨基酸序列的组合或特定的可变区氨基酸序列的组合的氨基酸序列的人抗il-33中和单克隆抗体,实施同样的实验,求出饱和状态下的结合量(饱和结合量2)。继而,用本发明的含有特定的互补性决定区的氨基酸序列的组合或特定的可变区氨基酸序列的组合的氨基酸序列的人抗il-33中和单克隆抗体使传感芯片上的人il-33蛋白质饱和后,加入作为被分析物的任意的抗il-33抗体(15μg/ml),调查该被分析物是否以追加的形式结合至已经饱和地结合有本发明的含有特定的互补性决定区的氨基酸序列的组合或特定的可变区氨基酸序列的组合的氨基酸序列的人抗il-33中和单克隆抗体的人il-33蛋白质。将下述情况判断为“非竞争性结合”:任意的抗il-33抗体能够在呈现通过上述算出的任意的抗il-33抗体的饱和结合量1的同时,以追加的形式结合至已经饱和地结合有本发明的含有特定的互补性决定区的氨基酸序列的组合或特定的可变区氨基酸序列的组合的氨基酸序列的人抗il-33中和单克隆抗体的人il-33蛋白质。另一方面,将下述情况判断为“竞争性结合”:任意的抗il-33抗体无法以追加的形式结合至已经饱和地结合有本发明的含有特定的互补性决定区的氨基酸序列的组合或特定的可变区氨基酸序列的组合的氨基酸序列的人抗il-33中和单克隆抗体的人il-33蛋白质。或者,即使在任意的抗il-33抗体能够以追加的形式结合至已经饱和地结合有本发明的含有特定的互补性决定区的氨基酸序列的组合或特定的可变区氨基酸序列的组合的氨基酸序列的人抗il-33中和单克隆抗体的人il-33蛋白质的情况下,如果追加的结合量低于饱和结合量1且差异显著,则该抗体被判断为“竞争性结合”。显著差异可以通过通常的检测方法(例如,学生检测,student′st-test)调查,显著的标准为5%或1%以下。上述的与含有特定的互补性决定区的氨基酸序列的组合或特定的可变区氨基酸序列的组合氨基酸序列的人抗il-33中和单克隆抗体竞争性结合il-33的抗il-33中和单克隆抗体可以是小鼠抗体、人抗体、大鼠抗体、兔抗体、山羊抗体、骆驼抗体等源于任意的动物的抗体、这些抗体的组合即嵌合抗体、人源化抗体。上述的与含有特定的互补性决定区的氨基酸序列的组合或特定的可变区氨基酸序列的组合氨基酸序列的人抗il-33中和单克隆抗体竞争性结合il-33的抗il-33中和单克隆抗体优选为嵌合抗体、人源化抗体、或人抗体,最优选为人抗体。作为上述的与含有特定的互补性决定区的氨基酸序列的组合或特定的可变区氨基酸序列的组合氨基酸序列的人抗il-33中和单克隆抗体竞争性结合il-33的抗il-33中和单克隆抗体,有抗体的片段。作为抗体的片段的例子,可以举出fab片段、fv片段、fab’)2片段、fab’片段、或scfv,优选为结合有peg等的抗体的片段。以下,对本发明的抗il-33中和单克隆抗体等的制造方法进行说明。如果使用基因工程方法,则可以通过下述方法制造本发明的人抗il-33中和单克隆抗体:将含有期望的互补性决定区的组合及框架区的组合,并且含有编码轻链可变区及重链可变区的dna序列的dna序列整合至表达载体,将该载体转化至宿主细胞中,对该宿主细胞加以培养(例如,参见borrebaeckc.a.k.andlarrickj.w.therapeuticmonoclonalantibodies,publishedintheunitedkingdombymacmillanpublishersltd,1990)。另外,通过将编码轻链及重链的恒定区的dna序列分别与编码重链可变区及轻链可变区的dna序列连结,可以制备编码重链的全长及轻链的全长的dna序列。本发明中,优选的编码人抗il-33中和单克隆抗体的重链全长及轻链全长的dna序列为例如具有作为轻链的λ链的igg1,示于以下的表5。但是,通过基因工程方法用动物细胞制造该抗体时,有时会剔除重链的c末端的赖氨酸残基,也可以将表5所示的构成重链的核酸序列(序列表中序列号254~277)3’末端的3个核苷酸“aag”从各重链核酸序列中除去。[表5]表5以下的序列号表示序列表中的序列号用于制造单克隆抗体的生产系统可以利用invitro的生产系统。作为invitro的生产系统,可以举出使用真核细胞、例如动物细胞、植物细胞、或真菌细胞的生产系统、使用原核细胞、例如大肠菌、枯草杆菌等细菌细胞的生产系统。作为使用的动物细胞,可以使用哺乳动物细胞、例如cho、cos、骨髓瘤、bhk、hela、vero等通常使用的细胞、昆虫细胞、植物细胞等,优选为293细胞、cho细胞优选。用上述那样的invitro的生产系统生产单克隆抗体时,可以将编码单克隆抗体重链或轻链的dna分别整合至表达载体并同时转化到宿主中,或者也可以将编码重链及轻链的dna整合至单一的表达载体,转化至宿主(参见国际公开94/11523号)。作为能够在动物细胞中使用的载体,优选为例如pconplus、pcdm8、pcdnai/amp、pcdna3.1、prep4等,但不限于这些载体。可以将得到的单克隆抗体纯化直到均匀。单克隆抗体的分离、纯化使用通常的蛋白质所用的分离、纯化方法即可。例如,合适地选择、组合亲和层析等色谱柱、过滤器、超滤、盐析、透析、sds聚丙烯酰胺凝胶电泳、等电聚焦电泳等,可以分离、纯化单克隆抗体(antibodies:alaboratorymanual.edharlowanddavidlane,coldspringharborlaboratory,1988),但不限于上述方法。作为用于亲和层析的柱,可以举出proteina柱、proteing柱。作为例如proteina柱的柱,可以举出hyperd、poros、sepharosef.f.(amershambiosciences)等。通过将本申请的人抗il-33中和单克隆抗体与除了il-33以外的其他的具有抗原结合特异性抗体结合,可以制备双特异性抗体等多特异性抗体。关于双特异性抗体的制造方法,已知的化学性方法(nisonoff,a.etal.,archivesofbiochemistryandbiophysics.,1961,vol.90,p.460-462,brennan,m.etal.,science,1985,vol.299,p.81-83)被广泛获知。这些方法中,首先利用酶将2种抗体分别水解,之后,用还原剂切割抗体的重链的二硫键,继而将异种的抗体混合并进行再氧化,从而得到二价反应性抗体。最近,公开了使用戊二醛、碳二亚胺等交联剂的制备方法(特开平2-1556号公报)。本领域中也已经确立了通过基因工程制备双特异性抗体等多特异性抗体的方法。例如,利用将2种单克隆抗体的抗原结合区域串联地连结的dvd-ig(wu等,naturebiotechnology25(11),1290(2007))的技术、通过改变抗体的fc区域,将与不同的抗原结合的2种抗体的重链组合的art-ig技术(kitazawa等,naturemedicine18(10),1570(2012)),即可以取得期望的双特异性抗体。如果将破坏了α1,6-岩藻糖转移酶(fut8)基因的cho细胞用作宿主细胞制造单克隆抗体,则糖链的岩藻糖含量降低,可以得到细胞毒性提高的抗体,如果将导入了fut8基因的cho细胞用作宿主细胞制造单克隆抗体,则可以得到细胞毒性低的抗体(国际公开第2005/035586号、国际公开第2002/31140号、国际公开第00/61739号)。另外,通过改变fc区域的氨基酸残基,可以调节补体激活功能(美国专利第6737056号、美国专利第7297775号、美国专利第7317091号)。此外,通过使用与作为fc受体之一的fcrn的结合提高的fc区域的突变体,可以期待血中半衰期的延长(桥口周平等,生化学,2010,vol.82(8),p710;strohl,currentopinioninbiotechnology,2009,vol.20,p685)。这些功能改造抗体可以通过基因工程制造。本发明的人抗il-33中和单克隆抗体可以与其他的功能分子结合从而制备偶联抗体。例如,将作为功能分子的peg结合至抗体时,peg的分子量没有限制,可以使用为2000至100000da、更优选为10000至50000da的peg,可以是直链型,也可以是支链型。pegは、通过使用例如nhs活性,能够与抗体的氨基酸的n末端氨基等结合。将放射性物质用作功能分子时,可以使用131i、125i、90y、64cu、99tc、77lu或211at等。通过氯胺t法等可以使放射性物质直接结合至抗体。将毒素用作功能分子时,可以使用细菌毒素(例如,白喉毒素)、植物毒素(例如,赖氨酸)、低分子毒素(例如,庆大霉素)、美登素(maytansinoid)、及卡奇霉素(calicheamicin)等。将低分子化合物用作功能分子时,可以举出道诺霉素(daunomycin)、阿霉素(doxorubicin)、氨甲蝶呤、丝裂霉素、新制癌菌素(neocarzinostatin)、长春地辛(vindesine)及fitc等荧光色素等。将酶用作功能分子时,可以使用荧光素酶(例如,萤火虫荧光素酶及细菌荧光素酶;美国专利第4737456号)、苹果酸脱氢酶、脲酶、过氧化物酶(例如,辣根过氧化物酶(hrpo))、碱性磷酸酶、β-半乳糖酶、葡糖淀粉酶、溶菌酶、糖氧化酶(例如,葡萄糖氧化酶、半乳糖氧化酶、及葡萄糖-6-磷酸脱氢酶)、杂环式氧化酶(例如,尿酸酶及黄嘌呤氧化酶等)、乳过氧化物酶、微过氧化物酶等。作为将毒素、低分子化合物或酶化学性结合时使用的连接体,可以举出二价自由基(例如,亚烷基、亚芳基、杂芳基)、-(cr2)no(cr2)n-(r为任意的取代基)表示的连接体、烷氧基的重复单元(例如,聚氧乙烯(polyethyleneoxy)、peg、聚氧甲烯(polymethyleneoxy)等)及氨基烷(例如,聚氨乙烯(polyethyleneamino)、jeffaminetm)、以及、二价酸酯及酰胺(可以举出丁二酸酯、丁二酰胺、二乙醇酸酯(diglycollate)、丙二酸酯及癸酰胺等)。本领域中已经确立了使功能分子结合的化学性修饰方法(d.j.king.,applicationsandengineeringofmonoclonalantibodies.,1998t.j.internationalltd,monoclonalantibody-basedtherapyofcancer.,1998marceldekkerinc;charietal.,cancerres.,1992vol152:127;liuetal.,procnatlacadsciusa.,1996vol93:8681)。与本发明的含有特定的互补性决定区的氨基酸序列的组合(表1中c1、c8、c15、c17或者c18)或特定的可变区氨基酸序列的组合(表2中v1、v8、v15、v17或者v18)的氨基酸序列的人抗il-33中和单克隆抗体竞争性结合il-33的抗il-33中和单克隆抗体可以是小鼠抗体、人抗体、大鼠抗体、兔抗体、山羊抗体、骆驼抗体等源于任意的动物的抗体,也可以是这些抗体的组合即嵌合抗体、人源化抗体。这些抗il-33中和单克隆抗体可以使用杂交瘤法、噬菌体展示法等基因工程手法等任意的已知的方法取得,特别优选通过基因工程方法取得。嵌合抗体可以通过以下方法得到:将编码非人源抗体可变区的dna和编码人抗体恒定区的dna连结,将其整合至表达载体并导入宿主,进行生产(参见欧洲公开第125023号、国际公开92/19759号)。人源化抗体可以通过以下方法得到:将非人源抗体的互补性决定区(cdr)和编码其他的部分的人抗体区域dna连结,将其整合至表达载体并导入宿主,进行生产。人抗体可以使用例如以下提供的实施例中记载的步骤制备。另外,人抗体可以使用三元杂交瘤(trioma)技术、人b-细胞杂交瘤技术(kozbor等,1983immunoltoday4:p72)及用于生产人单克隆抗体的ebv杂交瘤技术(cole等,1985,monoclonalantibodiesandcancertherapy,alanr.liss,inc.,p.77)等制备。此外,通过用抗原蛋白质免疫导入了人抗体基因的转基因小鼠并培育杂交瘤,可以生成人抗体。作为转基因小鼠,可以举出humab(注册商标)小鼠(medarex)、kmtm小鼠(kirinpharma)、km(fcγriib-ko)小鼠、velocimmune小鼠(regeneron)等。作为本发明的其他方式,可以举出与本发明的含有特定的互补性决定区的氨基酸序列的组合(表1中c1、c8、c15、c17或者c18)或特定的可变区氨基酸序列的组合(表2中v1、v8、v15、v17或者v18)的氨基酸序列的人抗il-33中和单克隆抗体竞争性结合il-33的人工抗体。作为人工抗体,可以利用例如人纤维连接蛋白iii型结构域的10号单元(unit)(fnfn10),通过在该单元的bc、de、及/或fg环(loop)中导入突变,可以取得与期望的靶标结合的人工抗体。作为人工抗体,除了纤维连接蛋白的细胞外结构域以外,可以利用丝氨酸蛋白抑制剂的kunitz结构域、锚蛋白、脂质运载蛋白等肽。这些人工抗体可以通过下述基因工程方法制造:将含有编码所述肽的核酸分子的载体导入大肠菌、酵母或动物细胞,利用培养该宿主细胞的培养上清进行纯化。作为人工抗体,可以不利用上述那样的特定的蛋白质、或其一部分的氨基酸序列,而是从将氨基酸随机地组合而成的随机序列文库中寻找像抗体那样与本发明的表位特异性结合的低分子肽分子(例如,hipolitoetal.,currentopinioninchemicalbiology,2012vol16:196,yamagishietal.,chemistry&biology,2011vol18:1562)。对于这样的肽而言,除了基因工程方法以外,还可以利用芴甲氧羰基法(fmoc)、叔丁氧基羰基(tboc)法等化学合成法制造。[抗体的序列的组合]本申请中记载的人抗il-33中和单克隆抗体的互补性决定区的氨基酸序列的组合即表1中c1至c30、可变区的氨基酸序列的组合即表2中v1至v30、互补性决定区的核酸序列的组合即表5中cn1至cn30,以及,抗体的核酸序列的组合即表5中ign1至ign30各自相当于相同的克隆的序列,对应关系示于下述表6。例如,克隆a10-1c04的互补性决定区的氨基酸序列为c1的6个互补性决定区的氨基酸序列的组合,该互补性决定区的氨基酸序列的组合可以由cn1的6个核酸序列编码而成。另外,该克隆的重链和轻链的可变区的氨基酸序列为v1的2个氨基酸序列,含有v1的可变区的λ轻链及γ重链的氨基酸序列由ign1的2个核酸序列编码而成。[表6]实施例以下,通过实施例对本发明进行详细说明,但除非有特别说明,本发明不限于以下这些实施例。实施例1:抗il-33抗体的取得和表位肽的鉴定[抗体的取得]用人il-33蛋白质免疫动物,通过利用免疫动物的脾细胞制备杂交瘤,取得单克隆抗体。另外,利用从免疫动物的脾细胞回收的rna制备的动物的抗体文库、人天然抗体文库,通过噬菌体展示技术克隆与人il-33蛋白质结合的抗体。这样,取得了8种(抗体a~h)抗il-33单克隆抗体。[肽阵列扫描]为了鉴定取得的il-33抗体的表位,实施了肽阵列扫描来调查人il-33的部分肽(长度为20残基)与各抗体的结合性。为了覆盖主要的成熟型人il-33分子,在从距离n末端为101位的缬氨酸(v101)到270位的苏氨酸(t270)位置的范围内,每隔10个氨基酸错开开始位置,合成了计16种长度为20氨基酸的肽(pep11至pep26)。这些肽的序列和位置关系示于表7。[表7]将n末端被生物素化的各肽作为配体,在surfaceplasmonresonance(spr)装置(bio-rad,proteonxpr36)的中性抗生物素蛋白传感芯片上固定化。另外,在作为阳性对照的成熟型人il-33(残基112至残基270)的n末上添加avitag序列,利用生物素连接酶反应将蛋白质(hil-33)avitag序列特异性地生物素化,在spr传感芯片上将作为配体的该蛋白质固定化。在配体已固定化的传感芯片上,流过作为被分析物的被测抗体、人il-33受体蛋白质(重组人st2fc嵌合)(enzolifescience,alx-201-367-c050)或仅流过缓冲液(0.05%tween20/pbs)(抗体浓度:10μg/ml;流速:100μl/min),使上述被测物与芯片结合,将清洗后与传感芯片上的配体结合的被分析物量(抗体量)以ru值表示。结果示于图2。以抗体表位距离人il-33蛋白质的n末端侧从近到远的顺序,依次如下说明。抗体a和抗体b与pep12结合。抗体c和抗体d与pep14结合。抗体e与pep16和pep17两者结合。抗体f与pep24结合。抗体g和抗体h与pep26结合。市售的抗人il-33多克隆抗体(r&dsystems,af3625)与大部分研究所用的16种人il-33肽结合。另一方面,人il-33受体(st2)与人il-33蛋白质结合,但几乎不与人il-33肽(pep11~pep26)结合,本试验中,无法得知il-33的哪一个部分对于与st2的结合是重要的。另外,仅有缓冲液的样品、小鼠igg(r&dsystems,mab002)未确认到与配体的结合。在使用的抗体间比较抗体对于hil-33(残基112至残基270)的结合性,结果,与hil-33(残基112至残基270)的结合按照从强至弱的顺序,依次为抗体g、抗体h、抗体d、抗体e、抗体b、抗体a、抗体c、抗体f。实施例2:抗il-33单克隆抗体的il-33中和活性的评价-1以针对固相化人st2和人il-33的结合的阻碍作用作为指标,实施了抗体a、抗体b、抗体e、抗体f的il-33中和活性的测定。将用磷酸缓冲生理盐水(pbs)稀释的重组人st2fc嵌合(enzolifescience,alx-201-367-c050)(1μg/ml,50μl/孔)分注于96孔微孔板(microplate)(nunctm,#442404)中,于4℃静置过夜。翌日,将上述微孔板用含有1%bsa的pbs(pbs-b)清洗1次后,添加相同的溶液(250μl/孔),于室温封闭(blocking)2小时。之后,添加用pbs-b稀释的被测抗体(最终浓度为10μg/ml)及重组人il-33蛋白质(atgen,ilc0701)(最终浓度为1μg/ml)的混合溶液(50μl/孔),于室温孵育2小时。将微孔板用含有0.1%tween20的pbs(pbs-t)清洗5次后,添加用pbs-b稀释的山羊抗人il-33抗体(r&dsystems:af3625,最终浓度为1μg/ml,50μl/孔),于室温孵育1小时。将微孔板用pbs-t清洗5次后,添加用pbs-b稀释2000倍的hrp标记兔抗山羊igg抗体(invitrogen:61-1620,50μl/孔),于室温孵育1小时。将微孔板用pbs-t清洗5次后,添加surebluetmtmbmicrowellperoxidasesubstrate(kpl:52-00-01,50μl/孔),使其于室温反应20分钟。用tmbstopsolution(kpl:50-85-05,50μl/孔)使反应停止,使用微孔板检测仪(platereader)(spectramax190,moleculardevices),测定波长450nm及620nm的吸光度之差。抗体针对st2和il-33的结合的阻碍作用(il-33/st2结合系统竞争性结合阻碍率)通过下述方法求出:以添加了人il-1β(peprotech,200-01b)代替人il-33(最终浓度为1μg/ml)的试样作为背景,求出相对于仅添加了人il-33(最终浓度为1μg/ml)的试样的阻碍率(%)。其结果是,抗体a(表位为pep12)为66%阻碍、抗体b(表位为pep12)为55%阻碍、抗体e(表位为pep16-17)为0%阻碍、抗体f(表位为pep24)为39%阻碍,研究的4种抗体中,除了抗体e以外,所有的抗体(抗体a、抗体b、抗体f)均以10μg/ml的最终浓度呈现了30%以上的阻碍率。[表8]实施例3:抗il-33单克隆抗体的il-33中和活性的评价-2使用正常人脐带静脉内皮细胞(huvec)(lonza,clc2517a),以针对人il-33诱发的il-6产生的阻碍作用作为指标,实施了被测抗体(抗体a~h)的il-33中和活性的测定。在96孔微孔板(iwaki,mt4940-010)中接种huvec(6×103/0.1ml/孔),确认到细胞成为汇合(confluent)状态。在培养基(egm-2培养基(lonza,clcc-3156,clcc-4176))中添加抗il-33抗体(最终浓度为10μg/ml)及重组人il-33(atgen,ilc0701,最终浓度为100ng/ml)(0.2ml/孔),于37℃孵育24小时。24小时后,使用市售的elisa试剂盒(thermoscientific、eh2il6)测定培养基中的il-6浓度。另外,使用细胞计数试剂盒(dojindo,345-06463)测定采集培养基时的细胞的生存率,确认了il-6产生抑制作用未导致生存细胞数量的降低。作为被测抗体的il-33中和活性(huvec系il-6产生阻碍率),算出相对于仅用重组人il-33处理的试样的il-6产生的阻碍率(%)。其结果是,抗体a(表位为pep12)为51%阻碍,抗体b(表位为pep12)为48%阻碍,抗体c(表位为pep14)为33%阻碍,抗体d(表位为pep14)为38%阻碍,抗体e(表位为pep16-17)为0%阻碍,抗体f(表位为pep24)为38%阻碍,抗体g(表位为pep26)为48%阻碍,抗体h(表位为pep26)为56%阻碍,8种抗体中,除了抗体e以外的全部抗体均呈现了30%以上的阻碍率(表9)。这些抗体中,与选自由序列号1的111位~130位、131位~150位、231位~250位及251~270位组成的组的表位结合的抗体在将抗体浓度设为3、10及30μg/ml时,中和活性的增加大(例如,对于抗体d而言,分别为23、42、61%阻碍),由此可知,上述表位适于生成具有拮抗剂作用的抗体。[表9]抗体e虽然与hil-33结合(图2),但没有呈现中和功能的性能(表8、表9)。专利文献2(wo2008/132709)中记载了表位1(155~198位)、表位2(165~188位)、表位3(175~178位)这3种表位,已经确定这些表位与本次被确认不具有il-33中和活性的抗体e的表位肽(151~180位)重复。根据这些结果,可以认为针对专利文献2的表位的抗体无法充分地阻碍il-33和作为受体的st2的结合,不具有il-33中和活性,或者即使具有活性,该活性也极低。作为抗体e没有呈现il-33中和活性的た理由,理论上,除了表位的优劣以外,还存在亲和性不足的可能性。但是,存在抗体d、抗体g、抗体h等尽管较之抗体e有与hil-33的结合比抗体e更弱的趋势却依然呈现明确的il-33中和活性的克隆,因此,所述可能性低。根据上述情况,可以认为,以中和作为细胞因子的il-33为目的时,专利文献2中记载的表位为和与il-33的结合及il-33中和活性无关的表位,而本次本发明人发现的4个表位(pep12、pep14、pep24、pep26)为和与il-33的结合及il-33中和活性相关的功能性表位。功能性表位与结合抗体针对il-33的拮抗剂作用高,另一方面,与非功能性表位结合的抗体针对il-33的拮抗剂作用低,或完全不具有拮抗剂作用。实施例4:对于表位肽的人il-33立体结构的定位(mapping)针对上述的4个表位肽,为了特定作为对于具有拮抗剂作用的抗体的生成而言理想的表位的界面原子(距离构成st2的原子为圈内的il-33的原子),在人il-33·人st2复合体的立体结构上定位了表位肽。人il-33·人st2复合体的x射线结晶结构(researchcollaboratoryforstructualbioinformatics:pdbid4kc3)中,il-33蛋白质的一部分的结构欠缺,因此,无法表示本次鉴定的全部表位肽的位置。于是,以上述x射线结晶结构(4kc3)作为模板,制作同一性建模(homologymodel)(图3,使用accelrys公司discoverystudio3.5),定位了本次确认到中和活性的抗体的表位肽(pep12、pep14、pep24、pep26)(图4~7)。图4~7中,以深灰色表示人il-33、表位肽,以淡灰色表示与其结合的st2。为了明确表示和il-33蛋白质表面上的受体的接触面的位置,用大的球体突出表示界面原子。结果表明,这些表位肽(pep12、pep14、pep24、pep26)各自具有含有界面原子的氨基酸。作为含有界面原子的氨基酸,可以举出pep12的p118、i119、t120、y122、l123、r124、s125、l126、s127、y129、n130、pep14的d131、q132、s133、t135、a137、l138、e139、s142、y143、e144、i145、y146、e148、d149、l150、pep24的d244、n245、h246、pep26的k266、l267、s268、e269。可以认为,作为具有拮抗剂作用的抗体特异性结合的表位,优选为具有含有界面原子的氨基酸的表位。实施例5:人抗il-33抗体(亲代克隆)的取得使用人scfv的噬菌体展示文库(bioinvent,n-coder)(soderlindetal.,naturebiotechnology,2000vol.18(8),p852),取得了2种亲代克隆(scfv)(表示分子型为scfv,以下记载相同)(克隆名称:a00-0070、a00-0036),所述亲代克隆与成熟型il-33(残基112至残基270)结合、阻碍il-33与st2的结合、且以后述被正常人脐带静脉内皮细胞(huvec)的il-33诱导的的il-6产生作为指标,阻碍il-33的活性。测定这些抗体的碱基序列,确定轻链及重链的可变区的氨基酸序列。a00-0070及a00-0036的轻链及重链可变区的氨基酸序列的组合分别为表2中v29及v30。实施例6:用于改良互补性决定区的氨基酸取代的确定以2种亲代克隆与il-33的亲和性提高和物性改善(表面疏水性的降低导致的凝集性的降低及溶解度的提高)为目的,利用fab核糖体展示及fab噬菌体展示进行了互补性决定区的改良。互补性决定区的改良分为2阶段实施,在第一阶段以与il-33的亲和性提高和物性改善为目的确定单氨基酸取代,在第二阶段确定这些单氨基酸取代的多个组合(fujinoetal.,biochem.biophys.res.commun.,2012vol.428(3),p395)。用2种亲代克隆的轻链及重链可变区构建了fab核糖体展示载体。将其作为模板,利用基因定点突变(site-directedmutagenesis)pcr及重叠延伸(overlapextension)pcr进行多阶段的pcr反应,将构成抗体的6个互补性决定区(lcdr1、lcdr2、lcdr3、hcdr1、hcdr2、hcdr3)的全部氨基酸残基中的每1个取代为总计20种的天然氨基酸,构建了综合单氨基酸取代突变体文库。通过使用了再构建型无细胞翻译系统puresystem(genefrontier,purefrex)(shimizuetal.,naturebiotechnology,,2001vol.19(8),p751)的fab核糖体展示法(fujinoetal.,biochem.biophys.res.commun.,2012vol.428(3),p395),以重组人il-33蛋白质(atgen,ilc0701)作为诱饵,将综合单氨基酸取代突变体文库反复富集数次(round)。用第二代测序仪确定富集前(构建后的初始状态)的文库及富集后的文库所含有的各克隆(fab)(表示分子型为fab,以下记载相同)的轻链及重链可变区的碱基序列(roche,454)。从富集前后的各文库中取得数千条(read)的序列数据,算出互补性决定区中的全部单氨基酸取代突变体的存在频率。接着,算出富集前的文库和富集后的文库中的全部单氨基酸取代突变体的存在频率的变化倍率(富集比),以文库富集的富集比的大小作为指标,确定对于提高针对人il-33蛋白质的亲和性有用的单氨基酸取代。进一步地,依据这些单氨基酸取代的总数和在氨基酸序列上的分布状态,确定在第二阶段构建的定制文库中导入氨基酸取代的位置。亲代克隆a00-0070中,确定将氨基酸取代导入lcdr1(序列表中序列号2)的12号天冬酰胺、lcdr2(序列表中序列号11)的4号谷氨酰胺、lcdr3(序列表中序列号23)的2号丝氨酸、3号酪氨酸、6号丝氨酸、hcdr1(序列表中序列号43)的1号天冬氨酸、5号天冬酰胺、hcdr2(序列表中序列号64)的4号丝氨酸、5号丝氨酸、7号丝氨酸、9号异亮氨酸。亲代克隆a00-0036中,确定将氨基酸取代导入lcdr1(序列表中序列号6)的9号天冬酰胺、13号天冬酰胺、lcdr2(序列表中序列号20)的6号精氨酸、7号亮氨酸、lcdr3(序列表中序列号40)的1号丙氨酸、9号丙氨酸、10号缬氨酸、hcdr1(序列表中序列号47)的1号天冬酰胺、hcdr2(序列表中序列号64)的4号丝氨酸、5号丝氨酸、6号丝氨酸、7号丝氨酸、8号酪氨酸、9号异亮氨酸、10号酪氨酸、11号酪氨酸、13号天冬氨酸、16号赖氨酸、hcdr3(序列表中序列号78)的2号甘氨酸、5号组氨酸、6号天冬氨酸。为了改善物性,使用蛋白质结构解析程序(accelrys,discoverystudio)制作了2种亲代克隆的同一性模型,予测互补性决定区中表面疏水性高的区域。接着,为了降低这样的区域的表面疏水性,在亲代克隆a00-0070中,确定将氨基酸取代导入lcdr3(序列表中序列号23)的3号酪氨酸、hcdr2(序列表中序列号64)的7号丝氨酸、9号异亮氨酸,另外,在亲代克隆a00-0036中,确定将氨基酸取代导入lcdr2(序列表中序列号20)的6号精氨酸、7号亮氨酸、hcdr2(序列表中序列号64)的7号丝氨酸、8号酪氨酸、9号异亮氨酸。根据使用了综合单氨基酸取代突变体文库的突变分析中的富集比的数据,确定了上述位点的对于维持与人il-33蛋白质的结合性能且降低表面疏水性而言有用的氨基酸取代。实施例7:改良了互补性决定区的人抗il-33抗体的制备通过将多个以亲和性提高和物性改善为目的的上述有用氨基酸取代组合,设计了全面的互补性决定区改良用定制文库。构建fab核糖体展示及fab噬菌体展示的载体,以fab核糖体展示载体作为模板,利用基因定点突变pcr及重叠延伸pcr进行多阶段的pcr反应,并以fab噬菌体展示载体作为模板,实利用kunkel法的位点特异性突变导入法(fellouseetal.,j.mol.biol.2007vol.373,p924),由此,将互补性决定区基于上述的设计随机化,构建了互补性决定区改良用定制文库。以人il-33蛋白质及食蟹猴(cynomolgusmonkey)il-33蛋白质(genbank:ehh57404,序列表中序列号227的残基112的ser至残基269的glu)作为诱饵,将fab核糖体展示文库及fab噬菌体展示文库反复富集数次。在后半阶段的富集中,通过在与il-33蛋白质结合之前使用octylsepharose(gehealthcare)或者phenylsepharose(gehealthcare)等疏水柱载体实施阴性选择,富集了与il-33蛋白质的亲和性高、且表面疏水性低的fab。作为诱饵使用的重组蛋白质通过以下方法制备。将在n末端侧添加有6histag-avitag的成熟型人il-33(残基112至残基270)及成熟型食蟹猴il-33(序列表中序列号227的残基112至残基269)插入pet30a(-),从而构建表达载体,制备重组蛋白质。在5mllb培养基中对含有表达载体的大肠菌bl21(de3)株进行预培养后,将1ml预培养液接种至50ml表达培养基(merck,overnightexpress;添加卡那霉素),于30℃/200rpm表达培养约18小时。清洗回收的菌体后,在bagbuster(novagen)中溶菌,回收上清。用ni-ntaagarose(qiagen)纯化上清中所含有的6histag-avitag-食蟹猴il33(残基112至残基269),使用市售的生物素连接酶(avidity、bira)导入了avitag特异性的生物素修饰。使用富集后的文库构建分泌表达fab的大肠菌文库,使用数百克隆的大肠菌的培养上清,利用表面等离子共振(spr)实施解离速度常数(koff)的测定(bio-rad,proteonxpr36)。在传感芯片(bio-rad,nlcsensorchip)上加入作为配体的生物素化的上述人il-33蛋白质(4μg/ml)及上述食蟹猴il-33蛋白质(4μg/ml),固定了相当于1300至1600ru的人il-33蛋白质及相当于1100至1500ru的食蟹猴il-33蛋白质。接着,加入作为被分析物的大肠菌的培养上清,取得结合相为1分钟、解离相为10至30分钟的传感图。用spr数据解析程序(bio-rad,proteonmanagerv3.1.0)实施传感图的点间(interspot)校正及空白(blank)校正,通过langmuir的off-rateanalysis求出koff。从改良了互补性决定区的克隆(fab)中,确定了28个与人il-33蛋白质的亲和性提高、且针对食蟹猴il-33蛋白质具有结合性的克隆,用于在实施例8及其后的高级评价(表2中v1至v28)。如表10所示,这些克隆(fab)较之亲代克隆(fab)呈现了针对人及食蟹猴il-33蛋白质的高亲和性(低koff值)。这些克隆的可变区中的框架区中没有氨基酸取代。即使在互补性决定区存在相同的单氨基酸取代,单氨基酸取代突变体和多氨基酸取代突变体的亲和性提高效果也会不同,因此,存在尽管在第一阶段的综合单氨基酸取代突变体文库中的富集比小,却在用于高级评价的28克隆的序列中频率高的氨基酸取代,反之,也存在尽管在第一阶段的富集比大,却在用于高级评价的28克隆的序列中的频率低的氨基酸取代。[表10]实施例8:igg抗体的制备针对取得的人抗il-33抗体的7个克隆(a10-1c04、a23-1a05、a25-2c02、a25-3h04、a26-1f02、a00-0070、a00-0036),通过将编码轻链及重链的氨基酸序列的dna插入cmv启动子的下游,构建了igg表达哺乳细胞用表达载体。各克隆的轻链的dna序列分别使用了序列表中序列号228、232、239、241、242、230及253,重链的dna序列分别使用了序列表中序列号254、261、262、264、265、276及277。使用基因导入试剂neofection-293-1(astec),将上述表达载体导入freestyle293-f细胞(lifetechnologies)。导入基因后,培养5天,之后,取得培养上清。通过使用了pconplus载体和chok1sv细胞的gs系统(lonza)建立了cho细胞的稳定表达株。使用wavebioreactorsystem20/50eht(gehealthcare公司),将cho细胞稳定表达株从0.3×106cells/ml的浓度开始培养,回收含有分泌的igg的培养液。利用采用了aktaexplorer100(gehealthcare)和proteina树脂(gehealthcare、hitrapmabselectsure)的亲和层析从培养上清中纯化igg。将与proteina树脂结合的igg在ph3.2的洗脱缓冲液中洗脱,立刻将ph中和至约为中性后,用pbs(ph7.2)透析。出于提高纯化纯度的目的,将proteina柱纯化后的igg用cht(ceramichydroxyapatitetypei树脂)(biorad)纯化。将与cht结合的igg在nacl浓度梯度中洗脱,回收目标组分(fraction)后,用pbs(ph7.2)透析。将通过本纯化方法得到的抗体作为“中性纯化抗体”。在上述纯化方法中自proteina树脂洗脱的工序之前,添加利用6columnvolume的100mm碳酸钠缓冲液(ph11.0)进行6分钟清洗操作的工序,实施该纯化方法。将通过所述纯化方法得到而得抗体作为“碱纯化抗体”。碱纯化抗体的各工序中的回收率示于表11。纯化后的碱纯化抗体用vivaspinturbo1530000mwco(sartoeius)离心浓缩。[表11]实施例9:针对il-33蛋白质的亲和性通过kineticexclusionassay(kinexa)测定被测抗体(igg)(表示分子型为igg,以下记载相同)在pbs中的解离常数(kd),确定抗体针对人il-33蛋白质的亲和性(sapidyne,kinexa3200)。针对一定浓度(最终浓度为数十pm至数百pm)的被测抗体,将人il-33蛋白质(atgen,ilc0701)的浓度滴定为广泛范围(通过12个阶段的2倍稀释,得到1至2048倍的浓度范围,从而使最终浓度的上限为数nm至数十nm),制备被测抗体和人il-33蛋白质的混合试样,于室温孵育直到抗原抗体反应达到平衡。达到平衡后,使用kinexa3200测定游离的抗il-33抗体的存在率。使用kinexa数据解析程序(sapidyne,kinexaprosoftwarev3.5.3),将未与人il-33蛋白质结合的抗il-33抗体的存在率(纵轴)和抗原浓度(横轴)的绘图拟合为理论式,从而算出kd。将50mg的azlactonebeads(sapidyne)悬浊于1ml的包被溶液(10μg/ml人il-33蛋白质(atgen,ilc0701)、50mm碳酸钠,ph9.6)中,于室温1小时孵育,制备抗il-33抗体捕获用玻璃珠。检测用抗体使用anti-humanf(ab)’2-dylight649(jackson,309-495-006)。如表12所示,使用中性纯化抗体时,改良了互补性决定区的抗体(a10-1c04、a23-1a05、a25-2c02、a25-3h04、a26-1f02)中,a23-1a05针对人il-33蛋白质的亲和性最弱(kd=231pm)a25-2c02最强(kd=720fm)。同样地操作,通过kinexa测定了碱纯化抗体针对人il-33蛋白质(残基112-残基270)(atgen,ilc0701)或全长人il-33蛋白质的亲和性(表12)。针对人il-33蛋白质(残基112-残基270)亲和性如下:a10-1c04为kd=100.3pm,a23-1a05为kd=195.3pm,a25-2c02为kd=700fm,a25-3h04为kd=7.7pm、a26-1f02为kd=5.3pm。针对全长人il-33蛋白质的亲和性如下:a10-1c04为kd=179.8pm,a26-1f02为kd=10.4pm。作为配体使用的重组蛋白质通过以下方法制备。将在n末端侧添加有nusatag-6histag-tevprotease切割序列的全长人il-33蛋白质插入pet30a(+),从而构建表达载体,制备重组蛋白质。在50mllb培养基中对含有表达载体的大肠菌bl21(de3)株进行预培养后,以od=0.5的密度接种,于37℃振荡培养4小时。4小时后,将培养温度变更为13℃并振荡培养30分后,添加iptg以使其最终浓度为0.1mm,继续于13℃振荡培养72小时,从而得到全长il-33表达大肠菌。用bugbustermastermix(novagen)将全长il-33表达大肠菌溶菌后,进行离心分离,得到上清组分。将回收后的上清供于利用histrapffcrude柱(gehealthcare)的imac纯化及利用captoqimpress柱(gehealthcare)的阴离子交换纯化,提高蛋白纯度。通过利用vivaspin6(5,000mwco)的超滤将阴离子交换后的试样离心浓缩。在1750μl浓缩液中添加100μlturbotevprotease(nacalaitesque,inc.)及4.5μl1mdtt,于4℃孵育,从而切除nustag及histag。为了除去切除标记后的试样中所含有的nustag及turbotevprotease(histag融合),供于nisepharoseexcel柱(gehealthcare),回收其流出组分。在流出组分中添加dtt,使最终浓度为3.3mm,将其作为全长人il-33蛋白质用于利用kinexa的测定。[表12]*:表中的数值为用特定的方法纯化的抗il-33单克隆抗体(igg)针对各种配体的解离常数实施例10:使用huvec的invitro人il-33中和活性评价以huvec的被il-33诱导的il-6产生作为指标,评价被测抗体(igg)的invitro的人il-33中和活性。作为阳性对照,使用市售多克隆抗il-33抗体(r&dsystems,af3625)。在egm-2培养基(lonza,clcc-3156,clcc-4176)中悬浊huvec(lonza,clc2517a),接种于96孔微孔板(iwaki)(6x103/孔),确认到细胞成为汇合状态。在培养基中添加抗il-33抗体(最终浓度为1μg/ml(约6.7nm))及重组人il-33(atgen,ilc0701)(最终浓度为100ng/ml(约5nm))的混合溶液,于37℃孵育24小时。采集培养基,使用市售的elisa试剂盒(thermoscientific,eh2il6)测定培养上清中的il-6浓度。另外,使用细胞计数试剂盒(dojindo,345-06463)测定采集培养基时的细胞的生存率,确认了il-6产生抑制作用未导致生存细胞数量的降低。作为被测抗体的il-33中和活性,算出相对于由仅用il-33处理诱导的il-6产生的阻碍率(%)。使用中性纯化抗体时,a10-1c04为67%阻碍,a23-1a05为74%阻碍,a25-2c02为96%阻碍,a25-3h04为97%阻碍,a26-1f02为96%阻碍,均呈现了强的中和活性,而作为亲代克隆的a00-0070为4%阻碍,a00-0036为-2%,呈现了非常弱的中和活性。通过将浓度上调为10μg/ml,a00-0070为42%阻碍,a00-0036为38%阻碍,呈现了中等程度的中和活性。另一方面,以1μg/ml的最终浓度添加市售多克隆抗体(r&dsystems,af3625)时,呈现了30%阻碍这样中等程度的中和活性。同样地,在huvec中添加碱纯化被测抗体(最终浓度为0.1~10μg/ml(约0.67~67nm))及重组人il-33(atgen,ilc0701)(最终浓度为100ng/ml(约5nm))的混合溶液,作为抗体的中和活性,算出相对于由仅用il-33处理诱导的il-6产生的阻碍效果(ic50值)。a10-1c04为ic50=0.35μg/ml,a23-1a05为ic50=0.27μg/ml,a25-2c02为ic50=0.19μg/ml,a25-3h04为ic50=0.21μg/ml,a26-1f02为ic50=0.23μg/ml。另外,在huvec中碱纯化被测抗体(最终浓度为0.1~3μg/ml)及重组食蟹猴il-33(使用未生物素化的通过实施例7记载的方法制备的蛋白质)(最终浓度为100ng/ml)的混合溶液,作为抗体的中和活性,算出相对于由仅用il-33处理诱导的il-6产生的阻碍效果(ic50值)。a10-1c04的ic50为0.43μg/ml,确认到a10-1c04以同样的强度中和人il-33和食蟹猴il-33。实施例11:使用ku-812细胞的invitro人il-33中和活性评价以ku-812细胞的被il-33诱导的il-5、il-6、il-13的产生作为指标,评价被测抗体(igg)的invitro的人il-33中和活性。作为阳性对照,使用市售多克隆抗il-33抗体(r&dsystems,af3625)。在96孔微孔板(falcon)中接种人嗜碱性细胞细胞株、ku-812细胞(ecacc,ec90071807)(1x104/孔)。继而,添加被测抗体(最终浓度为3μg/ml(约20nm))和重组人il-33(atgen、ilc0701)(最终浓度为100ng/ml(约5nm))的混合溶液,于37℃孵育24小时。使用bdtmcytometricbeadarray(bdbiosciences)的humanil-5flexset、humanil-6flexset及humanil-13flexset,测定含有10%fbs的rpmi-1640培养基中的il-5、il-6、il-13的浓度。另外,使用细胞计数试剂盒(dojindo,345-06463)测定采集培养基时的细胞的生存率,确认了il-5、il-6、il-13的产生抑制作用未导致生存细胞数量的降低。使用中性纯化抗体时,该评价体系中,a26-1f02对于il-5、il-6、il-13的产生的阻碍率分别为70%、82%、72%,较之市售多克隆抗体(分别为47%、51%、41%阻碍),对任一种细胞因子的产生均呈现了强的中和活性。同样地,在ku-812细胞中添加碱纯化被测抗体(最终浓度为100~0.01μg/ml(约667~0.067nm))和重组人il-33(atgen,ilc0701)(最终浓度为3ng/ml(约0.15nm))、人il-3(peprotech,200-03,最终浓度为10ng/ml(约0.67nm)、人补体c5a(sigma-aldrich,c5788)(最终浓度为1nm)的混合溶液,于37℃孵育24小时。测定含有10%fbs的rpmi-1640培养基中的il-5、il-13的浓度。另外,使用细胞计数试剂盒测定采集培养基时的细胞的生存率,,确认了il-5、il-13的产生抑制作用未导致生存细胞数量的降低。该评价体系中,碱纯化被测抗体(a10-1c04、a23-1a05、a25-2c02、a25-3h04、a26-1f02)以1μg/ml的最终浓度呈现了针对il-5及il-13产生的50%以上的阻碍效果。实施例12:使用人末梢血单核细胞的invitro人il-33中和活性评价以人末梢血单核细胞(pbmc)的被il-33诱导的ifn-γ产生作为指标,评价被测抗体(igg)的invitro的人il-33中和活性。作为阳性对照,使用市售多克隆抗il-33抗体(r&dsystems,af3625)。制备pbmc,接种于96孔微孔板中(2x105/孔),添加重组人il-12(和光纯药工业)(最终浓度为10ng/ml)。添加被测抗体和重组人il-33蛋白质(10ng/ml)的混合物,于37℃孵育48小时。之后,采集培养上清,使用alfalisatmhumanifn-γimmuneassaykit(perkinelmer)测定培养基中的ifn-γ产生量,评价il-33中和活性。该评价体系中,使碱纯化抗体以10μg/ml的最终浓度发挥作用时的阻碍率如下:a10-1c04为96.9%阻碍,a23-1a05为97.5%阻碍,a25-2c02为98.75%阻碍,a25-3h04为97.9%阻碍,a26-1f02为98.25%阻碍。实施例13:针对由人il-33的腹腔内施予诱导的炎症的作用的评价通过将人il-33腹腔内施予至小鼠,诱导了各种炎症性变化。即,产生了血中的ige、iga、il-5的增加、嗜中性细胞、嗜酸性细胞、嗜碱性细胞的增加、脾细胞的增加(脾脏重量的增加)、及各种粘膜脏器的病理变化。以这些变化作为指标,评价被测抗体(igg)的invivo的抗炎症作用。对于雄性c57bl6(6~8周龄)(charlesriverjapan)に,将人il-33蛋白质(r&dsystems,3625-il-010)以0.4μg/个体实施腹腔内施予,实施7天(day0-day6)。继而,将被测抗体(igg)腹腔内施予7天(day0-day6)。施予开始7天后(day7),施予pbs代替人il-33蛋白质(图中记为“溶剂(vehicle)”)的群的脾脏重量为平均76±4mg,与此相比,施予il-33蛋白质的群的脾脏重量为平均90±7mg。另外,除了施予il-33蛋白质以外还以10mg/kg腹腔内施予了人controligg(mpbiomedicals,55908)(图中记为“mpk”)的群的脾脏重量为平均93±4mg,与此相比,除了施予il-33蛋白质以外还以10mg/kg腹腔内施予了作为中性纯化抗体的a26-1f02的群的脾脏重量为平均66±3mg。接着,在施予人il-33蛋白质的前一天(day-1),将碱纯化抗体仅皮下施予1次(sc,oneshot),进行评价。施予开始7天后(day7)、施予pbs代替人il-33蛋白质的群的脾脏重量为平均70mg,与此相比,除了施予il-33蛋白质以外还皮下施予了上述人controligg(10mg/kg)的群的脾脏重量为平均152mg。对此,图8如所示,除了施予il-33蛋白质以外还皮下施予了a25-3h04(1、3、5、10mg/kg)的群的脾脏重量分别为143、106、109、78mg,a25-3h04浓度依赖性(dose-dependent)地抑制了由炎症导致的脾脏重量的增加。与上述针对脾脏重量的抗炎症作用同样地,确认到由施予人il-33导致增加的血清中iga浓度、血清中ige浓度、血中的嗜中性细胞数、嗜碱性细胞数、嗜酸性细胞数、血清中il-5浓度也被a25-3h04抑制(图8)。根据以上的结果,确认到a25-3h04针对被il-33诱导的invivo的炎症反应呈现抑制作用。另外,测定了施予开始7天后(day7)的a25-3h04的小鼠血中浓度,结果,对应1、3、5、10mg/kg的施予,浓度分别为0.6、3.7、6.5、20.3μg/ml。其他的被测抗体(igg)的invivo的抗炎症作用也通过皮下施予(10mg/kg)以同样的方案进行评价。其结果如图9所示,皮下施予了人controligg的群的脾脏重量为平均181mg,与此相比,除了施予il-33蛋白质以外还皮下施予了各碱纯化抗体(a10-1c04、a23-1a05、a25-2c02、a26-1f02)的群的脾脏重量分别为82mg、92mg、100mg、77mg,抑制了由炎症导致的脾脏重量的增加。与上述针对脾脏重量的抗炎症作用同样地,确认到由施予人il-33导致增加的血清中iga浓度、血清中ige浓度、血中的嗜中性细胞数、嗜碱性细胞数、嗜酸性细胞数也被碱纯化抗体(a10-1c04、a23-1a05、a25-2c02、a26-1f02)抑制(图9)。根据以上的结果,确认到a25-3h04针对被il-33诱导的invivo的炎症呈现抑制作用,同样地,其他的被测抗体(a10-1c04、a23-1a05、a25-2c02、a26-1f02)也呈现了抗炎症作用。实施例14:针对由人il-33气管内施予诱导的肺障碍的作用的评价将il-33蛋白质气管内施予至小鼠,之后,采集支气管肺胞清洗液(balf),balf中总细胞数、嗜酸性细胞数、嗜中性细胞数增加,并可见气管上皮粘液增生。另外,也产生了balf中的il-4、5、6、13等细胞因子。通过将被测抗体(igg)腹腔内、皮下或者静脉内施予至该体系,可以评价被测抗体针对肺障碍的作用。实施例15:针对由人il-33鼻内施予诱导的气管过敏的作用的评价将il-33蛋白质鼻内施予至小鼠后,吸入乙酰甲胆碱,诱导气管过敏。通过将被测抗体(igg)腹腔内、皮下或者静脉内施予至该评价体系,可以评价被测抗体针对气管过敏的作用。实施例16:使用人il-33嵌入(knockin)小鼠的针对il-33作用的评价将螨抗原或木瓜蛋白酶(papain)滴鼻或气管内施予至人il-33嵌入小鼠后,诱发气管炎症,从该小鼠中回收balf,balf中的总细胞数增加すゐ。关于由螨抗原或木瓜蛋白酶导致的气管炎症,已知螨抗原或papain的蛋白酶活性引起il-33被从气管上皮细胞中释放(obokietal.,proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,2010,vol.107,p18581)。通过将被测抗体(igg)腹腔内、皮下或者静脉内施予至该评价体系,可以评价被测抗体针对由蛋白酶导致的气管炎症的作用、及针对被invivo诱导的il-33的作用。实施例17:针对lps腹腔内施予坏血病模型(model)中的炎症的作用的评价通过将lps腹腔内施予至人il-33嵌入小鼠,诱发坏血病(obokietal.,proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,2010,vol.107,p18581),在施予lps前将被测抗体(igg)腹腔内、皮下或者静脉内施予,可以评价被测抗体针对施予lps后的死亡率的作用。另外,在施予lps数小时以内,在血中以高浓度检测到il-6、tnf-α等炎症性细胞因子,通过测定这些浓度,可以评价被测抗体的抗炎症作用。实施例18:使用荷癌小鼠的针对癌症的invivo作用的评价将小鼠癌症细胞株、人癌症细胞株以对于各癌症细胞株而言适宜的细胞数小鼠通过皮下或静脉内的方式植入小鼠,并施予人il-33。将被测抗体(igg)腹腔内、皮下或者静脉内施予至该小鼠,植入癌症细胞株后,以体积、细胞数评价作为原发癌部位、转移病灶的脏器中的癌症细胞数,可以评价被测抗体针对癌症的作用。实施例19:抗体的胶体稳定性的评价利用动态光散射分析凝集物的有无,评价被测抗体(igg)的胶体稳定性。用vivaspin或vivaspinturbo(sartorius,10000至50000mwco)将各碱纯化抗体浓缩为约50mg/ml。于4℃实施离心,以合适的方式分别变更转数、时间。依次稀释被测抗体溶液,并使用200至250μl的试样,测定动态光散射(日机装,nanotracupaut-151),取得约1mg/ml至约50mg/ml的浓度范围中的数据。由200秒的累计数据算出抗体蛋白质的粒径分布,评价凝集物的有无。对于被测抗体(a10-1c04、a23-1a05、a25-2c02、a25-3h04、a26-1f02)而言,随着抗体浓度的增加,粒径分布中的10nm付近的峰向高粒径侧的移位程度非常轻微,另外,不存在不依赖于抗体浓度、源于不可逆的凝集物的粒径为数十nm以上的峰。根据以上的结果,确认了被测抗体的良好的胶体稳定性。为了定量地评价胶体稳定性,进行了相互作用参数(kd)的计算。表示扩散系数(与粒径成反比例)的浓度依赖性的相互作用参数是也被用于抗体等蛋白质高浓度制剂的处方设计的重要指标。据报道,相互作用参数的值如果高于-12.4ml/g,则由于斥力的相互作用,胶体稳定性优异,自缔合性低(saitoetal.,pharm.res.,2013.vol.30p1263)。用超滤膜将溶解于pbs(ph7.2)的被测抗体溶液浓缩为数10mg/ml,用相同的溶剂依次稀释2倍,用动态光散射测定装置(nanotracupaut151日机装)测定得到的试样的粒径。由得到的粒径通过以下的stokes-einstein式算出扩散系数。上式中,d为扩散系数(cm2/sec)、kb为玻尔兹曼常数(j/k)、t为热力学温度(k)、π为圆周率、η为稀释液粘度p(poise)、d为粒径(nm)。将扩散系数的浓度依赖性绘图,拟合为以下的计算式,从而求出相互作用参数。d=d0(1+kdc)d为通过stokes-einstein式得到的扩散系数,d0为无限稀释时的扩散系数,c为测定时的被测抗体的浓度(g/ml)。根据该数式算出拟合直线的斜率即相互作用参数(kd)。结果如下:a10-1c04为kd=-8.1ml/g(解析范围为0.41-63.7mg/ml)、a23-1a05为kd=-5.6ml/g(解析范围为0.40-61.8mg/ml)、a25-2c02为kd=-6.2ml/g(解析范围为0.43-66.3mg/ml)、a25-3h04为kd=-7.5ml/g(解析范围为0.34-56.5mg/ml)、a26-1f02为kd=-6.7ml/g(解析范围为0.35-62.7mg/ml),任一种抗体的相互作用参数均高于-12.4ml/g,胶体稳定性优异。实施例20:抗体的热力学稳定性的评价以免疫球蛋白结构域的折叠崩坏的温度(tm)评价被测抗体(igg)的热力学稳定性。按照附加文件,在数10μg/ml的被测抗体溶液中添加proteinthermalshiftdye(lifetechnologies),使用real-timepcr7500fast(lifetechnologies)以约1℃/min的速度使温度上升,并同时测定荧光强度。通过用proteinthermalshift(lifetechnologies)分析得到的数据,确定tm。需要说明的是,确认到多个tm时,以温度从低到高的顺序记为tm1、tm2。结果如下:使用中性纯化抗体时,a10-1c04为tm=73.9℃,a23-1a05为tm1=69.3℃、tm2=77.6℃,a25-2c02为tm1=69.3℃、tm2=80.3℃,a25-3h04为tm1=70.0℃、tm2=76.4℃,a26-1f02为tm=74.5℃。另外,使用碱纯化抗体时,a10-1c04为tm=73.7℃,a23-1a05为tm1=69.5℃、tm2=77.5℃,a25-2c02为tm1=69.5℃、tm2=80.4℃,a25-3h04为tm1=70.1℃、tm2=76.4℃,a26-1f02为tm=74.4℃。任一种抗体的tm均为65℃以上,呈现了良好的热力学稳定性。实施例21:抗体的保存稳定性的评价为了评价被测抗体(igg)的保存稳定性,将各碱纯化抗体以约10mg/ml的浓度溶解于柠檬酸缓冲液(50mm柠檬酸、150mmnacl(ph6.3)),于40℃保存4星期。为了评价保存后的抗体单体纯度,利用凝胶过滤分析(sec)及微芯片毛细管sds电泳(mce-sds)测定单体纯度,以及使用表面等离子共振测定抗原结合活性。将2个tskgelg3000swxl(tosoh)连结而成的柱安装于hplc装置(beckmansystemgold,126solventmanager,166detector,508autosampler),实施凝胶过滤分析。作为移动相溶剂,使用含有0.1m硫酸钠的0.1m磷酸缓冲液(ph6.7),以0.5ml/min的流量分离,检测在uv215nm下进行。将约10mg/ml的抗体保存溶液稀释为100倍,作为分析用试样,注入50μl该试样。通过凝胶过滤分析得到的单体纯度示于表13。任一种被测抗体(a10-1c04、a23-1a05、a25-2c02、a25-3h04、a26-1f02)均在于40℃保存4星期后,保持了90%以上的单体纯度,呈现了良好的保存稳定性。使用labchipgxii(perkinelmer)实施了毛细管(capillary)sds电泳。使用该装置专用的试剂盒htproteinexpressreagent(perkinelmer),按照制造商的标准方案在变性条件下实施还原。作为分析用试样,添加2μl约10mg/ml的抗体保存溶液。从上述试剂盒中取出用于电泳的试剂,加入专用的芯片htproteinexpresslabchip,version2(perkinelmer),按照用于抗体分析的内置方案htantibody200实施测定。如表13所示,即使在变性·还原条件下,任一种被测抗体(a10-1c04、a23-1a05、a25-2c02、a25-3h04、a26-1f02)也均在于40℃保存4星期后,保持了90%以上的单体纯度,呈现了良好的保存稳定性。为了调查是否形成了不依赖于保存后的抗体浓度的、不可逆的凝集体,实施了粒径测定。用柠檬酸缓冲液(50mm柠檬酸、150mmnacl(ph6.3))将抗体保存溶液稀释10倍(最终浓度:约1mg/ml),对于得到的分析用试样,通过动态光散射法(日机装,nanotracupaut-151)实施粒径测定。以累计时间200秒实施了测定。任一种被测抗体(a10-1c04、a23-1a05、a25-2c02、a25-3h04、a26-1f02、a00-0070、a00-0036)均在于40℃保存4星期后未检测到凝集体,取得了保存稳定性优异的抗体。为了调查保存后的抗原结合性能的有无,使用表面等离子共振装置biacoret200(gehealthcare)实施了抗原结合活性测定。使用胺偶联试剂盒(aminecouplingkit)(gehealthcare)将人il-33蛋白质(atgen,ilc0701)固定化于sensorchipcm5(gehealthcare)(固定化量为约3000至6000ru)。接着,用柠檬酸缓冲液(50mm柠檬酸、150mmnacl(ph6.3))将抗体保存溶液稀释10倍,用微量吸光光度计astrageneii(astranet)测定溶液中的总蛋白质浓度(蛋白质浓度:约1mg/ml)。用hbs-ep缓冲液(10mmhepes、150mmnacl、3mmedta、0.05%(v/v)surfactantp20(ph7.4))将已测定总蛋白质浓度的抗体溶液稀释1000倍,作为被分析物溶液。于25℃实施测定。将各种被分析物溶液添加36秒,得到结合相的传感图。以5μl/min、100μl/min的流速实施,针对在2种流速下得到的传感图,通过使用了数据解析程序(gehealthcare,biacoret200evaluationsoftwarev1.0)的calibrationfreeconcentrationanalysis求出具有抗原结合活性的抗体的浓度。作为对照,同样地测定于4℃保存4星期后的各种被测抗体的抗原结合活性,算出于40℃保存4星期后的被测抗体的抗原结合活性的比例。如表13所示,任一种被测抗体(a10-1c04、a23-1a05、a25-2c02、a25-3h04、a26-1f02)均在于40℃保存4星期后,保持了90%以上的单体纯度,呈现了良好的保存稳定性。表[13]实施例22:利用强制氧化的抗体稳定性的评价调查了氧化对于被测抗体(igg)的抗原结合活性的影响。在最终浓度为约1mg/ml的各种碱纯化抗体中添加过氧化氢水溶液(最终浓度为1%),使其于37℃氧化24小时。之后,添加80mm甲硫氨酸溶液终止氧化。接着,使用脱盐柱zebaspin(thermoscientific)将被测抗体溶液置换为pbs。与上述实施例21同样地,使用表面等离子共振装置biacoret200(gehealthcare)调查实施了氧化处理的被测抗体的抗原结合活性。算出氧化处理后的抗原结合活性相对于无氧化处理的各种被测抗体的抗原结合活性的比例,结果,就结合活性的保持比例而言,a10-1c04为83%,a23-1a05为95%,a25-2c02为100.5%,a25-3h04为98.7%,a26-1f02为89.5%。根据这些结果,任一种被测抗体(a10-1c04、a23-1a05、a25-2c02、a25-3h04、a26-1f02)均呈现了在1%过氧化氢水溶液处理的强制氧化中保持了80%以上抗原结合活性的稳定性。实施例23:由物理压力(搅拌)导致的凝集体形成的评价将被测抗体(igg)用pbs稀释为0.2mg/ml,通过在安装于aggregatessizer(岛津制作所)的批式池(batchcell)中搅拌施加物理压力。于室温使搅拌子上下运动30分钟(190次/分钟)后,用aggregatessizer测定40nm至20μm的凝集体浓度。使用碱纯化抗体时,由搅拌产生的凝集体浓度如下:a10-1c04为17.2μg/ml,a23-1a05为16.4μg/ml,a25-2c02为13.3μg/ml,a25-3h04为23.4μg/ml,a26-1f02为17.0μg/ml,任一种抗体的由物理压力诱导的凝集体形成均为15%以下,任一种被测抗体均对于物理压力稳定。实施例24:抗体的小鼠血中浓度推移的评价将荧光标记的被测抗体(igg)静脉内施予(3mg/kg)至雄性c57bl6小鼠(8~10周龄)(charlesriverjapan)后,通过检测血浆中的荧光,测定被测抗体的浓度。如图10所示,使用碱纯化抗体时,任一种被测抗体(a10-1c04、a23-1a05、a25-2c02、a25-3h04、a26-1f02)的消失半衰期(eliminationhalf-life)均为100小时以上,呈现了良好的血中稳定性。实施例25:猴血中浓度推移的评价将被测抗体(igg)静脉内施予(1mg/kg)至雄性食蟹猴(2~3岁)(hamrico.,ltd.)后,使用humantherapeuticigg1eiakit(caymanchemical,500910),测定血清中的被测抗体的浓度。将碱纯化抗体a10-1c04施予至2只食蟹猴(no.201、202),将碱纯化抗a23-1a05施予至1只食蟹猴(no.301)。如图11所示,a10-1c04的消失半衰期为16.56天(no.201)及11.40天(no.202),清除率(clearance)为3.598ml/day/kg(no.201)及5.451ml/day/kg(no.202)。另外,a23-1a05的消失半衰期为10.87天,清除率10.07ml/day/kg。任一种被测抗体均在食蟹猴中呈现了良好的血中稳定性。实施例26:抗体的免疫原性评价为了评价被测抗体(igg)的免疫原性,实施了invitrot细胞检测(lonza)。为了代表目标人口群体,将提供者人数设为50名,在源于从提供者采集的人末梢血的树突细胞中添加50μg/ml的各种碱纯化抗体,使树突细胞摄入抗体。另一方面,分离源于从相同的提供者采集的人末梢血的cd4阳性t细胞。之后,将两者,即摄入了被测抗体的树突细胞和cd4阳性t细胞共同培养,测定cd4阳性t细胞的反应(增殖)。作为阴性对照,使用不含有被测抗体的缓冲液(pbs)同样地实施,得到cd4阳性t细胞的反应,通过将二者比较,评价将抗体施予至人时的免疫原性风险。结果,未确认到任一种被测抗体(a10-1c04、a25-2c02、a25-3h04、a26-1f02)与阴性对照之间存在t细胞的反应的差异。实施例27:人组织交差反应性的评价通过免疫组织化学染色法,评价被测抗体(igg)与人组织(源于同一名提供者、满足fda及ema指南标准的35个组织的冰冻切片)的交差反应性(covancelaboratoriesltd.)。35个组织包括肾上腺、膀胱、血液细胞、骨髓、乳腺、小脑、大脑皮质、结肠、内皮细胞(血管)、眼球、输卵管、胃肠道(包括平滑肌)、心脏、肾脏(肾小球、肾小管)、肝脏、肺、淋巴结、卵巢、胰腺、甲状旁腺、腮腺、末梢神经、脑下垂体、胎盘、前列腺、皮肤、脊髓、脾脏、横纹肌、精巢、胸腺、甲状腺、扁桃体、输尿管、子宫(颈部、内膜)。其结果是,使用碱纯化抗体时,任一种被测抗体(a10-1c04、a23-1a05、a26-1f02、a25-2c02)均在il-33广范围表达的血管内皮细胞(阳性对照)中确认到强染色性。另外,在上皮·间质细胞·神经组织·肌组织·血细胞等各种组织中,确认了抗体与细胞质或者核的交差性,但在任一组织中均为确认到与细胞膜的交差反应性。根据ichs6(r1)指南及其他论文(toxicologicpathology2010,38(7):1138-1166),与抗体难以invivo到达的细胞质、核的交差反应性在毒性学上不具有显著意义。因此,未发现任一种被测抗体(a10-1c04、a23-1a05、a26-1f02、a25-2c02)存在毒性方面的顾虑。实施例28:a10-1c04及a25-3h04的表位区域的筛选抗il-33单克隆抗体a10-1c04及a25-3h04与上述实施例1中记载的pep14表位结合。对于20个氨基酸残基组成的pep14所含有的更短的连续氨基酸序列,通过使用呈现这样的氨基酸序列的噬菌体展示文库进行实验,发现了2种表位(ledesyeiyv(序列表中序列号426)及edesyeiyv(序列表中序列号427))。肽ledesyeiyv相当于序列表中序列号226所示的人il-33的残基138至残基147,肽edesyeiyv相当于序列表中序列号226所示的il-33的残基139至残基147。合成这些肽,通过与实施例9同样的kinexa实验,算出kd,作为与碱纯化抗体的亲和性(表14)。[表14]产业上的可利用性本发明的具有中和作用的抗体可以作为用于il-33相关疾病的诊断、治疗、预防或减轻的医药组合物使用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1