植物高温诱导基因AT3G56970的启动子在改良植物抗逆性中的应用的制作方法
植物高温诱导基因at3g56970的启动子在改良植物抗逆性中的应用
技术领域
[0001]
本发明涉及植物高温诱导基因at3g56970的启动子在改良植物抗逆性中的应用,属于植物基因工程领域。
背景技术:
[0002]
适宜的温度是植物正常生长发育的重要条件。植物在生长发育过程中会受到各种胁迫的影响,其中高温是对植物影响尤其严重的一种非生物胁迫。近几年来,随着温室效应加剧,全球气候变暖越来越严重。温度的逐渐上升,导致高温天气出现天数增多,影响植物有关调控机制的变化,例如出现早花、叶片萎蔫、光合效率下降。高温也是限制农作物产量的一个重要因素,甚至直接导致作物的死亡和绝产,这也是二十一世纪农业生产的新挑战。因此,解析植物耐受干旱胁迫的分子机制,培育高产、抗逆农作物新品种成为高度紧迫的重大问题。
[0003]
由于植物不能移动,植物为了应对各种生物和非生物的逆境胁迫,形成了一套不同于动物的特殊响应机制。当高温来临时,植物对高温胁迫应答的第一步为膜脂成分结构以及流动性等的改变,随后膜上钙离子通道受到膜成分改变的影响被激活,钙离子通道因此打开,钙离子由膜外流向膜内,细胞内钙离子浓度增加,信号激活完成。同时细胞内会产生其他一系列反应如活性氧地积累、酶类地失活、蛋白稳定性地改变等。植物为了适应高温,需要尽快构建细胞内的代谢和物质均衡,以便植物继续生存甚至在高温下繁殖。这种植物在短时间内适应高温的细胞内代谢和物质均衡是由热激信号转导来完成的。
[0004]
近些年来,对植物耐高温机理的研究热点主要集中在以下两个方向:
[0005]
(一)高温胁迫下植物根系的生理状态研究
[0006]
植物的根系是一个庞大的系统,承担了植物生长过程中很多重要的生理功能。植物的根能够为植物吸收水分和有机物,还能合成植物生长发育所需的多种物质。处于高温胁迫下的植物,最先感受到高温信号并做出相应的是植物的地上部分。而根系与地上部分之间存在复杂的信号传递网络,根系在接受到高温信号后,会发生一系列复杂的生理应答反应,如积累渗透调节物质、提高自身的渗透能力等,以降低高温对植物的迫害。
[0007]
(二)耐热性分子层面研究
[0008]
高温胁迫会导致植物体内过度积累活性氧。为防止活性氧伤害,植物形成一系列活性氧清除机制。其中酶促系统主要指过氧化物歧化酶,过氧化物酶和过氧化氢酶等。非酶促系统主要包括抗坏血酸、谷胱甘肽等,可保持原生质与外环境的平衡,保持膜结构的完整性,提高抗逆性。另外,脯氨酸、丙二醛、甜菜碱的含量是植物对逆境胁迫适应或抵抗能力的重要指标。
[0009]
高温诱导下植物自身产生的热激蛋白与细胞的耐热性密切相关。在较高温度下,热激转录因子可激活耐高温基因的转录。在高温处理过程中,热激转录因子的结构发生变化,包括热激转录因子的三聚化、磷酸化、核转位等,从而使得热激转录因子的活性大幅度
提高。热激转录因子处于活性状态的结构和热激元件高度契合,进而耐高温基因开始进行转录。
技术实现要素:
[0010]
本发明克服了上述现有技术的不足,提供植物高温诱导基因at3g56970的启动子在改良植物抗逆性中的应用,该启动子来源于哥伦比亚生态型拟南芥,可以作为特异性启动子驱动功能基因改良植物耐高温性状,可以提高植株对高温的抗逆性,避免生长负面效应。
[0011]
一种植物高温诱导基因at3g56970的启动子,其特征在于,核苷酸序列如seq id no.1所述。
[0012]
一种含有如权利要求1所述的启动子的重组载体,其特征在于,所述启动子的序列连接到pmdc163载体中。
[0013]
上述重组载体,其特征在于,所述pmdc163载体为下游含有β-葡萄糖苷酸酶基因(gus)标签的pmdc163载体。
[0014]
一组用于扩增如权利要求1所述的启动子的引物,其特征在于,包括正向引物和反向引物,所述正向引物的核苷酸序列如seq id no.2所述,所述反向引物的核苷酸序列如seq id no.3所述.
[0015]
上述启动子、重组载体或引物在启动耐高温基因表达中的应用,其特征在于,所述耐高温基因为基因at3g56970。
[0016]
上述启动子、重组载体或引物在改良植物抗逆性中的应用;所述抗逆性为耐高温性能;所述植物指拟南芥。
[0017]
上述启动子、重组载体或引物在培育耐高温植物中的应用;所述植物为拟南芥。
[0018]
有益效果:
[0019]
本发明提供了植物高温诱导基因at3g56970的启动子在构建转基因植物改良其抗逆性中的应用,所述的启动子可以作为特异性启动子驱动功能基因改良植物耐高温性状,从而获得耐高温的植株。提高植株对高温的抗逆性,避免生长负面效应。
附图说明
[0020]
图1高温处理下at3g56970的相对表达量(半定量pcr结果)。
[0021]
图2高温处理下at3g56970的相对表达量(qrt-pcr结果)。
[0022]
图3高温处理下标记基因的表达分析(gus染色结果)。
具体实施方式
[0023]
为了使本技术领域人员更好地理解本申请中的技术方案,下面结合实施例对本发明作进一步说明,所描述的实施例仅是本申请一部分实施例,而不是全部,本发明不受下述实施例的限制。
[0024]
实施例
[0025]
一、高温诱导型基因的获得
[0026]
(一)植物材料的培养方法:
[0027]
将哥伦比亚野生型拟南芥种子消毒后播在ms培养基上,黑暗下4℃春化2天,然后转到16小时光照/8小时黑暗条件下,18℃正常生长7天。
[0028]
(二)植物材料高温处理方法:
[0029]
将生长的拟南芥植株转到38℃高温下,分别处理0、3、12、48h。
[0030]
(三)植物总rna提取方法:
[0031]
1.在无rnase的1.5ml离心管中,加入150μl裂解液(使用前加入1%β-巯基乙醇),取50-100mg植物叶片,在裂解液中用匀浆器迅速研磨成匀浆,再加入300μl裂解液,涡旋剧烈震荡混匀,室温裂解5min。
[0032]
2.12,000rpm(~13,400
×
g)离心2min,将过滤柱放在收集管中,上清转移至过滤柱上,12,000rpm(~13,400
×
g)离心2min,小心吸取收集管中的上清400μl至无rnase的离心管中,吸头尽量避免接触收集管中的细胞碎片沉淀。
[0033]
3.加入200μl无水乙醇,混匀(此时可能会出现沉淀),将得到的溶液和沉淀一起转入吸附柱中,12,000rpm(~13,400
×
g)离心1min,倒掉收集管中的废液,将吸附柱放回收集管中。
[0034]
4.向吸附柱中加入350μl去蛋白液,12,000rpm(~13,400
×
g)离心1min。
[0035]
5.dnase i工作液的配制:取10μl dnase i储存液放入新的无rnase离心管中,加入70μl工作缓冲液,轻柔混匀。
[0036]
6.向吸附柱中央加入80μl的dnase i工作液,室温放置15min。12,000rpm(~13,400
×
g)离心1min,倒掉收集管中的废液,将吸附柱放回收集管中。
[0037]
7.向吸附柱中加入350μl去蛋白液,12,000rpm(~13,400
×
g)离心1min,倒掉收集管中的废液,将吸附柱放回收集管中。
[0038]
8.向吸附柱中加入500μl漂洗液(使用前加入3倍体积乙醇),室温静置2min,12,000rpm(~13,400
×
g)离心1min,倒掉收集管中的废液,将吸附柱放回收集管中。
[0039]
9.重复步骤8。
[0040]
10.12,000rpm(~13,400
×
g)离心2min,倒掉废液。将吸附柱置于室温放置3min,以彻底晾干吸附材料中残余的漂洗液。
[0041]
11.将吸附柱放入一个新的无rnase离心管中,向吸附膜的中间部位滴加30-100μl无rnase ddh2o,室温放置2min,12,000rpm(~13,400
×
g)离心2min,得到rna溶液。
[0042]
(四)高温诱导基因的筛选:
[0043]
将提取的对照组和处理组植株的总rna,利用rna高通量测序技术(深圳华大基因)筛选到一个高温诱导下显著高表达的基因,在拟南芥基因组数据库中查询得到该基因的基因座号为at3g56970。如表1所示,其表达可被高温高效诱导。
[0044]
表1高温处理下at3g56970的相对表达量(rna测序结果)
[0045][0046]
二、高温诱导基因at3g56970表达量的验证
[0047]
(一)植物材料的培养和高温处理方法:
[0048]
将野生型哥伦比亚拟南芥种子消毒后播在ms培养基上,4℃下避光春化2天,然后转到18℃条件下,以16小时光照/8小时黑暗培养7天。将生长的拟南芥植株转到38℃高温下,分别处理0、1、2、4、8、16h。
[0049]
(二)植物rna反转录成cdna:
[0050]
用前述方法提取植物总rna,以rna为模板进行反转录,具体方法如下:
[0051]
1.按以下成分配置反应体系:
[0052][0053]
2.混匀后,65℃保温5min后,冰上迅速冷却。
[0054]
3.按以下成分继续配置反应体系:
[0055][0056][0057]
4.缓慢混匀后,按下列条件进行反转录反应:
[0058]
42℃
ꢀꢀꢀꢀꢀ
60min
[0059]
95℃
ꢀꢀꢀꢀꢀ
5min
[0060]
冰上冷却 5min
[0061]
(三)半定量pcr:
[0062]
以合成的cdna为模板,以内源看家基因gapc为内参进行半定量pcr,反应体系如下:
[0063][0064]
(四)实时荧光定量pcr:
[0065]
以合成的cdna为模板,以内源看家基因gapc为内参进行实时荧光定量pcr,反应体系如下:
[0066][0067]
at3g56970的表达量如图2所示,其在高温诱导1、2、4、8和16h后,其表达量分别为正常温度下的2.21、1.95、2.26、4.49和30.58倍,证明该基因确实可被高温高效诱导。
[0068]
三、高温诱导基因at3g56970启动子序列的克隆
[0069]
在拟南芥相关公共数据库(https://www.arabidopsis.org/)上查找到at3g56970基因。选取该基因翻译起始密码子位点上游2210个碱基作为启动子区域(序列如seq id no:1)。
[0070]
以at3g56970_prof(5
’-
cggagggaaatgaaatag-3
’
)和at3g56970_pror(5
’-
tttttgcttaatcaaggacaag-3
’
)为引物扩增该启动子的全长序列。
[0071]
四、含启动子序列载体的遗传转化
[0072]
将含有启动子序列和下游gus标签的pmdc163载体转化至eha105宿主农杆菌。
[0073]
通过农杆菌介导的拟南芥遗传转化将其导入到拟南芥哥伦比亚型中,转化共获得30株独立的转基因拟南芥植株。具体步骤:将抽薹的植物上已开的花和角果剪掉,保留未开放的花蕾;将要转化植物的农杆菌接种到含有卡那霉素50mg/l的lb(luria-bertani)液体培养基中,28℃220rpm过夜培养至od
600
约为1.6;室温下6000rpm离心10min收集菌体;倒掉上清,加入等体积浸染液(5.0%蔗糖溶液+0.025%(v/v)silwet-l77)重悬菌体;重悬好的菌液放入培养皿中,将拟南芥的花茎在浸染液中充分浸泡;转化完毕的植株浇水并用塑料袋罩住保湿暗培养,约12h后去掉塑料袋正常培养;转化3周后收取转基因材料种子,在含潮霉素20mg/l的1/2ms培养基上筛选获得的t1代转基因阳性苗,t1代植株自交一代收取t2代种子,通过t2代抗性分离比可以确定各株系转基因插入的拷贝数;自交一代收取t3代种子,通过抗性分离比选择纯合的t3代转基因株系。
[0074]
五、gus染色验证启动子能被高温诱导
[0075]
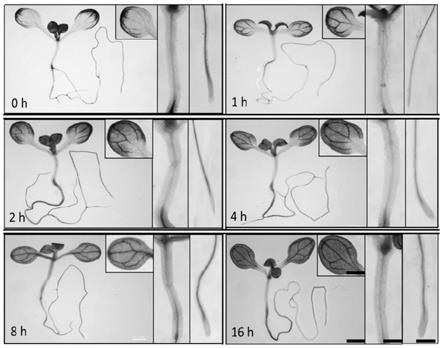
为进一步验证上述启动子能被高温诱导,我们将t3代纯合的转基因株系在1/2ms培养基上于22℃光照培养10天,然后转到38℃下高温处理转基因材料0、1、2、4、8、16h后,对植株进行gus染色。具体步骤为:将植物材料放置于90%的丙酮中固定20min,用漂洗液漂洗3次,加入gus染液进行染色处理。染色结束后,用70%乙醇脱色完全后,用显微镜记录结果。如图3所示,pat3g56970::gus在子叶中表达,高温处理2h后表达开始被增强,在高温处理4h时,莲座叶及根毛区gus染色程度最大。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1