在水相中催化不对称Aldol反应合成β-羟基羰基化合物的方法与流程
在水相中催化不对称aldol反应合成
β-羟基羰基化合物的方法
技术领域
[0001]
本发明属于医药中间体的制备领域,具体涉及一种全-(6-氨基)-环糊精在水相中高效催化不对称aldol反应合成β-羟基羰基化合物的方法。
背景技术:
[0002]
超分子化学是一门新兴的交叉学科,主要涵盖化学、材料学、药学及生物学等研究领域,其中超分子催化作为超分子化学的重要组成部分,是指经历识别、组装后对底物进行化学转化的一个过程,是一种模拟天然酶的催化方式。
[0003]
环糊精(cyclodextrins,cds)是直链淀粉在芽孢杆菌产生的环糊精葡萄糖基转移酶作用下生成的一系列天然环状低聚糖,研究较多且具有实际意义的是含有6-8个葡萄糖的α-、β-和γ-环糊精。环糊精官能团的差异性分布致使环糊精出现外部亲水内部疏水的结构特性。环糊精及其衍生物可用于催化水相反应,避免使用有毒和昂贵的试剂。毋庸置疑环糊精的优点很明显(来源经济、无毒、反应条件温和),是一种具有很大发展潜力的催化剂。
[0004]
然而,在已报道的环糊精及其衍生物作为催化剂催化的化学反应中,研究较多的是环糊精在水相中对反应速率及其化学选择性和区域选择性的调控,而对其催化立体选择性反应的报道则十分少见。pitchumani小组利用6-位全氨基化的β-环糊精进行了几种不对称催化反应研究([1]p.suresh,k.pitchumani,tetrahedron asym.2008,19,2037
–
2044.;[2]k.kanagaraj,p.suresh,k.pitchumani,org.lett.2010,12,4070
–
4073.[3]k.kanagaraj,k.pitchumani,j.org.chem.2013,78,744
–
751.),包括michael反应、henry反应和二氢喹诺酮及4h-苯并吡喃的不对称合成,可获得较好的对映选择性结果。但这些反应的底物范围较小,且反应类型比较单一。全-(6-氨基)-环糊精在水相中催化不对称aldol反应的例子尚未见报道。另外,全-(6-氨基)-α-环糊精和全-(6-氨基)-γ-环糊精也未被开发成手性催化剂,与全-(6-氨基)-β-环糊精相比,它们具有不同的结构和性质,特别是空腔大小和水溶性有显著不同,因而很可能适合于不同的底物范围甚至不同反应类型。
[0005]
羟醛缩合反应(aldol反应)是一类重要的有机反应,是指具有α-氢的醛或酮,在酸或碱催化下,与另一分子醛或酮发生亲核加成反应生成β-羟基醛或β-羟基酮,在实际生产中应用广泛。但该反应常在有机试剂中进行,不可避免的对环境造成了一定的污染,与当今绿色化学的理念相悖。
[0006]
水相aldol反应之前已经有一些文献进行报道([1]c
ó
rdova a,notz w,barbas c f iii.chem.commun.,2002,3024-3025;[2]mase n,nakai y,ohara n,et al.j.am.chem.soc.,2006,128:734-735;[3]mase n,noshiro n,mokuya a,et al.adv.synth catal.2009,351:2791-2796;[4]chen x h,luo s w,tang z,et al.chem.eur.j.,2007,13:689-701.)。在这些报道中,除了底物范围较小以外,往往不是单一的水作为溶剂,而需要添加二甲基亚砜(dmso)或四氢呋喃(thf)等有机溶剂形成混合溶剂,或是需要添加等催化量的添加剂三氟乙酸、亦或是需要添加表面活性剂十八烷酸等。仅
用水或水的缓冲溶作为溶剂,全-(6-氨基)-环糊精做催化剂催化不对称aldol反应还未有过报道。
技术实现要素:
[0007]
本发明提供了一种在水相中催化不对称aldol反应高效合成β-羟基羰基化合物的方法,该方法是在水相中,以全-(6-氨基)-环糊精作为催化剂,在15℃~30℃下催化等摩尔量的酮与醛进行不对称aldol反应,反应结束后有机溶剂萃取,有机相依次用水、饱和食盐水洗涤,加入无水硫酸钠或无水硫酸镁干燥,硅胶柱纯化,nmr、ms等鉴定结构,hplc分析,获得β-羟基羰基化合物;
[0008]
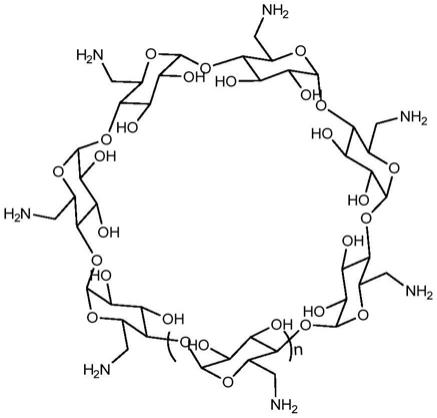
所述全-(6-氨基)-环糊精的结构通式如下:
[0009][0010]
其中n=0、1、2。
[0011]
当催化剂为全-(6-氨基)-α-环糊精时,酮为脂肪酮,醛为脂肪醛;即酮选自丙酮、丁酮、2-戊酮、2-己酮、2-庚酮;醛选自乙醛、丙醛、丁醛、环丁基醛、环己基醛。
[0012]
当催化剂为全-(6-氨基)-β-环糊精时,酮为脂肪酮,醛为芳香醛,酮选自丙酮、丁酮、2-戊酮、2-己酮、2-庚酮;醛选自苯甲醛、对硝基苯甲醛、对氨基苯甲醛、对氟苯甲醛、间碘苯甲醛、邻甲基苯甲醛、邻甲氧基苯甲醛、间羟基苯甲醛、邻氰基苯甲醛。
[0013]
当催化剂为全-(6-氨基)-γ-环糊精时,酮为脂肪酮或芳香酮,醛为芳香醛;酮选自丙酮、苯乙酮、环己酮;醛选自2-萘甲醛、1-羟基-2-萘醛、1-硝基-2-萘醛、6-乙氧基-2-萘醛、2-甲氧基-1-萘醛、2,3-二甲氧基-1-萘醛、9-蒽甲醛、5-吲哚甲醛、菲尼酮。
[0014]
所述水相为纯水或ph 6~8的磷酸盐缓冲溶液。
[0015]
所述全-(6-氨基)-环糊精的添加量为酮或醛摩尔量的10~40%。
[0016]
所述反应时间为2h~10h。
[0017]
本发明方法以高收率和高对映体过量值(ee%)生成β-羟基羰基化合物,且反应溶剂绿色环保;该方法所用的全-(6-氨基)-环糊精具有以下优点:(1)外部亲水内部疏水的结构特性,它们的空腔具有疏水性,能够在水相中提供疏水性环境,与反应底物结合,作为水相反应容器;使得环糊精能够在水相中均匀地溶解,并表现出“有机相”的特性将反应物容纳在空腔中;(2)6-位氨基一方面可通过共价作用活化底物,另一方面可作为氢键供体与底
物形成氢键从而固定底物位置,使亲核试剂从特定的方向进攻羰基碳,进而生成特定构型的产物;(3)三种不同尺寸空腔的环糊精可匹配不同尺寸的底物,从而扩大底物范围。
[0018]
本发明方法具有反应条件温和、收率高、对映选择性高、底物范围广等特点,在药物分子及其中间体的生产中具有较大的应用潜能。
附图说明
[0019]
图1是全-(6-氨基)-α-环糊精的核磁共振氢谱(1h nmr);
[0020]
图2是全-(6-氨基)-β-环糊精的核磁共振氢谱(1h nmr);
[0021]
图3是全-(6-氨基)-γ-环糊精的核磁共振氢谱(1h nmr);
[0022]
图4是(r)-4-羟基-4-(4-硝基苯基)-2-丁酮的核磁共振氢谱(1h nmr);
[0023]
图5是(r)-4-羟基-4-(4-硝基苯基)-2-丁酮的核磁共振碳谱(
13
c nmr);
[0024]
图6是4-羟基-4-(4-硝基苯)-2-丁酮消旋体的hplc谱图;
[0025]
图7是全-(6-氨基)-β-环糊精在水相中催化不对称aldol反应合成的4-羟基-4(4-硝基苯)-2-丁酮的hplc谱图。
具体实施方式
[0026]
以下结合实施例对本发明进行详细的描述,但本发明并不限于实施例所公开的内容。
[0027]
实施例1:全-(6-氨基)-α-环糊精的制备
[0028]
(1)称取三苯基膦12.12g,加入到50ml的dmf中,然后在搅拌下缓慢地加入12.27g的碘单质,搅拌0.25h,随后再加入干燥的α-环糊精3.0g,n2保护,70℃下搅拌19h;反应结束后旋蒸掉2/3体积的dmf,然后加入3mol/l的甲醇钠甲醇溶液淬灭,用丙酮沉淀,干燥得全(6-i)α-环糊精4g,收率80%;
[0029]
(2)取上一步产物4g溶解到60ml的dmf中,加入叠氮钠1.593g,60℃下搅拌20h;反应结束后浓缩,滴入纯水里沉淀,抽滤,滤饼用水洗三次,烘干得全(6-n3)α环糊精2.28g,收率83%;
[0030]
(3)取2.75g全(6-n3)α环糊精溶解到47ml dmf中,加入10.15g的三苯基膦,搅拌2h后加入8ml的25%浓氨水,室温下继续搅拌18h;浓缩后滴入无水乙醇中,抽滤,滤饼用无水乙醇洗三遍,烘干得产物2.35g,收率88%。
[0031]
核磁共振氢谱如图1所示:1h nmr(600mhz,d2o)δ5.20(d,6h,j=2.8mhz),4.27-4.32(m,6h),4.02(m,6h),3.60-3.72(m,12h),3.47-3.53(m,6h),3.27-3.36(m,6h)。
[0032]
实施例2:全-(6-氨基)-β-环糊精的制备
[0033]
(1)称取三苯基膦40.1g,加入到160ml的dmf中,然后在搅拌下缓慢地加入40.5g的碘单质,随后再加入干燥的β环糊精11.6g,n2保护,70℃下搅拌20h;反应结束后旋蒸掉大部分dmf,然后加入3m的甲醇钠甲醇溶液淬灭,用丙酮沉淀,干燥得全(6-i)β环糊精17.9g,收率92%;
[0034]
(2)取上一步产物4.5g溶解到60ml的dmf中,加入叠氮钠1.5g,60℃下搅拌20h;反应结束后浓缩到10ml,滴入纯水里沉淀,抽滤,滤饼用水洗三次,烘干得全(6-n3)β环糊精2.78g,收率92.6%;
[0035]
(3)取2.6g全(6-n3)β环糊精溶解到50ml dmf中,加入8.27g的三苯基膦,搅拌1h后加入11ml的25%浓氨水,室温下继续搅拌18h;浓缩至15ml后滴入无水乙醇中,抽滤,滤饼用无水乙醇洗三遍,烘干得产物2.1g,收率94.2%;
[0036]
核磁共振氢谱如图2所示:1h nmr(600mhz,d2o)δ3.12-3.20(m,7h),3.35(dd,j=3.08,13.50hz,7h),3.48(t,j=9.30hz,7h),3.58(dd,j=3.43,10.06hz,7h),3.86(t,j=9.6hz,7h),4.04-4.14(m,7h),5.07(d,j=3.45hz,7h)。
[0037]
实施例3:全-(6-氨基)-γ-环糊精的制备
[0038]
(1)称取三苯基膦20.2g,加入到40ml的dmf中,然后在搅拌下缓慢地加入19.55g的碘单质,搅拌0.5h,随后再加入干燥的γ-环糊精5.0g,n2保护,70℃下搅拌24h;反应结束后旋蒸掉大部分dmf,然后加入3m的甲醇钠甲醇溶液淬灭,用丙酮沉淀,干燥得全(6-i)γ-环糊精6.76g,收率81%;
[0039]
(2)取上一步产物2.21g溶解到20ml的dmf中,加入叠氮钠0.73g,60℃下搅拌20h;反应结束后浓缩到10ml,滴入纯水里沉淀,抽滤,滤饼用水洗三次,烘干得全(6-n3)-γ-环糊精1.42g,收率93%;
[0040]
(3)取0.5g全(6-n3)γ-环糊精溶解到6ml dmf中,加入1.58g的三苯基膦,搅拌2h后加入1.64ml的25%浓氨水,室温下继续搅拌24h;浓缩后滴入无水乙醇中,抽滤,滤饼用无水乙醇洗三遍,烘干得产物0.413g,收率96%;
[0041]
核磁共振氢谱如图3所示:1h nmr(600mhz,d2o)δ3.20
–
3.25(m,8h),3.38
–
3.42(m,8h),3.58(t,j=9.6hz,8h),3.67(dd,j=10.0,3.6hz,8h),3.96(t,j=9.6hz,8h),4.07
–
4.11(m,8h),5.20(d,j=3.6hz,8h)。
[0042]
实施例4:全-(6-氨基)-β-环糊精催化的不对称aldol反应
[0043]
在2ml纯水里加入112.7mg(0.1mmol)的全-(6-氨基)-β-环糊精,然后加入74μl(1mmol)的丙酮,120mg(1mmol)的对硝基苯甲醛,25℃下搅拌2h;随后加入乙酸乙酯萃取,有机层依次用水、饱和食盐水洗涤,然后加入无水硫酸钠干燥,旋干;用硅胶柱过柱,分离纯化,即得(r)-4-羟基-4-(4-硝基苯基)-2-丁酮的最终纯品167mg,收率81%;
[0044]
核磁共振氢谱和碳谱如图4和5所示:1h nmr(600mhz,cdcl3)δ8.22(d,j=8.7hz,2h),7.55(d,j=8.5hz,2h),5.27(dt,j=7.6,3.5hz,1h),3.65(d,j=3.3hz,1h),2.91
–
2.79(m,2h),2.23(s,3h).
13
c nmr(151mhz,cdcl3)δ208.64,149.91,147.28,68.88,51.49,30.74。
[0045]
hplc:ad-h手性柱,流动相正己烷:异丙醇=80:20,流速1ml/min;结果如图7所示:t
r
=9.3min,t
s
=10.3min,ee值为98%,与其消旋体hplc谱图(图6)对比。
[0046]
实施例5:全-(6-氨基)-α-环糊精催化的不对称aldol反应
[0047]
在2ml纯水里加入193.3mg(0.2mmol)的全-(6-氨基)-α-环糊精,然后加入74μl(1mmol)的丙酮,58mg(1mmol)的丙醛,15℃下搅拌6h;随后加入乙酸乙酯萃取,有机层依次用水、饱和食盐水洗涤,然后加入无水硫酸钠干燥,旋干;用硅胶柱过柱分离纯化,即得最终的纯品92.8mg,收率80%,ee值为95%。
[0048]
实施例6:全-(6-氨基)-β-环糊精催化的不对称aldol反应
[0049]
在2ml纯水里加入338.1mg(0.3mmol)的全-(6-氨基)-β-环糊精,然后加入74μl(1mmol)的丙酮,120mg(1mmol)的对硝基苯甲醛,25℃下搅拌8h;随后加入乙酸乙酯萃取,有
机层用水、饱和食盐水洗涤,然后加入无水硫酸钠干燥,旋干。用硅胶柱过柱,分离纯化,即得最终的纯品180mg,收率87%,ee值为99%。
[0050]
实施例7:全-(6-氨基)-γ-环糊精催化的不对称aldol反应
[0051]
在2ml纯水里加入386.6mg(0.3mmol)的全-(6-氨基)-γ-环糊精,然后加入74μl(1mmol)的丙酮,156mg(1mmol)的2-萘甲醛,25℃下搅拌5h,随后加入乙酸乙酯萃取,有机层用水、饱和食盐水洗涤,然后加入无水硫酸钠干燥,旋干,用硅胶柱过柱分离纯化,即得最终的纯品200mg,收率87%,ee值为97%。
[0052]
实施例8:全-(6-氨基)-β-环糊精催化的不对称aldol反应
[0053]
在2ml磷酸盐缓冲溶液(ph 8)里加入450.8mg(0.4mmol)的全-(6-氨基)-β-环糊精,然后加入74μl(1mmol)的丙酮,120mg(1mmol)的对硝基苯甲醛,30℃下搅拌8h,随后加入乙酸乙酯萃取,有机层用水、饱和食盐水洗涤,然后加入无水硫酸钠干燥,旋干,用硅胶柱过柱分离纯化,即得最终的纯品190mg,收率90%,ee值为91%。
[0054]
实施例9:全-(6-氨基)-γ-环糊精催化的不对称aldol反应
[0055]
在2ml纯水里加入515.5mg(0.4mmol)的全-(6-氨基)-γ-环糊精,然后加入90μl(1mmol)的丁酮,156mg(1mmol)的2-吲哚甲醛,25℃下搅拌10h,随后加入乙酸乙酯萃取,有机层用水、饱和食盐水洗涤,然后加入无水硫酸镁干燥,旋干,用硅胶柱过柱,分离纯化,即得最终的纯品210mg,收率87%,ee值为97%。
[0056]
实施例10:全-(6-氨基)-γ-环糊精催化的不对称aldol反应
[0057]
在2ml磷酸盐缓冲溶液(ph 6)里加入257.7mg(0.2mmol)的全-(6-氨基)-γ-环糊精,然后加入90μl(1mmol)的丁酮,162mg(1mmol)的菲尼酮,25℃下搅拌5h,随后加入乙酸乙酯萃取,有机层用水、饱和食盐水洗涤,然后加入无水硫酸钠干燥,旋干;用硅胶柱过柱,分离纯化,即得最终的纯品220mg,收率88%,ee值为99%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1