一种以木薯渣水解液为碳源生产ε-聚赖氨酸的方法与流程
一种以木薯渣水解液为碳源生产
ε-聚赖氨酸的方法
技术领域
[0001]
本发明涉及一种以木薯渣水解液为碳源生产ε-聚赖氨酸的方法,属于发酵技术领域。
背景技术:
[0002]
ε-聚赖氨酸(ε-poly-l-lysine,ε-pl)由25-35个l-赖氨酸残基通过α-羧基与ε-氨基的缩合作用聚合形成的一种同聚物。ε-pl具有很强的抑菌能力,对细菌、酵母菌、霉菌等,都具有良好的抑制作用。同时,ε-pl具有良好水溶性、热稳定性高、可食用、可降解以及对人和环境无毒害等优点。因此,ε-pl作为一种优良的天然食品防腐剂,已相继被日本、韩国、美国、中国和欧洲等国家和地区批准其在食品工业中使用。ε-pl可用作吸水材料、药物和基因载体、乳化剂等,因此ε-pl具有广阔的应用市场和重要的潜在商业价值。
[0003]
目前,ε-pl主要由小白链霉菌(streptomyces albulus)或其他链霉菌发酵生产,该法最早是由日本科研人员所开发。如,2001年kahar et al.利用s.albulus s410,以葡萄糖为碳源,通过营养成分流加技术结合两阶段ph调控策略,获得了当时48.3g/l的最高ε-pl产量,在随后十多年时间里保持为最高值。随后,许多研究人员相继通过各种方法来提高其产量。如孙启星等人(2015年)提出了在补料阶段利用调节ph值和流加酵母粉方法,实现ε-pl产量达到41.32g/l。2015年,ren等提出了“ph冲击”策略,以葡萄糖和甘油为碳源,经过192h,菌株s.sp.m-z18的ε-pl产量达到57.4g/l。xu等(2018年),将铵离子转运蛋白基因导入s.albulus pd-1,以葡萄糖为碳源,使ε-pl产量提升至35.7g/l。最近,wang et al.(2018年)通过六种抗生素抗性突变,筛到ε-pl摇瓶产量达4.41g/l的诱变株r6,利用葡萄糖和甘油为碳源及优化发酵工艺,在5l罐中获得70.3g/l产物,为目前报道的发酵法生产ε-pl的最高产量。
[0004]
上述研究显著提高了ε-pl的产量,为其工业化生产奠定了坚实的基础。但是,ε-pl生产成本仍然偏高。其中原因之一,是目前使用的碳源以葡萄糖或甘油为主,消耗的碳源成本占培养基成本的70%以上。因此,寻找廉价的碳源用于ε-pl生产,降低其生产成本是非常有必要的。
[0005]
木薯在非洲、东南亚和拉丁美洲等地区广泛种植,在中国南方地区的年产量高达911万吨。木薯渣是木薯淀粉工业的主要废料,就中国广西地区而言,每年都会有100余万吨的湿木薯渣产生。木薯渣通常用作低值的动物饲料,或填埋于垃圾场而产生二次污染。木薯渣主要含淀粉和纤维素成分,其中淀粉含量可达干重的40%-70%。因此,将其中的淀粉水解为可发酵糖,应用于微生物发酵极具潜力。已有文献报道,以木薯渣水解液为碳源发酵生产琥铂酸、生物油脂、丁醇等多种生物产品。但是,目前尚未见利用木薯水解液来生产ε-pl的报道。
技术实现要素:
[0006]
为解决上述问题,本发明提供一种以木薯渣水解液为碳源生产ε-聚赖氨酸的方
法。本发明利用“α-淀粉酶、糖化酶和纤维素酶”依次对木薯渣进行水解,获得含有一定量葡萄糖的木薯渣水解液(简称水解液),以该水解液为碳源进行分批或补料分批发酵,能有效生产ε-聚赖氨酸。
[0007]
本发明的第一个目的是提供一种以木薯渣水解液为碳源生产ε-聚赖氨酸的方法,所述方法是在ε-聚赖氨酸发酵过程中,以木薯渣水解液作为发酵培养基和/或补料培养基中的碳源。
[0008]
进一步地,所述的木薯渣水解液采用水解酶酶解,再经过滤、浓缩得到。
[0009]
进一步地,所述的水解酶包括α-淀粉酶、糖化酶、纤维素酶中的一种或多种。
[0010]
进一步地,具体的,所述的酶解是依次采用α-淀粉酶、糖化酶、纤维素酶进行酶解,其中,α-淀粉酶的添加量为木薯渣粉末重量的0.5-5%,水解条件为70-90℃、ph 5.0-7.0,水解反应1-3h;糖化酶的添加量为木薯渣粉末重量的0.1-1%,水解条件为50-60℃、ph 4-5,反应1-3h;纤维素酶的添加量为木薯渣粉末重量的0.5-2%,水解条件为40-60℃、ph 4.0-6.0,反应20-30h。
[0011]
进一步地,所述的发酵培养基中,木薯渣水解液的添加量以葡萄糖浓度计,控制葡萄糖浓度为10-70g/l。
[0012]
进一步地,所述的发酵培养基中还包括酵母粉3-7g/l,(nh4)2so
4 8-12g/l,硫酸镁0.3-0.7g/l,磷酸氢二钾0.5-1.0g/l,磷酸二氢钾1.2-1.4g/l,硫酸亚铁0.01-0.05g/l和硫酸锌0.02-0.06g/l。
[0013]
进一步地,所述的补料培养基中,木薯渣水解液的添加量以葡萄糖浓度计,控制葡萄糖浓度为100-800g/l。
[0014]
进一步地,所述的补料培养基中还包括硫酸铵60-150g/l和鱼粉80-160g/l。
[0015]
进一步地,所述的发酵过程是将ε-聚赖氨酸生产菌按照5-15%接种量接种至发酵培养基中,在温度为28-36℃,转速为180-700rpm,溶氧为18-40%条件下进行发酵。
[0016]
进一步地,所述的发酵过程所采用的ε-聚赖氨酸生产菌为白色链霉菌、禾粟链霉菌、吸水链霉菌、灰褐链霉菌或稠李链霉菌。
[0017]
进一步地,所述的发酵过程为分批发酵或补料分批发酵;分批发酵时,包括采用ph调控,包括如下步骤:当ph从初始的6-7自然下降至3.5-4.0,维持ph在3.5-4.0直至分批发酵结束;补料分批发酵时,包括采用ph调控,包括如下步骤:当ph从初始的6-7自然下降到4.5-5.5,ph在4.5-5.5维持6-10h;然后,待ph自然下降至3.5-4.0,维持ph在3.5-4.0直至补料分批发酵结束。
[0018]
进一步地,ph调控采用浓度为10.0%-26.0%的氨水进行调控。
[0019]
进一步地,所述的补料分批发酵时,当发酵液中葡萄糖浓度下降到设定值后,自动流加浓缩水解液和混合氮源溶液,使葡萄糖浓度控制5-15g/l和氨基氮浓度控制在0.5-1.5g/l。
[0020]
本发明的有益效果:
[0021]
(1)本发明以低值木薯渣的水解液为碳源,替代价格较高的其他碳源,有效发酵生产ε-pl,既能提升木薯渣利用价值,又可以减轻其给环境带来的污染,因此具有重要的现实意义和较明显的经济价值。(2)在相同条件下,利用水解液摇瓶和罐分批发酵ε-聚赖氨酸的最高产量,比葡萄糖分别高17.9%和24.6%;在补料分批发酵过程中,ε-聚赖氨酸最高产量
达37.41g/l,具有较高的经济效益。
附图说明
[0022]
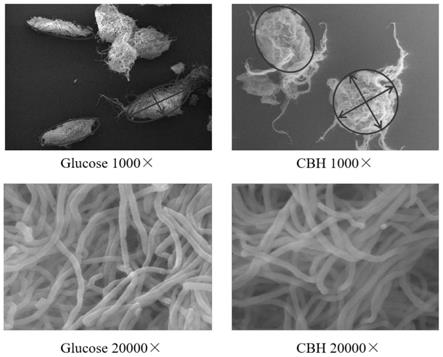
图1是发酵至24h时的扫描电镜显微图;
[0023]
图2是发酵液内蛋白质浓度;
[0024]
图3是在两种碳源中关键的酶活性变化。
具体实施方式
[0025]
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
[0026]
发酵菌株:ε-pl生产菌,具体本发明选用的是白色链霉菌。
[0027]
发酵(m3g)培养基(g/l):葡萄糖50,酵母粉5,(nh4)2so
4 10,硫酸镁0.5,磷酸氢二钾0.8,磷酸二氢钾1.36,硫酸亚铁0.03,硫酸锌0.04,ph 6.8,121℃灭菌20min。
[0028]
cbh培养基:将m3g培养基中的葡萄糖用木薯渣水解液(cbh)替换,其中葡萄糖含量为50g/l,其余成分同m3g培养基。
[0029]
其中葡萄糖浓度和木薯渣水解液用量可根据实验要求进行调整。
[0030]
0.75mmol/l甲基橙溶液:将重结晶并冻干后甲基橙精确称量0.491g,用蒸馏水溶解并定容至2l,转移纸棕色细口瓶内,4℃避光保存备用。
[0031]
ε-聚赖氨酸含量测定采用甲基橙比色法,精确称取1gε-聚赖氨酸标准品,使用磷酸缓冲溶液溶解并定容至500ml,分别吸取ε-聚赖氨酸溶液0、2、4、6、8、10、12、14、16ml,加蒸馏水补足至20ml。将不同浓度的ε-聚赖氨酸溶液同甲基橙试剂按1:1体积比例混合,避光水浴震荡(200rpm,30℃,30min),后离心去沉淀。上清稀释10倍后检测od
465
,制作标准曲线。
[0032]
实施例1:木薯渣水解液制备
[0033]
木薯渣预处理:将块状的木薯渣彻底烘干,用粉碎机研磨30min,直至木薯渣变为粉末状(50-100μm)。然后分别采用酸水解法和酶法水解法对粉末进行水解处理:
[0034]
酸水解:将10g木薯渣粉末和90ml 0.1n的hcl或h2so4溶液混匀,装入250ml的锥形瓶中,并将该混合物置于灭菌锅中,121℃水解15min。
[0035]
酶法水解:分为三组进行酶解反应,分别在烧杯内加入200g木薯渣粉末和1800ml蒸馏水,然后加入α-淀粉酶、糖化酶和纤维素酶进行酶法水解;分为三组进行酶解反应,第一组为依次添加α-淀粉酶和糖化酶,第二组为只添加纤维素酶进行反应,第三组为依次添加α-淀粉酶、糖化酶和纤维素酶进行反应。
[0036]
α-淀粉酶的添加量为1%(w/w,kg淀粉酶/kg干木薯渣粉末),水解条件为86℃、ph 6.0,反应2h;糖化酶的添加量为0.2%,水解条件为55℃、ph 4.5,反应2h;纤维素酶的添加量为0.9%(w/w),水解条件为48℃、ph 5.0,反应24h。
[0037]
将水解完的木薯渣混合液经过纱布过滤、离心,随后测定上清液中的还原糖、葡萄糖含量,并采用gc-ms对上清液中的副产物进行分析。再经浓缩得浓缩水解液。最后,实现木薯渣水解液中的葡萄糖产量和得率分别为45.6g/l和0.341g/g。
[0038]
表1木薯渣水解液还原糖、葡萄糖含量
[0039][0040]
实施例2:
[0041]
在250ml摇瓶中装有40ml发酵培养基,以木薯渣水解液为碳源,其中葡萄糖含量为50g/l,将培养24h的4ml种子液接种到发酵培养基中,发酵温度控制在30℃,摇床转速控制在180rpm,发酵时间控制在72h。最后,实现ε-pl产量和菌体量分别为1.19g/l和6.09g/l。
[0042]
对比例1:
[0043]
在250ml摇瓶中装有40ml发酵培养基,以葡萄糖为碳源(对照试验),含量为50g/l,将培养24h的4ml种子液接种到发酵培养基中,发酵温度控制在30℃,摇床转速控制在180rpm,发酵时间控制在72h。最后,实现ε-pl产量和菌体量分别为1.12g/l和4.89g/l。
[0044]
实施例3:
[0045]
在250ml摇瓶中装有40ml发酵培养基,以木薯渣水解液为碳源,其中葡萄糖含量为30g/l,将培养24h的4ml种子液接种到发酵培养基中,发酵温度控制在30℃,摇床转速控制在180rpm,发酵时间控制在72h。最后,实现ε-pl产量和菌体量分别为1.34g/l和6.89g/l。
[0046]
对比例2:
[0047]
在250ml摇瓶中装有40ml发酵培养基,以葡萄糖为碳源,含量为30g/l,将培养24h的4ml种子液接种到发酵培养基中,发酵温度控制在30℃,摇床转速控制在180rpm,发酵时间控制在72h。最后,实现ε-pl产量和菌体量分别为1.10g/l和4.91g/l。
[0048]
实施例4:
[0049]
在250ml摇瓶中装有40ml发酵培养基,以木薯渣水解液为碳源,其中葡萄糖含量为20g/l,将培养24h的4ml种子液接种到发酵培养基中,发酵温度控制在30℃,摇床转速控制在180rpm,发酵时间控制在72h。最后,实现ε-pl产量和菌体量分别为1.25g/l和6.43g/l。
[0050]
实施例5:
[0051]
以含50g/l葡萄糖的木薯渣水解液为碳源,在5l发酵罐中装3l发酵培养基进行分批发酵,将0.3l培养24h的种子液接种到发酵培养基中,ph值调至7.0。在发酵过程中,发酵温度控制在30℃,搅拌转速控制在180rpm,通气量控制在0.3vvm,溶氧控制在20%以上,罐内压强控制在0.03mpa(表压)。在发酵前期,使ph自发下降到3.8-4.2之后,通过自动流加氨水溶液,将ph维持在设定值,发酵时间为72-104h,直至发酵结束。最终,实现ε-pl产量和菌体量分别为3.22g/l和9.86g/l。
[0052]
对比例3:
[0053]
以50g/l葡萄糖为碳源,在5l发酵罐中装3l发酵培养基进行分批发酵,将0.3l培养24h的种子液接种到发酵培养基中,ph值调至7.0。在发酵过程中,发酵温度控制在30℃,搅拌转速控制在180rpm,通气量控制在0.3vvm,溶氧控制在20%以上,罐内压强控制在0.03mpa(表压)。在发酵前期,使ph自发下降到3.8-4.2之后,通过自动流加氨水溶液,将ph
维持在设定值,发酵时间为72-96h,直至发酵结束。最终,实现ε-pl产量和菌体量分别为2.59g/l和6.95g/l。
[0054]
实施例6:
[0055]
以含30g/l葡萄糖的木薯渣水解液为碳源,在5l发酵罐中装3l发酵培养基进行分批发酵,将0.3l培养24h的种子液接种到发酵培养基中,ph值调至7.0。在发酵过程中,发酵温度控制在30℃,搅拌转速控制在180rpm,通气量控制在0.3vvm,溶氧控制在20%以上,罐内压强控制在0.03mpa(表压)。在发酵前期,使ph自发下降到3.8-4.2之后,通过自动流加氨水溶液,将ph维持在设定值,发酵时间为72-104h,直至发酵结束。最终,实现ε-pl产量和菌体量分别为2.72g/l和9.37g/l。
[0056]
实施例7:
[0057]
以含40g/l葡萄糖的木薯渣水解液为碳源,在5l发酵罐中装3l发酵培养基进行分批发酵,将0.3l培养24h的种子液接种到发酵培养基中,ph值调至7.0。在发酵过程中,发酵温度控制在30℃,搅拌转速控制在180rpm,通气量控制在0.3vvm,溶氧控制在20%以上,罐内压强控制在0.03mpa(表压)。在发酵前期,使ph自发下降到3.8-4.2之后,通过自动流加氨水溶液,将ph维持在设定值,发酵时间为72-104h,直至发酵结束。最终,实现ε-pl产量和菌体量分别为3.39g/l和10.17g/l。
[0058]
实施例8:
[0059]
以含40.1g/l葡萄糖的木薯渣水解液为碳源,在5l发酵罐中装3l初始发酵培养基先进行分批发酵,将0.3l培养24h的种子液接种到初始发酵培养基中,ph值调至7.0。在发酵过程中,发酵温度控制在30℃,搅拌转速控制在180rpm,通气量控制在0.3vvm,溶氧控制在20%以上,罐内压强控制在0.03mpa(表压)。ph调节采用三段ph调控方法,即,当ph从初始的6.8自然下降到5.0;接着,维持ph在5.0约8h;随后,待ph自然下降至3.8,通过自动流加氨水维持ph在3.8,直至发酵结束。
[0060]
当发酵液中残留的葡萄糖浓度降为15g/l以下时,自动流加灭菌后浓缩的含600g/l葡萄糖的木薯渣水解液,使发酵液中葡萄糖浓度控制在15g/l左右;同时,自动流加灭菌后含80g/l硫酸铵和100g/l鱼粉的混合氮源溶液,使其中氨基氮浓度维持在1g/l左右。发酵200h后结束,获得最高ε-pl产量和菌体量分别为32.50g/l(184h)和37.89g/l(144h),ε-pl产率为4.23g/l/d。
[0061]
实施例9:
[0062]
以含39.4g/l葡萄糖的木薯渣水解液为碳源,在5l发酵罐中装3l初始发酵培养基,将0.3l培养24h的种子液接种到初始发酵培养基中,ph值调至7.0。在发酵过程中,发酵温度控制在30℃,搅拌转速控制在180rpm,通气量控制在0.3vvm,溶氧控制在20%以上,罐内压强控制在0.03mpa(表压)。ph调节采用三段ph调控方法,即,当ph从初始的6.8自然下降到5.0;接着,维持ph在5.0约8h;随后,待ph自然下降至3.8,通过自动流加氨水维持ph在3.8,直至发酵结束。
[0063]
当发酵液中残留的葡萄糖浓度降为10g/l以下时,自动流加灭菌后浓缩的含600g/l葡萄糖的木薯渣水解液,使发酵液中葡萄糖浓度控制在10g/l左右;同时,自动流加灭菌后含80g/l硫酸铵和100g/l鱼粉的混合氮源溶液,使其中氨基氮浓度维持在1g/l左右。发酵200h后结束,获得最高ε-pl产量和菌体量分别为37.41g/l(200h)和41.58g/l(184h),ε-pl
产率为4.49g/l/d。
[0064]
实施例10:
[0065]
取实施例3和对比例2,两种培养基条件下,5l发酵罐发酵至24h时的菌丝球进行形态观察,1000
×
扫描电镜结果如图1所示,结果显示,在葡萄糖培养基中菌丝的核心部分更多的表现为椭圆形,而在木薯渣水解液培养基中,菌丝的核心部分呈圆形,这一现象产生的原因可能与菌丝体需要抵御木薯水解液培养基中的不利成分有关,而圆形的菌丝球更加有利于菌丝体生长,因此,木薯水解液培养基中具有较高的菌体量。另外,木薯水解液培养基中的菌丝体更为完整,几乎未发现断裂菌丝,而葡萄糖培养基中的菌丝体出现了少量断裂,这也影响了葡萄糖培养基中菌体量的增长。另一方面,在葡萄糖培养基中的多个菌丝球出现了聚集的现象,而水解液中的菌丝球则较为分散,而细胞聚集影响营养成分的扩散和氧的传递,进而影响菌体的生长和产物的合成。综上,我们推测水解液培养基中ε-pl产量的提升与较高的菌体量和较为分散的菌丝球分布有关。
[0066]
此外,通过检测培养基上清液中蛋白质的浓度可以表征菌丝体的裂解程度,结果如图2,当发酵进行到约40h,葡萄糖培养基内的蛋白浓度要明显高于水解液中,表明发酵后期葡萄糖培养基内菌丝体的裂解确实要比水解液中更多,同样证明水解液培养基中的菌丝体相对更为完整。而完整的菌丝体形态也是菌体正常生长和产物持续合成的基础。
[0067]
取实施例3和对比例2,两种培养基条件下,间隔取样测定了菌体生长及产物合成过程中的几个关键酶活:6-磷酸葡萄糖脱氢酶(g6pdh)、磷酸烯醇式丙酮酸羧化酶(pepc)、天冬氨酸激酶(ask)和ε-聚赖氨酸合成酶(pls)。结果如图3所示,结果表明水解液培养基中的酶活力较葡萄糖培养基中均有不同程度的提高,说明由于水解液中其他副产物的作用,使菌种的生理代谢得到了明显的提高,有助于增加如前体l-赖氨酸等中间代谢产物的供应,以及提高用于产物聚合的ε-聚赖氨酸合成酶的活性,最终增加ε-pl的生产。
[0068]
实施例11:
[0069]
取实施例1中木薯渣水解液,利用气相色谱-质谱仪(先采用固相微萃取法萃取水解液)分析其中的挥发性副产物,检测到了数十种微量的副产物成分,主要有酚类、弱有机酸和醇类化合物。其中酚类化合物以酸、酮和醛类三种不同的形式存在。但呋喃衍生物很少,仅仅检测到了四氢呋喃。
[0070]
其中主要副产物成分为6-戊基-α-吡喃酮(6pp)。本发明首次在水解液中检测到6pp,从其结构及来源分析,该副产物应为木薯在生长过程中形成的代谢产物。在较低浓度时,6pp对白色链霉菌生长和ε-pl形成具有一定的促进作用。这也可能是在相同葡萄糖浓度下,利用木薯渣水解液为碳源时的ε-pl发酵产量比利用葡萄糖更高的原因之一。
[0071]
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1