核酸酶At_NrnCM及其编码基因与应用的制作方法
核酸酶at_nrncm及其编码基因与应用
技术领域
[0001]
本发明属于生物技术领域,具体涉及核酸酶at_nrncm及其编码基因与应用。
背景技术:
[0002]
核苷酸(nt)是构成核糖核酸和脱氧核糖核酸的基本组成单位。随着动物营养研究的深入,人们对核苷酸在饲料中的作用有了进一步的认识。核苷酸是一种重要的营养物质,外源添加的核苷酸对于水产动物的生长发育、应激耐受以及免疫获得都起到重要作用。外源核苷酸对幼鱼肠细胞的分化生长同样起到非常重要的作用。核苷酸还可以通过对巨噬细胞作用,调节其吞噬作用,增强鱼类机体的非特异性免疫功能,提高抗病能力、减少应激反应。同时,核苷酸还是一种重要的诱食剂,核苷酸本身具有强烈鲜味刺激水产动物味觉,在不同蛋白源替代鱼粉的产品中作为添加剂改善饲料风味,可改善水产动物摄食。
[0003]
核酸酶是一种可催化水解核酸碳原子羟基与磷酸之间的磷酸二酯键,将其水解为核苷酸的酶制剂。酶解法是目前核苷酸生产的主流方法,使用核酸酶可进一步提高饲料原料如酵母抽提物中的核苷酸含量,起到增强营养改善饲料风味的作用。
[0004]
目前应用于核苷酸生产的核酸酶主要是从桔青霉(penicillium citrinum t.)中提取的核酸酶p1(nuclease p1,aab19975),该酶主要的底物是单链dna和单链rna。而酵母核糖核酸中dna一般由双链构成,rna一般由单链构成,因此需要开发既能降解双链dna又能降解单链rna的核酸酶。农杆菌at_nrnc既能降解单链rna,又能降解单链dna和双链dna,可以应用于酶解酵母原料制备酵母核酸酶。
[0005]
农杆菌at_nrnc在实际生产应用中,存在低温和低ph下的酶解效率较低的问题。因此,提高at_nrnc核酸酶在低温和低ph下的酶解效率可改善其在室温和酵母抽提物生产常用酸性条件下的降解效率,可有效地增加产能降低成本,使该核酸酶更适用于生产应用。
技术实现要素:
[0006]
本发明的目的为提供一种耐低温和低ph的核酸酶。
[0007]
本发明首先保护核酸酶at_nrncm,可为c1)或c2):
[0008]
c1)氨基酸序列如seq id no:1所示的蛋白质;
[0009]
c2)在c1)所示的蛋白质的n端或/和c端连接标签得到的融合蛋白质。
[0010]
上述核酸酶at_nrncm中,在0-30℃和/或ph3.0-6.0条件下,核酸酶at_nrncm的酶活高于核酸酶at_nrnc。所述酶活可为核糖核酸酶酶活和/或脱氧核糖核酸酶酶活。
[0011]
上文中,核酸酶at_nrnc来自agrobacterium fabrum str.c58,uniprot accession number为a9cg28。核酸酶at_nrnc的第43位由q变为r、第88位由v变为k、第90位由f变为k、第91位由h变为r、第160位由l变为k、第161位由h变为p和第162位由a变为p,得到核酸酶at_nrncm。核酸酶at_nrncm和核酸酶at_nrnc的同源性达到97%。
[0012]
本发明还保护编码所述核酸酶at_nrncm的核酸分子。
[0013]
所述核酸分子的核苷酸序列可如seq id no:2所示。
[0014]
本发明还保护含有所述核酸分子的表达盒、重组载体或重组微生物。
[0015]
本发明还保护上述任一所述核酸酶at_nrncm、上述任一所述核酸分子或含有上述任一所述核酸分子的表达盒、重组载体或重组微生物在制备核酸酶中的应用。
[0016]
上述应用中,在0-30℃和/或ph3.0-6.0条件下,所述核酸酶的酶活高于核酸酶at_nrnc。所述酶活可为核糖核酸酶酶活和/或脱氧核糖核酸酶酶活。
[0017]
上述任一所述酶活可为相对酶活。
[0018]
本发明还保护上述任一所述核酸酶at_nrncm、上述任一所述核酸分子或含有上述任一所述核酸分子的表达盒、重组载体或重组微生物在生产核苷酸中的应用。所述核苷酸可为脱氧核糖核苷酸和/或核糖核苷酸。
[0019]
上述应用中,所述生产核苷酸的原料可为饲料酵母。
[0020]
本发明还保护上述任一所述核酸酶at_nrncm、上述任一所述核酸分子或含有上述任一所述核酸分子的表达盒、重组载体或重组微生物在提高核苷酸含量中的应用。所述核苷酸可为脱氧核糖核苷酸和/或核糖核苷酸。
[0021]
本发明还保护上述任一所述核酸酶at_nrncm、上述任一所述核酸分子或含有上述任一所述核酸分子的表达盒、重组载体或重组微生物在制备饲料添加剂中的应用。
[0022]
本发明还保护一种饲料添加剂,其含有上述任一所述核酸酶at_nrncm、上述任一所述核酸分子或含有上述任一所述核酸分子的表达盒、重组载体或重组微生物。
[0023]
所述饲料添加剂具体可由上述任一所述核酸酶at_nrncm、上述任一所述核酸分子或含有上述任一所述核酸分子的表达盒、重组载体或重组微生物组成。
[0024]
上述任一所述核苷酸可为酵母核苷酸。
[0025]
实验证明,在最适反应条件下,核酸酶at_nrnc的脱氧核糖核酸酶酶活为83.7u/ml,核糖核酸酶酶活为44.2u/ml;核酸酶at_nrncm的脱氧核糖核酸酶酶活为91.3u/ml,核糖核酸酶酶活性为43.7u/ml。由此可见,在最适反应条件下,核酸酶at_nrnc和核酸酶at_nrncm的酶活水平相当。但核酸酶at_nrncm在低温、低ph反应体系中的相对酶活较核酸酶at_nrnc均有明显的增加,具体如下:在30℃反应温度下,以dna或rna为底物,核酸酶at_nrncm的相对酶活分别由核酸酶at_nrnc的9.49%或30.94%提高到54.86%或47.51%;在ph3和ph6时,以dna为底物,核酸酶at_nrncm的相对酶活分别为34.05%和53.76%,而核酸酶at_nrnc的相对酶活仅15.40%和37.74%;在ph3时,以rna为底物,核酸酶at_nrncm和at_nrnc的相对酶活分别为31.53%核酸酶和20.28%。此外核酸酶at_nrncm在室温环境中的热稳定性也有一定程度的提升。核酸酶at_nrncm在低温酶活和低ph酶活的增高,更适宜于工业发酵满足饲料生产等生产需求。
[0026]
由此可见,核酸酶at_nrncm与核酸酶at_nrnc相比,酶活无明显变化,最适温度、最适ph不变,在低温和低ph环境中的稳定性有较大的提高,有助于提高饲料酵母原料酶解生产酵母核苷酸的效率,促进酵母核苷酸的生产。核酸酶at_nrncm更适合作为生产应用中的饲料添加剂,可广泛应用于包括水产动物在内的动物饲料领域。本发明具有重要的应用价值。
附图说明
[0027]
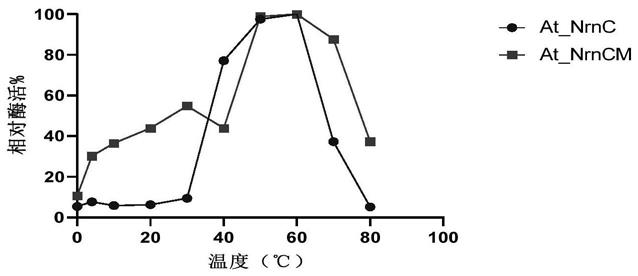
图1为在底物为dna下核酸酶at_nrnc和核酸酶at_nrncm的最适反应温度。
[0028]
图2为在底物为rna下核酸酶at_nrnc和核酸酶at_nrncm的最适反应温度。
[0029]
图3为在底物为dna下核酸酶at_nrnc和核酸酶at_nrncm的温度稳定性。
[0030]
图4为在底物为rna下核酸酶at_nrnc和核酸酶at_nrncm的温度稳定性。
[0031]
图5为在底物为dna下核酸酶at_nrnc和核酸酶at_nrncm的最适反应ph。
[0032]
图6为在底物为rna下核酸酶at_nrnc和核酸酶at_nrncm的最适反应ph。
[0033]
图7为在底物为dna下核酸酶at_nrnc和核酸酶at_nrncm的金属离子稳定性。
[0034]
图8为在底物为rna下核酸酶at_nrnc和核酸酶at_nrncm的金属离子稳定性。
具体实施方式
[0035]
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
[0036]
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0037]
扩增宿主trans1-t1 phage chemically comptent cell(以下简称trans1)和表达宿主bl21(de3)chemically competent cell(以下简称bl21)的感受态细胞均为北京全式金公司的产品。
[0038]
lb培养基的溶质及其浓度为1%蛋白胨、1%nacl和0.5%酵母提取物,溶剂为水,ph值为7.0。
[0039]
tb培养基:将11.8g蛋白胨和23.6g酵母提取物用900ml去离子水溶解,然后加入5ml 80%(v/v)甘油水溶液,混匀,115℃30min灭菌;待冷却至60℃以下时,加入磷酸盐溶液,混匀。
[0040]
pbs缓冲液为pbs干粉配置。pbs干粉为北京雪杰特科技有限公司的产品。
[0041]
实施例1、at_nrncm突变体(即核酸酶at_nrncm)和at_nrncm基因的获得
[0042]
本发明的发明人通过对野生型at_nrnc(uniprot accession number a9cg28,来自agrobacterium fabrum str.c58,或称为核酸酶at_nrnc)进行氨基酸残基位点突变,获得at_nrncm突变体。at_nrncm突变体的氨基酸序列如seq id no:1所示,其与野生型at_nrnc的同源性为97%。
[0043]
与野生型at_nrnc相比,at_nrncm突变体的如下氨基酸残基位点发生了突变:q43r、v88k、f90k、h91r、l160k、h161p和a162p;即野生型at_nrnc的第43位由q变为r、第88位由v变为k、第90位由f变为k、第91位由h变为r、第160位由l变为k、第161位由h变为p和第162位由a变为p,得到at_nrncm突变体。
[0044]
采用软件(网址为http://www.jcat.de/)对at_nrncm突变体的氨基酸序列进行密码子优化,获得编码at_nrncm突变体的基因(命名为at_nrncm基因)。at_nrncm基因的核苷酸序列如seq id no:2所示。
[0045]
实施例2、核酸酶at_nrnc和核酸酶at_nrncm的表达和纯化
[0046]
一、重组质粒的构建
[0047]
1、将pet-28a(+)载体多克隆位点处的开放阅读框替换为at_nrnc基因(编码野生
型at_nrnc),保留c端的his6-tag以便后期检测与纯化,得到重组质粒pet-28a_at_nrnc。
[0048]
2、将pet-28a(+)载体多克隆位点处的开放阅读框替换为at_nrncm基因(编码at_nrncm突变体),保留c端的his6-tag以便后期检测与纯化,得到重组质粒pet-28a_at_nrncm。
[0049]
二、重组大肠杆菌bl21/pet-28a_at_nrnc和重组大肠杆菌bl21/pet-28a_at_nrncm的构建
[0050]
1、将重组质粒pet-28a_at_nrnc通过化学转化法转化至trans1感受态细胞,之后涂布于含kana的lb固体平板上,筛选获得若干阳性单克隆。
[0051]
2、分别以阳性单克隆为模板,采用通用引物t7:5
’-
taatacgactcactataggg-3’和t7 terminator:5
’-
gctagttattgctcagcgg-3’组成的引物对进行pcr扩增,得到pcr扩增产物。
[0052]
3、将pcr扩增产物测序。根据测序结果,选择pcr扩增产物中含有at_nrnc基因的核苷酸序列的阳性单克隆进行后续实验。
[0053]
4、将步骤3筛选出来的阳性单克隆接种于lb液体培养基,37℃、200rpm振荡培养8h,得到培养液;之后采用质粒中提试剂盒(天根生化)提取质粒,并通过化学转化的方法转化至bl21感受态细胞,得到重组大肠杆菌bl21/pet-28a_at_nrnc。
[0054]
5、将重组质粒pet-28a_at_nrncm通过化学转化法转化至trans1感受态细胞,之后涂布于含kana的lb固体平板上,筛选获得若干阳性单克隆。
[0055]
6、分别以阳性单克隆为模板,采用通用引物t7:5
’-
taatacgactcactataggg-3’和t7 terminator:5
’-
gctagttattgctcagcgg-3’组成的引物对进行pcr扩增,得到pcr扩增产物。
[0056]
7、将pcr扩增产物测序。根据测序结果,选择pcr扩增产物中含有at_nrncm基因的核苷酸序列的阳性单克隆进行后续实验。
[0057]
8、将步骤7筛选出来的阳性单克隆接种于lb液体培养基,37℃、200rpm振荡培养8h,得到培养液;之后采用质粒中提试剂盒(天根生化)提取质粒,并通过化学转化的方法转化至bl21感受态细胞,得到重组大肠杆菌bl21/pet-28a_at_nrncm。
[0058]
三、核酸酶at_nrnc和核酸酶at_nrncm的表达和纯化
[0059]
1、诱导表达
[0060]
将重组大肠杆菌(重组大肠杆菌bl21/pet-28a_at_nrnc或重组大肠杆菌bl21/pet-28a_at_nrncm)单克隆接种于20ml含有50μg/μl卡那霉素的lb液体培养基,37℃、200rpm培养过夜,得到培养菌液1;之后培养菌液1以1%接种量接种于tb培养基,37℃、200rpm振荡培养至对数期中期;最后加入0.05%的iptg(异丙基-β-d-硫代半乳糖苷),16℃诱导表达12h,得到培养菌液2;将培养菌液2 8000rpm离心,收集菌体。
[0061]
2、蛋白纯化
[0062]
(1)取步骤1收集的菌体,加入pbs缓冲液重悬,之后200w超声破碎40min,8000rpm离心,收集上清,即为粗蛋白液。
[0063]
(2)采用亲和层析法纯化蛋白,具体步骤如下:4℃条件下,将粗蛋白液与镍柱结合1h,之后依次用浓度为10mm、20mm、50mm咪唑的洗脱缓冲液洗脱(每次均弃洗脱液,目的为去除杂蛋白),最后用浓度为200mm咪唑的洗脱缓冲液洗脱,收集3个柱体积的过柱溶液,过柱
溶液中含有目的蛋白。
[0064]
(3)将1ml过柱溶液和2ml丙酮混合,-80℃静置30min;之后12000rpm离心30min,收集沉淀,用sds-page检测蛋白大小。
[0065]
将剩余的过柱溶液先进行透析(目的为去除盐离子),再使用peg吸附法浓缩。
[0066]
选用10kb透析袋进行透析,将透析袋剪成适合长度,用2%naco
3-1mmol/l edta溶液及蒸馏水分别煮沸10min,蒸馏水清洗透析袋,将收集的缓冲液装入袋中,以蒸馏水为透析液透析24h。
[0067]
使用peg吸附法浓缩为将蛋白液浓缩至原发酵液体积的5%,再将浓缩后的蛋白液收集至50ml离心管中,使用冻干法获得目的蛋白冻干粉。
[0068]
当重组大肠杆菌为重组大肠杆菌bl21/pet-28a_at_nrnc时,获得的目的蛋白为核酸酶at_nrnc。
[0069]
当重组大肠杆菌为重组大肠杆菌bl21/pet-28a_at_nrncm时,获得的目的蛋白为核酸酶at_nrncm。
[0070]
实施例3、核酸酶at_nrnc和核酸酶at_nrncm的酶学性质研究
[0071]
一、以dna为底物检测核酸酶at_nrncm的最适温度
[0072]
用蒸馏水稀释待测核酸酶(核酸酶at_nrnc或核酸酶at_nrncm),得到浓度为1mg/ml的待测核酸酶溶液。
[0073]
1、制备30个反应体系。每个反应体系为300μl,由150μl 0.15mg/ml小牛胸腺dna溶液、100μl ph8.0、tris-hcl缓冲液、20μl待测核酸酶溶液和30μl浓度为25mm的mgcl2溶液组成。将30个反应体系随机分为10组,每组3个平行。
[0074]
检测各个反应体系在260nm处的吸光值,记为a0。
[0075]
2、完成步骤1后,将各组反应体系分别置于0℃、4℃、10℃、20℃、30℃、40℃、50℃、60℃、70℃或80℃反应1h;然后再次检测各个反应体系在260nm处的吸光值,记为a。
[0076]
3、按照公式(u/mg=(a-a0)
×
1000
×
f/t(f=50,f为稀释系数;t=60,t为反应时间))计算酶活,按组取平均值。以酶活最高值为标准值100%,计算各个反应体系的温度下相对酶活,确定酶反应最适温度。
[0077]
检测结果见图1。结果表明,核酸酶at_nrnc和核酸酶at_nrncm在底物为dna条件下酶反应最适温度均为60℃;与核酸酶at_nrnc相比,核酸酶at_nrncm在低温条件下酶活性有明显的提高;核酸酶at_nrnc在0-30℃条件下,酶活仅为最适温度下酶活的5.49%到9.49%;核酸酶at_nrncm在0-30℃条件下,酶活可达到最适温度下酶活的10.71%到54.86%。
[0078]
二、以rna为底物检测核酸酶at_nrncm的最适温度
[0079]
按照步骤一的方法,将0.15mg/ml小牛胸腺dna溶液替换为0.15mg/ml酵母rna溶液,其它步骤均不变。
[0080]
检测结果见图2。结果表明,核酸酶at_nrnc和核酸酶at_nrncm酶在底物为rna条件下酶反应最适温度均为60℃;与核酸酶at_nrnc相比,核酸酶at_nrncm在低温条件下酶活性有明显的提高;核酸酶at_nrnc在0-30℃条件下,酶活仅为最适温度下酶活的3.76%到30.94%;核酸酶at_nrncm在0-30℃条件下,酶活可达到最适温度的9.39%到47.51%。
[0081]
步骤一和步骤二的结果表明,与核酸酶at_nrnc相比,核酸酶at_nrncm在0-30℃条
件下的相对酶活普遍提高了最适酶活的5.22%到37.65%,对于常温下酶活的提升具有显著效果。核酸酶at_nrncm更适应于实际生产过程中的反应条件。
[0082]
三、以dna为底物检测核酸酶at_nrncm的热稳定性
[0083]
用蒸馏水稀释待测核酸酶(核酸酶at_nrnc或核酸酶at_nrncm),得到浓度为1mg/ml的待测核酸酶溶液。
[0084]
1、将待测核酸酶溶液分别置于4℃、20℃、30℃、60℃或70℃处理0min、10min、30min、60min或90min。
[0085]
2、制备反应体系。每个反应体系为300μl,由150μl 0.15mg/ml小牛胸腺dna溶液、100μl ph8.0、tris-hcl缓冲液、20μl经过步骤1处理过的待测核酸酶溶液和30μl浓度为25mm的mgcl2溶液组成。共25组处理酶溶液,每组三个平行。检测各个反应体系在260nm处的吸光值,记为a0。
[0086]
3、完成步骤2后,将各个反应体系置于60℃反应1h;然后再次检测各个反应体系在260nm处的吸光值,记为a。
[0087]
4、按照公式(u/mg=(a-a0)
×
1000
×
f/t(f=50,f为稀释系数;t=60,t为反应时间))计算酶活,按组取平均值。以处理0min酶活为标准值,计算各处理组酶活占标准值百分比,确定酶热稳定性。
[0088]
检测结果见图3(a为核酸酶at_nrnc,b为核酸酶at_nrncm)。结果表明,核酸酶at_nrncm在60℃、70℃环境下不稳定,热处理90min基本丧失酶活;核酸酶at_nrncm在30℃、20℃、4℃稳定性较强,30℃处理90min酶活性可达到56.80%;核酸酶at_nrnc在60℃、70℃处理60min基本丧失酶活,30℃处理90min活性为初始活性的21.29%。
[0089]
四、以rna为底物检测核酸酶at_nrncm的热稳定性
[0090]
按照步骤三的方法,将0.15mg/ml小牛胸腺dna溶液替换为0.15mg/ml酵母rna溶液,其它步骤均不变。
[0091]
检测结果见图4(a为核酸酶at_nrnc,b为核酸酶at_nrncm)。结果表明,核酸酶at_nrnc在4℃、20℃环境较为稳定,随着温度升高,酶稳定性逐渐降低;30℃时酶处理90min酶活仅为21.29%。核酸酶at_nrncm在60℃、70℃处理下酶活丧失活性较快,而在发酵常用的低温环境下具有更好的稳定性,30℃处理90min酶活可达处理初始酶活的的43.79%。
[0092]
步骤三和步骤四的结果表明,与核酸酶at_nrnc相比,核酸酶at_nrncm在室温环境中的热稳定性有一定程度的提升。
[0093]
五、以dna为底物检测核酸酶at_nrncm的最适ph
[0094]
用蒸馏水稀释待测核酸酶(核酸酶at_nrnc或核酸酶at_nrncm),得到浓度为1mg/ml的待测核酸酶溶液。
[0095]
待测ph缓冲液为ph3.0 250mm缓冲液、ph4.0 250mm缓冲液、ph5.0 250mm缓冲液、ph6.0 250mm缓冲液、ph7.0 250mm缓冲液1、ph7.0 250mm缓冲液2、ph8.0 250mm缓冲液、ph9.0 250mm缓冲液1、ph9.0 250mm缓冲液2或ph10.0 250mm缓冲液。其中,ph3.0 250mm缓冲液、ph4.0 250mm缓冲液、ph5.0 250mm缓冲液、ph6.0 250mm缓冲液和ph7.0 250mm缓冲液1为磷酸二氢钠-柠檬酸缓冲液,ph7.0 250mm缓冲液2、ph8.0 250mm缓冲液和ph9.0 250mm缓冲液1为tris-盐酸缓冲液,ph9.0 250mm缓冲液2和ph10.0 250mm缓冲液为甘氨酸-氢氧化钠缓冲液。
[0096]
1、制备30个反应体系。每个反应体系为300μl,由150μl 0.15mg/ml小牛胸腺dna溶液、100μl待测ph缓冲液、20μl待测核酸酶溶液和30μl浓度为25mm的mgcl2溶液组成。10种待测ph缓冲液分别设置3个平行。
[0097]
检测各个反应体系在260nm处的吸光值,记为a0。
[0098]
2、完成步骤1后,将各个反应体系置于60℃反应1h;然后再次检测各个反应体系在260nm处的吸光值,记为a。
[0099]
3、按照公式(u/mg=(a-a0)
×
1000
×
f/t(f=50,f为稀释系数;t=60,t为反应时间))计算酶活,按组取平均值。
[0100]
以酶活最高值为标准值100%,计算各个反应体系的ph下相对酶活,确定最适ph。
[0101]
检测结果见图5(a为核酸酶at_nrnc,b为核酸酶at_nrncm)。结果表明,核酸酶at_nrncm在底物为dna时最适ph为8.0;随着ph的升高和降低,酶活降低。与核酸酶at_nrnc相比,核酸酶at_nrncm在低ph环境中保持了较高的酶活性,ph3.0时酶活可达到最适ph酶活的34.05%;ph4.0、ph5.0时相对酶活分别可达到46.59%和47.31%。核酸酶at_nrnc随着缓冲液ph值的降低酶活迅速降低,ph5.0时酶活仅为最适ph下酶活的15.58%。
[0102]
六、以rna为底物检测核酸酶at_nrncm的最适ph
[0103]
按照步骤五的方法,将0.15mg/ml小牛胸腺dna溶液替换为0.15mg/ml酵母rna溶液,其它步骤均不变。
[0104]
检测结果见图6(a为核酸酶at_nrnc,b为核酸酶at_nrncm)。结果表明,在底物为rna的条件下,核酸酶at_nrncm的最适ph为7.0;与核酸酶at_nrnc相比,核酸酶at_nrncm在低ph环境中有较高酶活,在ph3.0时相对酶活可达31.53%,ph4.0及ph5.0酶活可达到最适ph酶活的45%以上,ph6.0时酶活可达最适酶活的58.46%,ph为9.0时酶活急剧下降。核酸酶at_nrnc在ph8为最高酶活,ph4.0时相对酶活仅有37.78%,ph3.0时相对酶活为20.28%。由此可见,核酸酶at_nrncm在低ph下具有更强的稳定性。
[0105]
步骤五和步骤六的结果表明,与核酸酶at_nrnc相比,核酸酶at_nrncm在ph3.0-6.0条件下的相对酶活有明显的提高。核酸酶at_nrncm更适应于实际生产过程中的反应条件。
[0106]
七、以dna为底物检测核酸酶at_nrncm的金属离子稳定性
[0107]
待测金属盐溶液分别为体系终浓度5mm的mgso4溶液、体系终浓度为2.5mm的mgso4溶液、体系终浓度为5mm的mgcl2溶液、体系终浓度为2.5mm的mgcl2溶液、体系终浓度为5mm的cuso4溶液、体系终浓度为2.5mm的cuso4溶液、体系终浓度为5mm的cucl2溶液、体系终浓度为2.5mm的cucl2溶液、体系终浓度为5mm的cacl2溶液、体系终浓度为2.5mm的cacl2溶液、体系终浓度为5mm的kcl溶液、体系终浓度为2.5mm的kcl溶液、体系终浓度为5mm的cocl2溶液、体系终浓度为2.5mm的cocl2溶液、体系终浓度为5mm的fecl2溶液、体系终浓度为2.5mm的fecl2溶液、体系终浓度为5mm的mncl2溶液或体系终浓度为2.5mm的mncl2溶液。
[0108]
用蒸馏水稀释待测核酸酶(核酸酶at_nrnc或核酸酶at_nrncm),得到浓度为2.5μg/ml的待测核酸酶溶液。
[0109]
1、制备反应体系。每个反应体系为300μl,由150μl 0.15mg/ml小牛胸腺dna溶液、100μl ph8.0、tris-hcl缓冲液、20μl待测核酸酶溶液和30μl待测金属盐溶液组成。共18组,每组3个平行。
[0110]
检测各个反应体系在260nm处的吸光值,记为a0。
[0111]
2、完成步骤1后,将各个反应体系置于30℃反应10min;然后再次检测各个反应体系在260nm处的吸光值,记为a。
[0112]
3、按照公式(u/mg=(a-a0)
×
1000
×
f/t(f=50,f为稀释系数;t=10,t为反应时间))计算酶活,按组取平均值。
[0113]
按照上述步骤,将反应体系替换为反应体系丙,其它步骤均不变,作为ck。反应体系丙为300μl,由150μl 0.15mg/ml小牛胸腺dna溶液、100μl ph8.0、tris-hcl缓冲液、20μl待测核酸酶溶液、30μl水组成。
[0114]
以ck组的酶活为标准值100%,计算各个反应体系的相对酶活,测量不同条件下的金属离子对酶活的影响。
[0115]
检测结果见图7(a为核酸酶at_nrnc,b为核酸酶at_nrncm)。结果表明,在底物为dna的条件下,相同条件下mg
2+
、ca
2+
对核酸酶at_nrnc和核酸酶at_nrncm酶活均有一定的提高。2.5mm mgcl2与5mm cacl2对核酸酶at_nrnc酶活增强作用最强,而2.5mm mgso4与5mm cacl2对核酸酶at_nrncm增强作用最强。cu
2+
、fe
2+
、mn
2+
对酶活均有抑制效果,其中fe
2+
在30℃反应10min条件下核酸酶at_nrnc和核酸酶at_nrncm完全丧失酶活性。
[0116]
八、以rna为底物检测核酸酶at_nrncm的金属离子稳定性
[0117]
按照步骤五的方法,将0.15mg/ml小牛胸腺dna溶液替换为0.15mg/ml酵母rna溶液,其它步骤均不变。
[0118]
检测结果见图8(a为核酸酶at_nrnc,b为核酸酶at_nrncm)。结果表明,以酵母rna为底物,金属离子酶稳定性与以dna为底物时基本一致;相同条件下mg
2+
、ca
2+
对核酸酶at_nrnc和核酸酶at_nrncm酶活均有一定的提高。5mm mgso4、5mm mgcl2、2.5mm mgcl2和5mm cacl2对核酸酶at_nrnc酶活增强作用最强,而2.5mm mgso4与5mm cacl2对核酸酶at_nrncm增强作用最强。cu
2+
、fe
2+
、mn
2+
显著抑制核酸酶活性。
[0119]
实施例4、核酸酶at_nrncm的酶活检测
[0120]
一、检测核酸酶at_nrncm的脱氧核糖核酸酶酶活
[0121]
脱氧核糖核酸酶酶活力定义:在ph7.0、60℃条件下,以1.5ml 0.15mg/ml小牛胸腺dna溶液为底物,1min内反应液在260nm处的吸光度增加0.001所需要的酶量为1u。
[0122]
参考gb/t 34801-2017脱氧核糖核酸酶活力检测方法(中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会)检测核酸酶at_nrnc和核酸酶at_nrncm的脱氧核糖核酸酶比活(每mg纯酶酶活力)并根据比活与发酵液纯化蛋白量计算发酵液酶活(每ml发酵液所含纯酶酶活力)。
[0123]
检测结果见表1。
[0124]
表1
[0125] 蛋白量(g/l)酶活(u/ml)比活(u/mg)核酸酶at_nrnc0.8483.799.6核酸酶at_nrncm1.0291.389.5
[0126]
二、检测核酸酶at_nrncm的核糖核酸酶酶活
[0127]
核糖核酸酶酶活力定义:在ph7.0、60℃条件下,以1.5ml 0.15mg/ml酵母rna溶液为底物,1min内反应液在260nm处的吸光度增加0.001所需要的酶量为1u。
[0128]
参考gb/t 34222-2017脱氧核糖核酸酶活力检测方法(中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会)检测核酸酶at_nrnc和核酸酶at_nrncm的核糖核酸酶比活(每mg纯酶酶活力)并根据比活与发酵液纯化蛋白量计算发酵液酶活(每ml发酵液所含纯酶酶活力)。
[0129]
表2
[0130] 蛋白量(g/l)酶活(u/ml)比活(u/mg)核酸酶at_nrnc0.8444.252.6核酸酶at_nrncm1.0243.742.8
[0131]
实施例5、检测核酸酶at_nrncm对酵母水解物的酶活力
[0132]
本实施例中,进行高效液相色谱的色谱条件为:流动相:60%水相(0.7%三乙胺、0.04%磷酸加入超纯水中,过滤超声后使用),40%有机相色谱级乙腈;流速1.0ml/min;柱温箱30℃;检测波长(uv)245nm;检测时间20min;进样量10μl。
[0133]
色谱柱:岛津c18 5020-07346(5um 4.6
×
250mm)
[0134]
一、标准曲线绘制
[0135]
分别准确称取a、t、c、g、u、i六种核苷酸标准品25.0mg,超纯水溶解依次定容至25ml,得到浓度为1.00mg/ml的标准储备液。
[0136]
准确吸取适量标准储备液,稀释成浓度为20、50、100、200、500μg/ml的标准品溶液。
[0137]
将标准品溶液进行高效液相色谱,记录标准品峰面积。根据核苷酸含量和峰面积绘制标准曲线并拟合方程。
[0138]
各个标准品溶液的方程见表3。
[0139]
表3
[0140]
核苷酸标准品方程ay=29282x+38106ty=14091x+36213cy=11178x+35385gy=25640x+57646uy=19836x+26368iy=32595x-21199
[0141]
注:y值为峰面积;x为样品核苷酸含量,单位μg/ml。
[0142]
二、检测核酸酶at_nrncm对酵母水解物的酶活力
[0143]
用蒸馏水稀释待测核酸酶(核酸酶at_nrnc或核酸酶at_nrncm),得到浓度为1mg/ml的待测核酸酶溶液。
[0144]
1、向0.5g酵母水解物中加入待测核酸酶溶液,调节ph为3.0,得到反应体系7。待测核酸酶溶液和反应体系7的质量比为45:100。
[0145]
2、向0.5g酵母水解物中加入灭活酶溶液,调节ph为3.0,得到反应体系8。灭活酶溶液和反应体系8的质量比为45:100。作为ck组。
[0146]
取待测核酸酶溶液,100℃水浴10min,得到灭活酶溶液。
[0147]
3、将反应体系7和反应体系8置于30℃恒温培养箱,反应30min;之后沸水浴10min
灭活蛋白,稀释10倍,离心后收集上清,使用0.22μm滤膜过滤。
[0148]
4、将滤液进行高效液相色谱,记录峰面积;之后根据标准曲线计算滤液中的核苷酸含量。
[0149]
检测结果见表4。
[0150]
表4
[0151] 核酸酶at_nrnc核酸酶at_nrncm核苷酸含量3.33%3.41%核苷酸增长量0.06%0.14%核苷酸增长率1.80%4.26%
[0152]
结果表明,以酵母水解物为底物,核酸酶at_nrnc和核酸酶at_nrncm在30℃条件下反应30min,核苷酸增长率分别可达1.80%和4.26%。
[0153]
由此可见,核酸酶at_nrncm在30℃条件下,对酵母水解物的酶活力要优于核酸酶at_nrnc。
[0154]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1