TGF-β抑制剂在诱导神经干细胞及类器官形成中的应用的制作方法
tgf
‑
β
抑制剂在诱导神经干细胞及类器官形成中的应用
技术领域
1.本发明属于生物领域,具体涉及一种tgf
‑
β小分子抑制剂在诱导神经干细胞及类器官形成中的应用。
背景技术:
2.外胚层是胚胎发育过程中形成的最外层,随着器官发生的开始,外胚层细胞逐渐分化为大脑、脊髓、感觉器官等重要的系统。其中神经系统是负责思维、情感、感知、运动等功能的重要系统。相比于肿瘤等疾病,目前神经系统疾病的药物数量较少,且研发周期漫长,其中最为重要的一个原因为外胚层谱系中多种原代细胞的特殊性,例如原代神经元的不可再生性造成了神经系统药物体外药物筛选平台的稀缺。
3.除了可以用于药物筛选之外,外胚层细胞的体外再生能治疗多种退行性疾病,例如神经退行性疾病是目前常见的老龄化疾病,该疾病的治疗及护理费用极其昂贵,而且市面上无特效药物可以进行有效的治疗。神经退行性疾病包括肌萎缩侧索硬化症(als)、帕金森病(pd)、阿尔茨海默症(ad)等疾病。世界卫生组织统计,2050年我国神经退行性疾病患者将超过3000万,预期医疗费用将超过1万亿人民币。目前主要以药物去补充或刺激脑内不足的左旋多巴、神经核团毁损术或脑深部电刺激手术等治疗方法,但均不能达到很好的疗效,并且会带来“异动症”或是“药效波动”等严重影响生活质量的不良反应。
4.除神经退行性疾病之外,脊髓损伤(spinal cord injury,sci)是常见的一种神经系统创伤性疾病,据国外统计sci患者一生的治疗康复费用平均达75万美元以上,美国每年对sci患者的花费超过60亿美元。我国的患病率更是高于欧美发达国家,昂贵的治疗费用,长时间的康复治疗以及劳动力的丧失给个人及家庭带来的巨大影响,也给社会带来沉重的负担。
5.神经退行性疾病和脊髓损伤的研究难点在于中枢神经系统的神经细胞具有不可再生性,体外疾病模型的稀缺是基础研究的限制性因素,而这类疾病是由于中枢神经的不可逆损伤造成。神经细胞包括神经干细胞,成熟神经元、星形胶质细胞和少突胶质细胞等不同神经细胞类型。现存的神经细胞系资源有限,多为神经系统肿瘤细胞系,且在建系过程中存在eb病毒带来的不稳定因素;神经细胞由于体外传代不易,胚胎及胎儿来源的神经干细胞由于伦理限制不便普及。目前,虽然神经干细胞的异体移植已经在临床上取得了一定的效果,但以上因素都进一步阻碍了相关疾病的临床推进。
6.2006年,山中伸弥的团队发明了一种由oct4、sox2、klf4和c
‑
myc四种转录因子构成的“鸡尾酒”法,能够成功将终端分化的皮肤成纤维细胞重编程成为具有分化多能性的干细胞,这种干细胞被称为诱导多能干细胞(induced pluripotent stem cells,ipsc)(takahashi k,et al.,cell,2006,126(4)pp.663
‑
676;takahashi k and yamanaka s,cell,2007,131(5)pp.861
‑
872)。这些干细胞具有和胚胎干细胞(embryonic stem cells)类似的分化潜能,能够形成人体发育最基本的三个胚层:外胚层、中胚层及内胚层,并最终形成多种成体细胞。这一发明突破了在医学上使用人胚胎干细胞的伦理限制,可以解决细
胞移植治疗中的免疫排斥问题,大大拓展了干细胞技术在临床医学上的应用潜力。使用包括胚胎干细胞及诱导多能干细胞(ipsc)在内的全能干细胞或者多能干细胞作为原材料进行外胚层细胞诱导分化可以作为临床治疗的新思路,大大拓展了外胚层细胞在临床医学上的应用潜力。
7.以神经系统为例,目前在再生医学领域,神经干细胞及神经元的诱导多采取smad途径双重抑制法(dual smad inhibition)(chambers sm,et.al.,nat biotechnol,2009,27(3):275
‑
80),该方法得到的神经干细胞能够分化为其它类型的神经元细胞,其原理是通过抑制bmp和tgf
‑
β途径来模拟胚胎发育早期的信号途径,从而诱导神经干细胞的产生。其中ldn
‑
193189和sb431542是广为使用的两种化学小分子抑制剂,分别通过作用于bmp4途径中的alk2和alk3,以及tgf
‑
β途径中的alk5来达到移植内胚层及中胚层形成,从而起到诱导外胚层发育及神经发生的作用。通过这种方法,可以在血清类成分(knockout serum replacement)的存在下得到诱导的神经细胞(chambers sm,et.al.,nat biotechnol.,2013,30(7):715
‑
720)。但使用smad途径双重抑制法(dual smad inhibition)获得的神经细胞中经常混有其他未完全分化的细胞类型,这是由于细胞分化不同步产生的结果,这类细胞的存在会在一定层度上影响移植治疗效果,同时带来安全性的担忧。因此,如何获得高纯度的分化细胞是细胞移植急需解决的技术问题。
8.本发明使用的galunisertib(ly2157299),标准化学命名为4
‑
(2
‑
(6
‑
甲基吡啶
‑2‑
基)
‑
5,6
‑
二氢
‑
4h
‑
吡咯并[1,2
‑
b]吡唑
‑3‑
基)喹啉
‑6‑
甲酰胺(4
‑
(2
‑
(6
‑
methylpyridin
‑2‑
yl)
‑
5,6
‑
dihydro
‑
4h
‑
pyrrolo[1,2
‑
b]pyrazol
‑3‑
yl)quinoline
‑6‑
carboxamide);其他化学命名2
‑
(6
‑
甲基
‑
吡啶
‑2‑
基)
‑3‑
(6
‑
氨甲酰基
‑
喹啉
‑4‑
基)
‑
5,6
‑
二氢
‑
4h
‑
吡咯[1,2
‑
b]吡唑(2
‑
(6
‑
methyl
‑
pyridin
‑2‑
yl)
‑3‑
(6
‑
carbamoyl
‑
quinolin
‑4‑
yl)
‑
5,6
‑
dihydro
‑
4h
‑
pyrrolo[1,2
‑
b]pyrazole);又或者4
‑
[5,6
‑
二氢
‑2‑
(6
‑
甲基
‑2‑
吡啶基)
‑
4h
‑
吡咯[1,2
‑
b]吡唑
‑3‑
基]
‑6‑
喹啉甲酰胺(4
‑
[5,6
‑
dihydro
‑2‑
(6
‑
methyl
‑2‑
pyridinyl)
‑
4h
‑
pyrrolo[1,2
‑
b]pyrazol
‑3‑
yl]
‑6‑
quinolinecarboxamide);或ly
‑
2157299、ly2157299。为tgf
‑
β受体ⅰ(tgf
‑
βri,alk5)小分子抑制剂。ly2157299目前正处于ii期临床评估,针对肝癌和胶质母细胞瘤的抗癌活性(giannelli g1,villa e,lahn m.transforming growth factor
‑
βas a therapeutic target in hepatocellular carcinoma.cancer res.2014apr 1;74(7):1890
‑
4),通过阻断tgf
‑
β信号通路抑制肿瘤的生长、侵袭和转移过程;此外,多项研究表明ly2157299阻断了ctgf的产生并抑制了新血管生成,从而抑制了癌细胞的生长。目前,该分子的发展方向主要是基于肺癌、肝癌和胶质母细胞瘤的药物开发以及治疗(pharmaceutics.2020may18;12(5):459),并没有公开任何在神经再生领域的应用。
[0009]
本发明具有如下优点:本发明使用了一种而非多种化学小分子来进行神经细胞诱导,与目前国际通行的多种小分子组合的诱导方法相比,本发明不仅大大节省了生产成本,而且展现出极大的纯度及产率优势。本发明也拓展了这一小分子在外胚层诱导领域里的全新的功能。除此之外,本发明避免了b27等代血清的使用,从而完全免除了在细胞培养过程中动物源性成分的存在带来的潜在危险,因此本发明大大拓展了神经细胞移植的临床前景。多个批次之间状态稳定,纯度高,解决了细胞类药物生产过程中纯度低,周期长的问题;尤其能够用于神经系统疾病药物的体外筛选,及神经退行性疾病的治疗,因此具有巨大的经济效应和社会效应。
技术实现要素:
[0010]
为了解决现有技术的不足,本发明提供一种诱导神经干细胞及类脑器官的无血清培养基及诱导分化的方法,上述诱导神经干细胞及类脑器官分化的培养基包括基础培养基和神经诱导化合物。
[0011]
为了实现上述目的,本发明提供如下技术方案:
[0012]
本发明提供一种tgf
‑
β抑制剂在诱导神经干细胞及类器官形成中的应用,该tgf
‑
β抑制剂为4
‑
[2
‑
(6
‑
甲基吡啶
‑2‑
基)
‑
5,6
‑
二氢
‑
4h
‑
吡咯并[1,2
‑
b]吡唑
‑3‑
基]喹啉
‑6‑
羧酰胺。
[0013]
优选地,上述tgf
‑
β抑制剂添加在基础培养基内,组成神经干细胞诱导培养基。
[0014]
优选地,上述基础培养基由杜氏改良伊格尔/f12培养基、最低必须培养基非必需氨基酸、氯化钠、亚硒酸钠、胰岛素和重组人转铁蛋白组成。
[0015]
优选地,上述基础培养基由杜氏改良伊格尔/f12培养基、1%最低必须培养基非必需氨基酸、0.1
‑
0.8g/l氯化钠、13.6μg/l亚硒酸钠、20ng/ml
‑
42μg/ml胰岛素和50
‑
180ng/ml重组人转铁蛋白组成。
[0016]
更优选地,上述基础培养基含有0.5g/l氯化钠、13.6μg/l亚硒酸钠、22ug/ml胰岛素和100ng/ml重组人转铁蛋白。
[0017]
优选地,上述tgf
‑
β抑制剂的浓度为10nm~100μm。
[0018]
更优选地,上述tgf
‑
β抑制剂的浓度为12.5μm。
[0019]
在一实施方案中,诱导神经干细胞形成包括以下步骤:采用神经干细胞诱导培养基贴壁培养多能干细胞。
[0020]
优选地,多能干细胞为哺乳动物多能干细胞。
[0021]
更优选地,多能干细胞为人多能干细胞。
[0022]
优选地,贴壁培养是在基底膜制剂存在下进行。
[0023]
更优选地,上述基底膜制剂为基底胶、层粘蛋白和玻连蛋白的一种或多种的组合。
[0024]
在一实施方案中,神经干细胞分化为神经元,该神经元选自下组的一种或多种:痛觉感受器神经元、光受体神经元、多巴胺能神经元。
[0025]
本发明还提供上述方法获得的神经干细胞于制备治疗神经损伤药物中的应用。
[0026]
在另一实施方案中,类器官形成包括以下步骤:(1)采用上述神经干细胞诱导培养基,添加10μm rock抑制剂y
‑
27632进行多能干细胞悬浮细胞团培养;(2)次日更换为前述的神经干细胞诱导培养基,并每日更换培养基直至第10天;(3)第10天时更换为上述基础培养基,并添加2%b27细胞培养添加剂培养至第120天。
[0027]
本发明还提供上述方法获得的类器官在神经系统疾病药物筛选上的应用。
[0028]
本发明提供一种抗肿瘤小分子抑制剂在外胚层体外发育中的应用,涉及到该化合物与基础培养基的组合,以及这一组合在多种神经细胞中的培养及其临床应用。
[0029]
本发明提供人诱导神经干细胞制备步骤:在无血清感觉神经诱导培养基中对多能干细胞进行单层贴壁培养,前述无血清培养基中含有本发明使用的化学小分子、氨基酸、无机盐等成分,而不含有血清,bmp或者tgf信号转导途径的物质等成分,使用这一无血清神经诱导培养基贴壁培养20天,得到形成神经花环状均匀排列的神经干细胞。
[0030]
在具体的实施方案中,作用于bmp信号转导途径的物质包括一个或者多个由下列
各项自由排列组合的蛋白质:bmp2、bmp4、bmp4、smad1、smad5、smad8;其中作用于tgf转导途径的物质包括一个或者多个由下列各项自由排列组合的蛋白质:activin、tgf
‑
β、nodal、smad2、smad3。
[0031]
在具体的实施方案中,贴壁培养是在有基底膜制剂的情况下进行的。本发明的基底膜制剂,可以在培养器皿的表面形成一层由胞外基质分子构成的薄膜,可以为细胞的形态、生长分化,以及运动等参数提供与体内环境类似的支持。在具体的实施方案中,上述基底膜为基底胶(matrigel,stemcell technologies)、层粘蛋白(laminin)和玻连蛋白的一种或多种的组合。
[0032]
本发明中的无血清培养基表示不含有直接从血液中分离的血清。血清为血浆的透明液体部分,其不含纤维蛋白原或血细胞,并且在血液凝固后保持为液体。无血清培养基可以含有血清替代物,血清替代物的实例包括血清白蛋白、转铁蛋白、脂肪酸等纯化物质。
[0033]
在具体的实施方案中,第1步到第3步中的贴壁培养,优选是在有基底膜的情况下进行的。本发明的基底膜,可以在培养器皿的表面形成一层由胞外基质分子构成的薄膜,可以为细胞的形态、生长分化,以及运动等参数提供与体内环境类似的支持。在具体的实施方案中,上述基底膜为基底胶(matrigel,stemcell technologies)、层粘蛋白(laminin)和玻连蛋白的一种或多种的组合。
[0034]
本发明中的无血清培养基表示不含有直接从血液中分离的血清。血清为血浆的透明液体部分,其不含纤维蛋白原或血细胞,并且在血液凝固后保持为液体。无血清培养基可以含有血清替代物,血清替代物的实例包括血清白蛋白、转铁蛋白、脂肪酸等纯化物质,这些物质为本领域熟知的可以替代血清的物质。
[0035]
制备用于治疗神经损伤的药物的方法的方法可以参考已发表的使用胚胎干细胞作为用于治疗神经损伤的药物的方法,如okada等人的发表(okada y,matsumoto a,shimazaki t,enoki r,koizumi a,ishii s,itoyama y,sobue g,okano h.stem cells.2008vol.26,pp.3086
‑
98)。
[0036]
除了人源的多能细胞外,用于治疗神经损伤的药物还可以含有其他成分,例如含有盐和/或抗生素的缓冲液、作为治疗目标的神经组织(例如脑、脊髓等中枢神经系统或周围神经系统)。此外,治疗的目标疾病不限于任何特定症状,包括诸如创伤性疾病的外伤性疾病(例如脊髓损伤)、神经退行性疾病(如萎缩侧索硬化症、帕金森病、阿尔茨海默症、进行性核上性麻痹、亨廷顿病、多系统萎缩和脊髓小脑变性)、由脑梗塞和脑出血等引起的神经细胞坏死;并且不限于任何特定病因,包括与损伤、脑梗塞等相关的原发性原因,以及感染、肿瘤等继发性原因,只要属于神经细胞受损的疾病或病理症状即包含在内。
[0037]
定义
[0038]
神经干细胞(neural stem cells,nscs):
[0039]
神经干细胞是具有分化为神经神经元、星形胶质细胞和少突胶质细胞的能力,能自我更新,并足以提供大量脑组织细胞的细胞群,是一类具有分裂潜能和自更新能力的母细胞,其可以通过不对等的分裂方式产生神经组织的各类细胞,包括神经元、少突胶质细胞和星形胶质细胞。根据本发明,神经干细胞可以是诱导神经干细胞(insc)。神经花环(rosette):
[0040]
神经胚形成为早期神经发生过程,被认为是人类胚胎发育中的关键阶段,神经胚
在各种因素的精密调控下发育为大脑、脊髓和其他神经系统。神经胚形成被描述为细胞组织团块内花环样神经干细胞结构的产生,即一个神经花环结构象征一个神经胚。
[0041]
有益效果
[0042]
(1)本发明提供的培养基不含血清,解决了动物源性培养方法制约干细胞在临床上的使用问题,适用于培养神经干经胞,包括但不局限于诱导多能干细胞。
[0043]
(2)本发明提供的培养基具有简便、安全、高效的特征,通过使用单一种小分子抑制剂,实现诱导干细胞定向分化为神经干细胞。
[0044]
(3)本发明提供的方法诱导分化的神经干细胞具有分化为神经元和类器官的能力,不仅能够作为临床研究和临床治疗的材料,还能用于神经系统疾病药物的筛选研究,具有巨大的经济和社会效应。
附图说明
[0045]
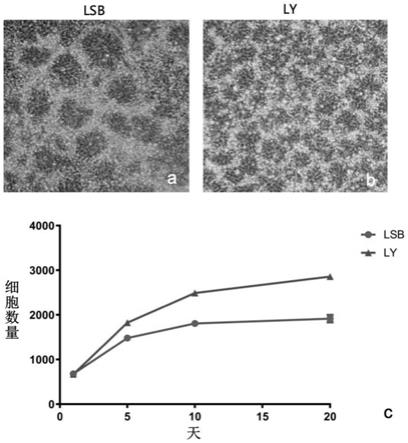
图1:本发明的方法(ly诱导方法)与对照方法(lsb诱导方法)在神经干细胞诱导过程中的差异比较。图1a显示使用多种小分子抑制剂诱导(lsb诱导方法)产生的神经花环结构;图1b显示单独使用ly2157299进行神经干细胞诱导(ly诱导方法)产生的神经花环结构;图1c显示两种方法得到的神经干细胞在获得的细胞数量上的差异。
[0046]
图2:本发明的方法中基础培养基核心成分的筛选结果。图2a显示不同浓度氯化钠对培养体系渗透压的影响,浓度过高导致渗透压超过细胞耐受;图2b显示不同浓度胰岛素对细胞生长(cyquant实验)的影响,胰岛素浓度与细胞活力呈正相关;图2c显示不同浓度重组人血清白蛋白对细胞生长(cyquant实验)的影响,重组人血清白蛋白浓度与细胞活力呈正相关。
[0047]
图3:本发明的方法(ly诱导方法)与对照方法(lsb诱导方法)所获细胞的分子鉴定。图3a表示使用lsb诱导方法获得的神经干细胞,经过体外传代后重建神经花环的结构;图3b表示使用lsb诱导方法获得的神经干细胞,表达特异性标志物pax6;图3c表示使用lsb诱导方法获得的神经干细胞,表达特异性标志物nestin;图3d表示图3a
‑
3c的通道整合图片;图3e表示使用ly诱导方法获得的神经干细胞,经过体外传代后重建神经花环的结构;图3f使用ly诱导方法获得的神经干细胞,表达特异性标志物pax6;图3g表示使用ly诱导方法获得的神经干细胞,表达特异性标志物nestin;图3h表示图3e
‑
3g的通道整合图片;图3i
‑
3k显示使用q
‑
pcr比较ly诱导方法与lsb对照诱导方法在神经干细胞形成过程中对神经干细胞标志物的表达差异。
[0048]
图4:不同浓度的ly2157299进行神经干细胞化学诱导。图4a显示使用多分子对照(lsb诱导方法,标示为ck)获得的神经干细胞;图4b显示使用0nm ly2157299进行化学诱导;图4c显示使用20nm ly2157299进行化学诱导;图4d显示使用12.5μm ly2157299进行化学诱导;图4e显示使用25μm ly2157299进行化学诱导;图4f为使用q
‑
pcr分析比较不同浓度ly2157299在诱导过程中对pax6的调控情况;图4g为使用q
‑
pcr分析比较不同浓度ly2157299在诱导过程中对细胞凋亡基因casp3的调控情况。
[0049]
图5:ly诱导方法获得的神经干细胞的分化能力鉴定。图5a
‑
5c显示通过ly2157299获得的诱导神经干细胞,进一步分化得到的痛觉感受器神经元;图5a显示通过此方法得到的痛觉感受器神经元,表达痛觉感受器神经元特异性标志物scn11a;图5b显示通过此方法
medium non
‑
essential amino acids,thermo fisher,货号:11140076)、氯化钠(sodium chloride,0.5g/l)、亚硒酸钠(sodium selenite,13.6μg/l)、胰岛素(22μg/ml)、重组人转铁蛋白(100ng/ml)。
[0056]
本发明使用的神经干细胞诱导培养基的制备方式为,在nouvneu001基础培养基中加入55nm~24μm的ly2157299(selleck,s2230),最终浓度优选为300nm、500nm、700nm、900nm、1μm、2.5μm、5μm、7.5μm、10μm、12.5μm、15μm、17.5μm、20μm或22μm,最优选为12.5μm。上述培养基简称ly诱导培养基,以下使用此培养基的实验组称为ly诱导方法。
[0057]
对照实验使用的培养基的制备方式为,在nouvneu001基础培养基中添加100nm ldn
‑
193189(selleck,s2618)和10μm sb431542(selleck,s1067)。上述培养基简称lsb诱导培养基,以下使用此培养基的实验组称为lsb诱导方法。
[0058]
实施例2:神经干细胞的诱导与鉴定
[0059]
2.1神经干细胞的化学诱导:
[0060]
人多能干细胞包括胚性多能干细胞,如h9细胞系和人诱导多能干细胞。其中本发明使用的人诱导多能干细胞按照“重编程培养基及重编程诱导多能干细胞的培养方法”(zl201910050800.7专利中的方法)进行,从cd34
+
细胞重编程获得。
[0061]
人多能干细胞使用matrigel(stemcell technologies)包被t25细胞培养瓶,铺板后置于37℃恒温箱中孵育一个小时以上。按照1
×
106细胞接种于t25培养瓶中进行扩增和传代。
[0062]
进行神经诱导时,使用50μg/ml多聚赖氨酸(sigma,货号:p6407)包被6孔培养板,铺板后置于37℃恒温箱中孵育3小时以上;然后使用5μg/ml层粘连蛋白(laminin,sigmaaldrich,货号:i2020)进一步包被,铺板后置于37℃恒温箱中孵育3小时以上。当多能干细胞达到70%的覆盖率时,用edta在37℃消化5分钟,使用dmem终止细胞消化。细胞洗涤离心后按照2
×
105每瓶的比例重新接种于t25培养板中。使用本发明培养基及神经诱导化合物组合进行神经诱导,每天更换培养基直至神经干细胞花环形成。本发明使用的单分子诱导法(ly诱导方法)和多分子诱导法(lsb诱导方法)对照相比,形成了小而均匀的神经花环结构,如图1a和图1b所示,这一结果说明本方法提供的单分子诱导方法,与对照使用的多分子诱导方法相比,产生了更为均一的诱导结果,而对照实验产生的花环结构大小不一,并且在同样的培养周期内,还有局部未形成神经花环结构。因此,本方法提供的单分子诱导方法能够更高效更均一的诱导多能干细胞形成神经花环结构。
[0063]
2.2诱导体系中关键成分的浓度鉴定:
[0064]
使用cyquant试验来进行细胞活力定量检测,从而研究ly2157299在细胞长期培养过程中对细胞生理状态的影响,使用lsb方法作为对照。包被96孔不透光细胞培养板,包被完成后将细胞按照5x104每孔的细胞数量分别接种,并设置三组平行重复(三组的平均值作为数据进行计算),重复实施例2.1的过程,培养条件为37℃,5%二氧化碳。分别在1天、5天、10天、15天以及20天取样,细胞活力检测使用cyquant kit(invitrogen,货号:x12223)进行,按照使用说明书操作,使用spectramax i3 multi
‑
mode microplate reader(vwr,型号id3
‑
std)进行数据读取。结果如图1c所示,cyquant实验显示,与lsb方法相比,ly2157299诱导得到的神经细胞数量更多,说明ly2157299在诱导过程中具有更强的增殖活性。
[0065]
同样使用cyquant试验来进行细胞活力定量检测,从而研究不同浓度重组胰岛素
和重组血清白蛋白在细胞长期培养过程中对细胞生理状态的影响,结果如图2b和图2c所示,重组胰岛素和重组血清白蛋白浓度均与细胞增殖速度呈正相关,结合成本因素,本发明使用的重组胰岛素和重组血清白蛋白范围属于最佳使用范围。
[0066]
使用全自动冰点渗透压计(fm
‑
8p,上海医大仪器有限公司)来检测不同浓度氯化钠对培养体系渗透压的影响,具体操作参加产品说明书(fm
‑
8p,上海医大仪器有限公司)。试验结果详见图2a,结果说明随着氯化钠浓度与培养体系渗透压呈线性增加。但当浓度达到1g/ml时,培养体系的渗透压已经超过细胞培养极限渗透压320mosm/kg。说明本发明使用的氯化钠浓度为最适于细胞培养的浓度。
[0067]
2.3神经干细胞的标志物荧光免疫鉴定:
[0068]
分别取ly诱导方法和lsb诱导方法得到的神经干细胞进行免疫荧光染色鉴定,采用4%多聚甲醛室温固定细胞40分钟,用dpbs缓冲液清洗两遍;用0.1%triton x
‑
100透化处理5分钟,用dpbs缓冲液清洗两遍;然后用含10%马血清和0.1%triton x
‑
100的dpbs缓冲液将细胞4℃孵育过夜;然后加入用dpbs缓冲液洗涤细胞,用含2%马血清和0.1%triton x
‑
100的dpbs缓冲液稀释一抗抗体,37℃孵育2小时;用dpbs缓冲液洗涤细胞后用含2%马血清和0.1%triton x
‑
100的dpbs缓冲液稀释二抗抗体,37℃孵育2小时,清洗三遍后拍照,拍照使用leica dmi8进行。抗体使用细节如表1所示,结果如图3a至图3h所示,与lsb诱导方法相比,ly诱导方法能够使多能干细胞产生神经花环结构,并且细胞表达神经干细胞标志pax6及nestin。
[0069]
表1、细胞免疫荧光染色所用抗体
[0070][0071][0072]
2.4神经干细胞的转录水平鉴定:
[0073]
使用q
‑
pcr检测从多能干细胞向神经干细胞诱导过程中的不同标志物基因的转录变化。本实施例中使用的诱导多能干细胞,使用ly诱导方法和lsb诱导方法得到的神经干细胞,分别使用rneasy mini or micro kit(qiagen)进行总rna抽提,1mg rna用superscript iii first
‑
strand synthesis system(invitrogen)合成cdna。用sybr premix ex taq(takara)和thermal cycler dice real time system(takara)来进行quantitative pcr的标记和反应,beta
‑
actin用来作为内参。所有数据用delta
‑
ct method进行分析。每组试验使用三组重复进行试验,并进行方差统计。用于鉴定不同细胞标志物的编码基因的引物序列如表2所示。结果如图3i
‑
3k所示,ly诱导方法和lsb诱导方法得到的神经干细胞均表达神经干细胞特异性标志物sox2、pax6及nestin,并且ly诱导方法在神经干细胞标志物的表
达上比lsb诱导方法均有所增加。
[0074]
通过以上方法在nouvneu001基础培养基中加入不同浓度的ly2157299进行浓度筛选,结果如图4b
‑
4e所示,图4b显示不使用ly2157299,导致细胞不能分化为外胚层细胞;图4c显示使用20nm ly2157299进行化学诱导,获得了包括神经细胞在内混合细胞群体;图4d显示使用12.5μm ly2157299进行化学诱导,获得了形态均一细胞群体,且细胞均具有典型神经干细胞形态,与对照类似(4a);图4e显示使用25μm ly2157299进行化学诱导,获得了神经类混合细胞群体,部分细胞形成了较长轴突,细胞出现胞内空泡的胁迫迹象。由以上结果可得知,低浓度条件下分化不完全,可见多种不同类型的细胞;高浓度条件下获得的神经干细胞易分化,且出现细胞胁迫。转录水平进一步证明了本发明使用的浓度为最佳浓度(图4f
‑
图4g),图4f显示ly2157299浓度与pax6表达量呈正相关;图4g显示ly2157299浓度与细胞凋亡呈正相关。以上结果说明,ly2157299浓度过低或者过高都会对神经诱导产生不利影响。
[0075]
表2、多能干细胞向神经干细胞诱导过程中的不同标志物基因引物
[0076][0077]
实施例3:神经干细胞的分化功能鉴定
[0078]
将实施例2中ly诱导方法获得的神经干细胞在nouvneu001基础培养基中进行定向分化。进行神经元分化时,使用50μg/ml多聚赖氨酸(sigma aldrich,货号:p6407)包被6孔培养板,铺板后置于37℃恒温箱中孵育3小时以上,直至细胞接种。
[0079]
3.1痛觉感受器神经元分化:
[0080]
实施例2中获得的神经干细胞按照1
×
105每瓶的比例接种于t25培养瓶中,在nouvneu001基础培养基中加入3μm chir99021(selleck,货号:s2924)、10μm su5402(tocris,货号:3300/1)、10μm dapt(selleck,货号:s2215),每隔3天更换新鲜培养基,直至
第21天。培养条件为37℃,5%的co2。实验结果表明实施例2中得到的神经干细胞分化后具有轴突结构,且表达痛觉感受器神经元标志物scn11a和nestin(图5a
‑
5c)。具体为图5a显示通过ly2157299获得的诱导神经干细胞,进一步分化得到的痛觉感受器神经元,表达痛觉感受器神经元特异性标志物scn11a;图5b显示通过此方法得到的痛觉感受器神经元,表达痛觉感受器神经元特异性标志物nestin;图5c显示图5a及图5b两种荧光通道的整合图片。
[0081]
3.2多巴胺神经元细胞的诱导:
[0082]
实施例2中得到的神经干细胞按照1
×
105每瓶的比例重新接种于t25培养板中。使用nouvneu001基础培养基添加1μm purmorphamine(sellek,货号:s3042)及1ng/ml tgf
‑
β3(novoprotein,货号:cj44)培养神经干细胞,培养条件为37℃,5%的co2,每3天更换新鲜培养基直至第30天神经元形成。实验结果表明实施例2中得到的神经干细胞分化后具有轴突结构,且表达成熟多巴胺能神经元特异性标志物酪氨酸羟化酶(tyrosine hydroxylase,th)和pitx3(图5d
‑
5f)。具体为图5d显示通过ly2157299获得的诱导神经干细胞,进一步分化得到的多巴胺能神经元表达成熟多巴胺能神经元特异性标志物pitx3;图5e显示通过此方法得到的多巴胺能神经元,表达成熟多巴胺能神经元特异性标志物th;图5f显示图5d及图5e两种荧光通道的整合图片。
[0083]
3.3光感受器神经元分化:
[0084]
实施例2中得到的神经干细胞按照1
×
105每瓶的比例重新接种于t25培养板中。使用nouvneu001基础培养基添加0.5μm乙酸视黄酯(retinyl acetate,sigma aldrich,货号:r7882),每隔3天更换新鲜培养基,直至第21天。培养条件为37℃,5%的co2。实验结果表明实施例2中得到的神经干细胞分化后具有轴突结构,且表达光受体神经元标志物opsin和crx(图5g
‑
5i)。具体为图5g显示通过ly2157299获得的诱导神经干细胞,进一步分化得到的光受体神经元,表达光受体神经元特异性标志物opsin;图5h显示通过此方法得到的光受体神经元,表达光受体神经元特异性标志物crx;图5i显示图5g及图5h两种荧光通道的整合图片。
[0085]
诱导分化完成后,收取细胞进行免疫荧光染色鉴定:采用4%多聚甲醛室温固定细胞40分钟,用dpbs缓冲液清洗两遍;然后用0.1%triton x
‑
100透化处理5分钟,用dpbs缓冲液清洗两遍;然后用含10%马血清和0.1%triton x
‑
100的dpbs缓冲液将细胞于4℃孵育过夜;用dpbs缓冲液洗涤细胞后用含2%马血清和0.1%triton x
‑
100的dpbs缓冲液稀释二抗抗体,37℃孵育2小时,清洗三遍后用leica dmi8进行拍照。抗体使用细节如表3所示。
[0086]
表3、定向分化免疫荧光染色所用抗体
[0087][0088][0089]
以上结果表明ly诱导方法获得的神经干细胞的具有多种神经元的分化能力。
[0090]
实施例4:ly2157299对mhc形成的影响
[0091]
4.1 q
‑
pcr检测:
[0092]
按照实施例2.4的方法,使用q
‑
pcr方法检测使用ly2157299诱导获得的神经干细胞的主要组织相容性复合体(major histocompatibility complex,mhc)基因,使用多能干细胞(ips)作为对照。引物序列如表4所示,检测结果结果如图6所示,与人源多能干细胞相比,mhc相关基因cd4、hla
‑
a、hla
‑
c、hla
‑
f和hla
‑
dpb1在ly2157299诱导获得的神经干细胞中表达极低。
[0093]
表4、免疫系统相关基因引物
[0094][0095][0096]
4.2流式细胞术检测:
[0097]
使用流式细胞术对ly2157299诱导获得的神经干细胞的hla
‑
dr抗原进行检测。hla
‑
dr是一种mhc ii类分子,其表达对于细胞的抗原呈递功能至关重要,并在过继免疫反应中起关键作用。先将实施例2中获得的诱导神经干细胞用edta消化后,使用dpbs洗涤,离心去除上清后,将106个细胞重悬于100μl稀释的一抗中(cd45 percp,abcam,货号ab157309;hla
‑
dr fitc,cst,货号54126),在冰上避光孵育1小时后,离心去除上清,将细胞重悬于500μl抗体稀释缓冲液(cst)中,并在流式细胞仪上进行分析。使用无一抗孵育样本作为对照。结果如图7所示,图7a为阴性对照,图7b为ly2157299诱导获得的神经干细胞的hla
‑
dr检测结果,结果显示ly诱导方法获得的神经干细胞不表达hla
‑
dr。此结果与实施例4.1结果相符合。
[0098]
实施例5:ly2157299对类器官形成的影响
[0099]
类脑器官培养采取人诱导多能干细胞进行,类脑器官诱导培养基配方如下:nouvneu基础培养基中添加12.5μm ly2157299。诱导多能干细胞使用accutase消化为单细胞,按照每孔中9000个细胞/150ml类脑诱导培养基的比例接种于u
‑
bottom
‑
ultra
‑
low attachment96孔板中。并加入10μm rock抑制剂y
‑
27632(selleck,s1049),置于37℃,5%二氧化碳细胞培养箱中培养24小时(panasonic,型号:mco
‑
18ac)。次日更换无y
‑
27632新鲜类脑器官诱导培养基直至第10天。第10天将类脑器官转移至ultra
‑
low
‑
attachment 6孔板
里,更换培养基为nouvneu001基础培养基,并添加2%b27细胞培养添加剂,在37℃,5%二氧化碳细胞培养箱中的水平旋转仪上按照80rpm旋转培养至第120天。
[0100]
对照实验根据已发表的方法(clair b et.al,nat methods.2019,nov;16(11):1169
‑
1175)进行,类器官培养基础培养基使用n2b27,对照类脑诱导培养基配方为:n2b27基础培养基中添加10μm sb
‑
431542、100nm ldn
‑
193189,以及2μm xav
‑
939。其余操作同上。该方法在本发明及图示中简称为n2b27方法。
[0101]
使用leica dmi8对类器官进行拍照并进行类脑器官拍照及直径测量,结果如图8a、图8b及图8e所示。
[0102]
使用多通道电极对诱导的类脑器官进行细胞自发放电信号检测。将诱导120天的类脑器官用10%胰酶/edta在37摄氏度消化5
‑
8分钟,取96孔mea系统多通道电极板(axion biosystem,us),使用100ng/ml多聚赖氨酸(poly
‑
l
‑
lysine,sigma
‑
aldrich,p4707)进行包被,置于37℃,5%二氧化碳细胞培养箱(panasonic,型号:mco
‑
18ac)中包被12小时;取出多聚赖氨酸包被好的mea多通道电极板,吸走多聚赖氨酸,用灭菌水清洗3次后,使用含有3μg/ml明胶(laminin,sigma aldrich,货号:i2020)的pbs溶液作为神经细胞包被基质,加入mea多通道电极板中,置于37℃,5%二氧化碳细胞培养箱中包被3小时。mea多通道电极板包被好后,按照5
×
105个细胞每孔的数量接种消化过的类脑器官混合细胞。将接种好的mea多通道电极板放置于mea腔室中,在axis navigator 2.0.2软件中调节细胞细胞培养条件为37℃,5%二氧化碳,运行10分钟至腔室环境稳定。用axis navigator 2.0.2软件(axion biosystem,us)记录细胞自发放电信号。实验结果表明nouneu体系诱导的神经元展现出良好的电生理活性,使用多通道电机系统检测细胞自发放电时,通过比较细胞单位时间放电数(图8c)和平均放电率(图8d),ly诱导方法和n2b27对照诱导方法相比,具有更活跃的电生理活性。
[0103]
使用q
‑
pcr检测类脑器官形成后的不同标志物基因的转录变化:不同方法培养获得的120天类脑器官,以及人诱导多能干细胞对照的总rna分别使用rneasy mini or micro kit(qiagen)进行抽提,1mg rna用superscript iii first
‑
strand synthesis system(invitrogen)合成cdna。用sybr premix ex taq(takara)和thermal cycler dice real time system(takara)来进行quan
‑
titative pcr的标记和反应,beta
‑
actin用来作为内参。所有数据用delta
‑
ct method进行分析。每组试验使用三组重复进行试验,并进行方差统计。用于鉴定不同细胞标志物的编码基因的引物序列如表5所示。ly诱导方法和n2b27对照诱导方法形成的类脑器官均能产生胶质细胞,神经祖细胞和神经元(图8f
‑
8g)。
[0104]
表5、类脑器官检测q
‑
pcr所用引物
[0105][0106]
综上所述,ly2157299可以诱导产生类脑器官,并且类脑器官具有电生理功能和关键基因的表达;此外和对照的n2b27对照诱导方法相比,ly诱导方法形成的类脑器官具有更大的直径,并具有更活跃的电生理功能。
[0107]
本发明提及的所有文献都在本技术中全文引用作为参考。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式的修改同样落于本技术权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1