一个玉米热激转录因子基因ZmHsf17编码蛋白的抗氧化功能及其应用
本发明属于基因工程技术领域,尤其涉及一个玉米热激转录因子基因zmhsf17编码蛋白的抗氧化功能及其应用。
背景技术:
随着全球温室效应的加剧,气候变暖已经为现代农业生产提出严峻的挑战,而高温往往伴随着干旱,植物的不可移动性导致其不断暴露在逆境胁迫环境中。为适应日益恶化的大气环境,植物逐步进化出应对胁迫的响应网络机制,热激转录因子(hsf)是该调控网络中一类重要的功能基因。hsf家族是位于热胁迫传导链的末端调控元件,能够通过直接激活热胁迫和其它胁迫响应基因的表达从而提高植物抗逆性,是作物品种抗逆性改良的优异备选基因。
自80年代酵母hsf首先被发现以来,模式植物拟南芥和番茄hsf家族率先得到重点研究。近年来,随着生物信息学的快速发展,多种作物的hsf家族基因被推测和报道。不同作物家族基因数量不等,拟南芥和番茄分别有21个和24个,大田作物hsf家族基因数目多,玉米有30个,小麦家族至少有82个。hsf家族包括a、b和c家族,不同家族分多个亚族,每个亚族包括多个基因成员。研究表明,a2亚族基因不仅参与植株耐热性调控,还介导多种逆境胁迫响应过程,而多数抗逆调控过程与植物的抗氧化性密切相关。
多种生物和非生物胁迫诸如高低温、干旱、紫外辐射、病原微生物等,都可导致植物体内防御活性氧有关的酶促和非酶促两类防御活性氧的保护系统能力降低,产生并积累超氧自由基、诱发膜脂过氧化,而且积累过量的活性氧本身及其引发的膜脂过氧化产物反过来对植物的防御体系起破坏作用,从而加剧膜脂过氧化,加快植株衰老甚至死亡。因此提高植株的抗氧化能力对于增强植物体的整体抗性有着重要意义。发掘抗氧化关键基因并进行功能鉴定是基因应用的前提和基础。目前,功能明确的抗氧化性强的基因资源缺乏,通过抗氧化提高植株整体抗逆性的基因更少。
技术实现要素:
本发明的目的之一在于提供一个玉米热激转录因子基因zmhsf17,该基因的核苷酸序列如seqidno.1所示,其为作物抗逆性遗传改良和种质创新提供后备基因资源。
本发明的目的之二在于提供该玉米热激转录因子基因zmhsf17编码的蛋白质,该蛋白质的氨基酸序列如seqidno.2所示。
本发明的目的之三在于提供一种表达载体,该表达载体包含玉米热激转录因子基因zmhsf17。
进一步的,所述表达载体为pcambia1300-zmhsf17。
本发明的目的之四在于提供一种农杆菌细胞,该细胞包含玉米热激转录因子基因zmhsf17。
进一步的,所述农杆菌细胞为包含重组载体质粒pcambia1300-zmhsf17的农杆菌gv3101。
本发明的目的之五在于提供玉米热激转录因子基因zmhsf17在制备抗氧化植株中的应用。
为了实现上述目的,采用如下具体步骤:
(1)用于扩增所述玉米热激转录因子基因zmhsf17的引物对,所述引物对的正向引物序列seqidno.3、反向引物序列seqidno.4。通过引物对能从玉米自交系h21中扩增获得zmhsf17基因。
(2)定量分析zmhsf17所用的引物对,见反向引物seqidno.5和正向引物seqidno.6。定量内参基因β-actin,引物对为正向引物seqidno.7和反向引物seqidno.8。
(3)一种表达载体pcambia1300-gfp-zmhsf17,包含所述的玉米热激转录因子基因zmhsf17。扩增所用引物对为正向引物seqidno.9和反向引物seqidno.10,通过对烟草表皮细胞遗传转化可亚细胞定位zmhsf17编码的蛋白质。
(4)一种表达载体pcambia1300-zmhsf17,包含所述的玉米热激转录因子基因zmhsf17。扩增所用引物对为正向引物seqidno.11和反向引物seqidno.12。
(5)用于从拟南芥中扩增半定量分析所述玉米热激转录因子基因zmhsf17的引物对,所述引物对正向引物序列如seqidno.13所示、反向引物序列如seqidno.14所示。内参基因atactin2,半定量引物正向引物序列如seqidno.15所示、反向引物序列如seqidno.16所示。
(6)一种农杆菌细胞gv3101,包含重组载体质粒pcambia1300-zmhsf17,用于拟南芥遗传转化。
(7)通过对拟南芥野生型植株遗传转化zmhsf17可获得高抗氧化能力的拟南芥纯系植株。利用任何一种可以介导外源基因在植物中表达的载体,将本发明的zmhsf17基因转入植物后,植物均表现出更强的抗氧化能力。
(8)本发明的zmhsf17构建到植物表达载体时,在其转录起始核苷酸前可加上任意一种增强启动子或诱导启动子。携带本发明zmhsf17基因的载体可通过使用农杆菌介导、植物病毒载体、直接dna转化、显微注射等常规生物学方法转化植物细胞,创制新种质。
(9)一种含10mmol/lh2o2的hoagland营养液,用于外源处理玉米根系,诱导植株体内zmhsf17基因的表达。
(10)一种含h2o2的ms培养基,先配制ms培养基,灭菌、倒平板,冷却后将h2o2滴于培养基上并涂抹均匀(h2o2终浓度为4.6mmol/l)。用于转基因拟南芥幼苗的抗氧化能力鉴定。
上述seqidno.1-seqidno.16的具体序列如下所示:
seqidno.1(1122bp):
atggactcaacgctgaaccaggtgaaggaggagagccatggggagggaggagatttgatggcaggcacggtggaggccgcggatgggccgtctgcggccgtcgccgcggcaccaaagccgatggagggtctgcatgaccctgggccgccgccgttcctcaccaagacatatgacatggtcgacgactcggacaccgacctgattgtgtcgtggagcgccaccaacaacagcttcgtggtgtgggatccgcacgccttcgccacggtgctgctgcccaggcacttcaagcacaacaacttctccagcttcgtccggcagctcaacacctatggtttcaggaaggtggatcctgatcggtgggaattcgcgaatgagggctttttacggggacagagacacctcctgaagaacatcaggcgtcgaaaacctcctgctcagaatgccacaaaccagcagtccattgggccttaccttgaggtgggacattttggatatgatgcagagattgacatgttgaagagagacaagcagttactgatggcagaagtggtgaagctaaggcaggagcagcagaacacaaaggcaaatctcaaagcgatggaggataggctacaagggactgaacagaagcagcagcagatgatggcgttcttggcacgtgtcatgcggaatcctgaattcttgaagcacctggtttcccagaatgagatgaggaaggagcttcaagatgctatttcaaagaaaagaagacggcgcatcgaccaagggcctgaagctgatgacttgggggctagtagcagcttggagcaaggttcaccggtcctgtttaatgcccaggacccagtcgaattccttgtcgacggaatcccagctgacctcgagagcccagctttcgatggccacggcctgattgggccacatgatattgatattgatattggcagtacctctgagcagcagcaagacatgccccagggggatctgaatgacaacttctgggagcagttgctgaacgaaggacttggcgaggagaacgatagccctgtaatcgaggatgatatgaatgtgctgtctgagaagatgggttatctcaactcagatggcccaacatctagcaattag;
seqidno.2(373aa):
mdstlnqvkeeshgeggdlmagtveaadgpsaavaaapkpmeglhdpgpppfltktydmvddsdtdlivswsatnnsfvvwdphafatvllprhfkhnnfssfvrqlntygfrkvdpdrwefanegflrgqrhllknirrrkppaqnatnqqsigpylevghfgydaeidmlkrdkqllmaevvklrqeqqntkanlkamedrlqgteqkqqqmmaflarvmrnpeflkhlvsqnemrkelqdaiskkrrrridqgpeaddlgasssleqgspvlfnaqdpveflvdgipadlespafdghgligphdididigstseqqqdmpqgdlndnfweqllneglgeendspvieddmnvlsekmgylnsdgptssn;
seqidno.3:5′-tgacattgtccaacagactattcc-3′;
seqidno.4:5′-aggaattcagaagggcatggaaac-3′;
seqidno.5:5′-ccacaccacgaagctgtt-3′;
seqidno.6:5′-gaggagatttgatggcagg-3′;
seqidno.7:5′-tgtccatcacttgtgaagcctcct-3′;
seqidno.8:5′-acgaccttagccaatatcgcacca-3′;
seqidno.9:5′-gagaacacgggggactctagaatggactcaacgctg-3′;
seqidno.10:5′-gcccttgctcaccatggatccattgctagatgttgg-3′;
seqidno.11:5′-gagaacacgggggactctagaatggactcaacgctg-3′;
seqidno.12:5′-cgatcggggaaattcgagctcctaattgctagatgttgg-3′;
seqidno.13:5′-atggactcaacgctgaacc-3′;
seqidno.14:5′-tgatgttcttcaggaggtgtct-3′;
seqidno.15:5′-caatcgtgtgtgacaatgg-3′;
seqidno.16:5′-aaccctcgtagattggca-3′。
与现有技术相比,本发明具有如下有益效果:
本发明通过生物信息学和同源克隆技术相结合的方法获得完整的玉米热激转录因子基因zmhsf17,并通过分析h2o2处理对基因表达的上调和转基因植株表型的差异性,对其编码蛋白进行精确的抗氧化能力鉴定,以期为提高作物抗氧化进而增强整体抗性提供重要的基因资源。
本发明中,所有引物均特异性设计,对于准确克隆、鉴定、分析基因的表达至关重要,本发明通过创造性研究确定了诱导玉米植株zmhsf17基因最高表达的最适h2o2浓度阈值和基因表达出现峰值时间阈值,是进行蛋白抗氧化能力鉴定的前提和基础。更重要地,本发明进一步确定了使得转基因拟南芥与野生型幼苗表型呈现明显差异的最适h2o2处理浓度,是精准鉴定zmhsf17基因编码蛋白抗氧化能力的核心。
在玉米热激转录因子家族中,a2亚族基因尤其是zmhsf17对多种逆境胁迫诱导表达响应最显著,高表达zmhsf17能够显著提高植株抗氧化能力,进而提高植物整体抗逆性。本发明获得的zmhsf17基因作为作物抗逆分子育种优异的备选基因,具有重要的应用价值。
附图说明
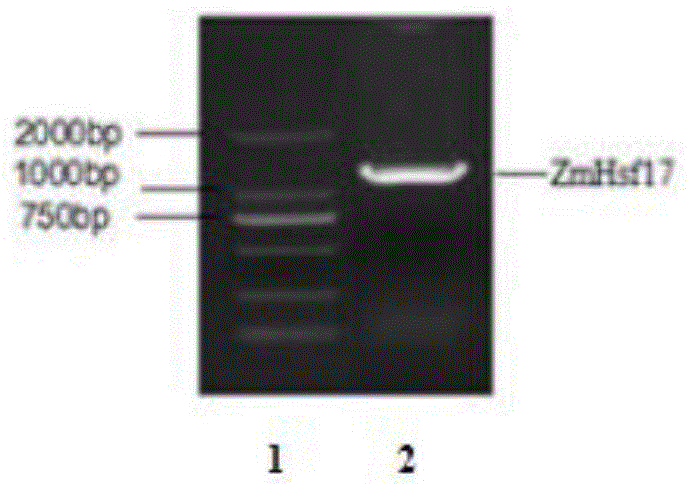
图1为实施例1中克隆获得的zmhsf17基因的凝胶电泳图。
图2为实施例1中10mmol/lh2o2处理玉米根系和叶片后zmhsf17基因表达的统计结果图。
图3为实施例1中玉米zmhsf17蛋白在烟草表皮细胞中的亚细胞定位图。
图4为实施例1中3个纯合转基因株系29_18,24_21和18_9的鉴定结果图。
图5为实施例1中3个拟南芥转基因系与野生型幼苗在ms培养基中的长势对比图。
图6为实施例1中3个拟南芥转基因系与野生型幼苗在含4.6mmol/lh2o2的ms培养基中的长势对比图。
图7为实施例1中正常和4.6mmol/lh2o2处理对转zmhsf17基因和wt拟南芥植株的叶绿素含量影响图。
具体实施方式
实施例1
本实施例提供了玉米热激转录因子基因zmhsf17的制备过程:
(1)外源h2o2处理玉米幼苗
供试材料为玉米(zeamaysl.)自交系h21(实验室备)。精选种子,经表面消毒后,用自来水反复冲洗,浸泡吸胀12h后,于28℃培养箱中催芽,根长1~2厘米时播至hoagland营养液中。待玉米幼苗长到二叶一芯时,将根系浸入含10mmol/lh2o2的hoagland溶液中处理,分别于0、15、30、60、90、120、240和480min取根系和第一展开叶,液氮速冻后用于zmhsf17基因定量分析。
(2)rna提取
将冷冻后的根系和叶片分别放入研钵中迅速研磨,直至植物组织成粉末状,期间不断补加液氮。迅速将研磨后的组织样品分装到rnase-free的1.5ml离心管中,每管约100mg,每个离心管加入1mlredzol(北京赛百盛),涡旋后将匀浆液30℃静置5min使其充分裂解。
分相:每个离心管中加入200μl氯仿,涡旋混匀后室温静置3min。4℃、12,000g离心15min。离心后混合物分成三相(下面氯仿相、中间白色界面、上面无色水相),rna全部在无色水相中。
沉淀rna:将上层水相转移到新的1.5mlrnase-free离心管中,加入500μl异丙醇,充分混匀后,室温静置10min,然后4℃12,000g离心10min,白色的rna小团沉淀在离心管的底部和侧面。
洗涤rna:弃上清,rna沉淀于管底。加入1ml75%乙醇,漂洗3次rna沉淀,4℃、7,500g离心5min,弃上清。
溶解rna:在无菌工作台中干燥rna沉淀10min。用50μldepc处理h2o溶解rna样品,55-60℃温育10min使rna完全溶解。通过260nm/280nm紫外吸收检测rna的质量和浓度。
(3)cdna第一链合成
primescriptrtreagentkitwithgdnakit购买于takara公司,将试剂盒中的试剂解冻后轻轻混匀、放置于冰盒上。分别向200μlnuclease-freepcr管中加入3μgtotalrna和1μloligo(dt)18primer,并用nuclease-freewater补足至12μl,轻微混匀并离心。混合体系在pcr仪中65℃、5min后放置于冰上冷却。向每个pcr管中加入4μl5xreactionbuffer、1μlribolockrnaseinhibitor(20u/μl)、2μl10mmdntpmix、1μlrevertaidm-mulvrt(200u/μl),轻微混匀并离心。将反应体系在pcr仪中42℃、60min反应,70℃、5min变性后-20℃储存。
(4)基因克隆
利用seqidno.3和seqidno.4引物对,使用高保真酶primerstar(takara公司)进行基因扩增,对pcr产物进行琼脂糖凝胶电泳分离,结果如图1所示,其中1为marker,2为目的基因。对1000bp~2000bp之间清晰目标片段进行切胶并回收凝胶(使用takaraminibestagarosegeldnaextractionkit),用nanodrop2000测定回收片段浓度。使用p-easy-bluntcloningkit(北京全式金生物技术有限公司)进行片段与载体的连接,将连接后的质粒转入大肠杆菌感受态细胞,进行抗性筛选,挑取单克隆进行pcr验证后,送上海生工生物工程股份有限公司进行测序。
(5)玉米zmhsf17基因定量分析
利用特异引物对seqidno.5和seqidno.6,对步骤(1)中的玉米根须和叶片进行zmhsf17表达定量分析,内参基因为β-actin,其引物对为seqidno.7和seqidno.8,采用2-△△ct方法进行基因相对定量表达分析,试验结果如图2所示,10mmol/lh2o2处理玉米根系可同时提高根系和叶片zmhsf17基因的表达,叶片中上调倍数达6倍左右,峰值出现的时间均为90min;根系峰值低于叶片,但出现的时间更早,表明根系对h2o2处理更敏感。
(6)转化烟草表皮细胞并观察亚细胞定位
通过特异性正向引物seqidno.9和反向引物seqidno.10,扩增zmhsf17编码序列,产物经限制性内切酶hindiii和bamhi消化后,连接到表达载体pcambia1300-gfp上。连接产物转化农杆菌gv3101感受态细胞,涂布在含有100μg/ml卡那霉素和25μg/ml利福平的lb固体培养基上,筛选阳性克隆。挑单克隆于3ml含卡那霉素抗性(终浓度100μg/ml)液体lb培养基中,28℃、200r/min摇床中培养2d左右。取2ml菌液,4000r/min离心5min,去上清液,加1ml重悬液涡旋;测od600,用重悬液将菌液od600调成0.4(根据细菌活力需要0.1~0.8,不要超过1),室温静置1~3h。在叶片上编号,用1ml的注射器从背面将菌液注射到烟草(nicotianatabacuml.)叶片,然后向叶片喷水,套上保鲜袋,黑暗放置过夜,第2d打开保鲜袋(注射后2~3d表达量最高)。撕取烟草表皮细胞,于22℃暗培养16h,然后放入浓度为10μg/ml的4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,dapi)染色3~5min,用生理盐水冲洗干净,置于激光共聚焦显微镜(zeissmeta510)下观察荧光,结果如图3所示,其中a为明场,b为gfp绿色荧光,c为细胞核dapi蓝色荧光,d为叠加图像。
由图3可知zmhsf17蛋白定位于细胞核内。
(7)植物表达载体pcambia1300-zmhsf17的构建
利用重组的方法将zmhsf17基因构建到双元表达载体pcambia1300上。首先,以酶切连接的方法将35s启动子插入到pcambia1300多克隆位点处的限制性酶切位点hindiii和xbai之间;以酶切连接的方法将nos终止子插入到pcambia1300多克隆位点处的限制性酶切位点saci和ecori之间;利用clonexpressii(诺唯赞生物科技有限公司)重组反应系统设计扩增zmhsf17特异引物seqidno.11和seqidno.12。利用限制性内切酶xbai和saci(neb公司)对改造载体进行酶切,将seqidno.11和seqidno.12的pcr扩增产物与线性化载体按1:2的摩尔比混合,利用clonexpressii快速克隆技术进行重组反应,将zmhsf17基因插入到35s启动子和nos终止子之间。
(8)农杆菌gv3101感受态细胞制备及转化
从lb平板上挑取根癌农杆菌单菌落,接种于含25mg/l利福平的lb液体培养基中,200rpm、28℃条件下培养过夜。取2ml过夜培养液接种于50ml含相同抗生素的lb液体培养基中,相同条件下培养至od600=0.5。菌液冰浴30min,4℃、5000rpm离心10min,收集菌体,将菌体重悬于冰浴的10ml0.15mol/l的nacl中,离心收集菌体。再悬浮于lml20mmol/l预冷的cacl2溶液中,以200μl/管将菌液分装在1mleppendorf管中,置液氮中速冻1min,-70℃保存备用。在室温下融化农杆菌感受态细胞,加入1μg表达载体质粒(pcambia1300-zmhsf17)dna,混匀后冰浴30min;置液氮速冻3min,迅速移至37℃保温3min;加入无抗生素的lb800μl,28℃震荡培养4h;5000rpm离心30s收集菌体,涂于含有25mg/l利福平和25mg/l潮霉素b的lb平板上,28℃倒置暗培养2~3天。pcr检测阳性菌株进行拟南芥转化。
(9)转化拟南芥野生型植株
选取鉴定为阳性的gv3101菌株,在lb液体培养基(含50mg/l卡那霉素和25mg/l利福平)中过夜培养。培养基中加入渗透培养基重悬农杆菌至od600达0.8~1.2之间。加入silwetl-77至终浓度0.05%,振摇混匀。通过真空蘸花法转化野生型拟南芥(arabidopsisthalianal.,生态型为columbia),浸入农杆菌悬液3~5min后,保鲜膜将拟南芥植株放倒置于托盘中,覆盖塑料布保湿避光过夜;次日将塑料布揭开透气,将拟南芥放置到培养架上正常培养,成熟后收获种子。
(10)转zmhsf17基因的拟南芥阳性苗筛选
将转化后的t0代种子消毒后播种在含有25μg/ml潮霉素的ms培养基上,4℃春化3天,然后正常光照培养。一周后即可分辨出已转入外源基因的拟南芥幼苗。由于双元载体上具有潮霉素抗性位点,所以抗性苗子叶为绿色,下胚轴较长,根伸长并长出两片正常的真叶;非转化体没有抗性,子叶虽绿、但没有正常真叶生长,胚根停止生长。
移栽抗性植株继续培养,收取t1代种子。将t1代种子播种在含25μg/ml潮霉素的培养基上继续筛选,根据t2代的分离比判定是否为单位点插入。选取单位点插入的转基因植株移栽,单株收取t3代种子,然后种在含25μg/ml的ms的培养基上进一步筛选,纯合体不再发生分离。
(11)转zmhsf17基因拟南芥幼苗抗氧化性鉴定
配制含4.6mmol/lh2o2的ms培养基,灭菌、倒平板。利用zmhsf17半定量引物对seqidno.13和seqidno.14、以及内参基因atactin2的引物对seqidno.15和seqidno.16,经pcr鉴定,选取3个纯合转基因株系29_18,24_21和18_9,结果如图4所示。将上述3个纯合转基因株系29_18,24_21和18_9的种子进行清洗、浸泡、消毒后,平铺于ms培养基上,4℃春化2天,22℃光照培养8天,进行抗氧化性鉴定,观察表型并拍照。结果显示,3个拟南芥转基因系与野生型幼苗在ms培养基中的长势对比如图5所示,可知其没有明显差异,其在含4.6mmol/lh2o2的ms培养基中的长势对比如图6所示,可知所有幼苗的都表现出黄叶,3个转基因系的长势均好于野生型wt幼苗,幼苗死亡少于wt型,说明转基因系抗氧化能力明显高于wt幼苗,尤其是转基因株系24_21,表现出最强抗氧化性。正常生长条件下,野生型wt和3个转基因系叶绿素含量无明显差异,含量为0.6~0.7mg/g·fw之间。h2o2处理后,叶绿素含量均降低,但3个转基因株系叶绿素含量明显高于野生型,其对比结果如图7所示,由图7可知叶绿素含量进一步证明了表型差异性。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
序列表
<110>河北省农林科学院遗传生理研究所(河北省农林科学院农产品质量安全研究中心)
<120>一个玉米热激转录因子基因zmhsf17编码蛋白的抗氧化功能及其应用
<130>2020.12.28
<141>2020-12-31
<160>16
<170>siposequencelisting1.0
<210>1
<211>1122
<212>dna
<213>玉米()
<400>1
atggactcaacgctgaaccaggtgaaggaggagagccatggggagggaggagatttgatg60
gcaggcacggtggaggccgcggatgggccgtctgcggccgtcgccgcggcaccaaagccg120
atggagggtctgcatgaccctgggccgccgccgttcctcaccaagacatatgacatggtc180
gacgactcggacaccgacctgattgtgtcgtggagcgccaccaacaacagcttcgtggtg240
tgggatccgcacgccttcgccacggtgctgctgcccaggcacttcaagcacaacaacttc300
tccagcttcgtccggcagctcaacacctatggtttcaggaaggtggatcctgatcggtgg360
gaattcgcgaatgagggctttttacggggacagagacacctcctgaagaacatcaggcgt420
cgaaaacctcctgctcagaatgccacaaaccagcagtccattgggccttaccttgaggtg480
ggacattttggatatgatgcagagattgacatgttgaagagagacaagcagttactgatg540
gcagaagtggtgaagctaaggcaggagcagcagaacacaaaggcaaatctcaaagcgatg600
gaggataggctacaagggactgaacagaagcagcagcagatgatggcgttcttggcacgt660
gtcatgcggaatcctgaattcttgaagcacctggtttcccagaatgagatgaggaaggag720
cttcaagatgctatttcaaagaaaagaagacggcgcatcgaccaagggcctgaagctgat780
gacttgggggctagtagcagcttggagcaaggttcaccggtcctgtttaatgcccaggac840
ccagtcgaattccttgtcgacggaatcccagctgacctcgagagcccagctttcgatggc900
cacggcctgattgggccacatgatattgatattgatattggcagtacctctgagcagcag960
caagacatgccccagggggatctgaatgacaacttctgggagcagttgctgaacgaagga1020
cttggcgaggagaacgatagccctgtaatcgaggatgatatgaatgtgctgtctgagaag1080
atgggttatctcaactcagatggcccaacatctagcaattag1122
<210>2
<211>373
<212>prt
<213>玉米()
<400>2
metaspserthrleuasnglnvallysglugluserhisglyglugly
151015
glyaspleumetalaglythrvalglualaalaaspglyproserala
202530
alavalalaalaalaprolysprometgluglyleuhisaspprogly
354045
propropropheleuthrlysthrtyraspmetvalaspaspserasp
505560
thraspleuilevalsertrpseralathrasnasnserphevalval
65707580
trpaspprohisalaphealathrvalleuleuproarghisphelys
859095
hisasnasnpheserserphevalargglnleuasnthrtyrglyphe
100105110
arglysvalaspproaspargtrpgluphealaasngluglypheleu
115120125
argglyglnarghisleuleulysasnileargargarglyspropro
130135140
alaglnasnalathrasnglnglnserileglyprotyrleugluval
145150155160
glyhispheglytyraspalagluileaspmetleulysargasplys
165170175
glnleuleumetalagluvalvallysleuargglngluglnglnasn
180185190
thrlysalaasnleulysalametgluaspargleuglnglythrglu
195200205
glnlysglnglnglnmetmetalapheleualaargvalmetargasn
210215220
proglupheleulyshisleuvalserglnasnglumetarglysglu
225230235240
leuglnaspalaileserlyslysargargargargileaspglngly
245250255
proglualaaspaspleuglyalaserserserleugluglnglyser
260265270
provalleupheasnalaglnaspprovalglupheleuvalaspgly
275280285
ileproalaaspleugluserproalapheaspglyhisglyleuile
290295300
glyprohisaspileaspileaspileglyserthrsergluglngln
305310315320
glnaspmetproglnglyaspleuasnaspasnphetrpgluglnleu
325330335
leuasngluglyleuglyglugluasnaspserprovalilegluasp
340345350
aspmetasnvalleuserglulysmetglytyrleuasnseraspgly
355360365
prothrserserasn
370
<210>3
<211>24
<212>dna
<213>人工序列()
<400>3
tgacattgtccaacagactattcc24
<210>4
<211>24
<212>dna
<213>人工序列()
<400>4
aggaattcagaagggcatggaaac24
<210>5
<211>18
<212>dna
<213>人工序列()
<400>5
ccacaccacgaagctgtt18
<210>6
<211>19
<212>dna
<213>人工序列()
<400>6
gaggagatttgatggcagg19
<210>7
<211>24
<212>dna
<213>人工序列()
<400>7
tgtccatcacttgtgaagcctcct24
<210>8
<211>24
<212>dna
<213>人工序列()
<400>8
acgaccttagccaatatcgcacca24
<210>9
<211>36
<212>dna
<213>人工序列()
<400>9
gagaacacgggggactctagaatggactcaacgctg36
<210>10
<211>36
<212>dna
<213>人工序列()
<400>10
gcccttgctcaccatggatccattgctagatgttgg36
<210>11
<211>36
<212>dna
<213>人工序列()
<400>11
gagaacacgggggactctagaatggactcaacgctg36
<210>12
<211>39
<212>dna
<213>人工序列()
<400>12
cgatcggggaaattcgagctcctaattgctagatgttgg39
<210>13
<211>19
<212>dna
<213>人工序列()
<400>13
atggactcaacgctgaacc19
<210>14
<211>22
<212>dna
<213>人工序列()
<400>14
tgatgttcttcaggaggtgtct22
<210>15
<211>19
<212>dna
<213>人工序列()
<400>15
caatcgtgtgtgacaatgg19
<210>16
<211>18
<212>dna
<213>人工序列()
<400>16
aaccctcgtagattggca18
- 还没有人留言评论。精彩留言会获得点赞!