一种基于生理环境下的细胞动态观测模组的制作方法
本实用新型涉及细胞观测技术领域,特别是涉及一种基于生理环境下的细胞动态观测模组。
背景技术:
细胞活体高分辨成像是生物成像技术的发展方向,也是生命科学领域具有挑战性的技术难题。
目前,普通光学显微镜、荧光显微镜,激光扫描共聚焦显微镜,以可见光、紫外光、激光、x-射线等作为激发源,实现了活细胞成像,但分辨率低,仅为亚微米水平,不能识别单个蛋白等细胞超微结构。相反,由于扫描电子显微镜的分辨率小于1nm,透射电子显微镜的分辨率更可达到亚埃级别,从而可以用于识别单个蛋白等细胞超微结构。这两种显微镜在进行细胞观测时,通过与液体样品杆结合,可实现样品在液体中成像,但由于样品室的空间小,难以构建适合全细胞到膜蛋白等单分子尺度的观察条件,并且对于透射电子显微镜而言,在观测时,高能量和高辐照剂量的电子束也是生物活体难以相容的。与此同时,冷冻电镜能够观察到提纯的冷冻生物分子结构,但不能在生理环境下对细胞进行动态观测,这大大影响到对细胞的观测效果,并难以基于观测结果对细胞的病例特征、细胞间的相互作用及细胞对药物的反应机理实施有效的研究。
技术实现要素:
本实用新型实施例提供一种基于生理环境下的细胞动态观测模组,用于解决当前对细胞活体进行观测时,存在样品室容纳空间小,并难以在生理环境下对细胞进行动态观测的问题。
为了解决上述技术问题,本实用新型实施例提供了一种基于生理环境下的细胞动态观测模组,包括平行相对布置的第一芯片和第二芯片;所述第一芯片、所述第二芯片之间通过设置的环形围框构成一个封闭式间隙空间;所述第一芯片上设有第一透明窗口,所述第二芯片上设有第二透明窗口,所述第一透明窗口与所述第二透明窗口相对应;所述第二芯片上还设有气体进口和/或液体进口、液体出口及加热电阻,所述气体进口、所述液体进口、所述液体出口及所述第二透明窗口位于所述环形围框所围成的区域内。
其中,还包括压盖和承载平台;所述第一芯片、所述第二芯片安装在所述压盖与所述承载平台之间,所述第一芯片靠近所述压盖设置,所述第二芯片靠近所述承载平台设置;所述压盖上设有与所述第一透明窗口相对应的入射电子束窗口,所述承载平台上设有与所述第二透明窗口相对应的出射电子束窗口。
其中,所述承载平台上还设有输气通道、输液通道及排液通道;所述输气通道的一端与所述气体进口对应连通,所述输液通道的一端与所述液体进口对应连通,所述排液通道的一端与所述液体出口对应连通。
其中,还包括第一密封圈和/或第二密封圈;所述第一密封圈设置在所述压盖与所述第一芯片之间,并沿所述入射电子束窗口布置;所述第二密封圈设置在所述第二芯片与所述承载平台之间,所述第二密封圈包括多个,并分别沿所述气体进口、所述液体进口及所述液体出口布置。
其中,还包括第三密封圈;所述第三密封圈设置在所述压盖与所述第二芯片之间,所述第一芯片位于所述第三密封圈所围成的区域内。
其中,所述第一透明窗口与所述第二透明窗口均包括多个呈阵列排布的单元窗口,所述单元窗口为低应力氮化硅薄膜窗口;所述第一透明窗口与所述第二透明窗口相应的单元窗口呈一一相对布置,并构成多个微腔。
其中,所述气体进口和/或所述液体进口设置在所述第二透明窗口的一侧,所述第二透明窗口相应的另一侧设置所述液体出口。
其中,所述加热电阻以曲线状排布在所述第二芯片上,并位于所述环形围框的外侧;所述加热电阻的一端连接第一压焊区和第二压焊区,另一端连接第三压焊区和第四压焊区。
其中,所述低应力氮化硅薄膜窗口的厚度为20-50nm;所述微腔的长为20-150μm,宽为20-100μm,厚度为1-3μm。
本实用新型实施例提供的基于生理环境下的细胞动态观测模组,在对细胞活体进行观测时,第一透明窗口与第二透明窗口之间可构成较大容积的样品室,通过在第二透明窗口处进行细胞爬片,将由第一芯片、第二芯片及环形围框构成的封闭式间隙空间设置成与扫描电子显微镜的真空环境相隔绝,通过气体进口向相应的真空环境中通入气体,和/或通过液体进口向相应的封闭环境中通入液体,通过加热电阻来控制相应真空环境的温度,扫描电子显微镜的电子束在穿过第一透明窗口并从样品表面反射,散射的电子穿过第一透明窗口时或直接从样品透射的电子在穿过第二透明窗口时,可在模拟的生理环境下同时对多个细胞同时进行观测,并在观测完成后可通过液体出口排出废液,以待下次观测。
由此可见,本实用新型的样品室容纳空间大,可对多个细胞(上百个细胞)同时进行观测,实现了模拟满足细胞生长的相应的气液生理环境,提高了细胞的存活率及生物活性,并在观测的过程中,可通过调节相应真空环境的进气和进液的气压与流速,并调控真空环境的温湿度,可使得细胞成像环境可控。
与此同时,本实用新型实施例所示的细胞动态观测模组在基于扫描电子显微镜进行观测时,细胞活体的成像分辨率高,可达到识别和测试特异性标识的单一蛋白分子,并在观测过程中,放大倍率在50-400000倍之间连续可调,实现细胞群-单细胞-亚细胞-单个蛋白等细胞超微结构(微米-亚微米-纳米)的跨尺度高倍率动态观测,从而尤其可用于研究细胞的病理特征,以及细胞表面蛋白之间、细胞之间、细胞与环境之间的相互作用,以及细胞对药物的反应机理。
附图说明
为了更清楚地说明本实用新型实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本实用新型的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本实用新型实施例所示的基于生理环境下的细胞动态观测模组的剖面结构示意图;
图2为本实用新型实施例所示的基于生理环境下的细胞动态观测模组的俯视结构示意图。
附图标记说明:1、第一芯片;2、第二芯片;3、环形围框;4、第一透明窗口;5、第二透明窗口;6、气体进口;7、液体进口;8、液体出口;9、加热电阻;10、压盖;11、承载平台;12、入射电子束窗口;13、出射电子束窗口;14、输气通道;15、输液通道;16、排液通道;17、第一密封圈;18、第二密封圈;19、第三密封圈;20、第一压焊区;21、第二压焊区;22、第三压焊区;23、第四压焊区。
具体实施方式
为使本实用新型实施例的目的、技术方案和优点更加清楚,下面将结合本实用新型实施例中的附图,对本实用新型实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本实用新型一部分实施例,而不是全部的实施例。基于本实用新型中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本实用新型保护的范围。
在本实用新型的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本实用新型中的具体含义。
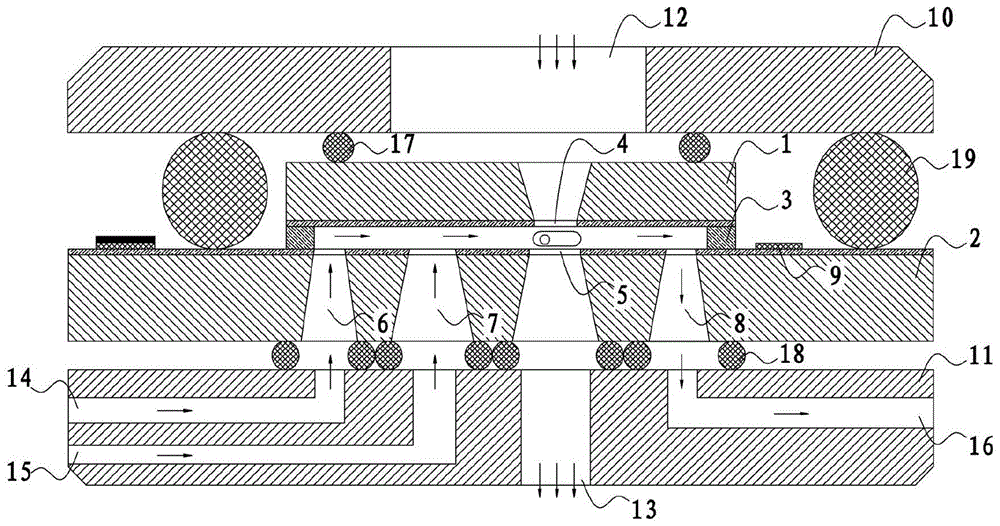
参见图1至图2,本实施例提供了一种基于生理环境下的细胞动态观测模组,包括平行相对布置的第一芯片1和第二芯片2;第一芯片1、第二芯片2之间通过设置的环形围框3构成一个封闭式间隙空间;第一芯片1上设有第一透明窗口4,第二芯片2上设有第二透明窗口5,第一透明窗口4与第二透明窗口5相对应;第二芯片2上还设有气体进口6和/或液体进口7、液体出口8及加热电阻9,气体进口6、液体进口7、液体出口8及第二透明窗口5位于环形围框3所围成的区域内。
具体的,本实施例所示的基于生理环境下的细胞动态观测模组,在对细胞活体进行观测时,第一透明窗口4与第二透明窗口5之间可构成较大容积的样品室,通过在第二透明窗口5处进行细胞爬片,将由第一芯片1、第二芯片2及环形围框3构成的封闭式间隙空间设置成与扫描电子显微镜的真空环境相隔绝,通过气体进口6向相应的真空环境中通入气体,和/或通过液体进口7向相应的真空环境中通入液体,通过加热电阻9来控制相应真空环境的温度,扫描电子显微镜的电子束在穿过第一透明窗口4并从样品表面反射,散射的电子穿过第一透明窗口4时或直接从样品透射的电子在穿过第二透明窗口5时,可在模拟的生理环境下同时对多个细胞同时进行观测,并在观测完成后可通过液体出口8排出废液,以待下次观测。
由此可见,本实用新型的样品室容纳空间大,可同时对多个细胞(上百个细胞)进行观测,实现了模拟满足细胞生长的相应的气液生理环境,在其中一个具体实施例中可模拟的生理环境为,温度37℃,通入气体为5%体积比的co2,湿度为100%rh,气压为1atm,由此,在模拟的相应的生理环境中,可大大提高细胞的存活率及生物活性,并进行相应的观测试验。与此同时,在进一步的观测过程中,可通过相应的压力表、流量计、万用电表等相应的检测设备,调节相应真空环境的进气和进液的气压与流速,调控真空环境的温湿度,可使得细胞成像环境可控。
在此应指出的是,第一透明窗口4与第二透明窗口5均包括多个呈阵列排布的单元窗口,单元窗口为低应力氮化硅薄膜窗口,厚度为20-50nm;第一透明窗口4与第二透明窗口5相应的单元窗口呈一一相对布置,并构成多个微腔,多个微腔相应地构成了微腔阵列,每个微腔可容纳2-4个细胞,从而第一透明窗口4与第二透明窗口5之间构成的样品室具有了较大的容积,可对容纳几百个以上的细胞同时观测,其中,对于每个微腔而言,微腔的长为20-150μm,宽为20-100μm,厚度为1-3μm,在其中的一个具体实施例中,可设置微腔的长为120μm,宽为50μm。本实施例所示的环形围框3为设置在下芯片上的多晶硅层,多晶硅层的高度与微腔的厚度一致。
进一步的,第一透明窗口4与第二透明窗口5相应地设置在第一芯片1、第二芯片2的中心部位,并且在其中一个具体实施例中,第一透明窗口4与第二透明窗口5均设置有多个低应力氮化硅薄膜窗口,并构成对应设置的m*n矩形阵列,其中,m,n取值为1-5中任一的整数。
如图2所示,本实施例具体给出了第一透明窗口4与第二透明窗口5均设置有9个低应力氮化硅薄膜窗口,并构成对应设置的3*3矩形阵列。
对于本实施例所示的第一芯片1、第二芯片2而言,均是采用双面抛光硅片作为衬底,通过半导体微机电系统加工工艺技术制造而成,其中,上芯片的基体厚度为200-500μm,上芯片的长宽尺寸为0.5cm*1cm;下芯片的基体厚度为200-500μm,下芯片的长宽尺寸为1.5cm*2cm。
与此同时,本实施例所示的加热电阻9作为加热部件,并通过在下芯片上热传导的方式来调控模拟的相应生理环境的温度,在实际检测过程中,通过四电极法测量模拟的细胞环境温度,并通过反馈来调节外部加热电阻9的功率,达到细胞适合生存的温度环境,其中,加热电阻9既可设置在环形围框3所围成的区域内,也可设置在环形围框3所围成的区域外,并对加热电阻9的具体排布形式也不作限制,只要便于加热电阻9工作发热的热传导,并便于对加热电阻9进行相应的参数检测即可。
优选地,本实施例中还包括压盖10和承载平台11;第一芯片1、第二芯片2安装在压盖10与承载平台11之间,第一芯片1靠近压盖10设置,第二芯片2靠近承载平台11设置;压盖10上设有与第一透明窗口4相对应的入射电子束窗口12,承载平台11上设有与第二透明窗口5相对应的出射电子束窗口13。
具体的,在实际组装时,可将压盖10、第一芯片1、第二芯片2及承载平台11从上往下依次排列,并通过锁紧螺栓将第一芯片1、第二芯片2紧固在压盖10与承载平台11之间,以便于在扫描电子显微镜的搭载平台进行搭载安装,并进行相应的观测实验,其中,压盖10与承载平台11均由金属材质制成。
优选地,为了便于向上述模拟真空环境中通气、通液,并在检测完成后进行废液排放,本实施例在承载平台11上还设有输气通道14、输液通道15及排液通道16;输气通道14的一端与气体进口6对应连通,输液通道15的一端与液体进口7对应连通,排液通道16的一端与液体出口8对应连通。
优选地,本实施例还包括第一密封圈17和/或第二密封圈18;第一密封圈17设置在压盖10与第一芯片1之间,并沿入射电子束窗口12布置;第二密封圈18设置在第二芯片2与承载平台11之间,第二密封圈18包括多个,并分别沿气体进口6、液体进口7及液体出口8布置。
具体的,第一密封圈17用于确保压盖10与第一芯片1之间的接触密封,并防止第一芯片1因与压盖10直接刚性接触而造成损伤;相应的,第二密封圈18用于确保输气通道14的端口与气体进口6之间、输液通道15的端口与液体进口7之间及排液通道16的端口与液体出口8之间较好的密封性,也用于防止第二芯片2因与承载平台11直接刚性接触而造成损伤。
进一步的,本实施例还包括第三密封圈19;第三密封圈19设置在压盖10与第二芯片2之间,第一芯片1位于第三密封圈19所围成的区域内。
具体的,第三密封圈19用于确保压盖10与第二芯片2之间的接触密封,并防止第二芯片2因与压盖10直接刚性接触而造成损伤。与此同时,在第一芯片1、第二芯片2及环形围框3构成的封闭式间隙空间出现气体泄漏时,由压盖10、第一密封圈17、第一芯片1、第二芯片2及第三密封圈19围成的密封腔体还可构成第二道密封防护,有效防止了外界环境因素对细胞成像的影响。
优选地,本实施例中气体进口6和/或液体进口7设置在第二透明窗口5的一侧,第二透明窗口5相应的另一侧设置液体出口8。
具体的,通过对气体进口6、液体进口7及液体出口8的排布位置进行如上设置,可使得加入的气体和液体在预先混合后,再通过细胞爬片,以持续维持细胞的生理环境,并通过液体出口8排出废液。
优选地,本实施例中加热电阻9以曲线状排布在第二芯片2上,并位于环形围框3的外侧;加热电阻9的一端连接第一压焊区20和第二压焊区21,另一端连接第三压焊区22和第四压焊区23。
具体的,如图1与图2所示,第一芯片1靠近其周边的端面压覆在环形围框3上,加热电阻9的两端设置在环形围框3外侧的一侧边,加热电阻9的中部以曲线状沿着环形围框3另外三个侧边的外侧排布,其中,加热电阻9具体为铂电阻丝,加热电阻9两端对应连接的第一压焊区20、第二压焊区21、第三压焊区22和第四压焊区23作为电极,具体为采用蒸发剥离得到的金压焊区。另外,对加热电阻9采用四电极法进行温度测量,可相应的控制模拟的生理环境的温度。
基于上述实施例,对本实用新型所示的基于生理环境下的细胞动态观测模组的组装步骤具体如下所示:
首先,在第二芯片2对应的低应力氮化硅薄膜窗口处将细胞进行爬片,将第二密封圈18相应地摆放在承载平台11上输气通道14、输液通道15及排液通道16对应的端口处,并与第二芯片2上相应的气体进口6、液体进口7及液体出口8相对应;
然后,将第一芯片1放置在第二芯片2的环形围框3上,并使得第一芯片1与第二芯片2相应的各个低应力氮化硅薄膜窗口相对齐;
接着,将第一密封圈17放置在第一芯片1上,将第三密封圈19放置在第二芯片2,将压盖10同时压覆在第一密封圈17和第三密封圈19上,并通过锁紧螺栓将第一芯片1、第二芯片2紧固在压盖10与承载平台11之间;
接着,将上述得到的细胞观测模组安装在扫描电子显微镜的搭载平台上,调整参数至最佳观测状态。在观测时,对加热电阻9通电加热,并连接万用表,用四电极法测出加热电阻9的电阻,通过电阻与温度之间的线性关系测量其温度,对模拟的细胞所在的生理环境进行加热并控制温度,在该生理环境中,先通入液体,再通入气体,控制液体压力与气体流量,待环境稳定,即可原位观测生理环境细胞动态变化。
另外,在此应当指出的是,第一芯片1、第二芯片2均可采取半导体微机电系统制造技术实现大批量生产,并可确保相同的质量,下面以第二芯片2的加工工艺步骤进行具体说明。
首先,通过采用双面抛光硅片作为衬底,在双面抛光硅片的表面通过lpcvd(低压化学气相沉积法)生长形成厚度为20-50nm的氮化硅层;然后,通过磁控溅射在氮化硅层的表面溅射50nm厚的钛(ti)或铬(cr)粘附层,再继续在粘附层上溅射一层厚度为200nm铂(pt)金属层;接着,进行第一次光刻,形成与如图2所示的加热电阻9相应的导线图形,并对其进行刻蚀;接着,进行第二次光刻,蒸发剥离形成金(au)压焊区电极;接着,通过pecvd(等离子体增强化学气相沉积法)在表面生长厚度为200nm的氧化硅绝缘层;接着,进行第三次光刻,并刻蚀掉表面氧化硅,释放四个压焊区、气体进口6、液体进口7、液体出口8及阵列排布的低应力氮化硅薄膜窗口表面的氧化硅;接着,进行第四次光刻,刻蚀掉气体进口6、液体进口7及液体出口8处的表面氮化硅;接着,将上述双面抛光硅片翻转至背面,进行第五次光刻,刻蚀掉低应力氮化硅薄膜窗口所需刻蚀区域的背面氮化硅与氧化硅,将上述双面抛光硅片置于硅湿法刻蚀剂中,进行各向异性湿法腐蚀至表面氮化硅截止层,形成最终获得的低应力氮化硅薄膜窗口,完成工艺步骤,结束。
优选地,本实施例在另一方面还提供了一种扫描电子显微镜,包括搭载平台,搭载平台上安装如上所述实施例所示的基于生理环境下的细胞动态观测模组。
具体的,本实施例所示的扫描电子显微镜,由于采用了上述基于生理环境下的细胞动态观测模组,从而细胞活体的成像分辨率高,其中,主机分辨率约0.8nm;细胞在液体环境中的分辨率约10nm(液体厚度1-3μm),可达到识别和测试特异性标识的单一蛋白分子,并在观测过程中,放大倍率在50-400000倍之间连续可调,实现细胞群-单细胞-亚细胞-单个蛋白等细胞超微结构(微米-亚微米-纳米)的跨尺度高倍率动态观测,从而可尤其用于研究细胞的病理特征,以及细胞表面蛋白之间、细胞之间、细胞与环境之间的相互作用,以及细胞对药物的反应机理。
以上所述仅为本实用新型的较佳实施例而已,并不用以限制本实用新型,凡在本实用新型的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本实用新型的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!