治疗亨廷顿病的组合物和方法与流程
治疗亨廷顿病的组合物和方法
1.本技术根据35u.s.c.
§
119(e)要求对2019年3月8日提交的美国临时专利申请号62/815,647的优先权。前述申请是通过引用并入本文。
技术领域
2.本发明总体上涉及基因沉默领域。具体地,本发明提供用于调节亨廷顿蛋白基因的表达的组合物和方法。
背景技术:
3.亨廷顿病(hd)是一种常染色体显性神经系统变性疾病。hd是聚谷氨酰胺(聚q)障碍家族的一部分,所述家族包含至少九种不同的神经系统变性疾病,它们源自特定基因(例如,亨廷顿蛋白)中可变扩增的三核苷酸cag重复(walker,f.o.(2007)lancet,369:218-228;walker,f.o.(2007)semin.neurol.,27:143-150)。所述扩增的大小与发病年龄(例如,成年发病与幼年型)呈部分负相关。hd是由亨廷顿蛋白基因的第一外显子内的cag重复扩增(约》36个重复)引起的。
4.亨廷顿蛋白基因(htt)和蛋白质(htt)广泛且普遍地表达,但是所述疾病具有选择性神经元易损性的模式(例如,在脑内)(ambrose等人(1994)somat.cell mol.genet.,20:27-38;landles等人(2004)embo rep.,5:958-963)。htt的正常功能和突变体htt的病理学机制都没有被完全理解。可能存在多种机制,包括功能的毒性增益和野生型功能的丧失。值得注意的是,可以在不同位置和不同类型的神经元中发现htt蛋白的聚集体。
5.对于hd不存在治愈,并且治疗集中于管理其症状(johnson等人(2010)hum.mol.genet.,19:r98-r102)。近期数据表明,全长和截短的mrna转录物及其相关蛋白质产物存在于hd患者中,并且对神经元功能障碍和死亡的机制有贡献(sathasivam等人(2013)proc.natl.acad.sci.,110:2366-2370)。值得注意的是,遗传修饰的小鼠模型的应用显示,如果消除突变体亨廷顿蛋白表达,即使在晚期疾病阶段,hd样疾病表型可能消退(yamamoto等人(2000)cell,101:57-66;diaz-hernandez等人(2005)j.neurosci.,25:9773-9781)。因此,减少突变体htt mrna(全长和/或终止的)可以导致治疗性干预(sah等人(2011)j.clin.invest.,121:500-507)。然而,需要改进的调节htt基因表达的方法。
技术实现要素:
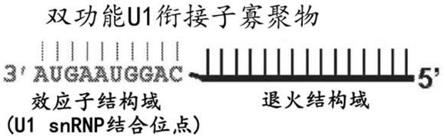
6.根据本发明,提供用于抑制亨廷顿蛋白基因(htt)表达的核酸分子。在特定实施方案中,所述核酸分子包含与至少一个效应子结构域可操作地连接的退火结构域,其中所述退火结构域与htt的前体mrna杂交,并且其中所述效应子结构域与u1 snrnp的u1 snrna杂交。在特定实施方案中,u1ao可以针对全长的和/或截短的htt。
7.根据本发明的另一方面,所述核酸分子可以与靶向部分缀合(例如,直接地或经由接头)。所述靶向部分可以与5'端和/或3'端缀合(例如,核酸可以包含两个相同或不同的靶向部分)。在特定实施方案中,所述核酸分子与适配体缀合。
8.根据本发明的另一方面,提供用于抑制htt表达的方法,其包括向细胞递送至少一种本发明的核酸分子。
9.根据本发明的另一方面,提供组合物,其包含至少一种本发明的核酸分子和至少一种药学上可接受的载体。
10.在仍另一方面,还提供编码本发明的核酸分子的载体。
11.根据本发明的另一方面,提供治疗、抑制和/或预防受试者的亨廷顿病的方法。所述方法包括将治疗有效量的至少一种本发明的核酸分子(例如,u1ao或编码u1ao的载体)施用至有需要的受试者。在特定实施方案中,所述方法包括施用超过一种u1ao。在特定实施方案中,所述方法包括施用针对全长htt、截短的htt或者全长和截短的htt二者(例如,用单独的u1ao)的u1ao。
附图说明
12.图1a是u1衔接子寡核苷酸的示意图,描绘其2个结构域:用于与3'末端外显子中靶基因的前体mrna碱基配对的退火结构域,以及通过内源u1snrnp的结合抑制前体mrna的成熟的效应子结构域。所提供的效应子结构域序列是seq id no:1。图1b是与靶前体mrna退火的u1衔接子的示意图。所提供的效应子结构域序列是seq id no:1。图1c是结合u1 snrnp的u1衔接子的示意图,其导致多聚(a)位点抑制。ψ=u1 snrnp中的u1 snrna的假尿苷。所提供的在u1 snrnp中的u1 snrna的序列是seq id no:2。所提供的效应子结构域序列是seq id no:1。
13.图2提供显示hd9197细胞中针对次黄嘌呤磷酸核糖基转移酶1(hprt1)归一化的人亨廷顿蛋白(htt)mrna的变化百分比的图,所述hd9197细胞用一组20nm u1衔接子寡核苷酸(u1ao)和20nm针对全长人htt的sirna转染44小时。
14.图3提供用20nm的各种hhtt-fl u1ao和sirna转染48小时的du145细胞的蛋白质印迹,泳道9中的7nm和泳道7中的30nm例外。gapdh是作为上样对照来提供。u1a(u1 snrnp亚基)是作为第二上样对照来提供。每个泳道加载1,500,00个细胞当量。泳道4和6是独立的重复。mw:分子量标记。
15.图4a提供在将盐水或hhtt-fl-2 u1ao脑室内(icv)注射至左脑室中之后,yac128前脑中hhtt-fl mrna的变化百分比的图。yac128是亨廷顿病的完善的小鼠模型,其含有约300,000个碱基对的具有128个cag重复的人亨廷顿蛋白基因。将对照小鼠的平均值设为100%。n=7是来自两个不同实验(n=3和n=4)。图4b提供在icv注射盐水或hhtt-fl-2 u1ao后,yac128前脑中hhtt-tr mrna的变化百分比的图。将对照小鼠的平均值设为100%。
16.图5提供在注射盐水或hhtt-fl-2 u1ao后,来自yac128前脑的总rna的8%变性聚丙烯酰胺凝胶电泳(page)rna印迹的图像。探针是33个核苷酸的
32
p-抗hhtt-fl-2寡核苷酸。标准品是未注射的u1ao。
17.图6提供盐水icv处理的小鼠(左图)或htt-fl-2 u1ao icv处理的小鼠(右图)的纹状体中hhtt-fl的检测的图像。在4天的持续时间后分析小鼠。使用4',6-二脒基-2-苯基吲哚(dapi)对细胞核进行染色。
18.图7a提供在所指示时间中盐水或hhtt-fl-2 u1ao的icv注射后,yac128前脑中hhtt-fl mrna的变化百分比的图。将对照小鼠的平均值设为100%。图7b提供在注射盐水或
hhtt-fl-2 u1ao后的所指示时间,来自yac128前脑的总rna的rna印迹的图像。探针是33个核苷酸的
32
p-抗hhtt-fl-2寡核苷酸。标准品是未注射的u1ao。对照盐水小鼠1-7以及小鼠11-12和16-17是与图4和图5中所示相同的小鼠。
19.图8a提供在盐水、hhtt-tr-1 u1ao或hhtt-tr-2 u1ao的icv注射后,yac128前脑中hhtt-tr mrna的变化百分比的图。在5天的持续时间后分析小鼠组织。将对照小鼠的平均值设为100%。n=7是来自两个不同实验(n=3和n=4)。图8b提供在盐水、hhtt-tr-1 u1ao或hhtt-tr-2 u1ao的注射后,yac128前脑中hhtt-fl mrna的变化百分比的图。将对照小鼠的平均值设为100%。n=7是来自两个不同实验(n=3和n=4)。
20.图9a提供在盐水、mhtt-tr-a u1ao或nc-a对照u1ao的注射后,8-9个月龄q175前脑中mhtt-tr mrna的变化百分比的图。q175是在小鼠htt基因中具有约175个cag重复的完善的敲入小鼠。将对照小鼠的平均值设为100%。n=7是来自两个不同实验(n=3和n=4)。图9b使用与图9a中相同的样品提供mhtt-fl mrna的变化百分比的图。将对照小鼠的平均值设为100%。n=7是来自两个不同实验(n=3和n=4)。
21.图10提供在4天的持续时间中,盐水处理的小鼠(左图)或mhtt-tr-a u1ao处理的小鼠(右图)的纹状体中mhtt-tr的检测的图像。
22.图11a提供在盐水或mhtt-tr-a u1ao的icv注射后二十一天,8-9个月龄q175小鼠前脑中mhtt-tr mrna的变化百分比的图。将对照小鼠的平均值设为100%。图11b提供在盐水或mhtt-tr-a u1ao的注射后二十一天,8-9个月龄q175小鼠前脑中mhtt-fl mrna的变化百分比的图。将对照小鼠的平均值设为100%。
23.图12a提供在盐水、mhtt-fl-a u1ao或nc-a对照u1ao的注射后,8-9个月龄q175前脑中mhtt-fl mrna的变化百分比的图。将对照小鼠的平均值设为100%。n=7是来自两个不同实验(n=3和n=4)。图12b提供在盐水、mhtt-fl-a u1ao或nc-a对照u1ao的注射后,q175前脑中mhtt-tr mrna的变化百分比的图。将对照小鼠的平均值设为100%。n=7是来自两个不同实验(n=3和n=4)。
24.图13提供盐水处理的小鼠(左图)或mhtt-fl-a u1ao处理的小鼠(右图)的纹状体中mhtt-fl的检测的图像。
25.图14a-图14l提供人htt中用于u1ao的靶位点以及呈dna形式的u1ao序列的例子。第50、272、151、3、187、4、5、10和2行中的靶序列分别是seq id no:26-34。第1、6-9、11-49、51-150、152-186、188-271和273-325行中的靶序列分别是seq id no:40-355。以dna形式提供的u1ao序列从顶部至底部是seq id no:356-680。
26.图15a-图15c提供在将mhtt-fl-a u1ao以四种不同浓度icv注射至q175小鼠中之后1个月(图15a)、2个月(图15b)和4个月(图15c),mhtt-fl和mhtt-tr的沉默水平的图。图15d提供在将对照nc-a u1ao以80μg icv注射至q175小鼠中之后1个月、2个月和4个月,mhtt-fl和mhtt-tr的沉默水平的图。
27.图16a-图16c提供在将mhtt-tr-a u1ao以四种不同浓度icv注射至q175小鼠中之后1个月(图16a)、2个月(图16b)和4个月(图16c),mhtt-fl和mhtt-tr的沉默水平的图。
28.图17提供mhtt-fl-a u1ao(上图)、mhtt-tr-a u1ao(中图)和nc-a u1ao(下图)的药代动力学的图。显示在1个月、2个月和4个月时rna的量。显示mhtt-fl-a u1ao和mhtt-tr-a u1ao的四种不同浓度中的每一种,而仅显示nc-a u1ao的80μg浓度。
具体实施方式
29.u1衔接子(或u1衔接子寡核苷酸(u1ao))是寡核苷酸介导的基因沉默技术,其在机制上与反义或sirna不同。u1衔接子通过选择性地干扰mrna成熟中的关键步骤来发挥作用:3'聚腺苷(多聚a)尾的添加。几乎所有编码蛋白质的mrna都需要多聚a尾,并且未能添加多聚a尾导致核内的新生mrna快速降解,从而阻止蛋白质产物的表达。u1衔接子已经描述于以下文献中:美国专利号9,441,221;美国专利号9,078,823;美国专利号8,907,075;以及美国专利号8,343,941(其各自通过引用并入本文)。
30.u1衔接子寡核苷酸非常适合于体内应用,因为它们可以接受用于改进核酸酶抗性的广泛的化学修饰以及大体积基团(如用于成像的标签或用于受体介导的靶细胞摄取的配体)的附接,而不丧失沉默活性。亨廷顿病具有几种特征,使其特别适合于使用u1ao来治疗。第一,减少突变体htt基因的表达在减慢和/或停止神经变性中将是有益的。第二,所述疾病可以通过基因测试确定地诊断。第三,所述疾病通常具有成年发病。第四,所述疾病进展缓慢并且记载充分,具有可预测的病程。第五,临床检查和非侵入性方法二者都可用于跟踪所述疾病的进展,以及确定干预是否有益。第六,尾状核是主要受影响的区域,可以通过成像来监测,并且位置靠近脑室,用于从在脑室系统中使用的干预扩散。最后,尾状核中高度易损的中型多棘神经元已进行充分研究,并且表达可用于通过修饰的载体进行细胞定向靶向的标记。
31.本文提供用于调节htt、特别是突变体htt(包含扩增的三核苷酸cag重复的htt,包括全长的和/或截短的)的表达的方法和组合物。所述方法包括u1衔接子寡核苷酸/分子的使用(总体上参见图1)。在其最简单形式中,u1ao是一种具有两个结构域的寡核苷酸:(1)设计为与htt基因的前体mrna(例如,在末端外显子中)碱基配对的退火结构域,以及(2)通过结合内源u1snrnp抑制靶前体mrna的3'端形成的效应子结构域(也称为u1结构域)。不受理论的束缚,u1衔接子将内源u1 snrnp栓系至基因特异性前体mrna,并且所得复合物阻断适当的3'端形成。值得注意的是,u1 snrnp是非常丰富的(约1百万/哺乳动物细胞核),并且与其他剪接体组分相比,处于化学计量过量中。因此,滴定出内源u1 snrnp没有有害影响。
32.u1ao能够单独地或与递送试剂(例如,基于脂质的转染试剂)复合地进入细胞。u1ao应该也能够进入核以与前体mrna结合。实际上,对于小核酸分子已经建立这种特性,如在那些利用rna酶h途径的反义方法中,其中寡聚物进入核并与前体mrna结合。另外,已经显示反义寡聚物可以与核前体mrna结合并且在空间上阻挡剪接因子的接近,从而导致改变的剪接模式(ittig等人.(2004)nuc.acids res.,32:346-53)。
33.在特定实施方案中,u1衔接子分子的退火结构域设计为对靶前体mrna上的靶位点具有高亲和力和特异性(例如,排除其他前体mrna)。在特定实施方案中,应在退火结构域过短(因为这会降低亲和力)或过长(因为这会促进“脱靶”作用或改变其他细胞途径)之间达到平衡。此外,退火结构域不应干扰效应子结构域的功能(例如,通过碱基配对和发夹形成)。u1ao退火结构域对长度没有绝对要求。然而,退火结构域的长度通常将为约10至约50个核苷酸,更通常为约10至约30个核苷酸或者约10至约20个核苷酸。在特定实施方案中,退火结构域的长度为至少约13或15个核苷酸。退火结构域可以与目的基因(htt)至少75%、至少80%、至少85%、至少90%、至少95%、至少97%或更特定地100%互补。在一个实施方案中,退火结构域与3'末端外显子内的靶位点杂交,所述3'末端外显子包括末端编码区和3'
utr和多聚腺苷酸化信号序列(例如,经由多聚腺苷酸化位点)。在另一实施方案中,靶序列在多聚(a)信号序列的约500个碱基对、约250个碱基对、约100个碱基对或约50bp内。
34.htt中的cag(编码谷氨酰胺)疾病扩增(通常大于36个重复)位于htt基因的第1外显子内(the huntington's disease collaborative research group(1993)cell 72:971-983)。源自突变体等位基因的异常剪接的短外显子1 htt多聚腺苷酸化的mrna被翻译为致病性外显子1 htt蛋白,其促进疾病进展(sathasivam等人.(2013)proc.natl.acad.sci.,110:2366-2370;gipson等人.(2013)rna biol.,10:1647-1652)。人htt和htt的示例性氨基酸和核苷酸序列可以发现于例如gene id:3064和genbank登录号nm_002111.8和np_002102.4中。
35.本文中已经使用用于基因沉默的选择标准来鉴定htt内用于u1ao的靶位点。图14a-图14l列出htt内用于u1ao的靶位点,首先列出得分最佳的靶位点。在特定实施方案中,退火结构域与图14a-图14l中提供的靶位点杂交。在特定实施方案中,退火结构域与图14a-图14l的第1-278行中提供的靶位点杂交。在特定实施方案中,退火结构域与图14a-图14l的第1-192行中提供的靶位点杂交。在特定实施方案中,退火结构域与图14a-图14l的第1-58行中提供的靶位点杂交。在特定实施方案中,退火结构域与图14a-图14l的第1-26行中提供的靶位点杂交。在特定实施方案中,退火结构域与图14a-图14l的第1-10行中提供的靶位点杂交。在特定实施方案中,退火结构域与选自以下的靶位点杂交:
36.cccacatgtcatcagcagga(seq id no:26);
37.cagcaggatgggcaagctgg(seq id no:27);
38.gagcaggtggacgtgaacct(seq id no:28);
39.gtggacgtgaaccttttctg(seq id no:29);
40.tctgcctggtcgccacagac(seq id no:30);
41.gtctgtgcttgaggtggttg(seq id no:31);
42.gctgctgacttgtttacgaa(seq id no:32);
43.ggtgggagagactgtgaggc(seq id no:33);
44.tcctttctcctgatagtcac(seq id no:34);
45.gcggggatggcggtaaccct(seq id no:35);或者
46.gtcttcccttgtcctctcgc(seq id no:36)。
47.在特定实施方案中,退火结构域与gtggacgtgaaccttttctg(seq id no:29)杂交。退火结构域可以与图14a-图14l内的任何靶序列或seq id no:26-36中的任一项至少75%、至少80%、至少85%、至少90%、至少95%、至少97%或更特定地100%互补。退火结构域可以在图14a-图14l内的任何靶序列或seq id no:26-36中的任一项的5'和/或3'端包含另外的或更少的核苷酸。例如,退火结构域可以包含添加至图14a-图14l内的任何靶序列或seq id no:26-36中的任一项的5'和/或3'端的至少1、2、3、4、5或者多达10或20个核苷酸(例如,来自htt基因的序列),或者可以具有图14a-图14l内的任何靶序列或seq id no:26-36中的任一项的5'和/或3'端的至少1、2、3、4或5个核苷酸的缺失。
48.在特定实施方案中,u1ao的u1结构域以高亲和力与u1 snrnp结合。在特定实施方案中,u1结构域与内源u1 snrna的核苷酸2-11互补。在特定实施方案中,u1结构域包含5'-cagguaagua-3'(seq id no:1);5'-cagguaaguau-3'(seq id no:4);5'-gccagguaaguau-3'
(seq id no:5)。在特定实施方案中,u1结构域包含序列5'-cagguaagua-3'(seq id no:1)。在特定实施方案中,u1结构域包含序列5'-gccagguaaguau-3'(seq id no:5)。在另一实施方案中,u1结构域具有与seq id no:1、seq id no:4或seq id no:5的至少70%、至少75%、至少80%、至少85%、以及更特定地至少90%、至少95%或至少97%同一性。u1结构域可以在seq id no:1、seq id no:4或seq id no:5的5'或3'包含另外的核苷酸。例如,u1结构域可以在seq id no:1、seq id no:4或seq id no:5的5'或3'包含至少1、2、3、4、5或者多达10或20个核苷酸。实际上,增加u1结构域的长度以包括碱基配对至茎1和/或碱基配对至u1 snrna的位置1改进u1衔接子对u1 snrnp的亲和力。效应子结构域的长度可以为约8个核苷酸至约30个核苷酸,约10个核苷酸至约20个核苷酸,或者约10至约15个核苷酸。例如,效应子结构域的长度可以为8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸。
49.将点突变插入u1结构域中,即,从共有序列seq id no:1、seq id no:4或seq id no:5分岔,可以减轻沉默。实际上,改变共有序列将产生具有不同的强度和对u1 snrna的亲和力的u1结构域,从而导致不同的沉默水平。因此,一旦已经针对目的基因确定退火结构域,可以将不同强度的不同u1结构域附接至退火结构域,以实现目的基因的不同沉默水平。例如,gagguaagua(seq id no:3)将比seq id no:1更弱地与u1 snrnp结合,并且因此,会产生更低的沉默水平。如上文所讨论,u1结构域中可以包括核苷酸类似物以增加对内源u1 snrnp的亲和力。如果核苷酸类似物与所替代的核苷酸结合相同的核苷酸,则核苷酸类似物的添加可以不被认为是点突变。
50.可以修饰u1ao以对核酸酶具有抗性。在特定实施方案中,u1ao可以包含至少一个非天然核苷酸和/或核苷酸类似物。核苷酸类似物可以用于增加退火亲和力、特异性、在细胞和生物体中的生物利用度、细胞和/或核转运、稳定性和/或对降解的抗性。例如,已经充分确立,在寡核苷酸内包括锁核酸(lna)碱基增加寡核苷酸与其靶位点的退火的亲和力和特异性(kauppinen等人.(2005)drug discov.today tech.,2:287-290;orum等人.(2004)letters peptide sci.,10:325-334)。与基于rnai和rna酶h的沉默技术不同,u1ao抑制不涉及酶活性。因此,在与用于基于rnai和rna酶h的沉默技术的寡聚物相比时,可以用于u1ao中的允许的核苷酸类似物的灵活性显著更大。
51.核苷酸类似物包括但不限于具有磷酸酯修饰的核苷酸,所述磷酸酯修饰包括一个或多个硫代磷酸酯、二硫代磷酸酯、磷酸二酯、甲基膦酸酯、氨基磷酸酯、甲基膦酸酯、磷酸三酯、氨基磷酸酯、吗啉基、酰胺化氨基甲酸酯、羧甲基、乙酰胺化物、聚酰胺、磺酸酯、磺酰胺、氨基磺酸酯、甲缩醛、硫代甲缩醛和/或烷基硅烷基取代(参见例如,hunziker and leumann(1995)nucleic acid analogues:synthesis and properties,modern synthetic methods,vch,331-417;mesmaeker等人.(1994)novel backbone replacements for oligonucleotides,carbohydrate modifications in antisense research,acs,24-39);具有修饰的糖(参见例如,美国专利申请公开号2005/0118605)和糖修饰的核苷酸,所述糖修饰如2'-o-甲基(2'-o-甲基核苷酸)、2'-o-甲氧基乙氧基和2'-卤基(例如,2'-氟);以及核苷酸模拟物,例如但不限于肽核酸(pna)、吗啉代核酸、环己烯基核酸、脱水己糖醇核酸、二醇核酸、苏阿糖核酸和锁核酸(lna)(参见例如,美国专利申请公开号2005/0118605)。其他核苷酸修饰也提供于美国专利号5,886,165;6,140,482;5,693,773;5,856,462;5,973,136;5,929,226;6,194,598;6,172,209;6,175,004;6,166,197;6,166,188;6,160,152;6,
160,109;6,153,737;6,147,200;6,146,829;6,127,533;和6,124,445中。在特定实施方案中,u1ao包含至少一个锁核酸。在特定实施方案中,退火结构域包含至少一个锁核酸(任选地其中效应子结构域不含锁核酸)。在特定实施方案中,u1ao(特别是退火结构域)具有间隔2-4个核苷酸(特别是三个核苷酸)的锁核酸。
52.值得注意的是,应谨慎以不设计出如下u1衔接子:其中效应子结构域具有对mrna的靶位点或紧接靶位点侧翼的位点的显著亲和力。换言之,应选择靶位点以使效应子结构域与靶前体mrna,尤其是侧接退火位点上游的部分的碱基配对潜力降至最低。
53.为了增加u1ao的沉默能力,还应将u1ao设计为具有低自身退火,以防止在单一u1衔接子内形成发夹和/或在两个或更多个u1衔接子之间形成同二聚体或同聚物。
54.可以连接u1ao的退火结构域和效应子结构域,使得效应子结构域位于退火结构域的5'端和/或3'端。另外,退火结构域与效应子结构域可以经由接头结构域可操作地连接。接头结构域可以包含例如1、2、3、4、5、6、7、8、9、10、多达15、多达20或多达25个核苷酸。
55.u1ao可以包含核糖核苷酸和/或脱氧核苷酸。关于本文提供的序列,尿嘧啶碱基与胸苷碱基可以交换。在特定实施方案中,u1ao包含2'-o-甲基核苷酸、2'-o-甲氧基乙氧基核苷酸、2'-卤基(例如,2'-氟)和/或锁核酸。在特定实施方案中,u1ao包含硫代磷酸酯。
56.在特定实施方案中,u1ao包含图14a-图14l中提供的u1ao(特定地呈rna)。在特定实施方案中,u1ao包含图14a-图14l的第1-278行中提供的u1ao序列。在特定实施方案中,u1ao包含图14a-图14l的第1-192行中提供的u1ao序列。在特定实施方案中,u1ao包含图14a-图14l的第1-58行中提供的u1ao序列。在特定实施方案中,u1ao包含图14a-图14l的第1-26行中提供的u1ao序列。在特定实施方案中,u1ao包含图14a-图14l的第1-10行中提供的u1ao序列。在特定实施方案中,u1ao包含:
57.uccugcugaugacauguggggccagguaaguau(seq id no:8);
58.ccagcuugcccauccugcuggccagguaaguau(seq id no:37);
59.agguucacguccaccugcucgccagguaaguau(seq id no:38);
60.cagaaaagguucacguccacgccagguaaguau(seq id no:9);
61.gucuguggcgaccaggcagagccagguaaguau(seq id no:39);
62.caaccaccucaagcacagacgccagguaaguau(seq id no:10);
63.uucguaaacaagucagcagcgccagguaaguau(seq id no:11);
64.gccucacagucucucccaccgccagguaaguau(seq id no:12);
65.gugacuaucaggagaaaggagccagguaaguau(seq id no:13);
66.cagaaaaggtucacguccacgccagguaaguau(seq id no:14);
67.agggutaccgccatccccgcgccagguaaguau(seq id no:15);或者
68.gcgagaggacaagggaagacgccagguaaguau(seq id no:16)。
69.在特定实施方案中,u1ao包含cagaaaagguucacguccacgccagguaaguau(seq id no:9)。在另一实施方案中,u1ao具有与上文序列或图14a-图14l中的一个序列的至少70%、至少75%、至少80%、至少85%、以及更特定地至少90%、至少95%、至少97%或更高同一性。关于本文提供的序列,尿嘧啶碱基与胸苷碱基可以交换。在特定实施方案中,u1ao包含至少一个或所有核苷酸类似物。在特定实施方案中,u1ao包含2'-o-甲基核苷酸、2'-o-甲氧基乙氧基核苷酸、2'-卤基(例如,2'-氟)和/或锁核酸。在特定实施方案中,u1ao包含硫代磷酸
酯。在特定实施方案中,u1ao如实施例中所述进行修饰。
70.在本发明的另一实施方案中,可以使用针对目的基因(htt)的超过一个u1ao来调节表达。与同一前体mrna中的不同序列的多重u1ao靶向(退火)可以提供增强的抑制。本发明的组合物可以包含针对htt基因(例如,htt基因内的不同靶标)的超过一个u1ao。
71.在仍另一实施方案中,u1ao可以与调节目的基因表达的其他方法组合。例如,u1ao可以与其他抑制性核酸分子(如反义寡核苷酸)或基于rna酶h的方法、rnai、mirna和基于吗啉基的方法协调使用,以产生增强的抑制。由于u1ao利用与这些其他方法不同的机制,与单独使用单一抑制剂相比,组合使用将导致增加的对基因表达的抑制。实际上,u1ao可以靶向核中的生物合成步骤,而rnai和某些反义方法通常靶向预先存在的mrna池的胞质稳定性或可译性。
72.在本发明的另一方面,可以用调节基因表达的多种核因子中任一种的结合位点替代u1衔接子的效应子结构域。例如,聚嘧啶束结合蛋白(ptb)的结合位点较短,并且已知ptb抑制多聚(a)位点。因此,用高亲和力ptb结合位点替代效应子结构域也会使靶基因的表达沉默。
73.存在相对于上文所述的典范u1 snrna,序列变化的u1 snrna基因。总之,这些u1 snrna基因可以称为u1变体基因。一些u1变体基因描述于genbank登录号l78810、ac025268、ac025264和al592207中以及kyriakopoulou等人(rna(2006)12:1603-11)中,其鉴定人基因组中接近200个潜在的u1 snrna样基因。由于这些u1变体中的一些的5'端序列与典范u1 snrna不同,一种似乎合理的功能是识别前体mrna剪接期间的选择性剪接信号。因此,可以以与将u1结构域设计为与如本文所述的典范u1 snrna杂交相同的方式将本发明的u1ao的u1结构域设计为与u1变体snrna的5'端杂交。然后可以使用与u1变体杂交的u1ao来调节目的基因的表达。
74.u1衔接子技术相对于其他现有的沉默技术有许多优点。这些优点中的某些如下。第一,u1ao分离为两个独立的结构域:(1)退火(即,靶向)活性,和(2)抑制性活性,从而允许在不影响抑制性活性的情况下优化退火,或者反之亦然。第二,如与其他技术相比,使用两个u1ao靶向同一基因产生加和性、甚至协同性的抑制。第三,u1ao具有新型抑制机制。因此,其在与其他方法组合使用时将是相容的。第四,u1ao通过抑制关键的几乎普遍存在的多聚(a)尾添加(也称为3'端加工)的前体mrna成熟步骤来抑制mrna的生物合成。
75.本发明的组合物包含至少一个本发明的u1ao和至少一种药学上可接受的载体。组合物还可以包含抑制目的基因(htt)的表达的至少一种其他药剂。例如,组合物还可以包含针对目的基因(htt)的至少一种sirna或反义寡核苷酸。
76.本发明的u1ao可以作为裸多核苷酸单独施用至细胞或生物体,包括动物和人。u1ao可以与增强其细胞摄取的药剂一起施用。在特定实施方案中,u1ao可以含于脂质体、纳米颗粒或聚合组合物内。
77.在另一实施方案中,可以将u1ao以表达载体(如质粒或病毒载体)递送至细胞或动物(包括人)。例如,u1ao可以从载体(如质粒或病毒)表达。来自质粒或病毒的此类短rna的表达已经成为惯例,并且可以容易地调整以表达u1ao。用于表达rna分子的表达载体可以采用强启动子,所述启动子可以是组成型的或调节的。此类启动子是本领域中熟知的,并且包括但不限于rna聚合酶ii启动子、t7 rna聚合酶启动子以及rna聚合酶iii启动子u6和h1。病
毒介导的递送包括使用基于但不限于以下的载体:逆转录病毒、腺病毒、腺相关病毒、痘苗病毒、慢病毒、脊髓灰质炎病毒和疱疹病毒。
78.本发明的药物组合物可以通过任何合适的途径来施用,例如,通过注射(例如,静脉内、脑室内和肌内)、通过口服、肺、鼻、直肠或其他施用方式。可以施用组合物用于治疗可以通过下调htt来治疗的亨廷顿病。组合物可以在体外、在体内和/或离体使用。关于离体使用,可以将本发明的u1ao(或包含它的组合物)递送至自体细胞(任选地包括从受试者获得所述细胞的步骤),然后再引入所述受试者体内。本发明的组合物、u1ao和/或载体也可以包含在试剂盒中。
79.本发明还涵盖治疗、抑制(减慢或降低)和/或预防受试者的亨廷顿病的方法。在特定实施方案中,所述方法包括将治疗有效量的至少一种本发明的组合物施用至有需要的受试者(例如,动物或人)。在特定实施方案中,组合物包含至少一种本发明的u1ao和至少一种药学上可接受的载体。在特定实施方案中,u1ao针对htt,特定地全长的和/或截短的htt(例如,突变体htt)。
80.本发明方法还可以包括施用抑制靶htt基因表达的至少一种其他药剂。例如,所述方法还可以包括施用针对htt基因的至少一种sirna或反义寡核苷酸。所述方法还可以包括施用至少一种其他治疗剂(例如,用于亨廷顿病的减轻症状的治疗剂(例如,丁苯那嗪或氘代丁苯那嗪或氘代丁苯那嗪)。在特定实施方案中,治疗剂与u1ao缀合(例如,直接地或经由接头;例如,在3'端和/或5'端)。治疗剂可以以单独组合物(例如,具有至少一种药学上可接受的载体)或以同一组合物施用。治疗剂可以与u1ao同时和/或连续施用。
81.如上文所述,本发明的u1ao可以单独施用(作为裸多核苷酸),或者可以与增强其细胞摄取的药剂一起施用。在特定实施方案中,u1ao可以含于递送媒介物(如胶束、脂质体、纳米颗粒或聚合组合物)中。在特定实施方案中,u1ao与树枝状聚合物,特定地阳离子树枝状聚合物(如聚(酰胺基胺)(pamam)树枝状聚合物和聚丙烯亚胺(ppi)树枝状聚合物(例如,第2代、第3代、第4代或第5代))复合(例如,含于其内或被其包封)。在特定实施方案中,u1ao与ppi-g2复合。
82.在特定实施方案中,u1ao靶向特定细胞类型(例如,神经元)。在特定实施方案中,u1ao与至少一个靶向部分共价连接(例如,直接地或经由接头)。靶向部分可以与5'端、3'端或两端或与内部核苷酸可操作地连接。在特定实施方案中,一个或多个靶向部分与u1ao的一端缀合(例如,经由单一接头)。在特定实施方案中,包含u1ao的复合物(例如,树枝状聚合物、胶束、脂质体、纳米颗粒或聚合组合物)与至少一个靶向部分共价连接(例如,直接地或经由接头)。
83.通常,接头是包含将两个化合物(如靶向部分)共价附接至u1ao或复合物的共价键或原子链的化学部分。接头可以连接至靶向部分和u1ao或复合物(媒介物)的任何在合成上可行的位置。在特定实施方案中,接头经由胺基和/或巯基/硫醇基、特别是巯基/硫醇基连接靶向部分和u1ao或复合物。例如,u1ao可被衍生(例如,在5'端)具有一个或多个氨基或硫基。在特定实施方案中,接头附接在避免阻断靶向部分或u1ao的活性的位置。示例性接头可以包含至少一个任选地被取代的;饱和的或不饱和的;直链、支链或环状烷基,或任选地被取代的芳基。接头还可以是多肽(例如,约1至约20个氨基酸或更多,或者1至约5个)。接头可
以是在生理环境或条件下生物可降解的(可切割的(例如,包含二硫键))。在特定实施方案中,接头包含聚乙二醇(peg)(单独的或与另一接头组合)。在特定实施方案中,接头是spdp(n-琥珀酰亚胺基3-(2-吡啶基二硫基)-丙酸酯)接头,如lc-spdp(琥珀酰亚胺基6-(3-[2-吡啶基二硫基]-丙酰胺基)己酸酯);或者smcc(琥珀酰亚胺基-4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯)接头,如lc-smcc(琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-羧基-(6-酰胺基己酸酯))。接头还可以是不可降解的(不可切割的),并且可以是在生理环境或条件下基本上无法切割或完全无法切割的共价键或任何其他化学结构。
[0084]
本发明的靶向部分优先与相关组织(例如,神经)或器官(例如,脑)结合。在特定实施方案中,靶向部分与在靶细胞上特异性(例如,仅在靶细胞上)表达的标记或者与其他细胞相比在靶细胞上上调的标记特异性结合。在特定实施方案中,靶向部分是抗体或抗体片段,其对靶细胞上的表面蛋白或者在靶细胞上以比其他细胞、组织或器官更高的水平(或更大的密度)表达的表面蛋白具有免疫特异性。抗体或抗体片段可以是治疗性抗体(例如,本身具有治疗效果)。在特定实施方案中,靶向部分是靶细胞上的细胞表面受体的配体或其结合片段。在特定实施方案中,靶向部分是适配体。
[0085]
本发明的u1ao可以进一步与其他所需化合物缀合。例如,u1ao可以进一步与可检测药剂、治疗药(例如,单克隆抗体、肽、蛋白质、抑制性核酸分子、小分子、化学治疗剂等)、载体蛋白以及改进生物利用度、稳定性和/或吸收的药剂(例如,peg)缀合(直接地或经由如上所述的接头)。另外的化合物可以附接至u1ao的任何在合成上可行的位置(或者缀合,例如,与u1衔接子(例如,任一端)或靶向部分)。可替代地,靶向部分和u1ao各自单独附接至另外的化合物(例如,载体蛋白)(因此,可以认为所述另外的化合物用作u1ao与靶向部分之间的接头)。在特定实施方案中,u1ao在一端与靶向部分(例如,神经元靶向部分)缀合,并且任选地在另一端与治疗剂缀合。优先地,另外的化合物的附接不会显著影响u1ao或靶向部分的活性。可检测药剂可以是可以直接或间接(特别是直接)测定的任何化合物或蛋白质。可检测药剂包括例如化学发光的、生物发光的和/或荧光化合物或蛋白质、成像剂、造影剂、放射性核素、顺磁性或超顺磁性离子、同位素(例如,放射性同位素(例如,3h(氚)和
14
c)或稳定同位素(例如,2h(氘)、
11
c、
13
c、
17
o和
18
o))、光学药剂和荧光剂。
[0086]
载体蛋白包括但不限于血清白蛋白(例如,牛血清白蛋白、人血清白蛋白)、卵白蛋白和钉形贝血蓝蛋白(klh)。在特定实施方案中,载体蛋白是人血清白蛋白。载体蛋白(以及其他蛋白质或肽)可以在任何合成上可行的位置与u1ao缀合(或缀合)。例如,接头(例如,lc-spdp)可以附接至在载体蛋白的赖氨酸上发现的任何游离氨基,然后u1ao和靶向部分可以与接头缀合。可以通过用半胱氨酸阻断来使任何未反应的接头失活。
[0087]
本发明的u1ao可以与将u1ao靶向所需细胞类型和/或促进u1ao的细胞摄取(例如,细胞穿透部分)的化合物(例如,抗体、肽、蛋白质、核酸分子、小分子等)缀合(例如,直接地或经由接头)。靶向部分可以与5'端、3'端或两端或与内部核苷酸可操作地连接。在特定实施方案中,靶向部分和/或细胞穿透部分缀合至5'端和/或3'端。在特定实施方案中,靶向部分和/或细胞穿透部分缀合至5'端。在特定实施方案中,u1ao与靶向部分和细胞穿透部分二者缀合。如本文所用,术语“细胞穿透剂”或“细胞穿透部分”是指介导化合物从细胞外空间转移至细胞内的化合物或官能团。在特定实施方案中,u1ao与适配体缀合。适配体可以靶向所需细胞类型的表面化合物或蛋白质(例如,受体)(例如,表面化合物或蛋白质可以优先或
仅在要靶向的细胞类型的表面上表达)。在特定实施方案中,适配体是细胞穿透适配体(例如,c1或otter(参见例如,burke,d.h.(2012)mol.ther.,20:251-253))。在特定实施方案中,u1ao与细胞穿透肽(例如,tat肽(例如,ygrkkkrrqrrrppq;seq id no:6(任选地在n末端上乙酰化))、穿透素(例如,rqikiwfqnrrmkwkkgg;seq id no:7)、短两亲性肽(例如,来自pep家族和mpg家族)、寡聚精氨酸(例如,4-12个连续精氨酸)、寡聚赖氨酸(例如,4-12个连续赖氨酸))缀合。在特定实施方案中,u1ao与小分子(如生物素,作为靶向抗体的一部分)或非极性荧光基团(例如,菁染料,如cy3或cy5)或与其他细胞穿透剂缀合。
[0088]
在特定实施方案中,u1ao的3'端和5'端中的至少一个包含游离sh基团。
[0089]
本文所述u1ao(包括包含它的媒介物)通常将作为药学制剂被施用至患者。如本文所用术语“患者”和“受试者”包括人和动物。这些u1衔接子可以在医师的指导下以治疗方式使用。
[0090]
包含本发明的u1ao的组合物可以用任何一种或多种药学上可接受的载体便捷地配制以供施用。例如,u1ao可以用可接受的介质(如水、缓冲盐水、乙醇、多元醇(例如,甘油、丙二醇、液体聚乙二醇等)、二甲亚砜(dmso)、油、洗涤剂、悬浮剂或其合适的混合物)来配制。u1ao在所选介质中的浓度可变,并且可以基于药学制剂的所需施用途径来选择所述介质。考虑任何常规介质或药剂在药学制剂中的使用,但其与要施用的u1ao不相容的情况除外。
[0091]
适于施用至特定患者的根据本发明的u1ao的剂量和剂量方案可以由医师在考虑以下因素后确定:患者的年龄、性别、体重、一般健康状况以及施用的u1ao所针对的具体病症及其严重程度。医师还可以考虑到施用途径、药物载体以及u1ao的生物学活性。
[0092]
合适的药学制剂的选择还将取决于所选施用方式。例如,本发明的u1ao可以通过直接注射至所需部位(例如,脑)来施用。在此情况下,药学制剂包含分散于与注射部位相容的介质中的u1ao。本发明的u1ao可以通过任何方法施用。例如,本发明的u1ao可以以不限于以下的方式施用:肠胃外、皮下、口服、局部、经肺、经直肠、经阴道、静脉内、脑室内、颅内、腹膜内、鞘内、大脑内、硬膜外、肌内、真皮内或颈动脉内。在特定实施方案中,施用方法是通过直接注射(例如,至脑中)或脑室内。用于注射的药学制剂是本领域中已知的。如果选择注射作为施用u1ao的方法,应采取步骤以确保足量的分子或细胞到达其靶细胞以发挥生物学作用。
[0093]
含有本发明的u1ao作为活性成分与药学上可接受的载体紧密混合的药物组合物可以根据常规制药复合技术来制备。载体可以采取众多种形式,根据施用所需的制剂形式而定,例如,静脉内、口服、直接注射、颅内、脑室内和玻璃体内。
[0094]
本发明的药学制剂可以以剂量单位形式来配制,以便于施用和剂量的一致性。如本文所用的剂量单位形式是指适合于经历治疗的患者的药学制剂的物理离散单位。每个剂量应含有经计算与所选药物载体联合产生所需效果的量的活性成分。确定适当剂量单位的程序是本领域技术人员熟知的。
[0095]
剂量单位可以基于患者体重成比例地增加或减少。用于减轻特定病理学病症的适当浓度可以通过剂量浓度曲线计算来确定,如本领域中已知。
[0096]
根据本发明,用于施用u1ao的适当剂量单位可以通过在动物模型中评价分子或细胞的毒性来确定。可以将药学制剂中各种浓度的u1ao施用至小鼠,并且可以基于作为处理
结果观察到的有益结果和副作用来确定最小和最大剂量。适当剂量单位还可以通过评估u1ao治疗与其他标准药物组合的功效来确定。u1ao的剂量单位可以根据所检测的作用单独地或与每种治疗组合地确定。
[0097]
包含u1ao的药学制剂可以以适当间隔来施用,例如,至少一天两次或更多,直至病理学症状减少或减轻为止,之后可以减少剂量至维持水平。在特定情况下,适当间隔通常将取决于患者的病症。
[0098]
定义
[0099]
单数形式“一个/一种(a)”、“一个/一种(an)”和“所述”包括复数指代物,除非上下文另外明确说明。
[0100]
如本文所用的“核酸”或“核酸分子”是指任何dna或rna分子,其是单链或双链的,并且如果是单链的,其互补序列的分子呈线性或环状形式。在讨论核酸分子时,特定核酸分子的序列或结构在本文中可以根据以5'至3'方向提供序列的正常惯例来描述。关于本发明的核酸,有时使用术语“分离的核酸”。此术语在应用于dna时是指dna分子,所述dna分子与在其所来源的生物体的天然存在的基因组中与所述dna分子直接邻接的序列分离。例如,“分离的核酸”可以包含插入载体(如质粒或病毒载体)中或整合至原核或真核细胞或宿主生物体的基因组dna中的dna分子。
[0101]
在应用于rna时,术语“分离的核酸”可以是指由如上所定义的分离的dna分子编码的rna分子。可替代地,所述术语可以是指rna分子,所述rna分子已经与在其自然状态中(即,在细胞或组织中)与所述rna分子相连的其他核酸充分分离。分离的核酸(dna或rna)还可以表示通过生物或合成手段直接产生并且与在其产生期间存在的其他组分分离的分子。
[0102]“载体”是基因元件,如质粒、粘粒、杆粒、噬菌体或病毒,另一基因序列或元件(dna或rna)可以附接至其。载体可以是复制子,以实现所附接序列或元件的复制。
[0103]“表达操纵子”是指可以具有转录和翻译控制序列(如启动子、增强子、翻译起始信号(例如,atg或aug密码子)、多聚腺苷酸化信号、终止子等)的核酸区段,并且其促进核酸或多肽编码序列在宿主细胞或生物体中的表达。“表达载体”是促进核酸或多肽编码序列在宿主细胞或生物体中的表达的载体。
[0104]
如本文所用术语“寡核苷酸”是指本发明的核酸序列、引物和探针,并且定义为由两个或更多个(优选地超过三个)核糖核苷酸或脱氧核糖核苷酸构成的核酸分子。寡核苷酸的确切大小将取决于多种因素,以及取决于寡核苷酸的特定应用和用途。
[0105]
短语“小干扰rna(sirna)”是指短(通常长度小于30个核苷酸,更通常长度在约21至约25个核苷酸之间)双链rna分子。通常,sirna调节所述sirna所靶向基因的表达。术语“短发夹rna”或“shrna”是指sirna前体,其是折叠成发夹结构的单一rna分子,包含sirna和至少一个(通常1-10个)核苷酸的单链环部分。
[0106]
术语“rna干扰”或“rnai”通常是指序列特异性或选择性过程,通过所述过程经由双链rna下调靶分子(例如,靶基因、蛋白质或rna)。通常驱动rnai活性的双链rna结构是sirna、shrna、微小rna和可以加工以产生小rna种类的其他双链结构,它们通过rna干扰来抑制靶转录物的表达。
[0107]
术语“反义”是指具有如下序列的寡核苷酸:所述序列通过watson-crick碱基配对与rna中的靶序列杂交,以与靶序列(通常与mrna)形成rna:寡核苷酸异源双链体。反义寡核
苷酸可以具有与靶序列的精确序列互补性或近互补性。这些反义寡核苷酸可以阻断或抑制mrna的翻译,和/或修饰mrna的加工以产生mrna的剪接变体。反义寡核苷酸的长度通常在约5至约100个核苷酸之间,更通常地,长度在约7与约50个核苷酸之间,甚至更通常地,长度在约10个核苷酸与约30个核苷酸之间。
[0108]
术语“基本上纯的”是指包含以重量计至少50-60%的给定材料(例如,核酸、寡核苷酸、蛋白质等)的制剂。更优选地,制剂包含以重量计至少75%,并且最优选地以重量计90-95%的给定化合物。纯度是通过适合于给定化合物的方法(例如,色谱法、琼脂糖或聚丙烯酰胺凝胶电泳、hplc分析等)来测量。
[0109]
术语“分离的”可以是指化合物或复合物,其已经与在自然中与其相连的其他化合物充分分开。“分离的”并不意味着排除与其他化合物或材料的人工或合成混合物,或者不干扰基本活性或随后测定并且可能例如由于不完全纯化或稳定剂的添加而存在的杂质的存在。
[0110]
术语“基因”是指包含编码多肽的开放阅读框的核酸,其包括外显子和(任选地)内含子序列二者。核酸还可以任选地包括非编码序列,如启动子或增强子序列。术语“内含子”是指给定基因中存在的dna序列,其不被翻译为蛋白质并且通常发现于外显子之间。
[0111]
如本文所用,术语“适配体”是指通过除了watson-crick碱基配对以外的相互作用与靶标(如蛋白质)特异性结合的核酸。在特定实施方案中,适配体与一个或多个靶标(例如,蛋白质或蛋白质复合物)特异性结合,通常排除样品中的其他分子。适配体可以是核酸,如rna、dna、修饰的核酸或其混合物。适配体还可以是呈线性或环状形式的核酸,并且可以是单链或双链的。适配体可以包含长度为至少5、至少10、至少15、至少20、至少25、至少30、至少35、至少40或更多个核苷酸的寡核苷酸。适配体可以包含长度为多达40、多达60、多达80、多达100、多达150、多达200或更多个核苷酸的序列。适配体的长度可以为约5至约150个核苷酸、约10至约100个核苷酸或约20至约75个核苷酸。虽然本文中将适配体作为核酸分子(例如,寡核苷酸)适配体来讨论,但是还可以使用适配体等效物来代替核酸适配体,如肽适配体。
[0112]
如本文所用短语“可操作地连接”可以是指被置于与另一核酸序列具有功能性关系的核酸序列。可以可操作地连接的核酸序列的例子包括但不限于启动子、转录终止子、增强子或激活剂和异源基因,所述异源基因在转录和(如果适当)翻译时将产生功能性产物,如蛋白质、核酶或rna分子。
[0113]“药学上可接受的”表示由联邦政府或州政府的管理机构批准。“药学上可接受的”药剂可以列于美国药典或用于动物且更特定地用于人的其他公认药典中。
[0114]“载体”是指例如与本发明的活性剂一起施用的稀释剂、防腐剂、增溶剂、乳化剂、佐剂、赋形剂、辅助剂或媒介物。此类药物载体可以是无菌液体,如水和油,包括石油、动物、植物或合成来源的那些,如花生油、大豆油、矿物油、芝麻油等。水和水性盐水溶液以及水性右旋糖和甘油溶液可以用作载体。合适的药物载体描述于例如e.w.martin的“remington'spharmaceutical sciences”中。
[0115]“抗体”或“抗体分子”是与特定抗原结合的任何免疫球蛋白,包括抗体及其片段(例如,免疫特异性片段)。如本文所用,抗体或抗体分子涵盖完整免疫球蛋白分子、免疫球蛋白分子的免疫活性部分和免疫球蛋白分子的免疫活性部分的融合物。所述术语包括多克
隆、单克隆、嵌合、单结构域(dab)和双特异性抗体。如本文所用,抗体或抗体分子涵盖重组生成的完整免疫球蛋白分子和免疫球蛋白分子的免疫活性部分,例如但不限于:fab、fab'、f(ab')2、f(v)、scfv、scfv2和scfv-fc。
[0116]
关于抗体,术语“免疫特异性的”是指如下抗体:其与目的蛋白质或化合物的一个或多个表位结合,但是基本上不识别并结合含有抗原性生物分子的混合群体的样品中的其他分子。
[0117]
术语“治疗”是指化合物缓解、减轻和/或减慢患者疾病的进展的能力。换言之,术语“治疗”是指抑制和/或逆转疾病的进展。
[0118]
以下实施例描述实践本发明的说明性方法,并且不意图以任何方式限制本发明的范围。
[0119]
实施例
[0120]
将hd9197细胞(coriel institute gm09197;21/181个cag重复,成纤维细胞,6岁龄雄性)使用lipofectamine
tm rnaimax转染试剂(invitrogen,卡尔斯巴德,加利福尼亚州)用针对全长人亨廷顿蛋白(htt)的一组u1衔接子寡核苷酸(u1ao)和sirna(见下文)转染。确定针对次黄嘌呤磷酸核糖基转移酶1(hprt1)归一化的人htt mrna的变化百分比。如图2中所见,人htt-全长mrna-2(hhtt-fl-2)u1ao具有最高沉默活性,其显著高于使用任何sirna时观察到的沉默。值得注意的是,进一步实验也显示,hhtt-fl-1 u1ao可以沉默至《30%。用du145(人前列腺癌细胞系)和mia paca2细胞(人胰腺癌细胞系)获得类似结果。关于htt的截短的形式(也称为选择性剪接的或内含子1截短的形式),确定hhtt-tr-1 u1ao具有最高沉默活性。
[0121]
用于本文所述实验的u1ao和sirna是:
[0122]
u1ao:
[0123]
hhtt-fl-11:uccugcugaugacauguggggccagguaaguau(seq id no:
[0124]
8),其中每个核苷酸是2'-o-甲基;
[0125]
hhtt-fl-21:cagaaaagguucacguccacgccagguaaguau(seq id no:
[0126]
9),其中每个核苷酸是2'-o-甲基;
[0127]
hhtt-fl-31:caaccaccucaagcacagacgccagguaaguau(seq id no:
[0128]
10),其中每个核苷酸是2'-o-甲基;
[0129]
hhtt-fl-41:uucguaaacaagucagcagcgccagguaaguau(seq id no:
[0130]
11),其中每个核苷酸是2'-o-甲基;
[0131]
hhtt-fl-51:gccucacagucucucccaccgccagguaaguau(seq id no:
[0132]
12),其中每个核苷酸是2'-o-甲基;
[0133]
hhtt-fl-61:gugacuaucaggagaaaggagccagguaaguau(seq id no:
[0134]
13),其中每个核苷酸是2'-o-甲基;
[0135]
hhtt-fl-2:mc+amgmama+amamgmg+tmumcma+cmgmumc+cmamc
[0136]
mgmcmcmamgmgmumamamgmumamu(seq id no:14),其中m=2'-o-甲基,并且+=锁核酸;
[0137]
hhtt-tr-1:ma+gmgmgmu+tmamcmc+gmcmcma+tmcmcmc+cmgmc
[0138]
mgmcmcmamgmgmumamamgmumamu(seq id no:15),其中m=2'-o-甲基,并且+=锁核
酸;
[0139]
hhtt-tr-2:mgmc+gmamgma+gmgmamc+amamgmg+gmamamg+amc
[0140]
mgmcmcmamgmgmumamamgmumamu(seq id no:16),其中m=2'-o-甲基,并且+=锁核酸;
[0141]
nc-a(对照):maamcmgmgmumumamgmgmcmamcmcmtmcmumumgma
[0142]
mgmcmcmamgmgmumamamgmumamu(seq id no:17),其中m=2'-o-甲基;
[0143]
mhtt-fl-a:mumgmc+amgmcmc+amcmcma+cmcmumc+amamamc+a
[0144]
mgmcmc+amgmg+tma+amgmu+amu(seq id no:18),其中m=2'-o-甲基,并且+=锁核酸;以及
[0145]
mhtt-tr-a:ma+gmumumc+tmcmumu+cmamcma+amcmamg+tmcma
[0146]
mgmcmc+amgmg+tma+amgmu+amu(seq id no:19),其中m=2'-o-甲基,并且+=锁核酸;
[0147]
sirna:
[0148]
hhtt-sirna-1(呈现两条链;r=rna):
[0149]
5'-rgrgra rurarg rurarg rarcra rgrcra rarura rarcru rcrggt-3'(seq id no:20)
[0150]
5'-rarcrc rgrarg rurura rururg rcrurg rurcru rarcru rarurc rcrgru-3’(seq id no:21);
[0151]
hhtt-sirna-2(呈现两条链;r=rna):
[0152]
5'-rargra rarcru rururc rargrc rurarc rcrara rgrara rarga c-3'(seq id no:22)
[0153]
5'-rgrurc rururu rcruru rgrgru rargrc rurgra rararg rururc rururu-3'(seq id no:23);以及
[0154]
hhtt-sirna-3(呈现两条链;r=rna):
[0155]
5'-rarcra rgrcru rcrcra rgrcrc rargrg rurcra rgrcrg rcrcg t-3’(seq id no:24)
[0156]5’‑
rarcrgr grcrg rcrtrg rarcrc rtrgrg rcrtrg rgrarg rcrtrg rtrtrg-3’(seq id no:25)。
[0157]
图3提供用多种抗hhtt-fl u1ao和sirna转染48小时(lipofectamine
tm 2000)的人du145细胞的蛋白质印迹(见下文)。将细胞直接裂解至laemmli缓冲液中,然后在6%-20%梯度凝胶上电泳后通过蛋白质印迹进行分析。此处使用最佳的抗hhtt-fl u1ao(hhtt-fl-1和hhtt-fl-2),并且在蛋白质水平上显示沉默活性。抗htt-fl sirna也显示沉默活性。值得注意的是,使用较少u1ao产生较少沉默(比较泳道9与泳道7)。
[0158]
yac128是含有整个人htt基因(300,000bp)的具有128个cag重复的小鼠。为了确定u1ao的有效性,将1μg或20μg的hhtt-fl-2 u1ao或盐水单侧脑室内(icv)注射至yac128小鼠中。在48小时后,通过灌注处死小鼠。通过基于trizol的方法提取来自左前脑的总rna并通过rt-qpcr进行分析,并且针对真核翻译起始因子4a3(eif4a3)归一化。如图4a中所见,如与盐水处理的小鼠相比,20μg单侧icv注射剂量的hhtt-fl-2 u1ao进行沉默使yac128脑中的hhtt-fl mrna减少62%。通过以下事实确认沉默的特异性:hhtt-tr mrna同种型(图4b)和
eif4a3持家基因的表达都没有经历可观察到的变化。
[0159]
通过
32
p rna印迹(8%page)分析来自yac128小鼠前脑的总rna(4μg/泳道)(图5)。具体地,用与hhtt-fl-2 u1ao互补的33nt 32
p-抗hhtt-fl-2寡核苷酸探测印迹以测量u1ao水平。标为“标准品”的泳道是未注射的u1ao,并且其引入允许严格定量。如图5中所见,脑组织中的u1ao既不降解也不缩短。所注射u1ao的缩短(即使仅缩短少量核苷酸)将导致迁移相对于标准品的显著变化。
[0160]
使用分析(一类原位杂交(ish)技术)以按单细胞分辨率检测hhtt-fl转录物。简单来说,方法涉及将半脑在4%多聚甲醛中固定48小时,将其转移至pbs,并且通过组织处理器进行处理以供石蜡包埋。将福尔马林固定的石蜡包埋的(ffpe)脑经由矢状面和纹状体剖面切割为5微米厚,之后使用对hhtt-fl mrna具有特异性的探针进行原位杂交。如图6中所见,如与盐水处理的小鼠(左图)相比,hhtt-fl-2 u1ao处理的小鼠(右图)具有更少的斑点和降低的强度,从而证实hhtt-fl的沉默。
[0161]
为了进一步证实hhtt-fl-2 u1ao的稳定性,将20μg的hhtt-fl-2 u1ao或盐水单侧脑室内(icv)注射至yac128小鼠中。在2、4或7天后,通过灌注处死小鼠。通过基于trizol的方法提取来自左前脑的总rna并通过rt-qpcr进行分析,并且针对真核翻译起始因子4a3(eif4a3)归一化。如图7a中所见,20μg单侧icv注射剂量的hhtt-fl-2 u1ao随时间恒定地减少yac128脑中的hhtt-fl mrna。图7b提供用与hhtt-fl-2 u1ao互补的33nt
32
p-抗hhtt-fl-2寡核苷酸探测的rna印迹分析,以测量u1ao水平。如图7b中所见,脑组织中的u1ao既没有随时间降解也没有随时间缩短。
[0162]
也已经证实使hhtt-tr沉默的能力。将20μg的hhtt-tr-1 u1ao、hhtt-tr-2 u1ao或盐水单侧icv注射至yac128小鼠中。在48小时后,通过灌注处死小鼠。通过基于trizol的方法提取来自前脑的总rna并通过rt-qpcr进行分析,并且针对真核翻译起始因子4a3(eif4a3)归一化。如图8a中所见,hhtt-tr-1 u1ao没有有效地使hhtt-tr沉默,而hhtt-tr-2 u1ao使hhtt-tr显著沉默约79%。效果具体为在盐水处理的或hhtt-tr处理的小鼠中对于hhtt-fl mrna未观察到沉默(图8b)。
[0163]
也合成抗小鼠htt u1ao并显示其可在培养的细胞中使mhtt沉默。最好的抗小鼠htt u1ao是mhtt-tr-a(靶向mhtt-tr mrna转录物)和mhtt-fl-a(靶向mhtt-fl mrna转录物)。然后在q175小鼠模型中测试这些u1ao。q175小鼠是敲入小鼠,其中对于杂合子,htt等位基因之一具有175个cag重复。为了确定u1ao的有效性,将盐水、20μg的mhtt-tr-au1ao或40μg的非特异性对照衔接子(nc-a)u1ao单侧icv注射至q175小鼠中。nc-a u1ao是设计为不使任何小鼠基因沉默的非特异性对照u1ao。在48小时后,通过灌注处死小鼠。通过基于trizol的方法提取来自左前脑的总rna并通过rt-qpcr进行分析,并且针对真核翻译起始因子4a3(eif4a3)归一化。如图9a中所见,如与对照处理的小鼠相比,20μg单侧icv注射剂量的mhtt-tr-a u1ao进行沉默使q175脑中的mhtt-tr mrna减少75%。通过以下事实确认沉默的特异性:mhtt-fl mrna同种型(图9b)和eif4a3持家基因的表达都没有经历显著变化。
[0164]
还进行分析以按单细胞分辨率检测mhtt-tr转录物。简单来说,方法涉及将半脑在4%多聚甲醛中固定48小时,将其转移至pbs,并且通过组织处理器进行处理以供石蜡包埋。将福尔马林固定的石蜡包埋的(ffpe)脑经由矢状面和纹
状体剖面切割为5微米厚,之后使用对mhtt-tr mrna具有特异性的探针进行原位杂交。如图10中所见,如与盐水处理的小鼠(左图)相比,mhtt-tr-a u1ao处理的小鼠(右图)具有更少的斑点和降低的强度,从而证实mhtt-tr的沉默。
[0165]
为了进一步证实mhtt-tr-a u1ao的稳定性,将20μg的mhtt-tr-a u1ao或盐水单侧脑室内(icv)注射至q175小鼠中。在21天后,通过灌注处死小鼠。通过基于trizol的方法提取来自左前脑的总rna并通过rt-qpcr进行分析,并且针对真核翻译起始因子4a3(eif4a3)归一化。如图11a中所见,20μg单侧icv注射剂量的mhtt-tr-a u1ao即使在21天后也减少q175小鼠脑中的mhtt-tr mrna。通过以下事实确认沉默的特异性:mhtt-fl mrna同种型(图11b)和eif4a3持家基因的表达都没有经历显著变化。
[0166]
为了确定mhtt-fl u1ao的有效性,将盐水、40μg的mhtt-fl-a u1ao或40μg的非特异性对照衔接子(nc-a)u1ao单侧icv注射至q175小鼠中。nc-a u1ao是设计为不使任何小鼠基因沉默的非特异性对照u1ao。在48小时后,通过灌注处死小鼠。通过基于trizol的方法提取来自左前脑的总rna并通过rt-qpcr进行分析,并且针对真核翻译起始因子4a3(eif4a3)归一化。如图12a中所见,如与对照处理的小鼠相比,40μg单侧icv注射剂量的mhtt-fl-a u1ao进行沉默使q175脑中的mhtt-fl mrna减少69%。通过以下事实确认沉默的特异性:mhtt-tr mrna同种型(图12b)和eif4a3持家基因的表达都没有经历显著变化。
[0167]
还进行分析以按单细胞分辨率检测mhtt-fl转录物。简单来说,方法涉及将半脑在4%多聚甲醛中固定48小时,将其转移至pbs,并且通过组织处理器进行处理以供石蜡包埋。将福尔马林固定的石蜡包埋的(ffpe)脑经由矢状面和纹状体剖面切割为5微米厚,之后使用对mhtt-fl mrna具有特异性的探针进行原位杂交。如图13中所见,如与盐水处理的小鼠(左图)相比,mhtt-fl-a u1ao处理的小鼠(右图)具有更少的斑点和降低的强度,从而证实mhtt-fl的沉默。
[0168]
还进行对hhtt-fl-2 u1ao的生物分布研究。简单来说,为了在单细胞水平下评估脑区中的生物分布,用cy3荧光标记的hhtt-fl-2 u1ao(cy3-hhtt-fl-2 u1ao)进行一系列实验。将5μg的cy3-hhtt-fl-2 u1ao单侧icv注射至6-8个月龄yac128小鼠中。在注射后1、7和28天,通过灌注(用盐水)处死小鼠,以去除血液和细胞外u1ao。随后通过共焦显微镜检查研究脑样品。值得注意的是,不使用较高剂量的cy3-hhtt-fl-2 u1ao,因为cy3荧光基团本身证实有毒。实际上,确定1.5μg和4μg游离cy3(其分别是30μg和80μg cy3-hhtt-fl-2 u1ao的化学计量当量)的注射对yac128小鼠有高毒性。5μg的cy3-hhtt-fl-2 u1ao的使用在yac128小鼠中未导致明显毒性影响。
[0169]
生物分布测定显示,在将cy3-hhtt-fl-2 u1ao icv注射至左脑室中后,cy3-hhtt-fl-2 u1ao快速(在1天内)且显著地跨越左半脑和右半脑二者分布,从而导致截至第7天和第28天,cy3-hhtt-fl-2 u1ao在脑的左侧和右侧两侧中的对称分布。这些结果显示,cy3-hhtt-fl-2 u1ao从左脑室注射部位快速迁移至其他脑区(例如,纹状体、皮质、海马、小脑)中,包括距注射部位最远的右半脑区域。cy3-hhtt-fl-2 u1ao也被大多数神经元(例如,皮质神经元)和细胞类型广泛摄取。另外,cy3-hhtt-fl-2 u1ao在核和核周中明显可见。最后,如与1天和7天时间点相比,在28天时间点,荧光强度仅略有减小,从而证实cy3-hhtt-fl-2 u1ao随时间的稳定性。
[0170]
进行其他实验以证实mhtt-fl转录物从一个月至四个月的50%至80%持续减少。在平行实验中,鉴定实现mhtt-tr转录物从一个月至四个月的50%至80%持续减少的条件。
[0171]
第一,q175小鼠用mhtt-fl-a u1ao以四种不同浓度(即10、20、40和80μg)经历单一单侧icv剂量(每剂量的小鼠n=9),总共得到36只小鼠。在1、2和4个月后将每种浓度三只小鼠的队列安乐死,其中小鼠经历用1x pbs灌注然后处死。收集半脑并处理,用于通过rt-qpcr和rna印迹进行分析。将所有u1衔接子处理的小鼠与未处理的q175小鼠进行比较。通过rt-qpcr评估mhtt-fl转录物的沉默,然后将其与设为100%的未处理小鼠进行比较。用于检测mhtt-tr转录物的rt-qpcr包括去除内含子#1 dna所需的dna酶处理,所述内含子#1 dna会干扰mhtt-tr转录物的ct值。
[0172]
如图15a、图15b和图15c中所见,mhtt-fl转录物分别在处理后1、2和4个月明确减少。图15d显示,用单一单侧icv剂量的对照nc-a u1ao以80μg的最高浓度处理的对照处理的q175小鼠不具有mhtt-fl转录物或mhtt-tr转录物的减少。
[0173]
第二,q175小鼠用mhtt-tr-a u1ao以四种不同浓度(即10、20、40和80μg)经历单一单侧icv剂量(每剂量的小鼠n=9),总共得到36只小鼠。在1、2和4个月后将每种浓度三只小鼠的队列安乐死,其中小鼠经历用1x pbs灌注然后处死。收集半脑并处理,用于通过rt-qpcr和rna印迹进行分析。将所有u1衔接子处理的小鼠与未处理的q175小鼠进行比较。通过rt-qpcr评估mhtt-tr转录物的沉默,然后将其与设为100%的未处理小鼠进行比较。用于检测mhtt-tr转录物的rt-qpcr包括去除内含子#1 dna所需的dna酶处理,所述内含子#1 dna会干扰mhtt-tr转录物的ct值。
[0174]
如图16a、图16b和图16c中所见,mhtt-tr转录物分别在处理后1、2和4个月明确减少。
[0175]
mhtt-tr-a u1ao对mhtt-tr转录物的沉默被认为是特异性的,因为:1)未观察到mhtt-fl转录物的显著变化,并且2)nc-a非特异性对照u1ao在最高剂量(80μg)下在1、2和4个月持续时间未显示沉默。同样,mhtt-fl-au1ao对mhtt-fl转录物的沉默被认为是特异性的,因为:1)未观察到mhtt-tr转录物的显著变化,并且2)nc-a非特异性对照u1ao在最高剂量(80μg)下在1、2和4个月持续时间未显示沉默。
[0176]
还进行药代动力学(pk)研究。在上文列出的相同小鼠的与3点时程持续时间组合的四点剂量反应中,通过
32
p-rna印迹分析获得pk谱。使用用于进行rt-qpcr的相同rna的等分样品进行rna印迹。简单来说,将来自u1衔接子处理的小鼠的rna样品以及标准品和
32
p示踪剂在8%变性尿素-page凝胶上分离,之后将其转移至rna印迹膜上。然后用同源
32
p探针探测所述膜,洗涤并暴露于x射线薄膜。同源探针是称为
32
p-抗mhtt-fl-a的
32
p标记的寡核苷酸,其对mhtt-fl-a u1ao是反义的;或者是称为
32
p-抗mhtt-tr-a的
32
p标记的寡核苷酸,其对mhtt-tr-a u1ao是反义的;或者是称为
32
p-抗nc-a的
32
p标记的寡核苷酸,其对nc-a u1ao是反义的。在几次暴露于x射线薄膜后,通过typhoon
tm
系统上的磷光成像仪分析对rna印迹进行定量。结果提供于图17中。
[0177]
还研究u1ao的组织病理学。简单来说,向yac128小鼠icv注射盐水(n=3)或50μg的盐水中的hhti-fl-2 u1衔接子寡聚物(n=5)。使用两只小鼠作为未处理对照。所述小鼠都是雄性并且年龄范围为3-5个月。将小鼠处理7天。检查来自每只小鼠的脑、肾和肝组织的两个经苏木素和伊红(h&e)染色的载玻片的组织病理学分析。上文载玻片的显微镜检查没有
揭示与icv-50μg u1衔接子寡聚物有关的毒性的特异性组织病理学变化。h&e载玻片的显微镜检查没有揭示与icv-50μg u1衔接子寡聚物有关的毒性的特异性组织病理学变化。
[0178]
尽管上文已经描述并明确例示本发明的某些优选实施方案,但并未意图将本发明限制于此类实施方案。可以在不背离如以下权利要求中所述的本发明的范围和精神的情况下对所述实施方案进行多种修改。
[0179]
在前述说明书中引用若干出版物和专利文件以更充分地描述本发明所属领域的最新技术水平。这些引用中每一项的公开内容通过引用并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1