具有多重化的抑制性RNA的细胞的制作方法
具有多重化的抑制性rna的细胞
技术领域
1.本技术涉及免疫治疗领域,更尤其涉及过继细胞治疗(adoptive cell therapy,act)领域。本文提供了经设计下调多个靶标的多个shrna。还提供了编码shrna的多核苷酸、载体和表达此类shrna的细胞,其单独或与嵌合抗原受体(chimeric antigen receptor,car)组合。这些细胞尤其适用于免疫治疗。本发明提供了在有此需要的患者中提高t细胞疗法功效的方法。此外,还提供了使用这些细胞治疗疾病例如癌症的策略。根据car的特异性,表达此类car的工程化免疫细胞,例如t细胞或自然杀伤(nk)细胞,适用于治疗淋巴瘤、多发性骨髓瘤和白血病,但也可以治疗其他肿瘤。
背景技术:
2.在细胞治疗中,下调可能干扰治疗的有益效果的靶标,例如可诱导移植物抗宿主病(graft versus host disease)的tcr组分、可诱导宿主抗移植物病(host versus graft disease)的hla组分、应激配体(stress ligand)、免疫检查点等,通常都是有利的。然而,由于实际限制(例如,可同时施用的载体大小和分子数量)和毒性,同时下调这些靶标中的多个常常是一个问题。
3.通常,提出基因工程化方法,例如,crispr/cas、talen、锌指核酸酶(zfn)等。然而,这些方法通常会导致永久性的不可逆变化和/或基因的完全敲除,这在不存在靶标会导致活力问题或毒性的情况下,可能是一个问题。此外,如果只需要靶标的瞬时下调,则永久性质导致灵活性较低。基因工程化技术通常也非常繁琐,理想状态下不适合同时敲低多个靶标。例如。在talen的情况下,针对每个靶标,需要将单独的核酸酶蛋白工程化以使其敲低可行。这些也需要评估有效性。两种或更多种不同talen的组合虽然在理论上可行,但在实践中有明显缺点:仍需要对两者的组合进行测试以检查这是否对功效产生影响。由于它们是大蛋白,因此在例如act的情况下表达两者是不切实际的,因为载体大小通常是有限的。当考虑多于两个靶标时,所有这些问题都会加剧。虽然crispr/cas通常是一种更通用的解决方案,但多重化(即,同时对多于一个靶标位点进行工程化)仍然具有挑战性,尤其是在真核生物中。这是由于例如dna修复效率低(真核生物中双链断裂的nhej修复机制容易出错),crispr有时会出现脱靶效应和染色体重排,以及对crispr多重化的整体效率低(当靶向多于一个基因时,转染效率显著降低)——即,效率和特异性均存在问题。此外,通过直接作用于dna来永久性沉默靶向基因的基因编辑方法提高了对稳健测试的要求,以确保基因组完整性,同时它们还需要复杂的多步骤生产方法,这可能导致晚期分化或耗竭细胞,使持久性和/或功能性受限(gattinoni et al.,2011)。这在act的情况下尤其关系重大:对于治疗功效,早期分化的未耗竭的细胞显然更优。
4.因此,本领域需要提供允许具有多重化的靶标敲低的细胞疗法的系统,所述系统不需要多步骤生产方法(并因此使制备相对容易且成本降低),并具有灵活性(例如,通过使变化可逆、允许削弱敲低(例如,以避免毒性)或将一个靶标换为另一个)。
技术实现要素:
5.在寻求解决多重化的基因组工程化所遇到的问题时,可以考虑为敲低而不是基因敲除带来可能性的系统,这将产生更大的灵活性(例如,时间调节将成为可能)。理想地,这些系统也不那么繁琐(从而不需要为每个靶标设计单独的蛋白),并且应该足够有效和特异。
6.可以考虑的一种解决方案是rna干扰(rnai)。植物和动物中存在几种rnai基因调节。第一种是通过表达小的非编码rna,称为microrna(“mirna”)。mirna能够靶向特定的信使rna(“mrna”)进行降解,从而促进基因沉默。
7.由于microrna通路在调节基因活性中的重要性,研究人员目前正在探索小干扰rna(“sirna”,其是人工设计的分子)所能介导rnai的程度。sirna可以引起靶分子例如mrna的裂解,并且与mirna类似,sirna依赖于碱基的互补性来识别靶分子。
8.在称为sirna的分子类别中,有短发夹rna(short hairpin rna,“shrna”)。shrna是包含有义区(sense region)和能够与有义区杂交的反义区(antisense region)的单链分子。shrna能够形成茎环(stem and loop)结构,其中有义区和反义区形成部分或全部的茎部。使用shrna的一个优势在于它们可以作为单个分子被递送或转录,在sirna具有两条独立的链时,这是不可能的。然而,与其他sirna一样,shrna仍然基于碱基的互补性而靶向mrna。
9.许多病况、疾病和病症是由多种蛋白之间或之中的相互作用导致的。因此,研究人员正在寻找同时向细胞或生物体递送多种sirna的有效方法。
10.一种递送选择是使用载体技术以在细胞中表达shrna,sharna在这些细胞中将通过内源mirna通路被加工。可能繁琐的是要为每个shrna使用单独的载体。因此,研究人员已经开始探索使用能够表达多个shrna的载体。不幸的是,有报道文献描述当从单个载体表达多个shrna时面临多种挑战。研究人员已遇到的问题包括:(a)载体重组和丧失shrna表达的风险;(b)多重盒(multiplex cassette)中的位置效应(positional effect)导致shrna功能性降低;(c)shrna克隆的复杂性;(d)rnai加工饱和;(e)细胞毒性;和(f)不希望的脱靶效应。
11.此外,sirna尽管已显示对某些转化的哺乳动物细胞系中的短期基因抑制有效,但已经证明,将其用于原代细胞培养或用于稳定转录物敲低更具挑战性。已知敲低效率变化很大,且范围在《10%到》90%之间(例如,taxman et al.,2006),因此需要进一步优化。当表达多于一种抑制剂时,效率通常会降低,因此这种优化在此类情况下更为重要。
12.因此,仍然需要开发用于递送多重化的rna干扰分子的有效的盒和载体。尽管对于一般的细胞应用的确探索较少,但在act领域中甚至更少,同时对这些细胞中的有效系统有高的需求。
13.令人惊讶地,本文证明不仅shrna可以成功地在细胞中,尤其是在工程化的免疫细胞中多重化,而且靶标也被非常有效地下调,甚至与基因敲除相当(参见实施例5-8和与crispr的比较)。
14.因此,本发明的一个目的是提供包含编码至少两个多重化的rna干扰分子的核酸分子的工程化细胞。
15.根据进一步的实施方案,提供了工程化的细胞,其包含:
16.o编码感兴趣的蛋白的第一外源核酸分子
17.o编码至少两个多重化的rna干扰分子的第二核酸分子。
18.工程化的细胞尤其是真核细胞,更尤其是工程化哺乳动物细胞,更尤其是工程化的人细胞。根据具体的实施方案,细胞是工程化的免疫细胞。典型的免疫细胞选自t细胞、nk细胞、nkt细胞、干细胞、祖细胞和ipsc细胞。
19.根据具体的实施方案,工程化的细胞进一步含有编码感兴趣的蛋白的核酸。具体地,这个感兴趣的蛋白是受体,尤其是嵌合抗原受体或tcr。嵌合抗原受体可以针对任何靶标,典型示例包括cd19、cd20、cd22、cd30、bcma、b7h3、b7h6、nkg2d、her2、her3、gpc3,但还存在更多靶标并且也适用。
20.根据具体的实施方案,第一和第二核酸分子存在于一个载体中,例如真核表达质粒、迷你环dna(mini-circle dna)或病毒载体(例如,衍生自慢病毒、逆转录病毒、腺病毒、腺相关病毒和仙台病毒(sendai virus))。
21.所述至少两个多重化的rna干扰分子可以是至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个、至少十个或甚至更多的分子,这取决于要下调的靶分子的数量以及多重化的分子的共表达的限制。“多重体(multiplex)”是编码多个相同类型分子,例如多个sirna或shrna或mirna的多核苷酸。在多重体中,当分子属于相同类型(例如,所有均为shrna)时,它们可以是相同的或包含不同的序列。在相同类型的分子之间,可能存在插入序列(intervening sequence),例如本文所述的接头。本发明的多重体的一个示例是编码多个串联的基于mirna的shrna的多核苷酸。多重体可以是单链、双链或同时具有单链区域和双链区域。
22.根据具体的实施方案,所述至少两个多重化的rna干扰分子受一个启动子控制。通常,这个启动子不是u6启动子。这是因为这个启动子与毒性有关,尤其是在高水平表达时。出于同样的原因,整体上可以考虑排除h1启动子(比u6弱的启动子)或甚至pol iii启动子(尽管它们可适用于某些条件)。根据具体的实施方案,启动子选自pol ii启动子和pol iii启动子。根据具体的实施方案,启动子是天然的或合成的pol ii启动子。根据具体的实施方案,启动子是选自以下的pol ii启动子:巨细胞病毒(cmv)启动子、延伸因子1α(ef1α)启动子(核心或全长)、磷酸甘油酸激酶(pgk)启动子、具有上游cmv iv增强子的复合β-肌动蛋白启动子(cag启动子)、泛素c(ubc)启动子、脾病灶形成病毒(spleen focus forming virus,sffv)启动子、劳斯肉瘤病毒(rous sarcoma virus,rsv)启动子、白细胞介素-2启动子、鼠干细胞病毒(murine stem cell virus,mscv)长末端重复序列(ltr)、长臂猿白血病病毒(gibbon ape leukemia virus,galv)ltr、猿猴病毒40(simian virus 40,sv40)启动子和trna启动子。这些启动子都属于驱动mrna表达最常用的聚合酶ii启动子。
23.根据具体的实施方案,所述至少两个多重化的rna干扰分子可以是shrna分子或mirna分子。最具体地,它们是mirna分子。shrna分子和mirna分子之间的区别在于mirna分子由drosha加工,而常规shrna分子则不是(这与毒性有关,grimm et al.,nature 441:537
–
541(2006))。
24.根据具体的实施方案,提供的mirna分子可以是在一个启动子控制下的一个mirna支架(scaffold)。
25.尤其适合用于mirna多重化的支架序列是mir-30支架序列、mir-155支架序列和
mir-196a2支架序列。
26.通常,mirna分子中的至少分子一个包含mir-196支架序列,优选mir-196a2支架序列。根据具体的实施方案,所述至少两个mirna分子中的全部分子均包含mir-支架序列,优选mir-196a2支架序列。对于mir-30和mir-155支架序列也可以这样说。此类合适支架的示例列于us8841267(尤其是其中的权利要求1)中,其通过引用并入本文。单个支架可商购smartvector
tm micro-rna适应支架(horizon discovery,lafayette,co,usa)。这个支架的多个拷贝可以以串联重复排列(见图5)。
27.其他合适的支架序列包括mir-26b(hsa-mir-26b)、mir-204(hsa-mir-204)以及mir-126(hsa-mir-126)、hsa-let-7f、hsa-let-7g、hsa-let-7a、hsa-let-7b、hsa-let-7c、hsa-mir-29a、hsa-mir-140-3p、hsa-let-7i、hsa-let-7e、hsa-mir-7-1、hsa-mir-7-2、hsa-mir-7-3、hsa-mir-26a、hsa-mir-26a、hsa-mir-340、hsa-mir-101、hsa-mir-29c、hsa-mir-191、hsa-mir-222、hsa-mir-34c-5p、hsa-mir-21、hsa-mir-378、hsa-mir-100、hsa-mir-192、hsa-mir-30d、hsa-mir-16、hsa-mir-432、hsa-mir-744、hsa-mir-29b、hsa-mir-130a或hsa-mir-15a。
28.根据可选的但非排他性的实施方案,不使用重复的特定mir支架(这形成人工重复支架),而是可以使用其中的内源mirna被替换为感兴趣的shrna的真实(authentic)的多顺反子mirna簇或其部分。为此,尤其合适的mir支架簇是mir-106a~363、mir-17~92、mir-106b~25和mir-23a~27a~24-2簇;最尤其是mir-106a~363簇及其片段。值得注意的是,为了节省载体有效载荷(payload),还尤其使用此类自然簇的部分而不是所有序列(这尤其有用,因为并非所有mirna都相等地间隔开,并且可能不需要全部接头序列)。可以考虑其他考虑因素,例如,采用在细胞中被最有效加工的mirna。例如,mir-17~92簇由(按顺序)mir-17、mir-18a、mir-19a、mir-20a、mir-19b-1和mir-92-1(也是mir-92a1)组成,其尤其有用的片段是从mir-19a至mir-92-1(即6个mirna中的4个)或从mir-19a至mir-19b-1(6个mirna中的3个)的支架序列。同样,106a~363簇由(按顺序)mir-106a、mir-18b、mir-20b、mir-19b-2、mir-92-2(也是mir-92a2)和mir-363组成。其尤其有用的片段是从mir-20b至mir-363(即6个mirna中的4个)或从mir-19b-2至mir-363(即6个mirna中的3个)的支架序列。可以使用天然接头序列以及其片段两者或人工接头(再次减少载体的有效载荷)。
29.可以使用这些策略的组合,例如,mir-106a~363簇和mir-196a2序列两者可以组合在一个新的支架中。
30.根据具体的实施方案,多重化的rna干扰分子中的至少两个分子针对相同的靶标。根据进一步的具体实施方案,多重化的rna干扰分子中的至少两个分子是相同的。
31.根据可选的实施方案,所述至少两个多重化的rna干扰分子中的所有分子都不同。根据进一步的具体实施方案,所述至少两个多重化的rna干扰分子中的所有分子针对不同的靶标。
32.本发明的rna干扰分子可以靶向工程化的细胞中存在的任何合适分子。涉及的靶标的典型示例是:mhc i类基因、mhc ii类基因、mhc共同受体基因(例如,hla-f、hla-g)、tcr链、cd3链、nkbbil、lta、tnf、ltb、lst1、ncr3、aif1、ly6、热休克蛋白(例如,hspa1l、hspa1a、hspa1b)、补体级联、调节型受体(例如,notch4)、tap、hla-dm、hla-do、ring1、cd52、cd247、hcp5、dgka、dgkz、b2m、mica、micb、ulbp1、ulbp2、ulbp3、ulbp4、ulbp5、ulbp6、2b4、a2ar、
bax、blimp1、c160(polr3a)、cbl-b、ccr6、cd7、cd95、cd123、dgk[dgka、dgkb、dgkd、dgke、dkgg、dgkh、dgki、dgkk、dgkq、dgkz]、dnmt3a、dr4、dr5、egr2、fabp4、fabp5、fasn、gmcsf、hpk1、il-10r[il10ra、il10rb]、il2、lfa1、neat 1、nfkb(包括rela、relb、nfkb2、nfkb1、rel)、nkg2a、nr4a(包括nr4a1、nr4a2、nr4a3)、pd1、pi3kcd、ppp2rd2、ship1、soat1、socs1、t-bet、tet2、tgfbr1、tgfbr2、tgfbr3、tigit、tim3、tox和zfp36l2。
[0033]
已经鉴定出了尤其合适的基于mirna的构建体。因此,提供了包含含有多重化的基于microrna的shrna编码区的多核苷酸的工程化细胞,其中所述多重化的基于microrna的shrna编码区包含编码以下的序列:
[0034]
两个或更多个人工的基于mirna的shrna核苷酸序列,其中每个人工的基于mirna的shrna核苷酸序列包含
[0035]
o mirna支架序列,
[0036]
o活性序列或成熟序列,和
[0037]
o过客(passenger)序列或星(star)序列,其中在每个人工的基于mirna的shrna核苷酸序列中,活性序列与过客序列至少80%互补。
[0038]
每个人工的基于mirna的shrna核苷酸序列的活性序列和过客序列的长度通常在18到40个核苷酸之间,更尤其在18到30个核苷酸之间,最尤其在19到25个核苷酸之间。
[0039]
通常,这些microrna支架序列由接头隔开,且接头序列的长度可以在例如30到60个核苷酸之间,尽管较短的区段也可以。事实上,令人惊讶地发现接头的长度并不重要,其可以非常短(少于10个核苷酸)或甚至不存在而不干扰shrna功能。这显示在图6和16中。
[0040]
人工序列可以是例如天然存在的支架(例如,mir簇或其片段,例如mir-106a~363簇),其中的内源mir序列已被替换为针对特定靶标而工程化的shrna序列;可以是单个mir支架的重复(例如,mir-196a2支架),其中的内源mir序列已被替换为针对特定靶标而工程化的shrna序列;可以是人工mir样(mir-like)序列;或其组合。
[0041]
这个工程化的细胞通常进一步包含编码感兴趣的蛋白的核酸分子,例如嵌合抗原受体或tcr,并且可以是工程化的免疫细胞,如上所述。
[0042]
多重化的rna干扰分子的共表达导致工程化细胞内至少一个基因,但通常是多个基因的抑制。这可促成更好的治疗功效。
[0043]
还提供本文所述的工程化细胞,用作药物。根据具体的实施方案,提供工程化的细胞用于治疗癌症。
[0044]
这相当于说提供了治疗癌症的方法,包括向有此需要的受试者施用合适剂量的如本文所述的工程化细胞,从而改善至少一种症状。
[0045]
工程化细胞可以是自体免疫细胞(从患者获得的细胞)或同种异体免疫细胞(从另一受试者获得的细胞)。
[0046]
附图简要说明
[0047]
图1:mirna支架长度的优化。a)通过cd19表达测定的经转导的t细胞的百分比。b)细胞的tcr和c)cd3e mfi,所述细胞用在不同长度的mirna支架中嵌入的靶向cd247的shrna转导。
[0048]
图2:不同的靶向cd52的shrna的筛选。a)显示了所转导的(cd19+)cd4+或cd8+t细胞的百分比,在fsc/ssc、活的cd3+细胞上设门。b)显示了所转导的(在cd19+中设门)cd4+或
cd8+t细胞的cd52 mfi。c)显示所转导的t(cd19+cd3+)细胞的cd52表达的代表性直方图。
[0049]
图3:不同供体中的cd52敲低。显示了衍生自三个不同供体的t细胞的cd52 mfi。细胞用mock或cd52 shrna-3表达载体转导。
[0050]
图4:筛选用于产生基于crispr/cas9的cd52敲除的t细胞的grna。在左侧小图中,显示了收获时(第8天)的cd4+和cd8+t细胞的cd52 mfi。对于mock(tcd19)和shrna条件,在cd19+细胞上进行设门,而对于其他条件,在cd3+t细胞上进行设门。在右侧小图中,代表性直方图显示了与仅cas9对照相比,三个不同grna的cd52表达。
[0051]
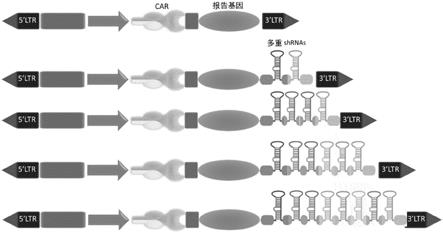
图5:显示了具有(上部)或不具有(下部)整合的mirna支架的car表达载体(例如,cd19、bcma、b7h3、b7h6、nkg2d、her2、her3、gpc3)的设计,允许来自同一载体的car和多个shrna(例如,2个、4个、6个、8个
……
)的共表达。ltr:长末端重复序列;启动子(例如,ef1a、pgk、sffv、cag
……
);标记物蛋白(例如,截短的cd34、cd19);多重化的shrna。
[0052]
图6:在原代t细胞中bcma-car载体的背景下,从相同的表达构建体中表达两个mirna shrna。评估了两个shrna之间的不同间隔子(多重体1-5)对cd247和cd52蛋白敲低的影响。a)通过报告蛋白tcd34的表达测量的转导效率,b)用bcma-fc融合蛋白染色然后用结合有pe的抗fc抗体染色后,细胞表面的bcma car表达。c)tcr的平均荧光强度(mfi),作为在由靶向cd247的shrna介导的tcr的cd3ζ亚基敲低后tcr表达下调效率的读数,和d)不同构建体下调cd52的效率,使用cd52 mfi作为读数。
[0053]
图7:a)cd247(cd3z)和b)cd52 rna水平,其是在用所示的单个或多重化的shrna构建体和相应对照转导的t细胞中,相对于用作管家基因的cypa rna,通过实时pcr分析评估的。
[0054]
图8:用bcma car转导的tcr和cd52染色的t细胞的代表性流式细胞术数据,所述bcma car共表达与间隔子-2或间隔子-5多重化的cd247、cd52或cd52和cd247 shrna两者。作为对照,细胞用rnp cas9grna cd52和grna cd247复合物进行核转染。
[0055]
图9:a)t细胞的tcr细胞表面表达和b)t细胞的cd52细胞表面表达的流式细胞术分析,所述t细胞用所示的单个或多重化的shrna构建体和各自的对照转导。
[0056]
图10:a)通过用bcma-fc融合蛋白染色,随后用结合有pe的抗fc和结合有apc的抗cd34抗体染色,来评估用不同表达构建体转导的细胞的bcma car表达。显示了所转导的(cd34+)t细胞的bcma-fc染色的中值荧光强度。b)将不同的表达bcma的癌细胞系(rpmi-8226、u266、opm-2)与mock(tcd34)、表达bcma-car的t细胞(具有或不具有cd247 shrna、cd52 shrna或cd247 cd52多重化的shrna)共培养24小时,通过elisa测量上清液中的ifn-γ水平。
[0057]
图11:显示了t细胞受体响应于促有丝分裂刺激(mitogenic stimuli)的体外功能测定。在浓度增加的抗cd3e抗体(克隆okt3)的存在下培养t细胞。24小时后,通过elisa测量上清液中的ifn-γ水平。显示了来自两个不同供体(cc19-174和cc19-184)的结果。
[0058]
图12:显示了评估t细胞对抗cd52介导的细胞杀伤的敏感性的体外功能测定。阿仑单抗(alemtuzumab)用作抗cd52抗体。在50μg/ml阿仑单抗或igg对照抗体的存在下用30%补体处理t细胞。4小时后评估活细胞数。
[0059]
图13:显示了用以单个或多重化表达的靶向b2m、dgk、cd247和cd52的四个shrna(如载体设计上所示)以及第二代cd19 car和选择标记物(使用慢病毒骨架)转导的jurkat
细胞中的rna表达。在转导后第7天,使用标记物特异性磁珠进行单步富集。通过qrt-pcr分析了shrna介导的对四个靶标转录表达的下调。
[0060]
图14:显示了用逆转录病毒载体转导的来自健康供体的原代t细胞中的rna表达,所述逆转录病毒载体编码第二代cd19指导的car、截短的cd34选择标记物以及靶向cd247、b2m或cd52的引入在106a-363mirna簇中的3 x shrna或6 x shrna。没有使用shrna(tcd34))作为对照。转导后两天,使用cd34特异性磁珠富集细胞,并在il-2(100iu/ml)中进一步扩增6天。使用亲环蛋白(cyclophilin)作为管家基因,通过qrt-pcr评估cd247、b2m和cd52的mrna表达。
[0061]
图15:显示了人ipsc细胞系scips-r1中的rna表达,所述细胞系用被长接头(接头1-41bp)或最小接头(接头2-6bp)分隔开的两个shrna以及选择标记物cd34(tcd34)(使用慢病毒骨架)转导。转导用在培养基中稀释至1ml总体积的50μl或500μl病毒上清液进行。在转导后第8天,使用cd34特异性clinimacs磁珠进行单步富集。随后使用亲环蛋白作为管家基因,通过qrt-pcr分析细胞的shrna靶标的转录表达。条形图表示以不表达shrna的scips-r1细胞作(tcd34)为对照的相对表达值。接头1(41bp):caagttgggctttaaagcttgcagggcctgctgatgttgag(seq id no:1);接头2(6bp-克隆衍生的):aagctt(seq id no:2)。
[0062]
图16:显示了人ipsc细胞系scips-r1中的rna表达,所述细胞系用被长接头(接头1-41bp)或最小接头(接头2-6bp)分隔开的两个shrna以及选择标记物cd34(tcd34)(使用慢病毒骨架)转导。转导用在培养基中稀释至1ml总体积的500μl病毒上清液进行。在转导后第8天,使用cd34特异性clinimacs磁珠进行单步富集。使用亲环蛋白作为管家基因,通过qrt-pcr分析细胞的shrna靶标表达。条形图表示以不表达shrna的scips-r1细胞(tcd34)作为对照的相对表达值。
具体实施方式
[0063]
定义
[0064]
本发明将结合具体实施方案并参考某些附图进行描述,但本发明不限于此,而仅受权利要求的限制。权利要求中的任何参考标记不应被解释为限制范围。所述附图只是示意性的并且是非限制性的。在附图中,为了说明的目的,一些元件的大小可能被夸大并且未按比例绘制。在本说明书和权利要求中使用术语“包含”时,它不排除其他元件或步骤。当指代单数名词时使用不定冠词或定冠词,例如“a”或“an”、“the”时,除非另有说明,否则包括该名词的复数形式。
[0065]
此外,说明书和权利要求中的术语第一、第二、第三等用于区分相似的元件,而并不一定用于描述顺序或时间顺序。应当理解,如此使用的术语在合适的情况下是可互换的,并且本文所述的本发明的实施方案能够以不同于本文所描述或说明的其他顺序进行操作。
[0066]
提供以下术语或定义仅用于帮助理解本发明。
[0067]
除非在本文中特别定义,否则本文所用的所有术语的含义与其对于本发明领域技术人员的含义相同。对于本领域的定义和术语,从业者尤其关注green and sambrook,molecular cloning:a laboratory manual,4th ed.,cold spring harbor laboratory press,,new york(2012);和ausubel et al.,current protocols in molecular biology(up to supplement 114),john wiley&sons,new york(2016)。本文提供的定义所解释的
范围不应小于本领域普通技术人员理解的范围。
[0068]
如本文所用,“工程化细胞”是已通过人为干预(与天然发生的突变相对)修饰的细胞。
[0069]
如本文所用,术语“核酸分子”被同义地称为“核苷酸”或“核酸”或“多核苷酸”,是指任何聚核糖核苷酸或聚脱氧核糖核苷酸,其可以是未修饰的rna或dna或修饰的rna或dna。核酸分子包括但不限于单链和双链dna、作为单链和双链区域混合物的dna、单链和双链rna以及作为单链和双链区域混合物的rna,包含dna和rna(其可以是单链的,或更典型地是双链的或单链和双链区域的混合物)的杂合分子。此外,“多核苷酸”是指包含rna或dna或rna和dna两者的三链区域。术语多核苷酸还包括含有一个或多个修饰碱基的dna或rna,以及骨架出于稳定性或其他原因被修饰的dna或rna。“修饰的”碱基包括,例如,三苯甲基化的碱基和不常见的碱基,例如肌苷。可以对dna和rna进行多种修饰;因此,“多核苷酸”包括通常在自然界中发现的化学、酶促或代谢修饰形式的多核苷酸,以及病毒和细胞特有的dna和rna的化学形式。“多核苷酸”还包括相对较短的核酸链,通常称为寡核苷酸。
[0070]“载体”是复制子,例如质粒、噬菌体、粘粒或病毒,其中可以可操作地插入另一个核酸区段以引起所述区段的复制或表达。“克隆”是通过有丝分裂从单个细胞或共同祖先衍生的细胞群体。“细胞系”是能够在体外稳定生长多代的原代细胞的克隆。在本文提供的一些示例中,通过用dna转染细胞来转化细胞。
[0071]
术语“表达”和“产生”在本文中同义使用,并且是指基因产物的生物合成。这些术语涵盖基因向rna的转录。这些术语还涵盖rna到一个或多个多肽的翻译,并进一步涵盖所有天然发生的转录后和翻译后修饰。
[0072]
如本文所用,术语“外源的”,尤其是在细胞或免疫细胞的上下文中,是指存在于个体活细胞中并具有活性但起源于该细胞外的任何物质(与内源因子相对)。因此,短语“外源核酸分子”是指已通常通过转导或转染被引入(免疫)细胞中的核酸分子。如本文所用,术语“内源的”是指存在于个体活细胞中并具有活性且源自于该细胞内部的任何因子或物质(并因此通常也在非转导或非转染细胞中产生)。
[0073]
如本文所用,“分离的”是指生物组分(例如核酸、肽或蛋白)已从该组分天然存在于其中的生物体的其他生物组分(即其他染色体的和染色体外的dna和rna以及蛋白)中基本上分离、从其中产生或从其中纯化。已“分离”的核酸、肽和蛋白因此包括通过标准纯化方法纯化的核酸和蛋白。“分离的”核酸、肽和蛋白可以是组合物的一部分,并且如果这样的组合物不是核酸、肽或蛋白的天然环境的一部分,则可以被继续分离。所述术语还涵盖通过在宿主细胞中重组表达制备的核酸、肽和蛋白,以及化学合成的核酸。
[0074]
在基因编辑的背景下,如本文所用的“多重化的(multiplexed)”是指同时靶向两个或更多个(即多个)相关或不相关的靶标。如本文所用,术语“rna干扰分子”是指通过中和所靶向的mrna分子来抑制基因表达或翻译的rna(或rna样)分子。示例包括sirna(包括shrna)或mirna分子。因此,如本文所用,“多重化的rna干扰分子”是同时存在用于同时下调一个或多个靶标的两个或更多个分子。通常,多重化的分子中的每一个将针对特定靶标,但两个分子可以针对相同靶标(且甚至可以是相同的)。
[0075]
如本文所用,“启动子”是核酸的调节区,通常位于基因区附近,为受调节的基因转录提供控制点。
[0076]“多重体”是编码多个相同类型分子的多核苷酸,例如多个sirna或shrna或mirna。在多重体中,当分子属于相同类型(例如,所有均为shrna)时,它们可能是相同的或包含不同的序列。在相同类型的分子之间,可能存在插入序列,例如本文所述的接头。本发明的多重体的一个示例是编码多个串联的基于mirna的shrna的多核苷酸。多重体可以是单链的、双链的或同时具有单链区域和双链区域。
[0077]
如本文所用,“嵌合抗原受体”或“car”是指嵌合受体(即,由来自不同来源的部分组成),其至少具有对抗原有特异性的结合部分(其可以例如衍生自抗体、受体或其关联配体(cognate ligand))和可以在免疫细胞中传递信号的信号传导部分(例如,cd3 zeta链。也可以使用其他信号传导或共信号传导部分,例如fc epsilon riγ结构域、cd3 epsilon结构域,最近描述的dap10/dap12信号传导结构域,或来自cd28、4-1bb、ox40、icos、dap10、dap12、cd27和cd2的结构域作为共刺激结构域)。“嵌合nk受体”是其中的结合部分衍生自或分离自nk受体的car。
[0078]
如本文所用,“tcr”是指t细胞受体。在过继细胞转移的背景下,这通常是指工程化的tcr,即已被工程化以识别特定抗原且最通常是肿瘤抗原的tcr。如本文所用,“内源tcr”是指内源存在于未修饰细胞(通常为t细胞)上的tcr。tcr是一种二硫键连接的膜锚定的异二聚体蛋白,通常由高度可变的alpha(α)和beta(β)链组成,表达为包含不变的cd3链分子的复合物一部分。tcr受体复合物是可变的tcr受体α和β链与cd3共同受体(包含一条cd3γ链、一条cd3δ链和两条cd3ε链)和两条cd3ζ链(又名cd247分子)的八聚体复合物。如本文所用,术语“功能性tcr”意指能够在与其关联配体结合时转导信号的tcr。通常,对于同种异体疗法,进行工程化以减少或损害tcr功能,例如,通过敲除或敲低至少一个tcr链。当工程化细胞中的内源tcr与具有内源tcr而没有任何工程化的细胞相比保留至少50%、至少60%、至少70%、至少75%、至少80%或甚至至少90%的信号传导能力(或t细胞激活)时,认为其是有功能的。用于评估信号传导能力或t细胞激活的测定是本领域技术人员已知的,并且包括测量干扰素γ的elisa等。根据可选的实施方案,如果没有进行干扰tcr功能的工程化,则内源tcr被认为是有功能的。
[0079]
如本文所用,术语“免疫细胞”是指作为免疫系统(其可以是适应性或先天性免疫系统)的一部分的细胞。本文所用的免疫细胞通常是为过继细胞转移(自体转移或同种异体转移)而制造的免疫细胞。许多不同类型的免疫细胞用于过继疗法,因此免疫细胞可用于本文所述的方法中。免疫细胞的示例包括但不限于t细胞、nk细胞、nkt细胞、淋巴细胞、树突细胞、骨髓细胞、干细胞、祖细胞或ipsc。后三个本身不是免疫细胞,但可用在过继细胞转移中用于免疫治疗(参见例如jiang et al.,cell mol immunol 2014;themeli et al.,cell stem cell 2015)。通常,尽管制造从干细胞或ipsc开始(或者甚至可能从自免疫细胞至ipsc的去分化步骤开始),但制造在施用前需要分化为免疫细胞的步骤。用于制造过继转移用免疫细胞的干细胞、祖细胞和ipsc(即,用本文所述的car转导的干细胞、祖细胞和ipsc或其分化后代)被认为是本文的免疫细胞。根据具体的实施方案,所述方法中涉及的干细胞不涉及破坏人胚胎的步骤。
[0080]
特别涉及的免疫细胞包括白细胞(白血球),其包括淋巴细胞、单核细胞、巨噬细胞和树突细胞。特别涉及的淋巴细胞包括t细胞、nk细胞和b细胞,最特别涉及的是t细胞。在过继转移的背景下,注意免疫细胞通常将是原代细胞(即,从人或动物组织中直接分离的,不
培养或仅短暂培养的细胞),并且不是细胞系(即,已经长时间连续传代并已获得同质的基因型和表型特征的细胞)。根据具体的实施方案,免疫细胞将是原代细胞(即,从人或动物组织中直接分离的,不培养或仅短暂培养的细胞),并且不是细胞系(即,已经长时间连续传代并已获得同质的基因型和表型特征的细胞)。根据可选的具体实施方案,免疫细胞不是来自细胞系的细胞。
[0081]
如本文所用,“microrna支架”或“mirna支架”是指含特定的microrna加工要求的经充分表征的初级microrna序列,其中可以插入rna序列(通常现有的mirna序列被替换为针对特定靶标的shrna)。mirna支架的示例包括smartvector
tm micro-rna适配支架(horizon discovery,lafayette,co,usa),或天然存在的mirna簇,例如mir-106a~363簇。
[0082]
术语“受试者”是指人和非人动物,包括所有脊椎动物,例如哺乳动物和非哺乳动物,例如非人灵长类动物、小鼠、兔、绵羊、狗、猫、马、牛、鸡、两栖动物和爬行动物。在所述方法的大多数具体实施方案中,受试者是人。
[0083]
术语“治疗”是指减轻或改善损伤、病理或病况的任何成功或成功标志,包括任何客观或主观参数,例如减轻、缓解、减弱症状或使患者对病况的耐受更强、减慢退化(degeneration)或衰退的速度、使退化的最终点不那么衰弱、改善受试者的身体或精神健康、或延长生存时间。治疗可以通过客观或主观参数进行评估;包括身体检查、神经系统检查或精神评估的结果。
[0084]
如本文所用,短语“过继细胞疗法”、“过继细胞转移”或“act”是指将细胞(最通常为免疫细胞)转移到受试者(例如患者)中。这些细胞可能源自受试者(在自体疗法的情况下)或源自另一个体(在同种异体疗法的情况下)。疗法的目标是提高免疫功能性和特性,以及在癌症免疫疗法中提高对癌症的免疫应答。尽管t细胞最常用于act,但其他免疫细胞类型也适用,例如nk细胞、淋巴细胞(例如,肿瘤浸润淋巴细胞(til))、树突细胞和骨髓细胞。
[0085]“有效量”或“治疗有效量”是指在必要的剂量和时间段内有效实现所需治疗结果的量。治疗剂(例如本文所述的转化的免疫细胞)的治疗有效量可根据例如个体的疾病状态、年龄、性别和体重以及治疗剂(例如细胞)在个体中引发所需应答的能力等因素而变化。治疗有效量也是治疗剂的治疗有益作用超出任何毒性或有害作用的量。
[0086]
短语“移植物抗宿主病”或“gvhd”是指在同种异体移植后可能发生的病况。在gvhd中,捐献的骨髓、外周血(干)细胞或其他免疫细胞将接受者的身体视为外来物(foreign),并且捐献的细胞会攻击身体。由于供体免疫活性免疫细胞(例如t细胞)是gvhd的主要驱动因素,因此预防gvhd的一种策略是减少这些免疫活性细胞中的(基于tcr的)信号传导,例如通过直接或间接抑制tcr复合物的功能。
[0087]
为了评估在不需要基因组编辑(及其相关成本和复杂制造过程)的情况下,在过继细胞转移(act)背景下靶向多个基因是否可行,决定测试多重化的rna干扰分子。
[0088]
潜在的方法基于来自特定载体的rna的转录,其通过内源rna编辑机器加工而生成活性shrna,该活性shrna能够通过碱基识别靶向所选择的mrna并通过dicer复合物对该特异性mrna进行破坏。所靶向的mrna的特异性破坏导致相关蛋白表达的相应减少。虽然可以将rna寡核苷酸转染到所选择的靶细胞中以实现基因表达的瞬时敲低,但从所整合的载体表达所需的shrna能够稳定敲低基因表达。
[0089]
shrna的成功表达在很大程度上取决于与聚合酶iii(pol iii)启动子(例如,h1、
u6)的偶联,这产生缺乏5'帽和3'多聚腺苷酸化的rna物质,能够进行shrna双链体的加工。转录后,shrna经历加工、从细胞核输出、进一步加工并加载到rna诱导的沉默复合物(rna-induced silencing complex,risc)中,导致选择的mrna靶向降解(moore et al.,2010)。poliii启动子驱动的转录虽然有效,但由于poliii启动子对shrna的过度高表达导致的内源microrna通路的饱和,转录的效率可导致细胞毒性(fowler et al.,2015)。此外,通常通过使用驱动治疗基因的聚合酶ii(polii)启动子和驱动感兴趣的shrna的poliii启动子,实现利用单个载体表达治疗基因和shrna两者。该表达是功能性的,但以载体空间(vector space)为代价,导致引入的治疗基因的选择较少(chumakov et al.,2010;moore et al.,2010)。
[0090]
将shrna嵌入microrna(mir)框架内允许在polii启动子的控制下加工shrna(giering et al.,2008)。重要的是,嵌入的shrna的表达水平往往较低,从而避免了在使用其他系统(例如u6启动子)表达时观察到的毒性(fowler et al.,2015)。事实上,接受由肝特异性polii启动子驱动的shrna的小鼠表现出稳定的基因敲低,超过一年没有耐受性问题(giering et al.,2008)。然而,这仅针对一个shrna,在肝细胞中完成,且蛋白水平的降低仅为15%(giering et al.,2008),因此尚不知晓对于多于一个靶标,且尤其是在免疫细胞(其更难操作)中时,是否可以达到更高的效率。
[0091]
令人惊讶的是,本文证明了针对多个不同靶标的多个基于microrna的shrna(基于例如用作支架的mir196a2支架或mir106a~363簇)的表达在t细胞中是可行的,没有显示出重组,没有显示出毒性,并且同时实现了对所述多个靶标的有效下调。
[0092]
因此,shrna不仅可以在细胞中(尤其在工程化的免疫细胞中)成功地被多重化,而且靶标也被非常有效地下调,甚至与基因敲除相当(参见实施例5-8和图8-12,提供与crispr的比较)。
[0093]
因此,本发明的一个目的是提供包含编码至少两个多重化的rna干扰分子的核酸分子的工程化细胞。
[0094]
含有至少两个rna干扰分子的细胞可以具有优势,尤其是治疗益处。rna干扰分子确实可以针对不希望(过)表达的靶标。然而,通常,本文提供的工程化细胞将进一步含有感兴趣的蛋白。
[0095]
根据这些进一步的实施方案,提供了工程化的细胞,其包含:
[0096]
o编码感兴趣的蛋白的第一外源核酸分子,和
[0097]
o编码至少两个多重化的rna干扰分子的第二核酸分子。
[0098]
任选的其他感兴趣的蛋白可以例如提供加合性的、支持性的或甚至协同性的作用,或者它可以用于不同的目的。例如,感兴趣的蛋白可以是针对肿瘤的car,并且rna干扰分子可以干扰肿瘤功能,例如通过靶向免疫检查点、直接下调肿瘤靶标、靶向肿瘤微环境。或者或可选地,rna干扰分子中的一个或多个可延长治疗细胞的持久性,或以其他方式改变生理应答(例如,干扰gvhd或宿主抗移植物反应)。
[0099]
感兴趣的蛋白原则上可以是任何蛋白,视情况而定。然而,通常它们是具有治疗功能的蛋白。这些蛋白可以包括分泌的治疗蛋白,例如,白细胞介素、细胞因子或激素。然而,根据具体的实施方案,感兴趣的蛋白不是分泌的蛋白。通常,感兴趣的蛋白是受体。根据进一步的具体实施方案,受体是嵌合抗原受体或tcr。嵌合抗原受体可以针对在靶细胞表面表
达的任何靶标,典型的示例包括但不限于cd5、cd19、cd20、cd22、cd23、cd30、cd33、cd38、cd44、cd56、cd70、cd123、cd133、cd138、cd171、cd174、cd248、cd274、cd276、cd279、cd319、cd326、cd340、bcma、b7h3、b7h6、ceacam5、egfrviii、epha2、间皮素(mesothelin)、nkg2d、her2、her3、gpc3、flt3、dll3、il1rap、kdr、met、粘蛋白1(mucin 1)、il13ra2、folh1、fap、ca9、folr1、ror1、gd2、psca、gpnmb、cspg4、ulbp1、ulbp2,但还存在有更多并且也是合适的。尽管大多数car是基于scfv的(即,结合部分是针对特定靶标的scfv,并且car通常以靶标命名),但一些car是基于受体的(即,结合部分是受体的一部分,并且car通常以受体命名)。后者的一个示例是nkg2d-car。
[0100]
工程化的tcr可以针对细胞的任何靶标,包括细胞内靶标。除了以上列出的存在于细胞表面的靶标之外,tcr的典型靶标包括但不限于ny-eso-1、prame、afp、mage-a3、mage-a4、mage-a6、mage-a10、mage-a12、gp100、mart-1、酪氨酸酶、wt1、p53、hpv-e6、hpv-e7、hbv、trail、甲状腺球蛋白、kras、herv-e、ha-1、cmv和cea。
[0101]
根据存在有其他感兴趣的蛋白的这些具体的实施方案,工程化的细胞中的第一和第二核酸分子通常存在于一个载体中,例如真核表达质粒、迷你环dna或病毒载体(例如,衍生自慢病毒、逆转录病毒、腺病毒、腺相关病毒和仙台病毒)。根据进一步的具体实施方案,病毒载体选自慢病毒载体和逆转录病毒载体。尤其对于后者,载体载荷(即,构建体的总大小)是重要的,并且使用紧凑的多重盒(compact multiplex cassette)尤其有利。
[0102]
工程化的细胞尤其是真核细胞,更尤其是工程化哺乳动物细胞,更尤其是工程化人细胞。根据具体的实施方案,细胞是工程化的免疫细胞。典型的免疫细胞选自t细胞、nk细胞、nkt细胞、干细胞、祖细胞和ipsc细胞。
[0103]
所述至少两个多重化的rna干扰分子可以是至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个、至少十个或甚至更多个分子,取决于要下调的靶分子的数量以及多重化的分子的共表达的限制。“多重体”是编码多个相同类型分子的多核苷酸,例如多个sirna或shrna或mirna。在多重体中,当分子是相同类型(例如,所有均为shrna)时,它们可以是相同的或包含不同的序列。在相同类型的分子之间,可以存在插入序列,例如接头,如本文所述。本发明的多重体的一个示例是编码多个串联的基于mirna的shrna的多核苷酸。多重体可以是单链、双链或同时具有单链区域和双链区域两者。
[0104]
根据具体的实施方案,所述至少两个多重化的rna干扰分子受一个启动子控制。通常,当表达多于一个rna干扰分子时,这通过引入多个拷贝的shrna表达盒来完成。这些拷贝通常携带相同的启动子序列,这会导致频繁的重组事件而去除重复序列片段。作为解决方案,通常在表达盒中使用数个不同的启动子(例如,chumakov et al.,2010)。然而,根据本实施方案,通过使用仅一个启动子而避免了重组。尽管表达通常较低,但这在毒性方面具有优势,因为过多的sirna可能对细胞有毒性(例如,通过干扰内源sirna通路)。使用仅一个启动子具有额外的优势,即所有shrna被共调节并以相似的水平表达。需要注意的是,如实施例中所示,可以从一个启动子转录多个shrna,而不显著降低功效。
[0105]
根据进一步的具体实施方案,所述至少两个多重化的rna干扰分子和感兴趣的蛋白均在一个启动子的控制下。这再次减少了载体载荷(因为未使用单独的启动子来表达感兴趣的蛋白),并提供了共调节性表达的优势。例如当感兴趣的蛋白是靶向癌症的car并且rna干扰分子想要在肿瘤根除中产生加合性或协同性作用时,这可能是有利的。
[0106]
通常,用于表达rna干扰分子的启动子不是u6启动子。这是因为这个启动子与毒性有关,尤其是在高水平表达时。出于同样的原因,整体可以考虑排除h1启动子(比u6弱的启动子)或甚至pol iii启动子(尽管它们可适用于某些条件)。因此,根据具体的实施方案,用于表达rna干扰分子的启动子不是rna pol iii启动子。rna pol iii启动子缺乏时间和空间控制,并且不允许mirna抑制剂的受控表达。相比之下,许多rna pol ii启动子允许组织特异性表达,并且存在诱导型和阻抑型rna pol ii启动子。尽管在本发明的上下文中通常不需要组织特异性表达(因为细胞是在工程化之前选择的),但具有针对例如免疫细胞的特异启动子仍然是一个优势,因为已经表明,不同启动子的rnai功效的差异在免疫细胞中尤为明显(lebbink et al.,2011)。根据具体的实施方案,启动子选自pol ii启动子和pol iii启动子。根据具体的实施方案,启动子是天然或合成的pol ii启动子。合适的启动子包括但不限于巨细胞病毒(cmv)启动子、延伸因子1α(ef1α)启动子(核心或全长)、磷酸甘油酯激酶(pgk)启动子、具有上游cmv iv增强子的复合β-肌动蛋白启动子(cag启动子)、泛素c(ubc)启动子、脾病灶形成病毒(sffv)启动子、劳斯肉瘤病毒(rsv)启动子、白细胞介素-2启动子、鼠干细胞病毒(mscv)长末端重复序列(ltr)、长臂猿白血病病毒(galv)ltr、猿猴病毒40(sv40)启动子和trna启动子。这些启动子属于驱动mrna表达最常用的聚合酶ii启动子。
[0107]
根据具体的实施方案,所述至少两个多重化的rna干扰分子可以是shrna分子或mirna分子。最具体地,它们是mirna分子。shrna分子和mirna分子之间的区别在于mirna分子是由drosha加工,而常规shrna分子则不是(其与毒性有关,grimm et al.,nature 441:537
–
541(2006))。
[0108]
根据具体的实施方案,提供的mirna分子可以是在一个启动子控制下的一个mirna支架。如果选择的支架通常带有一个mirna,则该支架可以是重复的或与其他支架组合以获得多个rna干扰分子的表达。然而,当进行重复或与其他支架组合时,通常设想所有的多重化的rna干扰分子将在一个启动子的控制下(即,在单个支架重复时,启动子不重复)。
[0109]
尤其适合用于mirna多重化的支架序列是mir-30支架序列、mir-155支架序列和mir-196a2支架序列。然而,根据具体的实施方案,不使用mir-30或mir-155序列。
[0110]
通常,mirna分子中的至少一个分子包含mir-196支架序列,优选mir-196a2支架序列。根据具体的实施方案,所述至少两个mirna分子中的所有分子均包含mir-支架序列,优选mir-196a2支架序列。对于mir-30和mir-155支架序列也可以这样说。此类合适支架的示例列于us 8841267(尤其是其中的权利要求1)中,其通过引用并入本文。单个支架可以商购smartvector
tm micro-rna适应支架(horizon discovery,lafayette,co,usa)。
[0111]
其他合适的支架序列包括mir-26b(hsa-mir-26b)、mir-204(hsa-mir-204)以及mir-126(hsa-mir-126)、hsa-let-7f、hsa-let-7g、hsa-let-7a、hsa-let-7b、hsa-let-7c、hsa-mir-29a、hsa-mir-140-3p、hsa-let-7i、hsa-let-7e、hsa-mir-7-1、hsa-mir-7-2、hsa-mir-7-3、hsa-mir-26a、hsa-mir-26a、hsa-mir-340、hsa-mir-101、hsa-mir-29c、hsa-mir-191、hsa-mir-222、hsa-mir-34c-5p、hsa-mir-21、hsa-mir-378、hsa-mir-100、hsa-mir-192、hsa-mir-30d、hsa-mir-16、hsa-mir-432、hsa-mir-744、hsa-mir-29b、hsa-mir-130a或hsa-mir-15a。
[0112]
根据可选的但非排他性的实施方案,不使用重复的特定mir支架(这形成人工重复的支架),而是可以使用真实的多顺反子mirna簇或其部分(其中的内源mirna被替换为感兴
趣的shrna)。为此,尤其合适的mir支架簇是mir-106a~363、mir-17~92、mir-106b~25和mir-23a~27a~24-2簇;最尤其是mir-106a~363簇及其片段。值得注意的是,为了节省载体有效载荷,还尤其使用此类自然簇的部分而不是所有序列(这尤其有用,因为并非所有mirna都相等地间隔开,并且可能不需要全部接头序列)。可以考虑其他考虑因素,例如,采用在细胞中被最有效加工的mirna。例如,mir-17~92簇由(按顺序)mir-17、mir-18a、mir-19a、mir-20a、mir-19b-1和mir-92-1(也是mir-92a1)组成,其尤其有用的片段是从mir-19a至mir-92-1(即6个mirna中的4个)或从mir-19a至mir-19b-1(6个mirna中的3个)的支架序列。同样,106a~363簇由(按顺序)mir-106a、mir-18b、mir-20b、mir-19b-2、mir-92-2(也是mir-92a2)和mir-363组成。其尤其有用的片段是从mir-20b至mir-363(即6个mirna中的4个)或从mir-19b-2至mir-363(即6个mirna中的3个)的支架序列。可以使用天然接头序列以及其片段两者或人工接头(再次减少载体的有效载荷)。
[0113]
可以使用这些策略的组合,例如mir-106a~363簇和mir-196a2序列两者可以组合在一个新的支架中。
[0114]
本文公开的细胞含有多个多重化的rna干扰分子。这些分子可以针对一个或多个需要下调的靶标(细胞内靶标或者在shrna被分泌时为细胞外靶标)。每个rna干扰分子可以靶向不同的分子,它们可以靶向相同的分子,或其组合(即,多于一个rna分子针对一个靶标,同时一个rna干扰分子针对不同的靶标)。当所述多个rna干扰分子针对相同靶标时,它们可以靶向相同区域,或他们可以靶向不同区域。换句话说,所述多个rna干扰分子在针对相同靶标时可以相同或不同。rna干扰分子的此类组合的示例显示在实施例9中。
[0115]
因此,根据具体的实施方案,多重化的rna干扰分子中的至少两个分子针对相同的靶标。根据进一步的具体实施方案,多重化的rna干扰分子中的至少两个分子是相同的。
[0116]
根据可选的实施方案,所述至少两个多重化的rna干扰分子中的所有分子都不同。根据进一步的具体实施方案,所述至少两个多重化的rna干扰分子中的所有分子都针对不同的靶标。
[0117]
工程化细胞中存在的任何合适的分子都可以被本发明的rna干扰分子靶向。靶标的典型示例是:mhc i类基因、mhc ii类基因、mhc共受体基因(例如,hla-f、hla-g)、tcr链、cd3链、nkbbil、lta、tnf、ltb、lst1、ncr3、aif1、ly6、热休克蛋白(例如,hspa1l、hspa1a、hspa1b)、补体级联、调节型受体(例如,notch4)、tap、hla-dm、hla-do、ring1、cd52、cd247、hcp5、dgka、dgkz、b2m、mica、micb、ulbp1、ulbp2、ulbp3、ulbp4、ulbp5、ulbp6、2b4、a2ar、bax、blimp1、c160(polr3a)、cbl-b、ccr6、cd7、cd95、cd123、dgk[dgka、dgkb、dgkd、dgke、dkgg、dgkh、dgki、dgkk、dgkq、dgkz]、dnmt3a、dr4、dr5、egr2、fabp4、fabp5、fasn、gmcsf、hpk1、il-10r[il10ra、il10rb]、il2、lfa1、neat 1、nfkb(包括rela、relb、nfkb2、nfkb1、rel)、nkg2a、nr4a(包括nr4a1、nr4a2、nr4a3)、pd1、pi3kcd、ppp2rd2、ship1、soat1、socs1、t-bet、tet2、tgfbr1、tgfbr2、tgfbr3、tigit、tim3、tox和zfp36l2。
[0118]
已经确定了尤其合适的基于mirna的构建体。因此,提供了包含含有多重化的的基于microrna的shrna编码区的多核苷酸的工程化细胞,其中所述多重化的的基于microrna的shrna编码区包含编码以下的序列:
[0119]
两个或更多个人工的基于mirna的shrna核苷酸序列,其中每个人工的基于mirna的shrna核苷酸序列包含
[0120]
o mirna支架序列,
[0121]
o活性序列或成熟序列,和
[0122]
o过客序列或星序列,其中在每个人工的基于mirna的shrna核苷酸序列中,活性序列与过客序列至少80%互补。
[0123]
每个人工的基于mirna的shrna核苷酸序列中的活性序列和过客序列的长度均通常在18到40个核苷酸之间,更具体地在18到30个核苷酸之间,最具体地在19到25个核苷酸之间。
[0124]
通常,这些microrna支架序列由接头隔开,且接头序列的长度可以在例如30到60个核苷酸之间,尽管较短的区段也可以。事实上,令人惊讶地发现接头的长度并不重要,并且可以非常短(少于10个核苷酸)或甚至不存在而不干扰shrna功能。这显示在例如图6和16。
[0125]
人工序列可以是例如其中的内源mir序列已被替换为针对特定靶标而工程化的shrna序列的天然存在的支架(例如,mir簇或其片段,例如mir-106a~363簇),可以是其中的内源mir序列已被替换为针对特定靶标而工程化的shrna序列的单个mir支架(例如,mir-196a2支架)的重复,可以是人工mir样序列,或其组合。
[0126]
这个工程化细胞通常进一步包含编码感兴趣的蛋白的核酸分子,例如嵌合抗原受体或tcr,并且可以是工程化的免疫细胞,如上所述。
[0127]
多重化的rna干扰分子的共表达导致工程化细胞内至少一个基因,但通常是多个基因的抑制。这可促成更好的治疗功效。
[0128]
还提供了本文所述的工程化的细胞,用作药物。根据具体的实施方案,提供工程化的细胞,用于治疗癌症。可以治疗的癌症的示例性类型包括但不限于腺癌、肾上腺皮质癌、肛门癌、星形细胞瘤、膀胱癌、骨癌、脑癌、乳腺癌、宫颈癌、结直肠癌、子宫内膜癌、食道癌、尤文肉瘤(ewing sarcoma)、眼癌、输卵管癌、胃癌(gastric cancer)、胶质母细胞瘤、头颈癌、卡波西肉瘤、肾癌、白血病、肝癌、肺癌、淋巴瘤、黑色素瘤、间皮瘤、骨髓增生异常综合征、多发性骨髓瘤、神经母细胞瘤、骨肉瘤、卵巢癌、胰腺癌、甲状旁腺癌、阴茎癌、腹膜癌、鼻咽癌、前列腺癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮肤癌、小肠癌、腹癌(stomach cancer)、睾丸癌、甲状腺癌、尿道癌、子宫癌、阴道癌和维尔姆斯瘤(wilms tumor)。
[0129]
根据具体的实施方案,可以提供细胞用于治疗液体(liquid)癌或血癌。此类癌症的示例包括例如白血病(包括,急性髓性白血病(aml)、急性淋巴细胞性白血病(all)、慢性粒细胞性白血病(cml)和慢性淋巴细胞性白血病(cll))、淋巴瘤(包括,霍奇金淋巴瘤和非霍奇金淋巴瘤,例如b细胞淋巴瘤(例如,dlbcl)、t细胞淋巴瘤、伯基特淋巴瘤(burkitt’s lymphoma)、滤泡性淋巴瘤、套细胞淋巴瘤和小淋巴细胞淋巴瘤)、多发性骨髓瘤或骨髓增生异常综合征(myelodysplastic syndrome,mds)。
[0130]
这等同于描述提供了治疗癌症的方法,包括向有此需要的受试者施用合适剂量的如本文所述的工程化细胞(即,包含编码至少两个多重化的rna干扰分子的外源核酸分子,和任选地包含编码感兴趣的蛋白的其他核酸分子的工程化细胞),从而改善与癌症相关的至少一种症状。治疗的癌症包括但不限于腺癌、肾上腺皮质癌、肛门癌、星形细胞瘤、膀胱癌、骨癌、脑癌、乳腺癌、宫颈癌、结直肠癌、子宫内膜癌、食道癌、尤文肉瘤、眼癌、输卵管癌、
胃癌(gastric cancer)、胶质母细胞瘤、头颈癌、卡波西肉瘤、肾癌、白血病、肝癌、肺癌、淋巴瘤、黑色素瘤、间皮瘤、骨髓增生异常综合征、多发性骨髓瘤、神经母细胞瘤、骨肉瘤、卵巢癌、胰腺癌、甲状旁腺癌、阴茎癌、腹膜癌、鼻咽癌、前列腺癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮肤癌、小肠癌、腹癌(stomach cancer)、睾丸癌、甲状腺癌、尿道癌、子宫癌、阴道癌和维尔姆斯瘤。根据进一步的具体实施方案,提供了治疗血癌的方法,包括向有此需要的受试者施用合适剂量的如本文所述的工程化的细胞,从而改善癌症的至少一种症状。
[0131]
根据可选的实施方案,可以提供细胞用于治疗自身免疫疾病。可治疗的自身免疫疾病的示例性类型包括但不限于类风湿性关节炎(ra)、系统性红斑狼疮(sle)、炎性肠病(ibd)、多发性硬化(ms)、1型糖尿病、肌萎缩侧索硬化症(als或葛雷克氏症(lou gehrig’s disease))、脊髓性肌萎缩症(sma)、克罗恩病、格林-巴利综合征、慢性炎性脱髓鞘性多发性神经病、银屑病、银屑病关节炎、阿狄森氏病、强直性脊柱炎、白塞病、乳糜泻、柯萨奇心肌炎(coxsackie myocarditis)、子宫内膜异位、纤维肌痛、格雷夫斯病、桥本氏甲状腺炎、川崎病、梅尼埃病(meniere’s disease)、重症肌无力、结节病、硬皮病、干燥综合征、血小板减少性紫癜(ttp)、溃疡性结肠炎、血管炎和白癜风。
[0132]
这相当于描述提供了治疗自身免疫疾病的方法,包括向有此需要的受试者施用合适剂量的如本文所述的工程化细胞,从而改善与自身免疫疾病相关的至少一种症状。可治疗的示例性自身免疫疾病列于上文。
[0133]
根据更进一步的实施方案,可以提供细胞,用于治疗感染性疾病。“感染性疾病”在本文中指由存在于患有疾病的受试者或生物体之中或之上的外部生物体(病原体)的存在引起的任何类型的疾病。通常认为感染是由微生物或微寄生虫(如病毒、朊病毒、细菌和类病毒)引起的,但较大的生物体(如大寄生虫(macroparasite)和真菌)也可以感染。可引起感染的生物体在本文中称为“病原体”(如果它们引起疾病)和“寄生虫”(如果它们以宿主生物体为代价受益,从而降低宿主生物体的生物适应性,即使不存在明显的疾病),并且包括但不限于病毒、细菌、真菌、原生生物(protist)(例如,疟原虫(plasmodium)、疫霉属(phytophthora))和原生动物(例如,疟原虫、内阿米巴属(entamoeba)、贾第虫属(giardia)、弓形虫(toxoplasma)、隐孢子虫(cryptosporidium)、毛滴虫(trichomonas)、利什曼原虫(leishmania)、锥虫(trypanosoma))(微寄生虫)和大寄生虫,例如蠕虫(例如,线虫如蛔虫、丝虫、钩虫、蛲虫和鞭虫等,或扁虫如绦虫和吸虫等),以及体外寄生虫例如蜱和螨。拟寄生物(parasitoid),即将宿主生物体灭菌或杀死的寄生生物体,包含在术语寄生虫内。根据具体的实施方案,感染性疾病由微生物或病毒生物体引起。
[0134]
如本文所用,“微生物生物体”可以指细菌,例如革兰氏阳性菌(例如,葡萄球菌属、肠球菌属、芽孢杆菌属)、革兰氏阴性菌(例如,埃希氏菌属、耶尔森氏菌属)、螺旋体(例如,密螺旋体属(treponema sp)例如梅毒螺旋体(treponema pallidum)、钩端螺旋体属(leptospira sp.)、疏螺旋体属例如伯氏疏螺旋体(borrelia burgdorferi))、软孢子菌(mollicute)(即没有细胞壁的细菌,例如支原体属)、耐酸细菌(例如,分枝杆菌属例如结核分枝杆菌、诺卡氏菌属(nocardia sp.))。“微生物生物体”还涵盖真菌(例如酵母菌和霉菌,例如念珠菌属、曲霉属、球孢子菌属、隐球菌属、组织胞浆菌属、肺孢子菌属或毛癣菌属)、原生动物(例如,疟原虫属、内阿米巴属、贾第虫属、弓形虫属、隐孢子虫属、毛滴虫属、利什曼
原虫属、锥虫属)和古细菌。引起可以用本方法治疗的感染性疾病的微生物生物体的其他示例包括但不限于金黄色葡萄球菌(包括耐甲氧西林金黄色葡萄球菌(methicillin-resistant s.aureus,mrsa))、肠球菌属(包括耐万古霉素肠球菌(vancomycin-resistant enterococci,vre)、院内病原体粪肠球菌(nosocomial pathogen enterococcus faecalis))、食物病原体例如枯草芽孢杆菌、蜡样芽孢杆菌(b.cereus)、单核细胞增生性李斯特菌(listeria monocytogenes)、沙门氏菌属和嗜肺军团菌。
[0135]“病毒生物体”或“病毒”,在本文中用作等价物,是只能在生物体的活细胞内复制的小的感染物。它们包括dsdna病毒(例如,腺病毒、疱疹病毒、痘病毒)、ssdna病毒(例如,细小病毒)、dsrna病毒(例如,呼肠孤病毒)、(+)ssrna病毒(例如,小核糖核酸病毒、披膜病毒(togavirus)、冠状病毒)、(-)ssrna病毒(例如,正粘病毒、弹状病毒(rhabdovirus))、ssrna-rt(逆转录)病毒,即在生命周期中存在dna中间物的具有(+)有义rna的病毒(例如,逆转录病毒)以及dsdna-rt病毒(例如,肝炎病毒)。也可以感染人受试者的病毒的示例包括但不限于腺病毒、星状病毒、肝炎病毒(例如,乙型肝炎病毒)、疱疹病毒(例如单纯疱疹病毒i型、单纯疱疹病毒2型、人巨细胞病毒、爱泼斯坦-巴尔病毒、水痘带状疱疹病毒、玫瑰疹病毒(roseolovirus))、乳多空病毒(papovavirus)(例如,人乳头状瘤病毒和人多瘤病毒)、痘病毒(例如,天花病毒(variola virus)、痘苗病毒、天花病毒(smallpox virus))、沙粒病毒(arenavirus)、布尼亚病毒(buniavirus)、calcivirus、冠状病毒(例如,sars冠状病毒、mers冠状病毒、sars-cov-2冠状病毒(covid-19的致病物))、丝状病毒(例如,埃博拉病毒、马尔堡病毒)、黄病毒(例如,黄热病病毒、西尼罗河病毒、登革热病毒、丙型肝炎病毒、蜱传脑炎病毒、日本脑炎病毒、脑炎病毒)、正粘病毒(例如,a型流感病毒、b型流感病毒和c型流感病毒)、副粘病毒(例如,副流感病毒、腮腺炎病毒(腮腺炎)、麻疹病毒(麻疹)、肺炎病毒,例如人呼吸道合胞病毒)、小核糖核酸病毒(例如,脊髓灰质炎病毒、鼻病毒、柯萨奇a病毒、柯萨奇b病毒、甲型肝炎病毒、ecovirus和肠道病毒)、呼肠孤病毒、逆转录病毒(例如,慢病毒,例如人免疫缺陷病毒和人t淋巴细胞病毒(htlv))、弹状病毒(例如,狂犬病病毒)或披膜病毒(例如,风疹病毒)。根据具体的实施方案,待治疗的感染性疾病不是hiv。根据可选的实施方案,待治疗的感染性疾病不是由逆转录病毒引起的疾病。根据可选的实施方案,待治疗的感染性疾病不是病毒性疾病。
[0136]
这等同于描述提供了治疗感染性疾病的方法,包括向有此需要的受试者施用合适剂量的如本文所述的工程化细胞(即,包含编码两个或更多个多重化的rna干扰分子的外源核酸分子,并且任选地包含编码感兴趣的蛋白的其他核酸分子的工程化细胞),从而改善至少一种症状。尤其是微生物或病毒感染性疾病是由以上列出的病原体引起的那些。
[0137]
被提供用作药物的这些细胞可用于同种异体疗法。即,它们被提供用于将同种异体act视为治疗选择的治疗(其中将来自另一受试者的细胞提供给有此需要的受试者)中。根据具体的实施方案,在同种异体疗法中,rna干扰分子的至少一个将针对tcr(最具体地,针对tcr复合物的亚基)。根据可选的实施方案,提供这些细胞用于自体疗法,尤其是自体act疗法(即,使用从患者获得的细胞)。
[0138]
应当理解,尽管本文已经针对根据本发明的细胞和方法讨论了具体的实施方案、具体的设置以及材料和/或分子,但是在不脱离本发明的范围和精神的情况下可以在形式和细节上进行各种改变或修改。提供以下实施例以更好地说明具体的实施方案,并且不应
将它们视为限制本技术。本技术仅受权利要求的限制。
[0139]
实施例
[0140]
实施例1:在tcr下调中评估mirna支架长度
[0141]
不同shrna在同一病毒表达载体中的成功多重化需要基于mirna的支架尽可能小。这将允许组合多个shrna,而不显著影响载体的整体大小。为了评估缩短的基于mirna的shrna支架是否仍然有效敲低靶标,我们从mirna-196a2支架(smartvector
tm micro-rna适应支架(horizon discovery,lafayette,co,usa))表达了先前鉴定的靶向cd247(tcr亚基)的shrna,其中新构建体的mirna支架长度不同。原始构建体具有263个核酸,两个缩短的构建体分别使用150或111个核酸。如截短的cd19标记物所示,所有病毒载体均能够转导原代t细胞,尽管程度不同(图1)。然而,所有三个构建体的tcr或cd3e蛋白敲低程度相当,这表明基于mirna的最小shrna支架仍然能够将tcr/cd3复合物表达降低至与较长mirna支架相似的程度。
[0142]
实施例2:筛选靶向cd52的不同shrna
[0143]
为了能够比较靶向cd52的不同shrna的效率,使用了与以前用于cd247的骨架相同的骨架构建体,在该构建体中仅交换了shrna的靶向序列,放置了cd52靶向序列而不是cd247靶向序列。使用逆转录病毒载体将shrna递送至原代t细胞中,其可以通过截短的cd19(tcd19)标记物进行跟踪。将靶向cd52的不同shrna克隆至逆转录病毒载体的mirna支架中。在细胞培养的第8天评估cd52敲低的程度。所有构建体均能够转导原代t细胞,如通过cd19表达所测量的(图2)。然而,所测试的4个shrna的cd52敲低程度不同。对于敲低cd52表达,shrna-3最有效,其次是shrna-1和shrna-2。相比之下,shrna-4未显示cd52表达降低(图2)。
[0144]
为了评估这个shrna的敲低效率是否会在不同供体之间变化,将来自3个不同供体的t细胞用mock构建体或表达cd52 shrna-3的构建体转导(图3)。在所有三个供体中,shrna-3均显示出显著且一致的cd52敲低(图3),这表明所鉴定的shrna导致了cd52的一致且独立于供体的敲低。
[0145]
实施例3:筛选用于crispr/cas9介导的cd52敲除的grna
[0146]
为了生成cd52和/或tcr/cd3复合物表达抑制的阳性对照,使用crispr/cas9技术生成了相应的敲除t细胞。设计并评估了不同的向导rna(guide rna,grna),以鉴定出有效生成cd52缺陷t细胞的那些grna(图4)。三个grna中有两个能够生成cd52敲除细胞(grna-1,在图4中表示为cd52.1.aa,和grna-3,在图4中表示为cd52.2.ae),其中使用cd52 grna-1时cd52缺陷细胞的频率略高。
[0147]
实施例4:mirna间隔子对靶标敲低的影响
[0148]
通过drosha复合物对来自转录的rna的mirna进行有效加工是有效敲低靶标的关键。我们之前的数据显示,基于mirna的shrna可以与编码car的载体有效共表达,并由来自载体的mirna机器进行加工。进一步需要生成能够共表达来自相同载体的多个基于mirna的shrna(例如,2个、4个、6个、8个
……
)的car表达载体(图5)。然而,之前的研究显示,多个基于mirna的shrna的共表达会导致shrna活性的丧失。因此,为了由单个表达载体敲低多个靶标,有效的mirna加工是重要的。
[0149]
为了优化两个共表达的shrna的活性,我们假设,不仅两个基于mirna的shrna之间的接头大小而且其序列以及mirna支架都会影响shrna活性。为了优化shrna加工,我们评估
了不同的shrna接头对两个靶基因cd247(cd3ζ)和cd52敲低的影响。基于衍生自天然存在的人mir-17-92簇的间隔子序列,设计了五个不同间隔子。在bcma car的背景下,在cd247和cd52 shrna之间克隆了五个不同的间隔子。用不同的构建体来转导t细胞,使用tcd34(mock)和bcma-cd247 shrna载体作为对照;结果如图6所示。多重体1在111bp cd247 shrna和111bp cd52 shrna之间不含间隔子。多重体2在mir-17-92簇中的mir-17和mir-18a之间含有43bp天然存在的间隔子。多重体3含有一个92bp间隔子,对应于mir-17-92簇中mir-19a和mir-20a之间的间隔区。多重体4含有一个56bp间隔子,对应于mir-17-92簇中的mir-20a和mir-19b1之间的间隔区。多重体5含有一个29bp的随机的富含ta的间隔区。所有具有shrna的构建体在收获时均显示出低但相当的转导效率。此外,bcma car的表达仅轻微受到多个shrna表达的影响(图6)。cd52和tcr敲低的评估显示,所有构建体均能够在相当的水平降低tcr和cd52的表达。仅有在两个发夹之间缺少任何间隔区的第一多重体构建体显示出与其他构建体相比略低的针对tcr(但不是cd52)的敲低活性,但它在减少表达方面仍然非常有效(图6)。
[0150]
实施例5:比较多重化的和单个的shrna
[0151]
接下来,我们旨在直接比较多重化的两个shrna与表达单个shrna对cd247和cd52的影响。rna表达分析显示,多重化的shrna构建体在下调cd52或cd247上与相应的单个shrna一样有效(图7)。
[0152]
作为另一个对照,我们使用了crispr/cas9系统,其用两个不同的grna同时靶向cd52和cd247。在收获时,将含有cd247 shrna或grna的细胞在进一步分析之前针对tcr阳性细胞耗竭。通过流式细胞术评估tcr和cd52表达,以比较用单个或多重化的shrna转导的细胞的蛋白表达(图8和9)。单个cd247 shrna能够降低tcr的表达(图8和9)。tcr表面表达的减少与crispr/cas9介导的cd247敲除相当。类似地,单个cd52 shrna能够降低cd52表达(图8和9)。具有不同接头的两个多重化的shrna构建体(参见实施例4)均显示出与单个shrna相同程度的tcr敲低。类似地,通过单个或多重化的shrna构建体将cd52表达降低至相同的程度(图8和9)。
[0153]
实施例6:car表达和细胞效力(potency)
[0154]
为了评估一个或多个shrna的共表达对car表达和功能性的影响,通过流式细胞术评估了bcma-car表达。将细胞用bcma-fc融合蛋白染色,然后用结合pe的第二抗体染色。如图10所示,所有组之间的car表达是相似的,这显示这些多重化的shrna不影响car表达水平。此外,我们评估了表达bcma-car的细胞针对bcma阳性癌细胞系rpmi-8226、opm-2和u226的功能活性(图10)。为此,将t细胞与癌细胞共培养24小时,然后评估上清液中的ifnγ水平。单独的t细胞不产生任何ifnγ,然而,与表达bcma的癌细胞共培养导致所有t细胞组均产生相当的ifnγ。因此,一个或多个shrna的共表达不影响car的表达或car-t细胞针对癌细胞系的功能活性。
[0155]
实施例7:car t细胞对促有丝分裂刺激的功能反应
[0156]
接下来,评估了car-t细胞对促有丝分裂tcr刺激的反应性。为此,用浓度增加的抗cd3抗体(克隆okt3)刺激t细胞,并在24小时后测量ifnγ的产生。mock转导的细胞在okt3激活后产生高水平的ifnγ。类似地,单独的bcma-car或与cd52 shrna组合的共表达没有降低t细胞响应于tcr激活刺激的能力。然而,单个或多重化的cd247 shrna共表达显著降低了
tcr的功能响应至cirspr/cas9 cd247基因组编辑的对照细胞的水平(图11)。因此,多重化的shrna在抑制tcr功能上与单个的shrna对照以及基因组编辑的t细胞一样有效。
[0157]
实施例8:cd52的功能性抑制
[0158]
在下一步中,我们旨在评估在存在抗cd52抗体的情况下,单个或多重化的cd52 shrna的表达将如何影响t细胞的补体依赖性杀伤。为此,在抗cd52抗体(阿仑单抗)或对照igg抗体存在下将t细胞与补体一同培养。4小时后,测定细胞数。在阿仑单抗存在下,mock和bcma-car转导的t细胞被补体系统有效地靶向(图12)。然而,单个和多重化的cd52 shrna均能够阻止cd52介导的杀伤。
[0159]
实施例9:多于2个靶标的多重化
[0160]
接下来评估了对四个shrna进行多重化的可行性。为了评估这一点,jurkat细胞的转导使用了靶向β2m、dgk、cd247(cd3ζ)和cd52的单个或多重化的shrna,以及第二代cd19 car和选择标记物(使用慢病毒骨架并利用重复的mir-196a2支架)。在转导后第7天,使用标记物特异性磁珠进行单步富集。通过qrt-pcr分析细胞的shrna靶标表达。在多重体和相应的单个shrna之间,shrna介导的对四个靶标的转录表达的下调是相等的(图13)。
[0161]
在jurkat细胞之后,将原代t细胞用编码第二代cd19 car的逆转录病毒载体转导,所述逆转录病毒载体含有在mir-106a-363簇中引入的靶向cd247、β2m和cd52的3x shrna或6x shrna(图14)。简言之,将来自健康供体的原代t细胞用编码以下的逆转录病毒载体转导:第二代cd19指导的car、截短的cd34选择标记物以及靶向cd247、b2m和cd52的3个shrna(其引入在106a-363mirna簇的最后三个mir(mir-19b2、mir-92a2和mir-363)中)或靶向相同的三个基因在所述簇的6个mir支架中的6个shrna(在这种情况下,靶向cd247的两个shrna不同)。简言之,shrna表达为6重(6-plex)、3重(3-plex)或作为对照的无shrna(tcd34)。转导后两天,细胞使用cd34特异性磁珠富集,并在il-2(100iu/ml)中进一步扩增6天。使用亲环蛋白作为管家基因,通过qrt-pcr评估cd247、b2m和cd52的mrna表达。
[0162]
多重化的shrna对所有靶向基因均产生了高效的rna敲低水平。与三个多重化的shrna(针对每个蛋白靶标有一个shrna)相比,引入六个多重化的shrna(针对每个蛋白靶标有两个shrna)导致更高的rna敲低水平(图14)。
[0163]
实施例10:ipsc细胞中靶标的多重敲低
[0164]
为了探索其他免疫细胞中多重化的rna干扰分子的敲低,接下来在ipsc中评估了多重化。在人ipsc细胞系scips-r1中表达由长接头(41bp)或最小接头(6bp)分隔开的两个shrna(针对β2m和dgka)。用50μl或500μl病毒上清液进行转导。与不用shrna转导的细胞相比,多重化的shrna产生了有效的rna敲低水平,其与接头大小或所用病毒上清液的体积无关(图15,图16)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1