纯化促卵泡激素的方法与流程
1.本发明涉及一种以高得率和高纯度纯化促卵泡激素的方法。
背景技术:
2.可以用作各种治疗剂的各种不同蛋白治疗剂不仅已被应用于研究重组蛋白的制备,而且还应用于它们的临床应用和商业化。
3.这些重组蛋白之一(即促卵泡激素(fsh))是一种由垂体前叶中的促性腺细胞产生,被释放到血流中,并与黄体生成素(lh)一起作用以控制女性中的卵母细胞成熟和男性中的精子发生的激素。人类fsh被用于治疗不排卵的女性,刺激多卵泡发育(超排卵),以及辅助受孕(例如ivf、icsi、gift和cift)的准备。此外,人类fsh用于在fsh产量低或不产生fsh的女性中刺激卵泡成熟,以及在患有少精子症的男性中刺激精子发生。
4.由于fsh在治疗生殖障碍中的重要性,因此对提供具有高纯度和高比活性的重组fsh存在着需求。
5.fsh治疗需要反复注射,高纯度的fsh制剂可以皮下给药,可以由患者自行给药,从而能够提高患者的便利性和依从性。
6.国际公开号wo 2006/051070 a1涉及一种纯化fsh的方法,所述方法包括下述步骤:1)进行染料亲和层析,2)进行疏水相互作用层析;和3)进行反相层析;还涉及一种纯化fsh的方法,其包括下述步骤:1)进行阴离子交换层析,2)进行染料亲和层析,3)进行疏水相互作用层析,4)进行反相层析,和5)进行阴离子交换层析。
7.国际公开号wo 2005/063811 a1涉及一种纯化重组人类fsh的方法,所述方法包括下述步骤:1)进行离子交换层析;2)进行固定化金属离子层析;和3)进行疏水相互作用层析(hic)。
8.国际公开号wo 2007/065918 a2涉及一种纯化fsh的方法,其包括下述步骤:进行染料亲和层析;进行弱阴离子交换层析;进行疏水相互作用层析;和进行强阴离子交换层析;所述方法可以以任何顺序执行。
9.因此,对用于纯化重组fsh和fsh变体的新方法,存在着持续不断的需求。具体来说,染料亲和层析主要用于fsh纯化的捕获步骤。尽管染料亲和层析的使用具有通过除去培养基中的培养基组分而在回收靶蛋白方面出色的优点,但它也具有除去源自于宿主细胞的杂质的能力下降的缺点。这些杂质多种多样且非常复杂,因此无法确定为一种。因此,存在着靶蛋白的品质改变的高风险,而且这些改变也难以控制。另外,为了进一步除去大量杂质,在捕获步骤后需要复杂的纯化步骤,从而导致得率下降。
10.因此,本发明人努力开发一种以高纯度和高得率获得fsh的纯化方法。结果他们发现,通过有效地安排纯化过程的顺序,可以提高过程操作效率,同时能够提高得率并最大化杂质去除能力,从而完成了本发明。
技术实现要素:
11.[技术问题]
[0012]
本发明的目的是提供一种纯化促卵泡激素(fsh)的方法。
[0013]
[技术解决方案]
[0014]
在下文中将更详细地描述本发明。
[0015]
同时,本发明中公开的相应描述和实施方式也可以应用于其他描述和实施方式。也就是说,本发明中公开的各种不同要素的所有组合均在本发明的范围之内。此外,本发明的范围不受下述具体描述的限制。
[0016]
此外,本领域普通技术人员仅使用常规实验即可识别或确认本技术中描述的本技术的特定方面的多个等效物。此外,此类等效物旨在包括在本技术中。
[0017]
实施本发明的一个方面提供了一种以高得率和高纯度纯化促卵泡激素(fsh)的方法。
[0018]
具体来说,所述纯化方法可以是以下述顺序进行的纯化方法,其中所述方法包括:(a)进行免疫亲和层析(iac);(b)进行疏水相互作用层析(hic);和(c)进行阴离子交换层析(aex)。
[0019]
本发明的纯化方法可以是其中步骤(a)至(c)中的每一步骤中的层析只进行一次,并且不进行另外的层析的纯化方法。
[0020]
所述另外的层析是选自尺寸排阻层析、染料亲和层析、反相层析和阳离子交换层析中的一者或多者,但所述另外的层析不限于此。
[0021]
本发明的纯化方法的重要性在于,即使步骤(a)至(c)中的每一步骤中的层析只进行一次,它也能够除去宿主细胞来源的蛋白质(即杂质),并提高纯化得率。
[0022]
当在本文中使用时,术语“促卵泡激素(fsh)”是一种由垂体前叶中的促性腺细胞产生并释放到血流中的激素。fsh与黄体生成素(lh)一起作用,以控制女性中的卵母细胞成熟和男性中的精子发生。fsh和lh属于一组异二聚体糖蛋白,其由两个非共价连接的由单独的基因编码的α和β链组成。α链和β链两者均被糖基化。α-亚基由92个氨基酸残基组成,而β-亚基由111个氨基酸残基组成,其中每个亚基具有两个潜在的天冬酰胺连接的糖基化位点。
[0023]
人类fsh被用于治疗不排卵的女性,刺激多卵泡发育(超排卵),以及辅助受孕(例如ivf、icsi、gift和cift)的准备。此外,人类fsh用于在fsh产量低或不产生fsh的女性中刺激卵泡成熟,以及在患有少精子症的男性中刺激精子发生。
[0024]
在用于诱导排卵的典型治疗方案中,患者通过注射以约75 iu fsh/天至约450 iu fsh/天的量每天接受fhs或其变体,持续约6至约12天。在用于受控卵巢过度刺激的典型治疗方案中,患者通过注射以约150 iu fsh/天至约600 iu fsh/天的量每天接受fsh或其变体,持续约6至约12天。
[0025]
也就是说,fsh治疗需要反复注射,因此高纯度的fsh制剂是必需的。
[0026]
为此目的,本发明人试图通过利用纯化过程顺序的有效排列以优化柱的清洗中的程序步骤,来提高得率、最大化去除宿主细胞衍生的蛋白质(即杂质)的能力并最大化杂质的去除,从而简化纯化步骤的数量,提高过程操作的效率。
[0027]
所述纯化促卵泡激素的方法的每一步骤将在下文中详细描述。首先,步骤(a)是进行免疫亲和层析(iac)的步骤。
[0028]
当在本文中使用时,术语“免疫亲和层析(iac)”是指一种方法,其中制备针对待纯化的生理活性物质的抗体并将其共价键合到固相载体;向抗体-载体复合物添加含有所述待纯化的生理活性物质的样品,以允许所述生理活性物质吸附到所述抗体;以适合的方式向其添加洗脱剂,从而通过洗脱获得靶物质。在本发明中,用于fsh纯化的免疫亲和层析是指一种交换树脂,其利用某种原理,使用柱来仅仅选择性地捕获fsh,所述柱包括fsh特异性蛋白(即与fsh的α亚基或β亚基结合的蛋白质),并通过使用某种与其具有相似的结构、物理和化学特征的蛋白质将所述fsh特异性蛋白连接到适合的基质来制备。。
[0029]
用于fhs纯化的免疫亲和层析包括captureselect
tm
fhs树脂(thermo fisher scientific)等,但不限于此,并且一般来说,可以使用用于免疫亲和层析并与fsh特异性结合的任何树脂。
[0030]
这种方法的优点在于与常规方法(及诸如凝胶过滤、离子交换层析等的方法)相比,它能够更快速且更定量地获取生理活性物质。
[0031]
出于本发明的目的,所述免疫亲和层析可以进行选自平衡步骤、进样步骤、清洗步骤、洗脱步骤和树脂清洁步骤中的任一个或多个步骤。
[0032]
为了使用免疫亲和的原理,可以使用ph在7至8范围内的缓冲溶液,并且可以使用摩尔浓度为10mm至50mm的tris;在实施方式中,可以使用诸如tris、pbs、3-吗啉基丙-1-磺酸(mops)、磺酸盐、2-[4-(2-羟乙基)哌嗪-1-基]乙磺酸(hepes)、tes、磷酸盐和/或异丙醇等的缓冲溶液,但所述缓冲溶液不限于此。
[0033]
所述平衡步骤是指在柱中产生某种环境(例如适合的ph、盐浓度等),以便将培养基中包含的fsh附着到层析柱的步骤。
[0034]
出于本发明的目的,在上述步骤(a)中,可以通过将所述清洗步骤进行一次或多次,特别是通过将所述清洗步骤进行三次或更多次,来除去吸附到柱上的各种不同蛋白质中除了fsh之外的包括宿主细胞衍生的蛋白质在内的杂质,但进行所述清洗步骤的次数不限于此。
[0035]
所述清洗步骤是指除去吸附到柱上的各种不同蛋白质中除了fsh之外的包括宿主细胞衍生的蛋白质在内的其他杂质的步骤。不仅可以除去宿主细胞衍生的蛋白质,而且可以除去培养基组分。在这个实施方式中引入了多步清洗步骤。具体来说,可以使用ph在7至8的范围内的缓冲溶液,并且可以将上述ph范围内的缓冲溶液应用于所有的平衡步骤、清洗步骤和洗脱步骤。
[0036]
在一个实施方式中,在第一清洗步骤中,可以除去对免疫亲和层析树脂具有非特异性或具有弱特异性的杂质或具有相对弱的疏水性的杂质;并且可以使用摩尔浓度为2mm至50mm的tris,特别是摩尔浓度为2mm至10mm的tris,但所使用的tris不限于此。另外,用于所述第一清洗步骤的清洗溶液可以是选自tris、pbs、3-吗啉基丙-1-磺酸(mops)、磺酸盐、2-[4-(2-羟乙基)哌嗪-1-基]乙磺酸(hepes)、tes、磷酸盐和/或异丙醇中的任一者或多者,但所述清洗溶液不限于此。
[0037]
在第二清洗步骤中,可以除去对免疫亲和层析树脂具有相对弱的离子结合亲和性的杂质,并且可以使用摩尔浓度为10mm至50mm的tris,特别是摩尔浓度为10mm至30mm的tris,但所使用的tris不限于此。另外,所使用的盐浓度可以在0.5m以上且3m以下的范围内,具体来说,可以使用0.5m至1.5m范围内的盐浓度。在一个实施方式中,所使用的盐可以
包括硫酸钠、氯化钠、硫酸铵、氯化铵和/或氯化镁等,更具体地可以是氯化钠,但所使用的盐不限于此。
[0038]
在第三清洗步骤中,可以除去与fsh相比对免疫亲和层析树脂具有相对弱的离子结合亲和性的杂质,并且可以使用摩尔浓度为10mm至50mm的tris,特别是摩尔浓度为10mm至30mm的tris,但所使用的tris不限于此。另外,所使用的盐浓度可以在0.01m以上且0.5m以下的范围内,具体来说,可以使用0.1m至0.3m范围内的盐浓度,但所使用的盐浓度的范围不限于此。在一个实施方式中,所使用的盐可以包括硫酸钠、氯化钠、硫酸铵、氯化铵和/或氯化镁等,更具体地可以包括氯化镁,但所使用的盐不限于此。
[0039]
所述洗脱步骤是指回收与树脂结合的fsh的步骤。可以使用氯化镁(mgcl2)来抵消fsh与树脂之间的免疫亲和性,并且具体来说,用于洗脱的条件可以在ph在7至8的范围内的缓冲溶液中,在1.5m至2.5m的盐浓度下进行。在一个实施方式中,所使用的盐可以包括硫酸钠、氯化钠、硫酸铵、氯化铵和/或氯化镁等,并且更具体来说可以包括氯化镁,但所使用的盐不限于此。
[0040]
此外,作为洗脱fsh的另一种方法,可以使用ph为2.5至3.5的的甘氨酸缓冲溶液,但所使用的缓冲溶液不限于此。
[0041]
所述树脂清洁(cip)步骤是用于完全除去剩余在柱中的残留fsh、微生物或其他杂质,以防止遗留的步骤。所使用的洗脱缓冲液可以包括柠檬酸、乙酸、磷酸、pab、脲、盐酸胍和/或异丙醇、naoh和/或乙醇等,并且具体来说可以使用浓度为0.1m至1m的乙酸,但所述洗脱缓冲液不限于此。
[0042]
在用于纯化fsh的方法中,上述步骤(b)是进行疏水相互作用层析(hic)的步骤。
[0043]
疏水相互作用层析是指一种利用蛋白质与介质的疏水表面之间的可逆相互作用的交换树脂。蛋白质在高离子强度条件下(即在高盐浓度下)结合到柱,并且当离子强度逐渐变低时,这些蛋白质被彼此差异地分离。
[0044]
出于本发明的目的,所述疏水相互作用层析可以进行选自进样步骤、平衡步骤、清洗步骤、洗脱步骤和树脂清洁步骤中的任一个或多个步骤。
[0045]
当在本文中使用时,“疏水相互作用层析(hic)”是指一种利用具有疏水官能团(例如苯基、辛基、(异)丙基、丁基、乙基等)的基质与某些分子之间的疏水相互作用的分离方法。
[0046]
具体来说,这种层析可以使用具有相对弱的疏水表面(与反相树脂的强得多的疏水表面相比)的hic树脂来进行。具有疏水表面性质的蛋白质通常附着到具有醚、苯基、丁基或己基的树脂。在本发明中,在所述疏水相互作用层析中使用的树脂可以是其中的官能团选自苯基、辛基、(异)丙基、丁基和乙基的树脂,但所述树脂不限于此,并且可以使用常用于疏水相互作用层析的任何树脂。
[0047]
所述疏水相互作用层析中的平衡步骤是指在柱内产生某种环境(例如适合的ph、盐浓度等)的步骤,以便将包含在从免疫亲和层析获得的洗脱液中的fsh附着到柱。具体来说,所使用的盐浓度可以在1.5m至2.5m的范围内,并且在一个实施方式中,可以使用硫酸钠、氯化钠、硫酸铵和/或氯化铵。此外,可以使用ph为7至8的缓冲溶液,并且可以使用摩尔浓度为10mm至50mm的tris。上述条件可以应用于所有的平衡步骤、清洗步骤和洗脱步骤。
[0048]
在所述进样步骤中,可以使用通过免疫亲和层析获得的洗脱液。
[0049]
出于本发明的目的,将平衡缓冲溶液用于所述清洗步骤,这是为了除去非特异性结合到所述树脂的杂质。
[0050]
所述洗脱步骤是指回收与树脂结合的fsh的步骤。为了抑制fsh与树脂之间的疏水相互作用,可能需要无盐或低盐浓度的环境。此外,可以使用ph在7至8范围内的缓冲溶液,并且可以使用摩尔浓度为10mm至50mm的tris,但所述缓冲溶液不限于此。
[0051]
所述树脂清洁(cip)步骤是用于完全除去剩余在柱中的残留fsh、微生物或其他杂质,以防止遗留的步骤。所述剩余的fsh可以使用纯水除去,此外可以使用氢氧化钠(naoh)、磷酸等,但本发明不限于此。
[0052]
出于本发明的目的,上述步骤(b)的目的是通过进一步除去在步骤(a)中可能未被除去的杂质(例如宿主细胞蛋白等)来进一步提高fsh的纯度。在这个步骤中,使用能够除去宿主细胞衍生的蛋白质的过滤装置,使用在分离机制上不同于步骤(a)的免疫亲和层析方法的疏水反应等,可以更有效地除去宿主细胞蛋白。
[0053]
当在本文中使用时,术语“宿主细胞蛋白(hcp)”是不同于fsh的蛋白质,通常是指源自于宿主细胞的蛋白质。对于可以用作药物的抗体或蛋白质来说,优选地将hcp排除在原始的抗体或蛋白质制剂之外。待去除的宿主细胞蛋白是一个概念,其包括除了待纯化的fsh之外的所有杂质,并且它们不仅可以包括宿主细胞蛋白本身,而且可以包括源自于宿主细胞的dna、用于细胞生长的因子等。因此,当除去宿主细胞蛋白时,只有待纯化的靶蛋白可以以高纯度被纯化。
[0054]
在上述纯化fsh的方法中,上述步骤(c)是进行阴离子交换层析(aex)的步骤。
[0055]
离子交换层析是指一种利用介质与蛋白质表面之间净电荷的可逆相互作用(即离子强度的差异)的交换树脂。
[0056]
代表性的强离子交换基团包括q和sp,代表性的弱离子交换基团包括deae、anx、cm等。由于每一者均具有携带充足电荷的不同ph范围,因此存在着可选的选择性。离子交换树脂分为负离子交换树脂和正离子交换树脂,并且具体来说在本发明中使用负离子交换树脂。
[0057]
当在本文中使用时,术语“阴离子交换层析(aex)”是指利用装填有阴离子交换树脂的柱的层析,并且在上述步骤中,通过进行阴离子交换层析可以进一步除去杂质、特别是宿主细胞蛋白,并且可以选择性地分离具有所需等电点的亚型。
[0058]
所述阴离子交换树脂是指被添加到不同的水性溶液中以将其阴离子与所述水性溶液中的特定阴离子交换的合成树脂,并且阴离子交换柱可以吸附在高于等电点时携带阴离子的蛋白质。在本发明的fsh的情况下,第三纯化步骤可以以下述方式进行,即在使用中性ph缓冲液时,所述蛋白质(fsh)由于等电点低而附着到所述阴离子交换树脂,并且在清洗后在通过洗脱液时,所述靶蛋白(即fsh)被分离。
[0059]
作为阴离子交换树脂,可以使用在本领域中常用的阴离子交换树脂,但阴离子交换树脂不限于此。具体来说,可以使用q sepharose、季氨基乙基、季胺(q)等,并且更具体来说,可以使用q fast flow
tm
。
[0060]
出于本发明的目的,所述阴离子交换层析可以进行选自进样步骤、平衡步骤、清洗步骤、洗脱步骤和树脂清洁步骤中的任一个或多个步骤。
[0061]
所述平衡步骤是指在柱中产生某种环境(例如适合的ph、盐浓度等),以便将从疏
水相互作用层析获得的fsh附着到层析柱的步骤。可以使用ph在7至8的范围内的缓冲溶液,并且可以使用摩尔浓度为10mm至50mm的tris,但所述缓冲溶液不限于此。所述缓冲溶液可以应用于排除清洗步骤的平衡步骤和洗脱步骤两者。
[0062]
所述清洗步骤是指除去柱内吸附的杂质的步骤。此外,可以选择性除去具有所需等电点的亚型之外的亚型。可以使用ph在5至6范围内的缓冲溶液,并且可以使用摩尔浓度为1mm至100mm的乙酸盐,特别是摩尔浓度为10mm至50mm的乙酸盐,但所述缓冲溶液不限于此。此外,在一个实施方式中,可以使用乙酸盐、柠檬酸盐等,但所使用的缓冲溶液不限于此。
[0063]
所述洗脱步骤是指回收与树脂结合的fsh的步骤。洗脱条件可以是在ph在7至8的范围内的缓冲溶液中盐浓度为0.05m至0.2m的条件。在一个实施方式中,可以使用硫酸钠、氯化钠、硫酸铵和/或氯化铵等,但所使用的盐不限于此。
[0064]
所述树脂清洁(cip)步骤是用于完全除去柱中剩余的残留fsh、微生物和其他杂质以防止遗留的步骤。在一个实施方式中,可以使用氢氧化钠(naoh)、磷酸等,但不限于此。
[0065]
待去除的宿主细胞蛋白是一个概念,其包括如上所述除了待纯化的fsh之外的所有杂质,并且它们不仅可以包括宿主细胞蛋白本身,而且可以包括源自于宿主细胞的dna、用于细胞生长的因子等。因此,当宿主细胞蛋白被除去时,只有待纯化的靶蛋白可以以高纯度被纯化。
[0066]
根据本发明,通过步骤(a)至(c)的fsh纯化方法(即三步柱过程),有可能最终纯化高纯度和高得率的fsh,杂质、特别是宿主细胞蛋白从其中被高效除去。
[0067]
在本发明中,在(a)至(c)的步骤后,可以进一步进行选自浓缩和透析过程和过滤过程的任一过程,但本发明不限于此。此外,可以包括病毒过滤过程和将缓冲液与储用缓冲溶液(uf/df)交换的过程,但本发明不限于此。
[0068]
在所述最后纯化后,所述宿主细胞蛋白(hcp)的含量可以在0.001ppm至50ppm,特别是0.01ppm至40ppm、0.1ppm至30ppm、1ppm至30ppm、3ppm至25ppm和5ppm至20ppm,更特别是0.01ppm至12ppm的范围内,但所述宿主细胞蛋白的含量不限于此。在本发明的实施方式中,确认了所述宿主细胞蛋白的含量降低到在第一次纯化后低于200ppm的水平,在第二次纯化后低于50ppm的水平,并在第三次纯化后低于15ppm的水平(实施例2-2)。具体来说,显示了仅仅依次使用免疫亲和层析、疏水相互作用层析和阴离子交换层析的三个步骤,可以表现出低于12ppm的宿主细胞蛋白含量,从而确认了本发明的出色效果(实施例2-2)。
[0069]
上述方法可以在上述步骤(a)至(c)中的进样之前使用ph为7以上且8以下的缓冲溶液来平衡柱。所述缓冲溶液可以是选自tris、pbs、3-吗啉基丙-1-磺酸(mops)、磺酸盐、2-[4-(2-羟乙基)哌嗪-1-基]乙磺酸(hepes)、tes和磷酸盐中的任一者或多者,更具体来说是tris,但所述缓冲溶液不限于此。
[0070]
此外,在上述方法的步骤(a)至(c)中,可以进行使用ph为4以上且8以下的清洗溶液清洗一次或多次的步骤。这是为了从培养液中除去主要杂质并提高样品纯度。所述清洗溶液可以是包括选自磷酸钠、氯化钾、氯化镁、磷酸钾、氯化钠、tris、3-吗啉基丙-1-磺酸(mops)、pipes、2-[4-(2-羟乙基)哌嗪-1-基]乙磺酸(hepes)、柠檬酸盐、乙酸盐、琥珀酸盐、柠檬酸钠、乙酸钠、琥珀酸钠、硫酸钠、硫酸铵、氯化铵和/或氯化镁的任一种或多种盐的清洗溶液,但所述清洗溶液不限于此。
平衡20mm tris(ph 7.6)3清洗30mm乙酸钠(ph 5.6)10平衡20mm tris(ph 7.6)5洗脱20mm tris(ph 7.6)/0.1m nacl10cip0.5n naoh5
[0094]
实施例2:纯化结果的确认
[0095]
实施例2-1:得率的结果
[0096]
使用octet qk分析装置对培养液和纯化液中的蛋白质进行定量分析。所述使用octet qk的方法是一种使用抗原/抗体反应的定量分析方法,并且只有靶蛋白可以被定量。所述分析方法如下:
[0097]
使用kinetics缓冲液(pall-fortebio)使生物传感器稳定。
[0098]
使用kinetics缓冲液和生物素化的抗fsh抗体进行固定。
[0099]
对用kinetics缓冲液适当稀释的每个样品进行定量。
[0100]
使用缓冲液(20mm tris-hcl,ph 7.6,1.7m mgcl2)进行再生。
[0101]
使用kinetics缓冲液进行中和。
[0102]
随后,对来自于每一步骤的纯化液进行定量并分析得率。
[0103]
按照纯化过程的顺序的最终得率概述在表5中。
[0104]
[表5]
[0105]
案例纯化过程的顺序最终得率(%)1iac-》hic-》aex66.72iac-》aex-》hic57.33hic-》aex-》iac4.24hic-》iac-》aex11.25aex-》iac-》hic54.66aex-》hic-》iac49.4
[0106]
作为结果,确认了当过程以iac-》hic-》aex(案例1)的顺序进行时最终得率最为出色,这是本发明的纯化方法。这个结果证实了在不同过程之间纯化效率随着进行所述过程的顺序而变,尽管在每个过程中均使用相同类型的层析(即免疫亲和层析、疏水相互作用层析和阴离子交换层析),并且以iac-》hic-》aex的顺序进行过程是最重要的因素。
[0107]
实施例2-2:用于hcp分析的条件和分析结果
[0108]
作为hcp含量分析的预处理步骤,使用amicon离心式过滤器,使用离心法将纯化液用纯水浓缩并交换缓冲液。缓冲液已被交换的样品中的蛋白质的定量分析使用实施例2-1的octet qk分析装置来进行。hcp含量分析使用已被浓缩和缓冲液交换的纯化液来进行。所述hcp分析使用“cho宿主细胞蛋白第三代”试剂盒(cygnus)来进行。分析方法如下。
[0109]
将每个样品用稀释缓冲液适当稀释,使得样品中的hcp含量落于标准品的范围之内。
[0110]
以每孔100μl的量向板孔装载抗cho抗体:hrp。
[0111]
以每孔50μl的量向每个孔装载标准品和每种样品,并允许它们在400rpm至600rpm的转速下在24
±
4℃反应2小时。
[0112]
舍弃反应物并用清洗缓冲液清洗4次。
[0113]
以每孔100μl的量向板孔装载tmb底物,并允许在24
±
4℃反应30分钟。
[0114]
通过以每孔100μl的量向板孔添加终止溶液来终止反应。
[0115]
使用靶蛋白的定量值和测量到的hcp含量,以ppm为单位计算每个纯化过程的hcp含量。
[0116]
[表6]
[0117][0118]
作为结果,确认了当所述过程以iac-》hic-》aex的顺序进行(3号试验)时hcp含量最低,这是本发明的纯化方法。此外,证实了与使用单一层析时相比,当使用多种类型的层析时hcp含量较低。从这些结果证实,纯化效率不仅随着层析数目的增加而提高,而且在不同过程之间随着进行所述过程的顺序而不同,尽管在每个过程中均使用相同的三种类型的层析(即免疫亲和层析、疏水相互作用层析和阴离子交换层析)。
[0119]
具体来说可以看到,在纯化以hic-》aex-》iac的顺序进行的过程(8号试验)和纯化以iac-》hic-》aex的顺序进行的过程即本发明的纯化方法之间,hcp含量可能相差3,000或更多倍,尽管在两个过程中均使用相同的三种类型的层析(即免疫亲和层析、疏水相互作用层析和阴离子交换层析)。这些结果表明在本发明的纯化方法中过程顺序是最重要的因素。
[0120]
实施例2-3:通过se-hplc进行的纯度分析的结果
[0121]
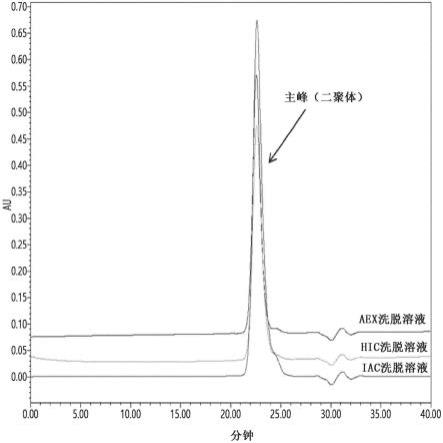
进行了尝试以通过se-hplc分析来分析fsh的纯度。向磷酸钠溶液添加乙腈以制备ph 7的流动相。然后将柱平衡并向其进样。在通过流动相的充分流动而获得的峰的基础上确认纯度。每个纯化步骤的纯度示出在图1中。
[0122]
如图1中所示,证实了主峰(即二聚体峰)的纯度随着纯化过程的进一步进行而提
高。
[0123]
实施例2-4:通过rp-hplc进行的氧化物含量分析的结果
[0124]
进行了尝试以通过rp-hplc分析来分析fsh的氧化物含量。通过向磷酸钾流动相(a)添加乙腈和磷酸钾来制备ph为2.5的流动相(b)。然后将柱平衡并向其进样。氧化物含量通过将所述两种流动相在浓度梯度条件下流过而获得的峰来确认。每个纯化步骤的氧化物含量示出在图2中。
[0125]
正如在图2中所示,证实了随着纯化过程的进一步进行,纯度提高而氧化物峰降低。
[0126]
综上所述,本发明所属领域的普通技术人员能够理解,在不改变本发明的技术概念或基本特征的情况下,本发明可以以其他特定形式体现。就此而言,本文公开的示例性实施方式仅用于说明的目的,不应被解释为限制本发明的范围。相反,本发明旨在不仅涵盖所述示例性实施方式,而且涵盖可以包括在由随附的权利要求书定义的本发明的精神和范围之内的各种不同替代、修改、等效物和其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1