作为用于生物催化还原胱氨酸的酶催化氧化还原系统的核心组分的生物催化剂的制作方法
1.本发明涉及将胱氨酸还原为半胱氨酸的酶,其特征在于所述酶是融合蛋白,其包含具有kegg数据库号ec1.8.4.8或ec1.8.4.10的硫氧化还原蛋白(蛋白i)和具有kegg数据库号ec1.8.1.9的硫氧化还原蛋白还原酶(蛋白ii)的蛋白质活性,其中该融合蛋白的活性是相同但未融合的单独蛋白i和ii的混合物的活性的至少100%。本发明进一步涉及使用所述融合蛋白在辅因子的存在下将胱氨酸酶促还原为半胱氨酸的方法。
背景技术:
2.半胱氨酸(缩写为cys或c)是具有侧链-ch
2-sh的α-氨基酸。因为天然存在的对映异构体形式是l-半胱氨酸,并且因为仅这是蛋白原氨基酸,所以在本发明的上下文中,l-半胱氨酸是指当术语半胱氨酸不用描述语时。巯基的氧化可以导致两个半胱氨酸残基一起形成二硫键,随后形成胱氨酸,相同的陈述适用于此,即。在没有描述语的情况下,它是本发明所指的l-对映异构体(或r,r-胱氨酸)。l-半胱氨酸是人的半必需氨基酸,因为它可以由氨基酸甲硫氨酸形成。
3.氨基酸l-半胱氨酸例如用作食品添加剂(特别是在烘焙工业中)、用作化妆品中的原料、以及用作用于生产活性药物成分(特别是n-乙酰半胱氨酸和s-羧甲基半胱氨酸)的起始材料并且因此具有经济重要性。半胱氨酸作为食品工业中的调味物质(例如作为鸡或肉调味剂)的使用被视为特别重要。l-半胱氨酸还用于修饰生面团的流变学并且用作抗氧化剂,例如在果汁中。
4.在所有生物体中,l-半胱氨酸在硫代谢中起关键作用。其用于合成蛋白质、甲硫氨酸、生物素、硫辛酸、谷胱甘肽和其他含硫代谢物。l-半胱氨酸还用于辅酶a的生物合成。在酶中,硫醇基通常在反应的催化中发挥着一种重要作用,或者通过形成分子内或分子间二硫键来稳定蛋白质。
5.l-半胱氨酸可通过从含角蛋白材料如毛发、鬃毛、指甲、蹄、羽毛和角水解获得。然而,此类方法总是提出关于生物安全性和环境保护的问题。它们还具有低生产率。作为替代方案,已经开发了用于通过从前体的生物转化生产并且用于发酵生产l-半胱氨酸的方法(us 6218168 b1、us 5972663 a、us 2004-038352 a、ca 2386539 a2、ep 2138585、ep 1769080、以及ep 2726625 b1)。发酵生产的缺点是低产量的l-半胱氨酸(甚至在优化发酵控制之后),这也是因为半胱氨酸在大气氧存在下氧化,然后主要作为二硫化物l-胱氨酸存在,并且可以以这种形式获得。
6.氧化反应是可逆的,因此l-胱氨酸可以通过选择性还原转化回l-半胱氨酸。然而,如果l-胱氨酸在从细胞分离(例如使用倾析器)后通过电解还原回l-半胱氨酸,则这种化学转化意指根据香料条例,此类l-半胱氨酸可能不被宣布为天然的。
7.根据欧盟风味条例(1334/2008 article 22 of the regulation on the reorganization of food labeling regulations),如下定义天然风味剂:“天然”调味剂
是具有天然发生的并且已经在自然界中检测到的调味特性的化学定义的物质。它们通过合适的物理、酶或微生物方法从植物、动物或微生物来源的起始材料获得,这些起始材料按原样使用或通过一种或多种常规的食物制备方法制备用于人类消费。
8.术语“天然”也在此意义上用于本技术中。在调味剂的生产中使用天然原料存在极大的兴趣。
9.酶促切割将允许天然半胱氨酸的产生,使用高发酵胱氨酸产率。为了进行这样的酶促过程,需要合适的氧化还原酶级联系统。已经描述的二硫化物裂解酶的实例包括硫氧化还原蛋白、戊二氧化还原蛋白和二硫化物异构酶。然而,这些酶最经常作用于已经在多肽内或蛋白质的两个亚基之间形成的二硫化物。仅针对几种蛋白质(例如细菌硫氧化还原蛋白)描述了游离胱氨酸的切割,该蛋白质进而通过硫氧化还原蛋白还原酶再生,对于该硫氧化还原蛋白还原酶需要nadph作为辅因子。此类氧化还原酶或酶级联通常需要nadh或nadph作为为还原反应提供相应电子的辅因子。
10.因此,胱氨酸还原酶的特征在于其使用底物胱氨酸,并在辅因子如nadph或nadh的帮助下转移两个电子,形成两个半胱氨酸作为最终产物。
11.这意味着该辅因子因此必须以等摩尔量添加到该反应中,这是成本密集的并且因此在经济上是不利的。这可以通过与第二反应偶联以再生该辅因子来避免。作为再生系统,可以使用脱氢酶如醇脱氢酶或葡萄糖-6-磷酸脱氢酶。从经济观点来看,也必须可能通过发酵以相应高的产率生产这些酶。
12.由于生产所需的酶所涉及的努力随着酶的数目而增加,通过基因工程融合各个酶是有经济意义的。这可以具有另外的优点:由于紧密的空间接近,底物能够更容易地从一种酶迁移至下一种酶。然而,此类酶融合体经常导致较差的发酵可生产性(fermentative producibility),否则融合蛋白具有降低的活性或甚至根本不具有活性。为了防止这两种酶在融合蛋白中具有相互抑制作用,反而经常采用连接/分开这两种蛋白质的更长的接头序列。当使用非常短的接头序列或根本不使用接头序列时,与起始蛋白的混合物相比,融合蛋白显示可比较的活性是罕见的。
13.在mycobacterium leprae(wieles b.et al.1995,j.biol.chem.270,pp.25604-25606),发现了作为硫氧化还原蛋白和硫氧化还原蛋白还原酶有活性的蛋白质,该蛋白质的n末端与硫氧化还原蛋白还原酶同源,c末端与硫氧化还原蛋白同源。在比较两个蛋白质单元与来自大肠杆菌的同源蛋白质时,这些在麻风分枝杆菌(m.leprae)中经由22-氨基酸间隔子(spacer)/接头(linker)连接。
技术实现要素:
14.本发明的目的是提供用于将胱氨酸生物催化还原为半胱氨酸的蛋白质,它可以廉价地生产,并且具有至少与现有技术中已知的硫氧化还原蛋白和硫氧化还原蛋白还原酶蛋白的混合物一样高的活性。通过在酶促还原胱氨酸至半胱氨酸的方法中使用该蛋白质,可提供特别有效且经济的方法。
15.该目的通过提供一种将胱氨酸还原为半胱氨酸的酶来实现,其特征在于所述酶是融合蛋白,其包含具有kegg数据库号ec1.8.4.8或ec1.8.4.10的硫氧化还原蛋白(蛋白i)和具有kegg数据库号ec1.8.1.9的硫氧化还原蛋白还原酶(蛋白ii)的蛋白质活性,其中该融
sequences)=100;短查询(short queries)=“自动调整用于短输入序列的参数(automatically adjust parameters for short input sequences)”;期望阈值(expect threshold)=10;字大小(word size)=28;自动调整用于短输入序列的参数(automatically adjust parameters for short input sequences)=0。相应的默认打分参数为:匹配/不匹配分数(match/mismatch scores)=1,-2;间隙成本(gap costs)=线性。
29.使用“蛋白质blast(protein blast)”程序(在http://blast.ncbi.nlm.nih.gov/)比较蛋白质序列。该程序使用blastp算法。默认参数用作两个或更多个蛋白质序列比对的算法参数。默认的一般参数为:最大靶序列=100;短查询=“自动调整用于短输入序列的参数”;期望阈值=10;字大小=3;自动调整用于短输入序列的参数=0。默认评分参数为:matrix=blosum62;间隙成本=存在(existence):11延伸(extension):1;组成调节(compositional adjustments)=条件组成分数矩阵调节(conditional compositional score matrix adjustment)。
30.在本发明的上下文中,蛋白质例如trxa、trxb、trxab、trxba、trxb5a或mi-trxba以大写字母开始,而编码这些蛋白质(也缩写为cds)的序列用小写字母(trxa、trxb、trxab、trxba、trxb5a或mi-trxba)指示。
31.在本发明的上下文中,术语融合蛋白是指所述蛋白包含两种单独的蛋白硫氧化还原蛋白(trx)和硫氧化还原蛋白还原酶(tr)。它由基因编码,该基因的编码区包含trx编码区和tr编码区,结果是它们作为单个单元一起转录和翻译成多肽。
32.与使用两种单独的蛋白质trx和tr相比,使用含有trx和tr的融合蛋白的具体优点来自两种蛋白质在空间中的位置:tr将电子转移至trx,其中trx和tr不需要首先在三维扩散过程中彼此相遇,而是在融合蛋白中是彼此相连。换言之,空间邻近意味着电子可以更容易地从一种酶传递到另一种酶。而单个蛋白必须单独纯化,融合蛋白中的酶活性则一起分离,这也是巨大的经济优势。
33.优选地,融合蛋白另外包括作为纯化辅助物的序列,例如,特别优选地,聚组氨酸标签(his-标签)。his-标签是可用于蛋白质纯化和用于检测标记蛋白质的蛋白质标签。聚组氨酸标签的氨基酸序列是至少6个组氨酸(6his)的序列,其基因序列克隆到起始甲硫氨酸密码子之后的n-末端或终止密码子之前的c-末端的cds中。这产生了具有聚组氨酸标签的融合蛋白。克隆仅一个his-标签使得可以纯化由蛋白trx和tr组成的融合蛋白。这不仅意味着纯化所需的反应步骤更少,而且克隆策略也被简化。
34.此外,有可能在多肽序列与his-标签之间插入蛋白酶或内含肽的裂解位点,以便使his-标签在蛋白质纯化后被裂解掉。
35.优选位于n-端的蛋白质的氨基酸序列在融合蛋白中c-端缩短1个至多5个氨基酸。特别优选的是,位于n-端的蛋白质的氨基酸序列在融合蛋白中c-端缩短1个氨基酸。
36.优选地,位于c-端的蛋白质的氨基酸序列在融合蛋白中n-端缩短一至至多五个氨基酸,特别优选地缩短一个氨基酸。特别优选地,起始密码子不存在于位于融合蛋白c端的蛋白质中。后一个特征具有以下优点:不存在在该点重新开始翻译的风险。
37.此外,优选硫氧化还原蛋白(蛋白i)和硫氧化还原蛋白还原酶(蛋白ii)的融合蛋白活性的氨基酸序列在融合蛋白中通过1-至多5个氨基酸,特别优选1个氨基酸的接头序列
连接。
38.特别优选融合蛋白硫氧化还原蛋白(蛋白i)和硫氧化还原蛋白还原酶(蛋白ii)的氨基酸序列在融合蛋白中直接彼此跟随,即不存在接头序列。
39.如上所述,有利的是在融合蛋白中将协同作用的蛋白质放在一起以便改进它们的克隆、纯化、以及活性。然而,为了不阻碍两种融合蛋白的折叠或在这种情况下必需的其间的相互作用,使用长接头序列似乎是可取的。然而,出人意料地发现,在这种情况下,两种蛋白质(trx、tr)的直接融合产生功能性酶对。这通过以下发现来加以强调:融合蛋白的活性取决于融合顺序。因此,融合蛋白trxab表现出与单独蛋白的混合物可比较的活性。
40.在融合蛋白trxab(seq id no.9)中,终止密码子不存在于trxa序列(seq id no.7)中,而在trxb(seq id no.8)中,第一个氨基酸(甲硫氨酸,m)已被缺失。此外,该蛋白携带his-标签(seq id no:9中的氨基酸1-12)。除去起始密码子后,在trxa的最后一个氨基酸(ala)和trxb的第一个氨基酸(gly)之间没有接头序列。
41.在融合蛋白trxba(seq id no.10)中,最后一个氨基酸(赖氨酸)和终止密码子在trxb序列(seq id no.8)中不存在,而在trxa(seq id no.7)中第一个氨基酸(甲硫氨酸,m)已经缺失。此外,该蛋白携带his-标签(seq id no.10中的氨基酸1-12)。氨基酸(gly)的接头序列存在于trxb的倒数第二个氨基酸(ala)和trxa的第一个氨基酸(ser)之间。
42.对于融合蛋白trxb5a(seq id no.28),与针对trxba所描述的相同,除了在trxb和trxa之间存在五个氨基酸(gly-pro-ala-pro-gly)的接头序列。
43.位于编码融合蛋白的氨基酸序列的起始密码子和终止密码子之间的区域被称为编码序列(cds)。cds由非编码区包围。所谓的基因是含有用于产生生物学功能蛋白质的所有基本信息的dna部分。基因含有通过转录由其产生单链rna拷贝的dna部分,以及涉及该拷贝过程调节的表达信号。表达信号包括例如至少一个启动子、转录起始、翻译起始和核糖体结合位点。此外,通过终止子和一个或多个操纵子的表达调节是可能的。
44.对于功能性启动子,在该启动子调节下的cds被转录为rna。
45.编码融合蛋白的蛋白i(硫氧化还原蛋白)的dna部分可以首先通过使用寡核苷酸作为引物和编码硫氧化还原蛋白的dna基质(例如从大肠杆菌中分离的基因组dna)的pcr扩增,然后通过标准分子生物学技术与在每种情况下的dna分子(其包含融合蛋白的蛋白ii序列(硫氧化还原蛋白还原酶)并且以类似方式产生)偶联(以发生框内融合的方式)。存在于蛋白i和ii之间的融合蛋白中的c-末端定位的融合配偶体(fusion partner)的第二起始密码子可以被缺失以便避免可替代的阅读框。在两个融合配偶体的转变点处,可以插入不同长度的接头序列。
46.作为通过克隆位点融合的替代方案,可以通过基因合成产生整个dna分子。然后可以将此dna分子引入载体(例如质粒)中,或通过已知方法直接整合到细菌菌株的染色体中。优选地,该dna分子被引入质粒,例如已知表达载体的衍生物,如pjf118eh、pkk223-3、puc18、pbr322、pacyc184、pask-iba3、pgj3477或pet。
47.优选的是,dna分子主要携带融合蛋白的编码序列和很少的其他核苷酸,并且因此克隆到质粒中,使得克隆发生在距启动子和终止子限定的距离处,即将所述dna分子在编码所述启动子的区域的3’处和在编码所述终止子的区域的5’处克隆至所述质粒中。
48.合适的启动子是本领域技术人员已知的所有启动子,如组成型启动子,例如gapdh
启动子,或诱导型启动子,例如lac、tac、trc、lambda pl、arab、cumate或tet启动子或由其衍生的序列。该融合蛋白特别优选地在该阿拉伯糖可诱导的arab启动子(p
bad
)的控制下表达。
49.所使用的质粒可以携带选择标记。适合作为选择标记的是编码对抗生素如氨苄青霉素、四环素、氯霉素、卡那霉素或其他抗生素具有抗性的基因。质粒优选含有其表达赋予氨苄青霉素抗性的基因。营养缺陷型标记也适合作为选择标记,因为它们编码在含有质粒的相应细菌菌株中缺失的代谢中的必需基因。
50.可以使用本领域技术人员已知的方法将质粒引入细菌菌株的细胞中(转化)。细菌菌株的特征优选地在于,细菌菌株是革兰氏阴性细菌,特别优选地是肠杆菌属(enterobacteriaceae)的细菌菌株,尤其优选地是物种大肠杆菌(escherichia coli)(e.coli)的菌株。
51.含有质粒的细菌菌株可用于发酵过程,即细菌细胞可以在培养基中繁殖,优选在选择性lb培养基(对应于质粒中存在的选择标记)中繁殖,培养后通过沉淀与培养基分离,弃去上清液,并裂解。然后可以例如通过亲和色谱法(例如经由his-标签,见上文)分离所表达的融合蛋白。
52.本发明的酶具有以下优点:它可以通过发酵以高产率并且因此廉价地生产。其生产在经济上是特别有效的并且也是有利的,还因为仅需要生产、纯化和分离一种融合蛋白而不是两种单独的蛋白。
53.有利的是该酶可以通过辅因子例如nadph或nadh作为电子供体再生并且因此作为还原剂再生,因为用于再生nadph或nadh的系统已经存在。
54.trx和tr的酶活性可以经由辅因子的转化来确定,例如在340nm处光度测定。这是可能的,因为当从还原(nadph/nadh)状态变为氧化(nadp/nad)状态时,在340nm处的消光系数显著改变。
55.在测量各种构建体(融合蛋白)的酶活性或单独蛋白的各种混合比率的酶活性时,令人惊奇且对本领域技术人员而言不可预见的是,发现融合蛋白的活性是相同但未融合的单独蛋白硫氧化还原蛋白和硫氧化还原蛋白还原酶的混合物的活性的至少100%,优选至少150%,且特别优选至少200%。这意味着融合蛋白的活性与相同但未融合的单一蛋白i和ii的混合物的活性一样高或甚至更高。
56.更确切地说,这意味着除了在没有辅因子或底物的阴性对照的情况下,在每种情况下最初装入由底物、辅因子、以及缓冲系统组成的相同的反应混合物。在将相同量的融合蛋白添加至一种混合物中,或将相同量的单独的蛋白i(trx)和ii(tr)添加至另一种混合物中之后,在相同的时间内在相同的反应条件下确定辅因子转化率。或者,同样可以检测底物量的降低或产物量的增加。
57.所述酶的特征优选在于,所述融合蛋白的基因包含与seq id no.2至少50%,优选至少70%,且特别优选至少90%同一性的一个dna序列,和与seq id no.3至少50%,优选至少70%,且特别优选至少90%同一性的另一个dna序列。
58.在特别优选的实施例中,编码融合蛋白的dna序列是seq id no.5。
59.本发明进一步提供一种将胱氨酸酶促还原为半胱氨酸的方法,其特征在于在辅因子的存在下通过本发明的酶还原半胱氨酸。
60.在胱氨酸酶促还原为半胱氨酸中,二硫化物(-s-s-)转化成两个巯基(-sh)基团,即两个分子的l-半胱氨酸是由一分子化合物胱氨酸形成的。本发明的融合蛋白催化还原并将电子转移至胱氨酸的二硫化物。
61.令人惊讶的是,融合蛋白trxba的活性特别显著高于相同但未融合的单个蛋白trxa和trxb的混合物的活性(参见实施例4,图4)。
62.本发明的方法的特别优点是使用该方法产生的半胱氨酸可以根据对调味品的规定(regulation on flavorings)宣布为天然半胱氨酸。
63.经济方法的另一挑战是胱氨酸在中性ph范围(或生理ph范围,即大约7.4的ph)的缓冲体系中的溶解度差。
64.该方法优选在4-11,特别优选5-10,特别优选6-9的ph范围内进行。
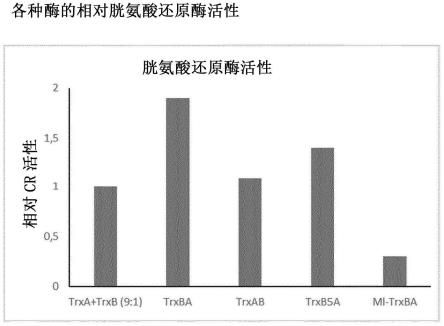
65.当本发明的酶在生理ph下用于将胱氨酸酶促还原为半胱氨酸的方法中使用时,这是特别有利的并且因此另外特别优选。
66.该方法优选在20℃至40℃、特别优选从25℃至30℃的温度下进行。
67.该方法的特征优选在于辅因子是选自由nadph和nadh组成的组的物质。该辅因子特别优选是nadph。
68.所述方法的特征优选在于,在还原之后,分离所形成的半胱氨酸。为了进一步纯化目标产物,可以采用以下步骤/程序:
[0069]-通过离子交换吸附分离l-半胱氨酸
[0070]-沉淀结晶。
[0071]
此类方法是从现有技术中已知的(参见例如wo 2013/000864)。
[0072]
在将胱氨酸还原为半胱氨酸时,本发明的酶被氧化,即它通过形成二硫键将电子转移到胱氨酸。由于存在的nadph或nadh辅因子的电子通过融合蛋白(tr部分)的活性被转移至融合蛋白(trx部分),因此分别形成nadp
+
或nad
+
。为此,优选所述工艺包括辅因子再生酶。特别优选地,该辅因子再生酶是一种脱氢酶,其中该还原在另外电子供体的存在下另外地发生。
[0073]
辅因子再生酶可以是葡萄糖-6-磷酸脱氢酶和/或醇脱氢酶。在特别优选的实施例中,所述脱氢酶是醇脱氢酶,其中异丙醇用作电子供体。
具体实施方式
[0074]
下面参考示例性实施例更详细地描述本发明,但本发明不限于此。
[0075]
实施例
[0076]
实施例1:胱氨酸还原酶系统trxa、trxb、trxba、和trxab的产生
[0077]
表达载体的制备:
[0078]
作为表达编码相应候选蛋白trxa、trxb、trxab、trxba、trxb5a或mi-trxba的dna序列的载体,选择表达质粒pgj3477。这是基于cole1复制起点的中到高拷贝质粒(50-60拷贝/细胞)。质粒图在图1中示出,其中在质粒图上指示共有的、仅单切割限制酶(具有6碱基识别序列)的位置。该序列在seq id no.11中指定。
[0079]
在该质粒中,将相应的候选物的编码序列置于阿拉伯糖诱导型启动子p
bad
的控制之下。
[0080]
首先,通过反向pcr扩增整个表达质粒:
[0081]-50ng的pgj3477 dna、0.5pmol的对应引物3477-fwrd(seq id no.12)和3477-rev(seq id no.13)、反应缓冲液(new england biolabs(新英格兰生物实验室),neb)、1单位的dna聚合酶(neb),终体积为50μl。
[0082]-pcr程序:在98℃下1min,然后在98℃下30s、在65℃下30s(退火)以及在72℃下2min(合成)的30个循环。
[0083]
在反应结束时,将限制性酶dpni(10个单位,neb)添加至反应混合物中并且将该混合物在37℃下孵育1h。这之后是dna的色谱纯化(macherey&nagel:gel和pcr clean-up-kit)。
[0084]
trxa和trxb的克隆:
[0085]
为了克隆蛋白质编码序列trxa(seq id no.2)和trxb(seq id no.3),定义了寡核苷酸引物,其靶基因特异性序列延伸至少15个核苷酸,其与载体dna末端的序列重叠。通过pcr从bl21的大肠杆菌基因组扩增这些基因(克隆pcr,colony pcr)。
[0086]
选择以下混合物用于通过pcr进行扩增:
[0087]-50ng的基因组大肠杆菌bl21 dna(neb)、0.5pmol的相应引物trxa-fwrd(seq id no.14)和trxa-rev(seq id no.15)或trxb-fwrd(seq id no.16)和trxb-rev(seq id no.17)、反应缓冲液(neb)、1单位dna聚合酶(neb),终体积为50μl。
[0088]-pcr程序:在98℃下1min,然后在98℃下30s、在60℃下30s(退火)、以及在72℃下15s(trxa)或30s(trxb)(合成)的30个循环。
[0089]
在反应结束时,将限制性酶dpni(10个单位,neb)添加至反应混合物中并且将该混合物在37℃下孵育1h。这之后是dna的色谱纯化(macherey&nagel:gel和pcr clean-up-kit)。
[0090]
lic-pcr:
[0091]
通常,通过aslanidis c.and de jong p.j.,nucleic acids res.18,pp.6069-6074中所述的lic-pcr(pcr产物的连接非依赖性克隆)将编码蛋白质的dna序列碱基精确地引入基础表达载体pgj3477中。
[0092]
为此目的,在lic-pcr反应中使用了50ng的对应的候选蛋白的纯化的编码dna以及50ng的制备的载体dna。然后使用标准方法将lic-pcr混合物转化到大肠杆菌xl1 blue细胞中并且铺板在选择性lb培养基(lb+100mg/l氨苄青霉素)上,并且在37℃下孵育18h。为了鉴定正确的克隆,从所获得的菌落中分离质粒dna并且对表达盒进行完全测序。
[0093]
由表达载体pgj3477和编码dna序列trxa或trxb组成的所得质粒在下文中称为trxa或trxb表达载体。
[0094]
trxab和trxba的克隆:
[0095]
分别编码相应融合蛋白trxab或trxba的dna trxab或trxba的克隆以类似于上述的克隆trxa和trxb的方式,通过lic-pcr在n-末端his标签与编码蛋白trxb的序列trxb之间将trxa序列插入trxb表达载体,或者通过lic-pcr在his标签与编码蛋白trxa的序列trxa之间将trxb序列插入trxa表达载体而进行:
[0096]
选择以下混合物用于通过pcr进行扩增:
[0097]-用引物vtrxa-fwrd(seq id no.18)和3477-rev(seq id no.13)或vtrxb-fwrd(seq id no.21)和3477-rev(seq id no.13)通过反向pcr扩增载体dna(trxa或trxb表达载体),为其选择以下pcr程序:98℃下2分钟,然后98℃下45s/60℃下30s/72℃下2.5分钟的30个循环。
[0098]-用引物ftrxa-fwrd(seq id no.22)和ftrxa-rev(seq id no.23)或ftrxb-fwrd(seq id no.19)和ftrxb-rev(seq id no.20)通过pcr扩增融合蛋白的trxa或trxb基因片段,为其选择以下pcr程序:98℃下2分钟,然后98℃下45s/60℃下30s/72℃下15s的30个循环。bl21基因组dna用作模板。
[0099]
在pcr反应结束时,将限制性酶dpni(10个单位,neb)添加至对应的反应混合物中并且将该混合物在37℃下孵育1h。这之后是插入dna的色谱纯化(macherey&nagel;gel和pcr clean-up-kit)。
[0100]
使用50ng的trxa或trxb表达载体的扩增载体dna和75ng的插入dna(trxb或trxa)进行lic-pcr反应。
[0101]
然后使用标准方法将lic-pcr混合物转化到大肠杆菌xl1 blue细胞中并且铺板在选择性lb培养基(lb+100mg/l氨苄青霉素)上,并且在37℃下孵育18h。为了鉴定正确的克隆,从所获得的菌落中分离质粒dna并且对表达盒进行完全测序。
[0102]
seq id no.9和seq id no.10规定分别从序列seq id no.4和seq id no.5的表达得到的融合蛋白trxba和trxab的氨基酸序列。
[0103]
实施例2:胱氨酸还原酶mi-trxba的克隆
[0104]
如引言中所述,麻风分枝杆菌(mycobacterium leprae)拥有编码与硫氧化还原蛋白(thioredoxin)(trx)和硫氧化还原氧化还原蛋白还原酶(thioredoxin reductase)(tr)具有同源性的蛋白质的基因片段(wieles b.et al.1995,j.biol.chem.270,pp.25604-25606)。该序列可以取自公开数据库(ncbi reference sequence:wp_010909042.1)。
[0105]
通过计算机针对宿主大肠杆菌的密码子使用定制取自公开数据库的序列。这是使用idt网络服务器(www.idtdna.com)完成的。为了克隆到靶载体pgj3477中,编码区在5’和3’端通过与载体序列重叠的序列延伸(还参见trxa和trxb的克隆)。所得总dna序列由geneart(www.thermofisher.com)合成性生产(在seq id no.24中指定),并命名为mi-trxba(也称为mi-trxba)。
[0106]
以与通过lic-pcr克隆trxa和trxb表达载体类似的方式将合成的mi-trxba序列克隆到载体pgj3477中。
[0107]
为了克隆蛋白质编码序列mi-trxba(seq id no.24),定义了寡核苷酸引物,其靶基因特异性序列延伸至少15个核苷酸,其与载体dna末端的序列重叠。合成基因充当模板。
[0108]
选择以下混合物用于通过pcr进行扩增:
[0109]-20ng的模板(geneart)、0.5pmol的对应引物mi-trxba-fwrd(seq id no.25)和mi-trxba-rev(seq id no.26)、反应缓冲液、1单位的dna聚合酶(neb),终体积为50μl。
[0110]-pcr程序:在98℃下1min,然后在98℃下30s、在60℃下30s(退火)、以及在72℃下60s(合成)的30个循环。
[0111]
在反应结束时,将限制性酶dpni(10个单位,neb)添加至反应混合物中并且将该混
合物在37℃下孵育1h。这之后是dna的色谱纯化(macherey&nagel:gel和pcr clean-up-kit)。
[0112]
lic-pcr:
[0113]
如aslanidis c.and de jong p.j.,nucleic acids res.18,pp.6069-6074所述,通过lic-pcr(pcr产物的连接非依赖性克隆)将编码蛋白质的dna序列碱基精确地引入基础表达载体pgj3477中。
[0114]
为此目的,将50ng的纯化的编码dna与60ng的制备的载体dna一起用于lic-pcr反应中。
[0115]
然后使用标准方法将lic-pcr混合物转化到大肠杆菌xl1 blue细胞中并且铺板在选择性lb培养基(lb+100mg/l氨苄青霉素)上,并且在37℃下孵育18h。为了鉴定正确的克隆,从所获得的菌落中分离质粒dna并且对表达盒进行完全测序。
[0116]
由表达载体pgj3477和编码dna序列mi-trxba组成的所得质粒在下文称为mi-trxba表达载体。
[0117]
实施例3:胱氨酸还原酶trxb5a(具有接头序列)的克隆
[0118]
trxb5a的克隆:
[0119]
编码相应融合蛋白trxb5a的dna trxb5a的克隆以类似于上述的克隆trxba的方式,通过lic-pcr在his-标签与编码蛋白trxa的序列trxa之间将c端延伸5个氨基酸的trxb序列(下文称为trxb5,并且cds称为trxb5)插入trxa表达载体中而进行:
[0120]
选择以下混合物用于通过pcr进行扩增:
[0121]-用引物vtrxa5-fwrd(seq id no.29)和3477-rev(seq id no.13)通过反向pcr扩增载体dna(trxa表达载体),为其选择以下pcr程序:98℃下2分钟,然后98℃下45s/60℃下30s/72℃下2.5分钟的30个循环。
[0122]-用引物ftrxb-fwrd(seq id no.19)和ftrxb5-rev(seq id no.30)通过pcr扩增trxb5,为其选择以下pcr程序:在98℃下2分钟,然后在98℃下45s/在60℃下30s/在72℃下15s的30个循环。bl21基因组dna用作模板。
[0123]
在pcr反应结束时,将限制性酶dpni(10个单位,neb)添加至对应的反应混合物中并且将该混合物在37℃下孵育1h。这之后是插入dna的色谱纯化(macherey&nagel;gel和pcr clean-up-kit)。
[0124]
使用50ng的trxa表达载体的扩增载体dna和75ng的插入dna(trxb5)进行lic-pcr反应。
[0125]
然后使用标准方法将lic-pcr混合物转化到大肠杆菌xl1 blue细胞中并且铺板在选择性lb培养基(lb+100mg/l氨苄青霉素)上,并且在37℃下孵育18h。为了鉴定正确的克隆,从所获得的菌落中分离质粒dna并且对表达盒进行完全测序。
[0126]
seq id no.28规定了由序列seq id no.27的表达产生的融合蛋白trxb5a的氨基酸序列。
[0127]
实施例4:胱氨酸还原酶的酶活性
[0128]
对于蛋白trxa、trxb、trxba、trxb5a、trxab和mi-trxba的重组表达,将研究的编码相应蛋白的表达质粒引入菌株大肠杆菌top10(赛默飞世尔科技公司(thermo fisher scientific),马萨诸塞州/美国)。将细菌细胞铺板于包含100mg/l氨苄青霉素的lb培养基
上。然后将包含100mg/l氨苄青霉素和0.2%阿拉伯糖(w/v)的25ml lb培养基用单菌落接种,并且在培养摇床柜中在28℃下孵育18h。
[0129]
为了分离表达的蛋白质,通过离心(在4000g下10min)沉淀细胞,去除培养基上清液,并且将生物质再悬浮于裂解缓冲液(pbs+10%bugbuster(西格玛公司,sigma))中。按照bugbuster试剂盒(sigma)的手册中的制造商的说明书,在室温下在15分钟内完全溶解细胞,然后通过离心(按照制造商的说明书,在9500rpm下20分钟)除去不溶性物质。为了通过亲和层析纯化上清液(=细胞溶解物),将获得的细胞溶解物加载到pbs平衡的protino ida2000柱(macherey&nagel)中。在洗涤步骤(7ml pbs)之后,用5ml洗脱缓冲液(pbs+200mm咪唑)洗脱样品。通过布拉德福德(bradford)测定(赛默飞世尔(thermo fisher))测定所得蛋白质浓度。
[0130]
使用以下详细描述的两种分析方法测定不同酶trxa、trxb、trxba、trxb5a、trxab或mi-trxba的胱氨酸还原酶活性。
[0131]
1.第一种方法由光度检测方法(photometric detection method)组成,该方法基于nadph的消耗和在还原反应过程中在340nm处吸光度值的所得下降。如图2中示意性所示,在还原至半胱氨酸中胱氨酸的酶促转化伴随辅因子nadph的消耗。
[0132]
使用以下检测混合物用于光度测定,样品的终体积是1ml:
[0133]
·
100mm磷酸盐缓冲液ph 7.4
[0134]
·
2mm edta
[0135]
·
0.2mm nadph(sigma)
[0136]
·
1mm胱氨酸(wacker chemie ag)
[0137]
·
混合除了酶之外的所有检测组分后,通过加入以下酶开始反应:
[0138]
10μg酶trxa、trxb、trxa和trxb的混合物、trxba、trxb5a、trxab或mi-trxba。将检测混合物在室温(大约25℃)下孵育直到以下描述的测量。
[0139]
使用分光光度计(evolution 201uv-vis分光光度计,赛默飞世尔科技公司(thermo fisher scientific))以在340nm处的吸光度值的形式在不同时间测量不同1ml检测混合物的nadph浓度。使用来自制造商赛默飞世尔科技公司(thermo fisher scientific)的thermo insight软件,使用在340nm处的吸光度值来计算不同样品的酶活性。在每种情况下作为阴性对照平行分析含有热灭活的酶、无酶、无胱氨酸作为底物或无nadph作为辅因子的样品。
[0140]
从所记录曲线开始的线性斜率确定酶活性,其中吸光度随时间的变化(降低)指示nadph消耗速率。由于总是使用相同量的酶,因此可以比较这些速率。
[0141]
2.在第二种方法中,通过胱氨酸还原酶活性由胱氨酸形成的半胱氨酸通过与化合物dtnb(5,5'-二硫代双-2-硝基苯甲酸;ellman试剂)反应经由游离sh基团直接进行检测,如图3示意性所示,在本发明的上下文中也称为dtnb测定。
[0142]
使用以下检测混合物用于光度测定,样品的终体积是1ml:
[0143]
·
100mm磷酸盐缓冲液ph 7.4
[0144]
·
2mm edta
[0145]
·
0.2mm nadph(sigma)
[0146]
·
1mm胱氨酸(wacker chemie ag)
[0147]
·
混合除酶之外的所有检测组分后,通过加入以下酶开始反应:
[0148]
10μg酶trxa、trxb、trxa和trxb的混合物、trxba、trxb5a、trxab或mi-trxba。将检测混合物在室温(大约25℃)下孵育直到以下描述的测量。
[0149]
l-半胱氨酸通过lee s.-h.et al.1995(biochemical and biophysical research communications 213,pp.837-844)描述的测试,使用5,5'-二硫代双-2-硝基苯甲酸(dtnb)进行定量。cys-tnb的定量是通过在412nm处测量dtnb介导的吸光度。通过hplc分析也是可能的。
[0150]
在每种情况下作为阴性对照平行分析含有热灭活的酶、无酶、无胱氨酸作为底物或无nadph作为辅因子的样品。
[0151]
图4显示了根据如上文第1点下所述的光度测定的酶trxba、trxb5a、trxab和mi-trx以及trxa和trxb的(9:1)混合物的相对胱氨酸还原酶活性,trxa和trxb的(9:1)混合物的活性被归一化为1,以及与其相关的所有其他活性集合。trxa和trxb的(9:1)混合物是比较测试已经显示是最具活性的混合比率的单个酶的估计的混合比率。
[0152]
图5显示根据dtnb检测和如上面第2点所述的hplc通过trxba和trxab检测半胱氨酸形成。
[0153]
在trxa和trxb的cds之间的≥60个核苷酸的区域中含有比trxb5a更长的接头序列的克隆的使用出人意料地导致了在融合蛋白中显著更低的活性。
[0154]
实施例5:胱氨酸还原酶与adh酶组合的活性
[0155]
对辅因子nadph和nadp
+
的酶特异性的比较发现胱氨酸还原酶trxba和trxab对辅因子nadph是高度特异性的。在这些测试中,用nadp
+
没有检测到针对胱氨酸的酶活性。
[0156]
联合实验研究了醇脱氢酶(adh)能够将nadp
+
转化回nadph用于反应的程度。
[0157]
为此目的,使用以下条件:
[0158]
·
100mm磷酸盐缓冲液ph 7.4
[0159]
·
5μl的异丙醇
[0160]
·
2mm edta
[0161]
·
15-50μm nadph或nadp
+
[0162]
·
1mm胱氨酸
[0163]
·
5μg的酶trxba
[0164]
·
50μl的细胞溶解物粗提取物或,作为阴性对照,50μl的磷酸盐缓冲液(0.5ml细胞在1.5ml的4x磷酸盐缓冲液(ph 7.4)中的快速制备型消化(fast prep digestion)。如在ep 1 832 658 b1中的描述生产细胞)
[0165]
将该反应在30℃下孵育60分钟。以5分钟间隔取样,并且如wo 2013/000864 a1中所描述的,用dtnb衍生化释放的半胱氨酸。通过测量在412nm的dtnb介导的吸光度进行定量。
[0166]
图6示出了在存在(有)或不存在(无)adh作为再生系统的情况下,使用dtnb检测,通过trxba测量半胱氨酸形成的结果。
[0167]
附图中使用的缩写
[0168]
arac:arac基因(抑制物基因)
[0169]
parac:arac基因的启动子(抑制物基因;针对p
bad
的rev取向)
[0170]
pbad(在本发明的上下文中也称为p
bad
):用于表达(下游)插入的靶蛋白序列的阿拉伯糖诱导型启动子
[0171]
6his:his-标签的编码区
[0172]
term:转录终止子
[0173]
amp:氨苄青霉素抗性标记
[0174]
cr:胱氨酸还原酶
[0175]
rel.:相对
[0176]
bps:碱基对
[0177]
t:时间。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1