利用深海链霉菌生产怡莱霉素E的培养基及其制备方法
本发明属于微生物发酵培养基技术领域,具体地说,是涉及培养深海链霉菌的培养基的技术领域,更具体地说,是关于一种利用深海链霉菌生产怡莱霉素e的培养基及其制备方法。
背景技术:
海洋是人类的资源宝库,蕴含着丰富的生物资源,海洋已知的生物物种的数量约有40多万种,占地球生物物种总数的80%,其中许多种类是陆地上没有的。海洋覆盖了地球70.8%的表面积,95%的海域深度超过了1000米,被称为深海。如今,深海由于其复杂独特的生境,被公认为未来重要的基因资源来源地,具有良好的应用开发前景。由于环境的独特性,深海蕴藏着丰富的极端微生物,它们往往能产生结构和功能独特的生物大分子与小分子,与陆源化合物结构、功能迥异。随着多药抗药性达到临界点,特别是在抗生素耐药的情况下,进入未知水域探索新化学实体势在必行。海洋稀有微生物中包含的大量活性物质正待开发。
从南海3536m(120°0.250'e,20°22.971'n)深处收集的沉积物样品中分离出放线菌菌株scsiozh16。基于近乎完整的16srrna基因序列的系统发育分析表明菌株scsiozh16属于链霉菌属。16srrna基因序列已经以登录号kt9708保藏在genbank中。该菌株保藏于中国科学院微生物研究所(中国北京)中国通用微生物菌种保藏中心,全名为streptomycesatratusscsiozh16。深海链霉菌scsiozh16具有产生多种次级代谢产物的能力,但大部分生物合成基因都是“沉默”的。其野生型菌株可生产一类环七肽类天然产物,被命名为“怡莱霉素”。怡莱霉素的七个氨基酸中只有两种氨基酸是天然无修饰的,且包括特殊的3-硝基酪氨酸、l-2-氨基-4-己烯酸、异戊烯基化色氨酸结构单元。中科院南海所鞠建华研究员团队通过基因工程改造,敲除编码细胞色素p450单加氧酶的ilar基因,打断了异戊烯基的环氧化反应,获得了基因工程改造株△ilar。该菌株能够产生具有强效抗结核杆菌活性的怡莱霉素e,其活性为一线抗结核药物利福平的30倍,是一种优异的潜在抗结核候选药物。
然而,怡莱霉素e在初始发酵工艺下的得率相当低,已经成为制约怡莱霉素e用于临床前研究的瓶颈。因此通过改善其发酵工艺提高怡莱霉素e产量势在必行。
技术实现要素:
本发明针对以上现状,对发酵生产怡莱霉素e的培养基进行深入研究,获得了一种成分简单,制备方法的操作方便,成本低廉,不需特殊设备的培养基,而且使用该培养基发酵深海链霉菌生产强效抗结核药物怡莱霉素e,能显著提高怡莱霉素e的产量。因此,本发明的第一个目的是提供一种利用深海链霉菌生产怡莱霉素e的培养基的制备方法。本发明的第二个目的是提供一种利用深海链霉菌生产怡莱霉素e的培养基。本发明的第三个目的是一种使用上述所述的培养基发酵生产怡莱霉素e的方法。
为实现上述目的,本发明采用如下技术方案:
作为本发明的第一个方面,一种利用深海链霉菌生产怡莱霉素e的培养基的制备方法,包括如下步骤:
步骤一、以重量份计,准确称取可溶性淀粉80-120g、酵母浸膏20-30g、玉米浆1.6-2.4g、氯化钠4-6g、硝酸钠6.4-9.6g、硫酸铵6.4-9.6g、磷酸二氢钾0.16-0.24g,以去离子水溶解,并定容至1000ml;
步骤二、再以3m氢氧化钠溶液调节ph至7.2-7.4,以重量份计,补加终浓度为6.4-9.6g的碳酸钙,分装至摇瓶后于121℃灭菌20分钟。
根据本发明,所述深海链霉菌为深海链霉菌scsiozh16△ilar。
进一步的,步骤一、以重量份计,准确称取可溶性淀粉120g、酵母浸膏20g、玉米浆1.6-2.4g、氯化钠4-6g、硝酸钠6.4-9.6g、硫酸铵6.4-9.6g、磷酸二氢钾0.16-0.24g,以去离子水溶解,并定容至1000ml;
步骤二、再以3m氢氧化钠溶液调节ph至7.2-7.4,以重量份计,补加终浓度为6.4-9.6g的碳酸钙,分装至摇瓶后于121℃灭菌20分钟。
优选的,所述的培养基的制备方法包括:步骤一、以重量份计,准确称取可溶性淀粉120g、酵母浸膏20g、玉米浆2.4g、氯化钠6g、硝酸钠9.6g、硫酸铵6.4g、磷酸二氢钾0.24g,以去离子水溶解,并定容至1000ml;
步骤二、用3m氢氧化钠溶液调节ph至7.2-7.4后,加入9.6g碳酸钙。
作为本发明的第二个方面,一种利用深海链霉菌生产怡莱霉素e的培养基,其是采用上述所述的制备方法制备获得。
作为本发明的第三个方面,一种使用上述所述的培养基发酵培养深海链霉菌生产怡莱霉素e的方法,包括如下步骤:
步骤一、将-20℃冷冻保存的深海链霉菌孢子液解冻后,在固体培养基中划线传代并生长7-14天,获得孢子量丰富的新鲜固体培养基;
步骤二、从新鲜的深海链霉菌的固体培养基中挖取大小约0.5cm2琼脂块,接种至种子培养基中发酵培养60h,获得新鲜种子液;
步骤三、取所述新鲜种子液,按10%(v/v)的接种量接入上述所述的培养基,以28℃、200rpm摇床振荡培养6-7天后,获得发酵液;
步骤四、取所述发酵液进行抽滤、浸提、纯化,获得怡莱霉素e;
步骤五、菌体生长由菌体干重来表征。取10ml混合均匀的发酵液,真空抽滤,并用100ml自来水冲洗并滤干。菌体和滤纸在55℃烘干24h,然后转移至干燥器中冷却并称重。菌丝体干重用差减法计算得到。
根据本发明,所述深海链霉菌为深海链霉菌scsiozh16△ilar。
根据本发明,所述固体平板培养基每升包含:可溶性淀粉4g、麦芽提取物10g、酵母提取粉4g、纯燕麦片5-10g、琼脂粉20g,以去离子水溶解后蒸煮20分钟,分装后于121℃灭菌20min,铺平板前添加终浓度为25mg/l的阿普拉霉素。
根据本发明,所述种子培养基每升包含:葡萄糖20g、蛋白胨2g、酵母提取粉2g、黄豆粉5g、七水硫酸镁0.5g、磷酸二氢钾0.5g、氯化钠4g、碳酸钙2g,以去离子水溶解。
本发明的有益效果:
1、本发明的培养基成分包括可溶性淀粉、酵母浸膏、玉米浆、氯化钠、硝酸钠、硫酸铵、磷酸二氢钾和碳酸钙,原料易得,价格低廉,有利于推广应用;
2、制备本发明的培养基只需将上述原料以去离子水溶解,方法简单,难度低,无需专门技术培训及特殊仪器设备;
3、采用本发明的培养基及方法发酵培养深海链霉菌scsiozh16△ilar,该菌株在该培养基中生长迅速,提高次级代谢途径通量,使用该培养基发酵培养深海链霉菌scsiozh16△ilar生产怡莱霉素e,可提高目标产物怡莱霉素e的产量,为后期纯化工作降低难度,怡莱霉素e的最高产量可达到202.96mg/l,是原始水平的12.76倍。
附图说明
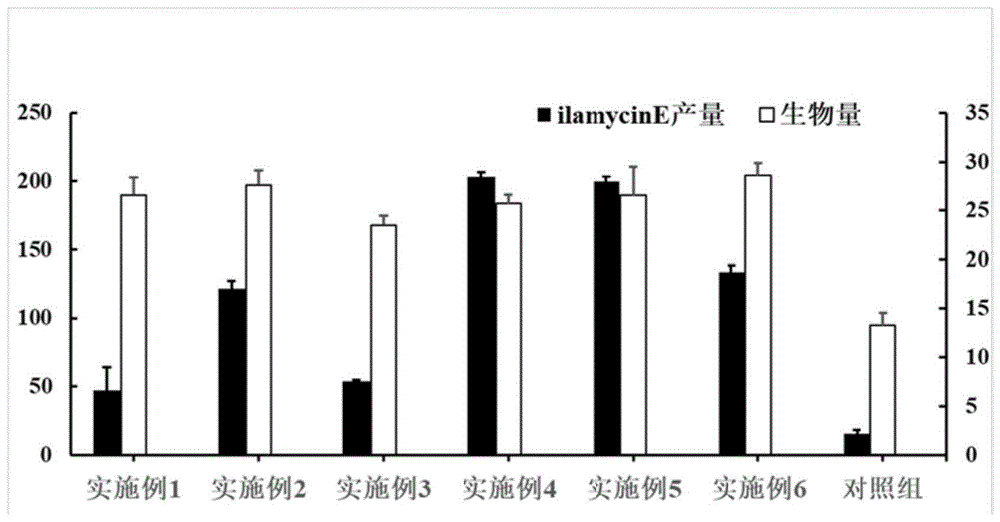
图1为本发明的各实施例与对照组的怡莱霉素e的产量的结果对照图。
具体实施方式
以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或厂商提供的条件进行。
应当说明,本发明选用的培养基成分均为市售产品。酵母浸膏购自国药集团化学试剂有限公司;可溶性淀粉购自上海泰坦科技股份有限公司;玉米浆购自山东无棣波皓生物科技有限公司。
应当说明,在进行小规模实验时,为保证灭菌彻底,玉米浆干粉需充分溶解,防止残留杂菌在发酵期间复苏。
1、本发明的所用的菌种:
深海链霉菌scsiozh16△ilar,由中科院南海所鞠建华研究员团队提供。深海链霉菌scsiozh16分离自中国南海3536米深处沉积物,经基因工程改造后获得改造菌株scsiozh16△ilar。
2、种子培养基:
准确称取葡萄糖20g、蛋白胨2g、酵母提取粉2g、黄豆粉5g、七水硫酸镁0.5g、磷酸二氢钾0.5g、氯化钠4g,以去离子水溶解,并定容至1000ml,用3m氢氧化钠溶液调节ph至7.2-7.4后,加入2g碳酸钙。
3、固体培养基
准确称取可溶性淀粉4g、麦芽提取物10g、酵母提取粉4g、纯燕麦片5-10g、琼脂粉20g,以去离子水溶解后蒸煮20分钟,分装后于121℃灭菌20min,铺平板前添加终浓度为25mg/l的阿普拉霉素。
实施例1
1)发酵培养基的配置
准确称取葡萄糖120g、黄豆粉20g、玉米浆2.4g、氯化钠6g、硝酸钠9.6g、硫酸铵6.4g、磷酸二氢钾0.24g,以去离子水溶解,并定容至1000ml,用3m氢氧化钠溶液调节ph至7.2-7.4后,加入9.6g碳酸钙。接着,分装至摇瓶后于121℃灭菌20分钟。
2)发酵操作过程
将-20℃冷冻保存的深海链霉菌scsiozh16△ilar孢子液解冻后,在固体培养基中划线传代并生长7-14天,获得孢子量丰富的新鲜固体培养基。从新鲜的深海链霉菌scsiozh16△ilar的固体培养基中挖取大小约0.5cm2琼脂块,接种至装有25ml种子培养基的250ml摇瓶中,以28℃、200rpm摇床发酵培养60h,获得新鲜种子液,按10%(v/v)的接种量接入所述新颖培养基,以28℃、200rpm摇床振荡。
3)怡莱霉素e产量检测
取25ml所获发酵液,真空抽滤,并用100ml自来水冲洗并滤干。将上清液用乙酸乙酯萃取三次之后在45℃减压蒸干,然后用甲醇溶出后将甲醇转移至ep管中,12000rpm离心,取上清至ep管中,超声溶解后用0.22μm滤膜过滤,保存于4℃冰箱供hplc检测。过滤后的菌体干燥后,在研钵中研磨,用甲醇提取后在45℃将溶剂减压蒸干,然后用甲醇溶出后将甲醇转移至ep管中,12000rpm离心,取上清至ep管中,超声溶解后用0.22μm滤膜过滤,保存于4℃冰箱供hplc检测。综上,用高效液相色谱法测定怡莱霉素e的含量,进而通过标准曲线换算成所述上清液及菌体中怡莱霉素e的实际含量。
最后测得目标产物怡莱霉素e的产量为46.8mg/l,生物量为26.6g/l。
实施例2
1)发酵培养基的配置
准确称取葡萄糖120g、酵母浸膏20g、玉米浆2.4g、氯化钠6g、硝酸钠9.6g、硫酸铵6.4g、磷酸二氢钾0.24g、以去离子水溶解,并定容至1000ml,用3m氢氧化钠溶液调节ph至7.2-7.4后,加入9.6g碳酸钙。接着,分装至摇瓶后于121℃灭菌20分钟。
2)发酵操作过程
同实施例1的发酵操作过程。
3)怡莱霉素e产量检测
同实施例1的怡莱霉素e产量检测。
最后测得目标产物怡莱霉素e的产量为121.55mg/l,生物量为27.6g/l。
实施例3
1)发酵培养基的配置:
准确称取可溶性淀粉120g/l、黄豆粉20g/l、玉米浆2.4g/l、氯化钠6g/l、硝酸钠9.6g/l、硫酸铵6.4g/l、磷酸二氢钾0.24g/l,以去离子水溶解,并定容至1000ml,用3m氢氧化钠溶液调节ph至7.2-7.4后,加入9.6g碳酸钙。接着,分装至摇瓶后于121℃灭菌20分钟。
2)发酵操作过程
同实施例1的发酵操作过程。
3)怡莱霉素e产量检测
同实施例1的怡莱霉素e产量检测。
最后测得目标产物怡莱霉素e的产量为54.05mg/l,生物量为23.5g/l。
实施例4
1)发酵培养基的配置
准确称取可溶性淀粉120g、酵母浸膏20g、玉米浆2.4g、氯化钠6g、硝酸钠9.6g、硫酸铵6.4g、磷酸二氢钾0.24g,以去离子水溶解,并定容至1000ml,用3m氢氧化钠溶液调节ph至7.2-7.4后,加入9.6g碳酸钙。接着,分装至摇瓶后于121℃灭菌20分钟。
2)发酵操作过程
同实施例1的发酵操作过程。
3)怡莱霉素e产量检测
同实施例1的怡莱霉素e产量检测。
最后测得目标产物怡莱霉素e的产量为202.96mg/l,生物量为25.7g/l。
实施例5
1)发酵培养基的配置
准确称取可溶性淀粉120g、酵母浸膏20g、玉米浆1.6g、氯化钠4g、硝酸钠6.4g、硫酸铵9.6g、磷酸二氢钾0.24g,以去离子水溶解,并定容至1000ml,用3m氢氧化钠溶液调节ph至7.2-7.4后,加入9.6g碳酸钙。接着,分装至摇瓶后于121℃灭菌20分钟。
2)发酵操作过程
同实施例1的发酵操作过程。
3)怡莱霉素e产量检测
同实施例1的怡莱霉素e产量检测。
最后测得目标产物怡莱霉素e的产量为199.77mg/l,生物量为26.6g/l。
实施例6
1)发酵培养基的配置
准确称取可溶性淀粉120g、酵母浸膏20g、玉米浆2.4g、氯化钠4g、硝酸钠9.6g、硫酸铵9.6g、磷酸二氢钾0.16g,以去离子水溶解,并定容至1000ml,用3m氢氧化钠溶液调节ph至7.2-7.4后,加入6.4g碳酸钙。接着,分装至摇瓶后于121℃灭菌20分钟。
2)发酵操作过程
同实施例1的发酵操作过程。
3)怡莱霉素e产量检测
同实施例1的怡莱霉素e产量检测。
最后测得目标产物怡莱霉素e的产量为133.93mg/l,生物量为28.6g/l。
对比例1初始发酵工艺
1)发酵培养基的配置
准确称取可溶性淀粉3g、蛋白胨3g、黄豆粉1g、甘油3g、海盐6g,以去离子水溶解,并定容至1000ml,用3m氢氧化钠溶液调节ph至7.2-7.4后,加入0.4g碳酸钙。
2)发酵操作过程
同实施例1的发酵操作过程。
3)怡莱霉素e产量检测
同实施例1的怡莱霉素e产量检测。
最后测得目标产物怡莱霉素e的产量为15.9mg/l,生物量为13.3g/l。
实施例1-6以及对比例1的结果如图1所示。
结果显示,对于筛选得的优选培养基(实施例1),分别进行碳氮源优化(实例3和2),获得了本发明所述最优培养基配方(实施例4),使得怡莱霉素e的产量达到202.96mg/l,同时实施例5和6中的怡莱霉素产量也分别达到了199.77mg/l及133.93mg/l,与对照组(对照组实例)相比,使用本发明的培养基发酵培养深海链霉菌scsiozh16△ilar生产怡莱霉素e,怡莱霉素e的产量得到显著提高。
以上所述仅是本发明的实施方式的举例,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!