一种减毒铜绿假单胞菌的构建方法及应用
本发明涉及基因工程技术领域,更具体地说是涉及一种减毒铜绿假单胞菌的构建方法及应用。
背景技术:
铜绿假单胞菌(pseudomonasaeruginosa)为革兰氏阴性细菌,普遍存在于环境中,在自然界(土壤、水和空气)、植物表面、人体的皮肤和呼吸道中均有分布,可引发免疫力低下人群(住院病人)的机会性感染,尤其易于感染肺部,如呼吸机相关性肺炎(ventilatorassociatedpneumonia,vap)。
铜绿假单胞菌的三型蛋白分泌系统(type3secretionsystem,t3ss)是其表面形成的一种针状复合物结构,可穿透真核细胞的细胞膜从而将细菌的毒素蛋白(exos、exot、exoy、ndk)直接注入到靶细胞内,避免免疫吞噬等作用以利于自身生存,是自然界存在的一种高效的蛋白质注入机制。近年来发现,敲除铜绿假单胞菌的muri基因可获得d-谷氨酸(d-glu)营养缺陷型菌株,由于人及哺乳动物体内无d-glu,因此可用以制备抗铜绿假单胞菌感染疫苗,但并未见有人将其制备成疫苗的报道。
因此,如何提供一种可以用于疫苗制备的铜绿假单胞菌是本领域技术人员亟需解决的问题。
技术实现要素:
有鉴于此,本发明提供了一种减毒铜绿假单胞菌的构建方法,该方法构建得到的铜绿假单胞菌毒性较弱,可用于制备疫苗。
为了实现上述目的,本发明采用如下技术方案:
一种减毒铜绿假单胞菌的构建方法,其特征在于,过程包括:将铜绿假单胞菌pak-jδsty菌株基因组中ndk基因敲除和三型蛋白分泌系统t3ss抑制性基因popn敲除,获得减毒铜绿假单胞菌apa-δ5;其中,野生型铜绿假单胞菌pak-jδsty保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号,保藏编号为cgmccno.21358,保藏日期为2020年12月14日;分类学命名为铜绿假单胞菌pseudomonasaeruginosa。
作为本发明优选的技术方案,构建方法还包括:在获得减毒铜绿假单胞菌apa-δ5的基础上,敲除apa-δ5中的muri基因,获得减毒铜绿假单胞菌apa-δ6。
以上技术方案达到的技术效果是:ndk基因为铜绿假单胞菌pak-jδsty菌株分泌毒性因子的基因,将这几种基因敲除,可以大大减弱铜绿假单胞菌pak菌株的毒性,从而降低其对宿主细胞的毒性,popn基因是抑制三型蛋白分泌的,将其敲除后,可以增强t3ss的抗原提呈作用,因此,apa-δ5菌株适用于做载体菌株,用于提呈各种细菌、病毒或肿瘤细胞的蛋白质抗原,进而使其抗原进入宿主细胞,激活抗原特异性的免疫细胞应答,达到预防细菌或病毒的目的;同理,减毒铜绿假单胞菌apa-δ6也是如此,不同的是,其细胞内还敲除了muri基因,该基因为谷氨酸消旋酶基因,将该基因消除,可获得营养缺陷型减毒铜绿假单胞菌,该菌对哺乳动物细胞无细胞毒性,在不添加外源的d-谷氨酸时无繁殖能力,所以,apa-δ6菌株在哺乳动物体内无繁殖能力,apa-δ5菌株在哺乳动物体内有繁殖能力,相对来说,apa-δ6菌株较apa-δ5菌株安全系数更高,致敏性更低。
一种减毒铜绿假单胞菌,由上述方法构建得到,命名为apa-δ5。
一种减毒铜绿假单胞菌,由上述方法构建得到,命名为apa-δ6。
减毒铜绿假单胞菌apa-δ5和减毒铜绿假单胞菌apa-δ6菌株可对多种细胞类型进行抗原蛋白的细胞内递呈,包括肿瘤细胞、上皮细胞、人外周血的单核细胞、中性粒细胞、干细胞。
一种减毒铜绿假单胞菌在制备疫苗中的应用。
一种减毒铜绿假单胞菌在制备疫苗中的应用,具体的应用过程包括:将蛋白质抗原与t3ss分泌信号肽exos54融合表达于apa-δ5或apa-δ6中,获得减毒铜绿假单胞菌载体疫苗。
作为本发明优选的技术方案,先将所述蛋白质抗原编码基因克隆到pexos54质粒中,得到抗原表达载体,再将抗原表达载体导入apa-δ5或apa-δ6中,获得减毒铜绿假单胞菌载体疫苗。
以上技术方案达到的技术效果是:减毒-活的重组菌株可增加疫苗的抗原性,具有非特异性免疫训练作用,可提高疫苗保护效力,该疫苗可通过鼻内吸入途径进行肺部给药,制备抗肺部感染疫苗;进一步来说,t3ss系统可通过提呈新型冠状病毒sars-cov-2抗原,制备covid-19疫苗。
经由上述的技术方案可知,与现有技术相比,本发明达到的技术效果是:
1)本发明利用减毒铜绿假单胞菌t3ss作为一种蛋白质抗原呈递的工具,既能够简单、高效地将蛋白质抗原递呈给宿主细胞,又可通过营养限制被机体快速清除,是一种安全、高效的疫苗递呈载体;
2)本发明还涉及利用减毒重组菌株肺部给药增强天然免疫,以制备抗肺部感染疫苗。一方面抗原直接注入抗原递呈细胞,可激活抗原特异性的cd8t细胞应答;同时重组菌株本身还可激活cd4t细胞反应,并产生“训练免疫”效应,提高疫苗的效力,无需加强免疫和使用佐剂;
3)重组菌株在抗covid-19方面具有独特优势:①该菌天然适于定殖于肺部,并可诱导宿主的抗病毒反应。②pa广泛存在于环境当中,是引发医院内感染的重要病原体,呼吸机是新冠肺炎治疗中必不可少的医疗器材,呼吸机相关性肺炎(vap)经常是导致重症患者治疗失败的原因之一,因此pa疫苗还可预防vap的发生,而且,该疫苗制作成本低廉,可快速实现大规模生产。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
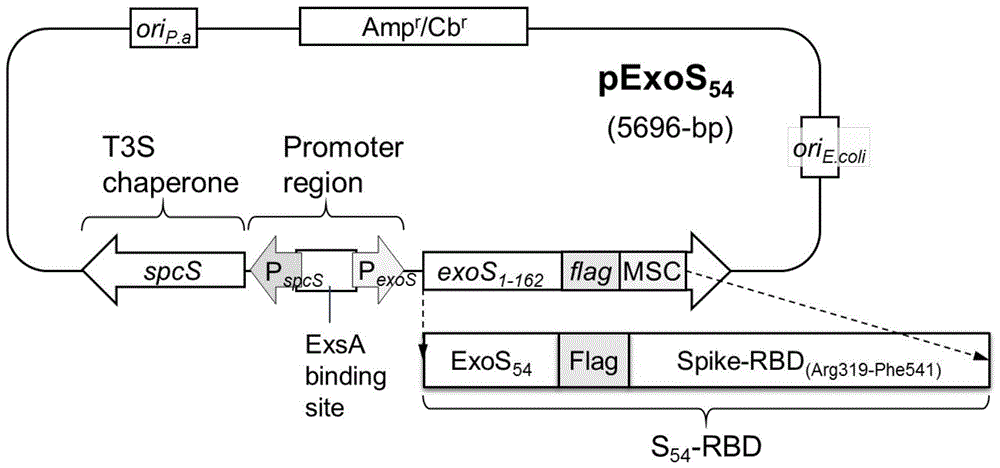
图1附图为本发明提供的新型冠状病毒抗原rbd表达载体构建图;
图2附图为抗原递呈菌株δ5-rbd和δ6-rbd的小鼠体内安全性评价表征图,其中,a为小鼠存活率示意图;b为小鼠各器官活菌数示意图,鼻内注射后12、24、72小时的肺部残留细菌计数(左)及脾脏细菌计数(右);
图3附图为rbd抗原细胞内递呈westernblot检测图,其中,hl-60为中性粒细胞前体,thp-1为巨噬细胞前体,a549为肺上皮细胞;
图4附图为疫苗接种后血清抗体免疫示意图;
图5附图为疫苗接种后中和抗体免疫示意图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明使用的菌种、质粒和病毒
野生型铜绿假单胞菌pak-jδsty和t3ss缺陷株δexsa为实验室保存;其中,野生型铜绿假单胞菌pak-jδsty保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号,保藏编号为cgmccno.21358,保藏日期为2020年12月14日;分类学命名为铜绿假单胞菌pseudomonasaeruginosa;铜绿假单胞菌减毒株apa-δ5(pak-jδsty背景下敲除染色体上的ndk和popn基因)和apa-δ6(δ5背景下敲除muri基因)为本研究构建;大肠杆菌dh5α用于分子克隆,本实验室保存;大肠杆菌s17-1/λpir用于接合转移,本实验室保存;基因敲除载体pex18tc,融合蛋白表达载体pexos54,本实验室保存;sars-cov-2假病毒(基于慢病毒包装的假病毒颗粒,携带荧光素酶报告基因)购自金斯瑞生物科技公司。
本发明使用的哺乳动物细胞
人肺上皮细胞a549,人单核细胞thp-1和人早幼粒白血病细胞hl-60均为本实验室保存,细胞培养于含10%fbs的rpmi-1640细胞培养基(gibco);hek293/ace2细胞(过表达sars-cov-2细胞受体ace2)购自金斯瑞生物科技公司,培养于dmem+10%fbs培养基;细胞均培养在37℃,,5%co2细胞培养箱中。
本发明使用的实验动物
雌性c57bl/6小鼠(6-8周大小)购自北京维通利华实验动物技术有限公司,实验动物使用许可证编号syxk(津)2019-0003,spf环境12h光照-黑暗循环,21℃,30%相对湿度下饲养。所有的程序和实验均遵循国际接受的实验动物饲养使用标准。
本发明使用的试剂
dnamarker、限制性内切酶、taqdna聚合酶、dntp来自于takara公司;t4dna连接酶(promega)、酵母提取物物(yeastextract)和胰蛋白胨(tryptone)购自英国oxoid公司;蔗糖(sucrose)和二甲基亚砜(dmso)为美国sigma公司产品;琼脂糖购自biowest;琼脂粉(bacto-agar)、d-谷氨酸、四环素和卡那霉素购自自生工生物工程(上海)股份有限公司;基因组提取试剂盒(easypuregenomicdnaextractionkit)为全氏金公司产品;质粒小提试剂盒(plasmidminiprepkit)为美国axygen公司产品;dna纯化试剂盒(dnaclean&concentrator)和dna胶回收试剂盒(zymocleangeldnarecoverykit)为美国zymoresearch公司产品;anti-flag抗体和酶标二抗为sigma公司产品;tmb双组分显色液(elisa)购自索莱宝;sars-cov-2spikeprotein(s1subunit,40591-v08h)购自义翘神州;sars-cov-2假病毒中和检测试剂盒(wt)_lucreporter(sc2087a)购自金斯瑞。
实施例1spike-rbd抗原递呈菌株的构建
以铜绿假单胞菌pak-j为背景菌株,利用同源重组的方法无痕删除exos,exot,exoy,ndk,popn基因构建减毒菌株apa-δ5;在apa-δ5基础上删除muri基因,构建d-谷氨酸营养缺陷型减毒菌株apa-δ6,具体如下:
基因敲除质粒的构建
以pak-jδsty菌株基因组dna为模板,pcr扩增待敲除基因上下游1-kb左右的同源臂片段。在1.0%的琼脂糖凝胶中电泳检测pcr产物的大小及大致浓度,并切胶回收同源臂dna片段。取上述pcr产物,经限制性内切酶,克隆到具有相应粘性末端的pex18tc质粒上,连接产物转化入dh5α感受态细胞,涂布在含10μg/ml四环素(tc)的lb平板上筛选转化子,pcr和质粒酶切对转化子进行鉴定,得到基因敲除质粒。
基因敲除菌株的构建
提取保存在大肠杆菌dh5a中的基因敲除质粒,使用化学转化的方法将该质粒转化到大肠杆菌s17感受态细胞中。运用接合转移的方法将s17中的基因敲除质粒转入到pak-jδsty菌株中,对基因组中的目标基因进行敲除。以ndk为例具体操作如下(其它基因的敲除方法同ndk):
挑取新鲜划线培养的s17/pex18tc-ndkdeletion单菌落,接种于2ml含有5μg/mltc的新鲜无菌l-broth培养基中,37℃,180rpm振荡过夜培养;同时,挑取新鲜划线培养的pak-jδsty单菌落,接种于2ml新鲜无菌l-broth培养基中,42℃,180rpm振荡过夜培养;次日分别以1:50的比例,转接过夜培养的s17/pex18tc-ndkdeletion和pak-jδsty到5ml含有tc5或不含有抗生素的l-broth培养基中,s17/pex18tc-ndkdeletion于37℃,180rpm振荡培养至对数期(od600=0.6-0.8),pak-jδsty于42℃振荡培养到对数期(od600=0.8-1.0);使用紫外分光光度计,测定并记录s17/pex18tc-ndkdeletion和pak-jδsty的od600的数值;分别将s17/pex18tc-ndkdeletion和pak-jδsty培养液,使用1.5ml离心管于16000g离心1min,收集菌体,弃去上清。加入1mll-broth,使用移液器吹散,于16000g离心1min,弃去上清,收集菌体,重复一次,然后将菌体重悬到1mll-broth中;将s17/pex18tc-ndkdeletion和pak-jδsty以细菌个数比为10:1-5:1的比例混合,调整总菌量少于3×109cfu;连接好膜结合用真空抽滤装置,向装置中加满75%的酒精杀菌,待所有酒精过滤到真空装置中的锥形瓶后,再次向装置中加满75%的酒精洗涤一次。最后向装置中加满无菌水洗涤两次,待无菌水全部真空过滤到锥形瓶后,用无菌镊子取一张0.45μm孔径的无菌的硝酸纤维素膜,小心地置于该装置的装膜位置,重新安装好真空抽滤装置;使用移液器将混合菌液转移到真空过滤装置中,真空过滤菌液到锥形瓶中,使混合好的s17/pex18tc-ndkdeletion和pak-jδsty存留在硝酸纤维素膜上;用无菌镊子小心地将硝酸纤维素膜存有混合菌的一面朝上放于nutrientagar培养基平板上,将培养皿正置于37℃培养箱,静置培养7-16h;使用无菌镊子将硝酸纤维素膜小心地转移到一个11mm的无菌试管中,向试管中加入1mll-broth,漩涡振荡洗涤硝酸纤维素膜;将硝酸纤维素膜的洗脱培养基转移到1.5ml的无菌离心管中,使用无菌的l-broth系列稀释到10-2;分别从原始洗下的菌液,稀释到10-1和10-2的离心管中各取100μl涂布于含有适当抗生素的平板上(50μg/mltc,25μg/ml卡那霉素kan),于37℃培养箱静置培养24-48h;挑取抗生素平板上长出的可能的单交换的单菌落,接种到1ml无抗生素的lb培养基中,37℃,180rpm振荡培养8h左右,使其浓度达到109cfu/ml;使用新鲜无菌无抗生素的lb培养基,以1:10的比例,系列稀释步骤12中的培养液到细菌细胞浓度为104cfu/ml;分别从104,105,106cfu/ml离心管中各取100μl菌液,涂布到包含和不包含终浓度为7.5%蔗糖的l-agar培养基平板上(注:muri基因敲除时需添加10mmd-glu),于37℃培养箱静置过夜培养;次日比较含有蔗糖的培养基平皿和不含有蔗糖的培养基平皿上的菌落数,含有蔗糖的平皿上出现的菌落数应该明显少于不含有蔗糖平板上的菌落数(注:muri基因敲除时需添加10mmd-glu)。从含有7.5%蔗糖的培养基平皿上挑选单菌落,进一步于终浓度为7.5%蔗糖的l-agar培养基平皿上纯化;将筛选到的双交换菌落,分别以单交换菌落和野生型菌株的培养液为对照,进行菌液pcr验证和抗生素抗性检测。
spike-rbd抗原递呈菌株的构建
pcr扩增sars-cov-2病毒spike蛋白(yp_009724390.1)的受体结合结构域rbd(r319—f541)基因,克隆到铜绿假单胞菌t3ss诱导表达载体pexos54中(图1),分别转化入减毒菌株apa-δ5和apa-δ6,构建成spike-rbd抗原递呈菌株δ5-rbd和δ6-rbd。该菌株在接触到靶细胞时其t3ss被激活,细菌大量表达s54-rbd重组蛋白,并通过t3ss注入到靶细胞内。
实施例2抗原递呈菌株的体内安全性评价
采用小鼠急性肺炎模型,对抗原递呈菌株δ5-rbd和δ6-rbd进行体内安全性评价。分别使用1×107、1×108、1×109cfu的菌量滴鼻感染c57bl/6小鼠,每组10只小鼠,记录存活率。如图2a所示,1×107cfu的δ5-rbd和δ6-rbd感染肺部不会造成小鼠死亡,且感染后小鼠食量和精神状态均无异常,绝大多数小鼠对1×108cfu的δ6-rbd耐受性良好。1×109cfu的菌量滴鼻感染小鼠,于感染后12、24、72小时取肺和脾组织,用co2窒息处死小鼠,迅速解剖,打开腹腔和胸腔,剪下整个肺和脾,放到于无菌的玻璃试管中,迅速置于冰上;向玻璃试管中加入1ml的1%的蛋白胨溶液,利用手提式调整匀浆仪进行肺组织匀浆。将匀浆刀头插入玻璃试管的液体中(不能接触试管底),匀浆5s,将玻璃试管再置于冰上,间歇10s后,重复匀浆过程4次;取小量体积的匀浆液,进行梯度稀释,在lb平板上滴板计数,如图2b所示;
与δ5-rbd相比,d-glu营养限制型δ6-rbd活菌数显著下降,在感染第3天时基本无残留。
实施例3细胞内抗原递呈效果评价
分别培养hl-60、thp-1和a549细胞至70~80%细胞密度,以moi=100,即1×108cfu/ml抗原递送菌株δ5-rbd和δ6-rbd感染细胞3个小时;同时,以携带pexos54-rbd表达载体的δexsa菌株作为细菌对照相同条件感染细胞。洗去细菌收集细胞,以β-actin作为细胞内参,利用抗flag标签的westernblotting检测细胞内rbd抗原。如图3所示,δ5-rbd和δ6-rbd均能有效地将rbd重组蛋白递送到免疫细胞hl-60、thp-1和肺上皮细胞a549中,说明其作为抗原递呈方法的可行性。
实施例4抗原递呈后的体液免疫检测
动物免疫
将小鼠随机分为四组:δ5-rbd疫苗组、δ6-rbd疫苗组、空载体组(apa空菌)和生理盐水对照组,每组5只小鼠;以5×107cfu菌量进行鼻内接种,间隔两周一次,末次免疫后一周,摘眼球采血,室温静置2-4小时后,5000rpm离心5分钟,收集血清;取5-ml无菌试管12支,用1×pbs稀释小鼠血清,待用。用0.01m碳酸缓冲液(ph9.6)配制1μg/ml重组spike抗原稀释液,包被96孔酶标板,于37℃保温1小时后置于湿盒中4℃过夜。取出酶标板,甩干各孔中包被液,将酶标板倒扣在吸水纸上叩干,每孔各加入用0.01mpbst(ph7.2)稀释的1%bsa300μl,37℃孵育1小时;甩干各孔中封闭液,每孔加入0.01mpbst(ph7.2)300μl,置于洗板机上3-5分钟,酶标板倒扣在吸水纸上拍干,重复洗涤操作3-5次;在96孔酶标板各列孔加入稀释好的血清100μl,12列最后4孔留作对照,h12不加任何血清留作空白对照、g12和f12孔加入未免疫动物血清作阴性对照,e12孔加入免疫动物未稀释血清做阳性对照,将酶标板平放在湿盒中37℃孵育1小时;洗板操作3-5次。加入酶标二抗hrp-羊抗鼠igg100μl,将酶标板平放在湿盒中37℃孵育1小时;洗板操作3-5次。加入tmb单组分显色液100μl,在室温(15-25℃)或37℃下避光温育10-30分钟,直至显色至预期深浅。加入100μl1mh2so4终止反应,孔中反应液由蓝色变为黄色。终止反应后30分钟内,在450nm波长下以空白孔(不加血清)调零,读取od值,如图4所示;
中和抗体检测
取血清样品和阳性对照,按照实验设计稀释样品;37℃水浴快速轻柔解冻sars-cov-2假病毒后置于冰上;将样品、阳性对照和阴性对照与假病毒在96孔板混合,设置空白对照孔,室温孵育1小时;在病毒孵育过程中,复苏hek293/ace2细胞,离心后用完全培养基重悬,调整细胞密度至600,000个细胞/ml后放入细胞培养箱待用;病毒孵育完成后,充分混匀hek293/ace2细胞,每个实验孔加入50μl细胞悬液,将96孔板放入37℃,5%co2细胞培养箱孵育24小时;孵育结束后,取出96孔板,用移液器小心吸弃培养基;加入50μl的荧光素酶显色液,室温孵育3-5分钟,酶标仪读取读数;如图5所示。
可知,相对于生理盐水组(sham)和空载菌组(vehicle),重组菌δ5-rbd和δ6-rbd均能刺激小鼠产生针对病毒s蛋白的抗体(图4)。同时,利用假病毒感染模型对血清中的中和抗体进行检测,如图5,δ5-rbd和δ6-rbd均能刺激小鼠产生中和抗体,阻止假病毒侵染hek293/ace2细胞,而空载菌组无中和抗体产生。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对于实施例公开的装置而言,由于其与实施例公开的方法相对应,所以描述的比较简单,相关之处参见方法部分说明即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!