一种CD22纳米抗体的筛选方法与流程
本发明涉及生物医药技术领域,具体涉及一种cd22纳米抗体的筛选方法。
背景技术:
1975年杂交瘤技术的问世拉开了单克隆抗体用于人类疾病诊断与治疗的序幕,然而单抗体积大、稳定性差,并具有免疫源性,使其在临床上的应用受到一定限制。20世纪80年代以后,新型基因工程抗体不断出现,包括嵌合抗体、人源化抗体、全人源化抗体和小型化基因工程抗体,单域抗体是一种小型化基因工程抗体,但是它在稳定性、表达产量、蛋白酶抵抗性和聚合性方面仍有待改进。1993年hamers-casterman报道了在骆驼科动物体内发现了一种天然缺失轻链的抗体,即重链抗体,其抗原结合位点仅由重链的可变区(vhh)构成,成为vhh抗体,是目前可以得到的具有完整功能的最小抗体分子片段。一般来说,scfv相对分子质量约为30kd,而vhh抗体的相对分子质量为15kd,仅为常规抗体的1/10,其分子高度4.8nm,直径为2.2nm,故又成为纳米抗体。与常规抗体相比,纳米抗体具有诸多优势:1)分子量小,可穿透血脑屏障,较易作用于病灶区;2)在原核或者真核系统中可高表达;3)特异性强、亲和力高;4)高耐热性和化学稳定性;5)对人的免疫原性弱。
cd22是b细胞抑制性共受体之一,表达于正常的前b细胞表面,而在浆细胞表面的表达则明显减少。cd22在各种非霍奇金淋巴瘤(nhl)中均有表达。抗cd22抗体与cd22结合后能够迅速通过内吞作用进入细胞,为特异性靶向肿瘤细胞药物提供了很好的运输载体。相比其他潜在靶点,cd22是更理想的适合通过抗体-药物偶联物(adc)治疗恶性b细胞淋巴瘤的靶点。目前以cd22为靶点研发的adc在临床试验阶段均显示出一定疗效,其所具有的高效、安全和药代动力学特征使其有望成为靶向cd22治疗nhl的新药。
因此构建筛选抗原结合特异性好,稳定好的cd22纳米抗体对以cd22为靶点的药物的研发,相关肿瘤疾病的预防、诊断和治疗具有重要的前景意义。
技术实现要素:
为了克服现有技术的缺陷,本发明的目的之一在于提供一种cd22纳米抗体的筛选方法,筛选出的cd22纳米抗体对靶向抗原cd22具有高的结合特异性、稳定性和安全性。
为了实现上述目的,本发明采用的技术方案如下:
一种cd22纳米抗体的筛选方法,包括以下操作步骤:
1)细胞免疫:用人cd22重组蛋白对羊驼进行冲击免疫,检测羊驼血清的免疫效价符合要求后,采集冲击免疫后的羊驼的外周血;
2)细胞分选:从步骤1)采用的外周血分离pbmc细胞,采用cd22重组蛋白孵育pbmc细胞,流式细胞分选双阳性单个细胞;
3)单域抗体克隆及测序:孵育步骤2)分选的细胞,提取rna,测序获得单域抗体编码区序列;
4)单域抗体筛选:根据步骤3)测序获得的序列信息进行基因合成,亚克隆至带有fc标签的单域抗体表达载体中,并表达单域抗体;筛选与靶蛋白cd22具有高结合力和亲和力的单域抗体,纯化单域抗体,即得cd22纳米抗体;
其中筛选的单域抗体的氨基酸序列如seqno:9所示,编码该单域抗体的核苷酸序列如seqno:8所示。
可选的,细胞免疫前还包括制备人cd22重组蛋白:人工基因合成人cd22胞外段氨基酸序列,构建cd22重组蛋白真核表达载体,转染cho-s细胞表达cd22重组蛋白,纯化获得人cd22重组蛋白;
进一步的,步骤1)中免疫效价的要求为elisa免疫效价达到1:160000以上。
更进一步的,步骤1)中用人cd22重组蛋白对羊驼进行冲击免疫前已对羊驼进行了四次免疫。
在本发明的一些实施例中,步骤2)中使用biotin偶联的cd22重组蛋白孵育pbmc细胞,同时孵育apc-streptavidn以及fitc-anti-camelidvhh抗体,流式细胞分选fitc和apc双阳性的单个细胞。
在本发明的一些实施例中,步骤3)中提取rna后还包括逆转录为cdna,使用单域抗体扩增引物进行pcr,产物经琼脂糖凝胶电泳分离,对分离的400bp左右的pcr产物进行测序。
进一步的,步骤4)中表达单域抗体和筛选的具体方法为:将构建的单域抗体表达载体转染至293f细胞中表达单域抗体;对表达获得的单域抗体采用elisa及流式细胞验证候选单域抗体与靶蛋白的结合,从中挑选流式检测信号值最高的1个克隆,表达纯化抗体,即为cd22纳米抗体。
为了进一步降低cd22纳米抗体的免疫原性,还包括表面氨基酸替换的设计对步骤4)筛选的cd22纳米抗体进行人源化;其中筛选获得的人源化抗体的氨基酸替换设计为1e、37v、44g、45l、119q,其氨基酸序列如seqno:10所示;对应的编码相应的人源化抗体的核苷酸序列如seqno:12所示。
在本发明的另一个实施例中,筛选获得的人源化抗体的氨基酸设计为1e、37v、44g、45l、119q、47w,其氨基酸序列如seqno:11所示;对应的编码相应的人源化抗体的核苷酸序列如seqno:13所示
在本发明的具体实施例方式中,步骤4)筛选的cd22纳米抗体进行人源化的具体方法包括以下操作步骤:
(a)人源化抗体设计及基因制备:
采用表面氨基酸替换的设计对筛选的cd22纳米抗体进行人源化,获得并合成人源化抗体序列后,构建人源化单域抗体表达载体;对上述制备的人源化单域抗体表达载体进行质粒大量抽提,制备转染级别的质粒。
(b)人源化抗体表达及纯化:
将步骤(a)制备的转染级别的质粒通过瞬时转染至293f细胞中,表达并纯化人源化cd22纳米抗体;
(c)人源化抗体筛选:
对步骤(b)制备的人源化抗体的结合特异性及亲和力检测,亲和力达到10-9m,即得人源化抗体。
本发明cd22纳米抗体筛选过程中,采用流式分选结合亲和力检测的方式,筛选出具有高的结合特异性的cd22纳米抗体,并且通过特定核苷酸突变修饰的人源化处理,提高cd22纳米抗体的稳定性和安全性。采用本发明筛选的cd22纳米抗体可以作为药物活性成分,或者靶向药物的联合结构,或者免疫效应细胞的靶向结合区域序列结构,或者诊断试剂成分,制备获得能够预防和治疗肿瘤的药物组合物,或者能够诊断肿瘤的诊断试剂。
附图说明
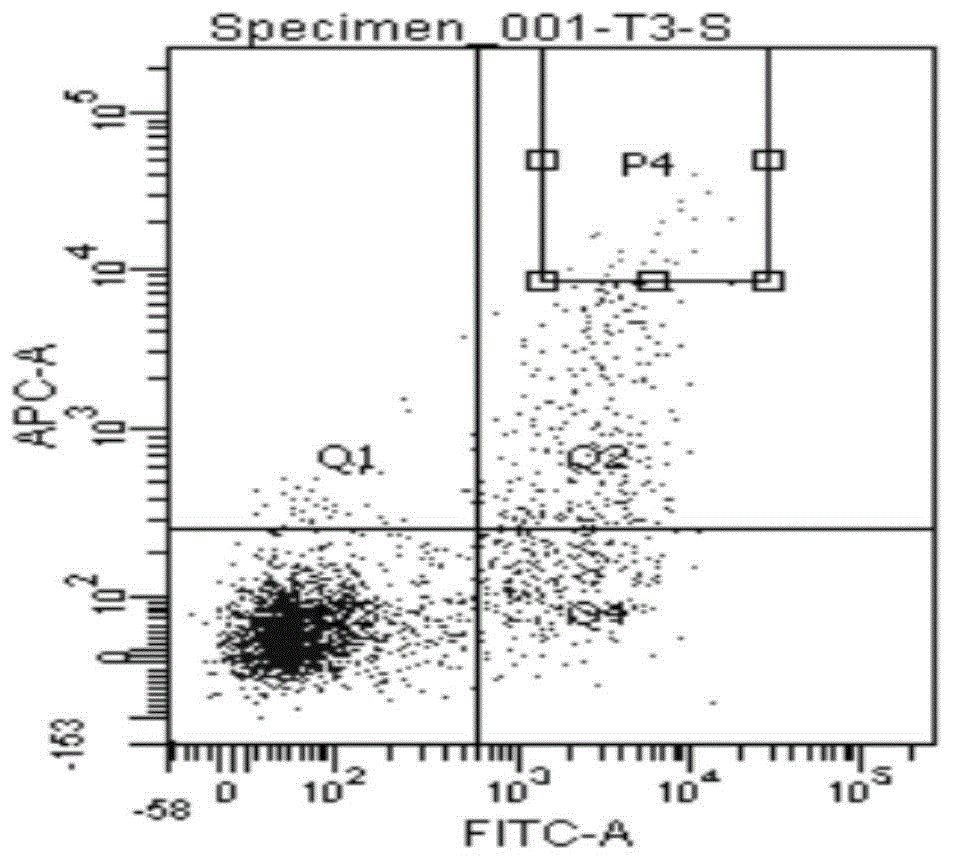
图1为实施例1中流式分选fitc和apc双阳性的单个细胞检测结果示意图;
图2为实施例1中流式检测结果示意图;其中cho-k1为不表达cd22蛋白的原始细胞,cho-k1-cd22为表达cd22蛋白的细胞;
图3为实施例2中不同人源化cd22纳米抗体的流式检测结果对比图;其中h10-2-1为氨基酸替换设计为1e、37v、44g、45l、119q的人源化cd22纳米抗体;h10-2-2为氨基酸替换设计为1e、34m、35s、37v、44g、45l、47w、119q的人源化cd22纳米抗体;h10-2-3为氨基酸替换设计为1e、34m、35s、37v、44g、45l、47w、50a、119q的人源化cd22纳米抗体;h10-2-4为氨基酸替换设计为1e、37v、44g、45l、119q、47w的人源化cd22纳米抗体;h10抗体为未做人源化处理的原始cd22纳米抗体;
图4为未人源化处理的原始cd22纳米抗体h10与靶蛋白亲和力检测结果示意图;
图5为人源化cd22纳米抗体h10-2-1与靶蛋白亲和力检测结果示意图;其中h10-2-1为氨基酸替换设计为1e、37v、44g、45l、119q的人源化cd22纳米抗体;
图6为人源化cd22纳米抗体h10-2-4与靶蛋白亲和力检测结果示意图;其中h10-2-4为氨基酸替换设计为1e、37v、44g、45l、119q、47w的人源化cd22纳米抗体。
具体实施方式
下面结合具体实施例对本发明做进一步的详细说明。除特殊说明的之外,各实施例及试验例中所用的设备和试剂均可从商业途径得到。
实施例1cd22单域抗体筛选
1.1人cd22重组蛋白制备:
1)cd22重组蛋白序列构建:
从ncbi及uniprot数据库获取到humancd22胞外段氨基酸序列后,进行人工基因合成,构建真核表达载体;
2)22序列载体转染表达
将上述构建的cd22序列的真核表达载体转染cho-s细胞并表达cd22重组蛋白;
3)鉴定
将产物通过亲和柱纯化,并纯化后进行蛋白活性鉴定。
1.2单细胞分选
1)羊驼免疫
用上述制备的人cd22重组蛋白对前期经过四次免疫的羊驼进行冲击免疫;
2)采血及elisa分析
冲击免疫10天后,采集部分外周血,分离得到血清,鉴定cd22免疫羊驼效价检测;若elisa免疫效价达到1:160000以上,进行外周血大量采集;
3)从上述步骤2)免疫过的羊驼采集50ml外周血,采用淋巴细胞分离液分离pbmc细胞;
4)使用biotin偶联的cd22重组蛋白孵育pbmc细胞,冰上孵育1小时,使用预冷的pbs清洗3次后,同时孵育apc-streptavidn以及fitc-anti-camelidvhh抗体,冰上孵育1小时,使用预冷的pbs清洗3次,采用流式分选fitc和apc双阳性的单个细胞至96孔板中(预先加入裂解液),如图1所示;共分离2~3块96孔板,用于单域抗体的克隆。
1.3驼源单域抗体制备
1)单域抗体克隆及测序
克隆上述1.2步骤4)培养后的96孔板,从每孔中的单个b细胞提取rna,逆转为cdna后,使用单域抗体扩增引物进行pcr,产物经琼脂糖凝胶电泳分离后,分离400bp左右的pcr产物进行sanger测序,获取单域抗体编码区序列信息。将测序获得的序列进行基因合成,亚克隆至带有fc标签的单域抗体表达载体中;
2)单域抗体表达载体构建
根据上述获取的单域抗体编码区序列信息,对所得的所有单域抗体序列进行比对分析,从不同的lineage中选择30个候选抗体序列(亲和力范围介于10-8~10-9m),对其基因合成;并构建在带有fc标签的单域抗体表达载体中;
3)单域抗体表达验证
将上述构建的单域抗体表达载体转染至293f细胞中,从上清中纯化单域抗体,将cd22抗原包被至96孔板上,采用elisa及流式细胞验证候选单域抗体与靶蛋白的结合;根据facs及elisa结果,从中挑选流式检测信号值最高(亲和力10-9m))的1个克隆(如图2所示),表达纯化抗体。
筛选的单域抗体的氨基酸序列如seqno:9所示,编码该单域抗体的核苷酸序列如seqno:8所示;其中重链互补决定区cdr1的氨基酸序列为gftldhyh,如seqno:1所示;cdr2的氨基酸序列为isnsggst,如seqno:2所示;cd3氨基酸序列为aagrwyydgsrycppgamdy,如seqno:3所示;重链可变区还包括四个框架区域,其中fr1氨基酸序列为avqlvesggglvqpggslrlscaas,如seqno:4所示;fr2氨基酸序列为igwfrqapgkeregvsc,如seqno:5所示;fr3氨基酸序列为nyadsvkgrftisrdnakntvylqmnslkpedtavyyc,如seqno:6所示;fr4氨基酸序列为wgkgtlvtvss,如seqno:7所示。
实施例2人源化单域抗体制备
2.1人源化纳米抗体设计及基因制备
采用表面氨基酸替换的设计对候选的单域抗体进行人源化,获得并合成人源化纳米抗体序列后,构建人源化单域抗体表达载体;对上述制备的表达载体进行质粒大量抽提,以此制备转染级别的质粒。
2.2人源化纳米抗体表达及纯化
以上述制备的人源化纳米抗体表达载体通过瞬时转染至293f细胞中,并使用proteina纯化重组抗体,浓缩后使用bca法定量。
2.3人源化纳米抗体的结合特异性及亲和力检测:
流式实验设计
实验组:纯化后的人源化纳米抗体与表达cd22的重组细胞株共孵育
阳性对照组:原始的未进行人源化处理的cd22纳米抗体和表达cd22的重组细胞株孵育
facs检测人源化纳米抗体与靶标蛋白的对比结合情况,若实验组与阳性对照组相比,流式细胞结合能力相当,则对其实验组进行克隆以便后续的亲和力检测(亲和力范围介于10-8~10-9m);
1)结合能力测定:
流式检测步骤如下:
(1)将靶细胞分为若干份,每份细胞的数量为5*10^5个细胞,使用100ulpbs重悬细胞,使用瞬时转染表达的人源化纳米抗体分别孵育靶细胞(表达cd22的重组细胞株),充分混匀后,室温孵育1小时,h10抗体为阳性对照,800xg室温离心5分钟,去掉含有抗体的上清,使用pbs洗涤细胞3次;
(2)加入1ulpe标记的anti-humanigg,充分混匀后,室温避光孵育30分钟;
(3)800xg室温离心5分钟,去掉含有二抗的上清,使用pbs洗涤细胞3次;
(4)使用500ulpbs重悬细胞,进行流式分析,如图3所示;其中h10-2-1为氨基酸替换设计为1e、37v、44g、45l、119q的人源化cd22纳米抗体、h10-2-2为氨基酸替换设计为1e、34m、35s、37v、44g、45l、47w、119q的人源化cd22纳米抗体、h10-2-3为氨基酸替换设计为1e、34m、35s、37v、44g、45l、47w、50a、119q的人源化cd22纳米抗体、h10-2-4为氨基酸替换设计为1e、37v、44g、45l、119q、47w的人源化cd22纳米抗体;h10抗体为未做人源化处理的原始cd22纳米抗体;
2)人源化单域抗体亲和力测定
根据上述流式结果,对抗体进行表达纯化,以及亲和力测定。采用biacoret200仪器,以原始驼源抗体作为对照,分别检测上述制备的阳性人源化纳米抗体与靶蛋白cd22的结合能力,目标亲和力要求在10-9m;
将人cd22重组蛋白使用10mmacetate缓冲液固定在cm5芯片上,以制备的阳性人源化纳米抗体及未人源化处理的原始cd22纳米抗体作为流动相,检测人源化前后抗体与靶蛋白cd22的结合能力;
使用未人源化处理的原始h10抗体作为阳性对照,根据流式检测结果,选择h10-2-1和h10-2-4进行抗体的表达纯化以及亲和力检测,结果如图4、图5和图6所示;
结果显示:h10抗体:ka=6.787×105m-1s-1;kd=2.270×10-4s-1;kd=3.345×10-10m;
h10-2-1抗体:结果:ka=1.184×105m-1s-1;kd=2.569×10-4s-1;kd=2.169×10-9m;
h10-2-4抗体:结果:ka=4.239×105m-1s-1;kd=2.950×10-4s-1;kd=6.958×10-10m;
最终得到有效的人源化cd22的抗体,氨基酸替换设计包括1e、37v、44g、45l、119q和/或47w,人源化纳米抗体的氨基酸序列如seqno:10或seqno:11所示;对应的编码相应的人源化纳米抗体的核苷酸序列如seqno:12或seqno:13所示。
由上述实施例1和实施例2的记载可知,本发明筛选获得的cd22纳米抗体对cd22蛋白具有高的结合特异性,并且通过创造性的选择特定的氨基酸突变修饰方案,对羊驼来源的cd22纳米抗体进行人源化处理,在不降低抗体的结合特异性的同时,提高抗体应用于人体的免疫排斥效应,提高其安全性和稳定性。并且通过实验验证也证明了以本发明抗体序列为抗原结合结构域构建的car-t细胞对表达cd22蛋白的肿瘤细胞具有高的裂解效果,能够产生靶向杀死肿瘤细胞的作用。那么结合上述实施例的验证结果应当可以理解的是,以本发明纳米抗体作为药物活性成分制备的药物可以应用于治疗以cd22为靶标的疾病,例如b细胞肿瘤或其他复发性肿瘤,比如治疗急性淋巴目细胞性白血病、慢性淋巴性白血病或非霍奇金氏淋巴瘤等。应当可以理解的是也可以制备诊断试剂。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
序列表
<110>河南创新生物科技研究院有限公司
<120>一种cd22纳米抗体的筛选方法
<160>13
<170>siposequencelisting1.0
<210>1
<211>8
<212>prt
<213>artificialsequence
<400>1
glyphethrleuasphistyrhis
15
<210>2
<211>8
<212>prt
<213>artificialsequence
<400>2
ileserasnserglyglyserthr
15
<210>3
<211>20
<212>prt
<213>artificialsequence
<400>3
alaalaglyargtrptyrtyraspglyserargtyrcysproprogly
151015
alametasptyr
20
<210>4
<211>25
<212>prt
<213>artificialsequence
<400>4
alavalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaser
2025
<210>5
<211>17
<212>prt
<213>artificialsequence
<400>5
ileglytrppheargglnalaproglylysgluarggluglyvalser
151015
cys
<210>6
<211>38
<212>prt
<213>artificialsequence
<400>6
asntyralaaspservallysglyargphethrileserargaspasn
151015
alalysasnthrvaltyrleuglnmetasnserleulysprogluasp
202530
thralavaltyrtyrcys
35
<210>7
<211>11
<212>prt
<213>artificialsequence
<400>7
trpglylysglythrleuvalthrvalserser
1510
<210>8
<211>381
<212>dna
<213>artificialsequence
<400>8
gctgtgcagctggtggagtctgggggaggcttggtgcagcctggggggtctctgagactc60
tcctgtgcagcctctggattcactttggaccattatcacataggctggttccgccaggcc120
ccagggaaggagcgtgagggggtctcatgtattagtaatagtggtggtagcacaaactat180
gcagactccgtgaagggccgattcaccatctccagagacaacgccaagaacacggtgtat240
ctgcaaatgaacagcctgaaacctgaggacacagctgtctattactgtgcagccgggcga300
tggtactatgatggtagtcgctactgcccaccaggtgccatggactactggggcaaaggg360
accctggtcaccgtctcctcg381
<210>9
<211>127
<212>prt
<213>artificialsequence
<400>9
alavalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrleuasphistyr
202530
hisileglytrppheargglnalaproglylysgluarggluglyval
354045
sercysileserasnserglyglyserthrasntyralaaspserval
505560
lysglyargphethrileserargaspasnalalysasnthrvaltyr
65707580
leuglnmetasnserleulysprogluaspthralavaltyrtyrcys
859095
alaalaglyargtrptyrtyraspglyserargtyrcysproprogly
100105110
alametasptyrtrpglylysglythrleuvalthrvalserser
115120125
<210>10
<211>127
<212>prt
<213>artificialsequence
<400>10
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrleuasphistyr
202530
hisileglytrpvalargglnalaproglylysglyleugluglyval
354045
sercysileserasnserglyglyserthrasntyralaaspserval
505560
lysglyargphethrileserargaspasnalalysasnthrvaltyr
65707580
leuglnmetasnserleulysprogluaspthralavaltyrtyrcys
859095
alaalaglyargtrptyrtyraspglyserargtyrcysproprogly
100105110
alametasptyrtrpglyglnglythrleuvalthrvalserser
115120125
<210>11
<211>127
<212>prt
<213>artificialsequence
<400>11
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrleuasphistyr
202530
hisileglytrpvalargglnalaproglylysglyleuglutrpval
354045
sercysileserasnserglyglyserthrasntyralaaspserval
505560
lysglyargphethrileserargaspasnalalysasnthrvaltyr
65707580
leuglnmetasnserleulysprogluaspthralavaltyrtyrcys
859095
alaalaglyargtrptyrtyraspglyserargtyrcysproprogly
100105110
alametasptyrtrpglyglnglythrleuvalthrvalserser
115120125
<210>12
<211>381
<212>dna
<213>artificialsequence
<400>12
gaggtgcagctggttgaatctggcggaggactggttcagcctggcggatctctgagactg60
tcttgtgccgccagcggcttcaccctggatcactatcacatcggctgggtccgacaggcc120
cctggcaaaggacttgaaggcgtgtcctgcatcagcaacagcggcggcagcaccaattac180
gccgatagcgtgaagggcagattcaccatcagccgggacaacgccaagaacaccgtgtac240
ctgcagatgaacagcctgaagcctgaggacaccgccgtgtactattgtgccgctggcaga300
tggtactacgacggcagcagatactgtcctcctggcgccatggattattggggccaggga360
acactggtcaccgtgtctagt381
<210>13
<211>381
<212>dna
<213>artificialsequence
<400>13
gaggtgcagctggttgaatctggcggaggactggttcagcctggcggatctctgagactg60
tcttgtgccgccagcggcttcaccctggatcactatcacatcggctgggtccgacaggcc120
cctggcaaaggacttgaatgggtgtcctgcatcagcaacagcggcggcagcaccaattac180
gccgatagcgtgaagggcagattcaccatcagccgggacaacgccaagaacaccgtgtac240
ctgcagatgaacagcctgaagcctgaggacaccgccgtgtactattgtgccgctggcaga300
tggtactacgacggcagcagatactgtcctcctggcgccatggattattggggccaggga360
acactggtcaccgtgtctagt381
- 还没有人留言评论。精彩留言会获得点赞!