一种促进成骨细胞增殖的小肽
1.本发明涉及一种促进成骨细胞增殖的小肽,属于食品加工技术领域。
背景技术:
2.骨质疏松症是以骨量减少、骨组织退化及微结构破坏导致骨强度和韧度降低为特征的一种代谢性疾病,其发病率较高,尤其是随着老龄化时代的到来,骨质疏松及其并发症如骨折等日益成为一项危害大众身体健康的社会问题。
3.目前治疗骨质疏松的药物以作用于破骨细胞的骨吸收为主,而靶向于成骨细胞增殖促进骨形成的药物较少,且目前市场上抗骨质疏松药物如双膦酸盐,选择性雌激素受体调节剂和降钙素等普遍存在严重的副作用。因此开发高效、安全、副作用小的抗骨质疏松的天然产物成分日益受到关注。
技术实现要素:
4.本发明的目的是提供一种对成骨细胞具有促增殖活性的小肽。
5.本发明的目的采用如下技术方案实现:
6.一种对成骨细胞具有促增殖活性的小肽,具有如seq id no:1所示的氨基酸序列。
7.本发明还提供所述小肽的修饰肽,对手术小肽进行修饰,在所述小肽的n端、c端或中间残基上连接氨基酸、多肽、蛋白质或peg。
8.在本发明中,对所述小肽的修饰包括:对所述小肽的n端进行甲酰化或乙酰化,或者在n端连接脂肪酸、肼基烟酰胺、二乙烯三胺五乙酸、肉豆蔻酸、十六酸或琥珀酰胺或peg;或者对所述小肽c端进行酰胺化、或在c端连有p
‑
硝基苯胺或7
‑
氨基
‑4‑
甲基香豆素;或者对所述小肽中间残基进行糖基化、磷酸化、甲基化、乙酰化、硝基化、磺酸化或者连接peg修饰或者所述小肽中间残基偶联蛋白质。
9.本发明还提供所述的小肽在制备促进成骨细胞增殖和抗骨质疏松产品中的应用。
10.本发明还提供所述的小肽在制备用于促进成骨细胞增殖和抗骨质疏松的药物中的应用。
11.本发明还提供所述小肽的具有促进成骨细胞增殖和抗骨质疏松的功能的食品。
12.有益效果:本发明小肽a来源于大豆蛋白,安全性好,具有显著的促进成骨细胞增殖的作用,且能够显著可以显著促进成骨细胞的分化,因此有望用于制备促进成骨细胞增殖和抗骨质疏松的药物或功能食品。本发明小肽合成方便,可工业化生产,在食品、医药及化妆品等领域具有良好的应用前景。
附图说明
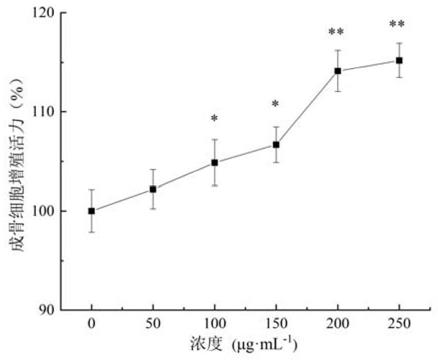
13.图1木瓜蛋白酶酶解产物浓度对成骨细胞增殖活力的影响,横坐标是木瓜蛋白酶酶解产物溶液的浓度。*表示与对照组相比差异显著(p<0.05),**表示与对照组相比差异极显著(p<0.01),下同。
14.图2超滤产物各组分对成骨细胞增殖活力的影响。不同字母表示差异显著(p<0.05)。下同。
15.图3sephadex g
‑
15分离色谱图。
16.图4各活性组分的促成骨细胞增殖活性。
17.图5小肽a对成骨细胞增殖活力的影响,其中10、25、50和100表示小肽a的干预浓度,单位是μm。
18.图6显示了小肽a对成骨细胞alp(碱性磷酸酶)活力的影响,damdgwfrl为加入了小肽a的孔。d7、d10分别表示小肽a干预前培养7、10天。
具体实施方式
19.试验材料:大豆分离蛋白,上海源叶生物科技有限公司;二甲基亚砜(dmso),美国sigma公司;噻唑蓝(mtt)、木瓜蛋白酶,北京索莱宝科技有限公司;mc3t3
‑
e1细胞株,上海中科院细胞库;胎牛血清(fetal bovine serum,fbs)、α
‑
mem培养基、edta
‑
胰酶(0.05%)、penicillin
‑
streptomycin(100
×
)、pbs磷酸盐缓冲液,美国gibco公司;碱性磷酸酶alcalase 2.4l,丹麦诺维信生物技术有限公司;sephadex g
‑
15,ge(中国)医疗集团;其他试剂均为国产分析纯,购自国药集团化学试剂有限公司。
20.仪器与设备:spectramax m2e酶标仪,美国molecular devices公司;蛋白纯化系统,上海沪西分析仪器有限公司;8400型超滤杯,美国millipore公司;hy
‑
1漩涡混合仪,上海仪电科学仪器股份有限公司;微型垂直电泳系统、化学发光凝胶成像系统,美国bio
‑
rad公司;冷冻干燥机,美国labconco公司;jy92
‑ⅱ
超声细胞粉碎仪,宁波新艺超声设备有限公司。
21.成骨细胞的增殖活性测定:
22.(1)设置加样组:将成骨细胞(mc3t3
‑
e1)消化收集后配置成每毫升含5
×
104个细胞的悬浮液,在96孔板的每孔中加100μl该细胞悬浮液,置于37℃、co2培养箱中培养24h使细胞贴壁。细胞贴壁后去除培养液,每孔加入100μl待检样品,每个待检样品设置6个平行。将细胞在co2培养箱中继续培养24h后,每孔加入10μl浓度为5mg
·
ml
‑1的mtt溶液,继续培养4h后将mtt溶液及培养液吸出并加入50μl dmso,然后在37℃恒温振荡器内振荡20min后使用酶标仪在570nm单波长下测吸光值。
23.(2)另外,设置空白组和对照组。对照组以等体积的α
‑
mem培养液替代待检样品,其他同加样组。空白对照组中每孔加入100μl的pbs缓冲液,在co2培养箱中培养48h后,每孔加入10μl浓度为5mg
·
ml
‑1的mtt溶液,继续培养4h后将mtt溶液和pbs缓冲液吸出并加入50μl dmso,然后在37℃恒温振荡器内振荡20min后使用酶标仪在570nm单波长下测吸光值。
24.(3)成骨细胞增殖活力=(od
加样组
‑
od
空白组
)/(od
对照组
‑
od
空白组
)
×
100%。
具体实施方式
[0025][0026]
实施例1制备促进成骨细胞增殖的活性肽的方法
[0027]
制备促进成骨细胞增殖的活性肽的方法,包括如下步骤:
[0028]
(1)木瓜蛋白酶酶解
[0029]
称取大豆分离蛋白(上海源叶生物科技有限公司,产品编号s30914)溶于超纯水中,配置成质量百分浓度为4.5%的蛋白溶液,加入naoh溶液,调节ph为7.0。按照每克蛋白加入3000u木瓜蛋白酶的比例,在该蛋白溶液中加入木瓜蛋白酶,然后置于旋转混匀仪上,在55℃进行酶解反应5h,经检测,大豆分离蛋白的水解度为11.08
±
0.31%。反应结束后,升温至85℃并保温20min以灭活木瓜蛋白酶,冷却至室温,在3000
×
g条件下离心15min,取上清,透析除盐,冷冻干燥后,得到木瓜蛋白酶酶解产物,于
‑
20℃条件下保存。
[0030]
将木瓜蛋白酶酶解产物采用α
‑
mem培养液配制成50、100、150、200、250μg
·
ml
‑1的溶液。按照成骨细胞的增殖活性测定方法,以不同浓度木瓜蛋白酶酶解产物溶液作为待检样品,检测各样品干预后成骨细胞增殖活力。结果如图1所示,木瓜蛋白酶酶解产物溶液浓度为的100μg
·
ml
‑1和150μg
·
ml
‑1时,成骨细胞增殖活力相比对照组有所增强(p<0.05),当浓度为200μg
·
ml
‑1和250μg
·
ml
‑1时相比对照组具有极显著差异(p<0.01),但这二剂量之间无显著性差异(p>0.05)。当木瓜蛋白酶酶解产物溶液的浓度为200μg
·
ml
‑1时,成骨细胞增殖活力为118.24
±
2.73%。
[0031]
(2)超滤膜分离
[0032]
将步骤(1)所得木瓜蛋白酶酶解产物溶于去离子水中,配置成10μg
·
ml
‑1的溶液,用0.45μm的纤维素膜过滤,除去其中的不溶物。将滤液采用10kda超滤膜分离,分别得到截留液a和透过液a。将截留液a采用30kda的超滤膜分离,得到截留液b和透过液b。超滤的条件均为:温度为4℃、压力为0.2mpa。分别将透过液a(含有小于10kda组分)、截留液b(含有大于30kda组分)和透过液b(含有10
‑
30kda组分)冷冻干燥,得到小于10kda组分、大于30kda组分和10
‑
30kda组分。
[0033]
将小于10kda组分、大于30kda组分和10
‑
30kda组分分别采用α
‑
mem培养液配制成200μg
·
ml
‑1的溶液并作为待检样品,按照成骨细胞的增殖活性测定方法,检测成骨细胞增殖活力。结果如图2所示。与对照组相比,大于30kda组分对成骨细胞无显著促增殖作用(p>0.05),10
‑
30kda组分和小于10kda组分均有显著的促增殖作用,其中小于10kda组分具有较高的促增殖活力,成骨细胞增殖活力达到120.45
±
2.28%,与其他各组之间具有显著性差异(p<0.05)。由此可知,木瓜蛋白酶酶解产物分子量越小,其促成骨细胞增殖活性越高。因此,选择透过液a(小于10kda组分)进行后续酶解实验。
[0034]
(3)碱性蛋白酶酶解
[0035]
将步骤(2)所得小于10kda组分溶于超纯水中,配置成质量百分浓度为5%的蛋白溶液,然后用naoh溶液调节ph至8.0,按照每克蛋白加入3000u的碱性蛋白酶(丹麦诺维信生物技术有限公司)的量加入碱性蛋白酶,在55℃下酶解0.5h,升温至85℃并保温20min以灭活碱性蛋白酶,冷却至室温,在3000
×
g条件下离心15min,取上清,透析除盐,冷冻干燥后,得到碱性蛋白酶酶解产物,于
‑
20℃条件下保存。
[0036]
将碱性蛋白酶酶解产物采用α
‑
mem培养液配制成200μg
·
ml
‑1的溶液并作为待检样品,按照成骨细胞的增殖活性测定方法,检测成骨细胞增殖活力。结果:碱性蛋白酶酶解产物对成骨细胞增殖活力达到123.02
±
2.69%。
[0037]
(4)sephadex g
‑
15分离
[0038]
将步骤(3)中所得碱性蛋白酶酶解产物采用交联葡聚糖sephadex g
‑
15进行分离。首先将sephadex g
‑
15干粉溶胀之后装入15mm
×
600mm层析柱中,再将碱性蛋白酶酶解产物
溶于超纯水配成2%(质量百分浓度)的溶液,经0.22μm的滤膜过滤除去颗粒物,上样量为柱体积的3%,且分离过程在4℃条件下进行。用超纯水以0.6ml
·
min
‑1流速洗脱,采用紫外检测器在220nm处检测吸光值,自动收集器每5min收集1管(约2ml)洗脱液,记录仪记录紫外检测结果。根据记录曲线,合并同一洗脱峰下的洗脱液,冷冻干燥。
[0039]
如图3所示,经sephadex g
‑
15分离后,得到4个洗脱峰,分别命名为活性组分f1(保留时间为40
‑
55min)、f2(保留时间为70
‑
90min)、f3(保留时间为95
‑
115min)和f4(保留时间为115
‑
130min)。将f1、f2、f3和f4分别冷冻干燥,采用α
‑
mem培养液配制成200μg
·
ml
‑1的溶液并作为待检样品,按照成骨细胞的增殖活性测定方法,检测成骨细胞增殖活力。结果如图4所示,与对照组相比,f1、f2、f3和f4对成骨细胞均有促增殖活性(p<0.05),其中f3干预后,成骨细胞增殖活力高达125.80
±
2.94%。
[0040]
(5)氨基酸含量分析和肽的结构鉴定及其对成骨细胞增殖活力的影响
[0041]
对步骤(4)所得活性组分f3进行氨基酸分析,氨基酸含量参照gb5009.124—2016进行测定。称取0.2g活性组分f3于水解管中,加入10ml 6mol
·
l
‑1的盐酸后封管,于110℃烘箱水解24h,然后利用全自动氨基酸分析仪,使用磺酸型阳离子树脂柱,测定样品中氨基酸含量。
[0042]
委托上海博苑生物科技有限公司完成活性组分f3中小肽的结构鉴定。采用串联质谱技术(esi
‑
tof ms/ms)对活性组分f3进行结构鉴定。流动相a:含有2%(体积百分浓度)乙腈和0.1%(体积百分浓度)甲酸的水溶液;流动相b:由乙腈、甲酸和水按照体积比为98:0.1:1.9配制而成的溶剂。质谱采用tripletof5600系统(ab sciex)结合纳升喷雾iii离子源,喷雾电压为2.5kv,雾化气压为5psi,气帘气压为30psi,加热器温度为150℃。
[0043]
在活性组分f3中存在小肽a。小肽a的序列(seq id no:1)为:damdgwfrl。采用化学法固相合成小肽a(纯度95%以上),该实验委托江苏金斯瑞生物科技有限公司完成。
[0044]
将化学法固相合成法制备的小肽a,分别采用α
‑
mem培养液配制成10、25、50、100μm的溶液并作为待检样品,按照成骨细胞的增殖活性测定方法,检测成骨细胞增殖活力,以考察该小肽是否具有促进成骨细胞增殖的作用。检测结果如图5所示,随着小肽a浓度的增加,成骨细胞的增殖活力也逐渐增加,当浓度为100μm时,小肽a对成骨细胞的增殖活力,达到127.98
±
3.06%,因此小肽a具有显著的促进成骨细胞增殖的作用。
[0045]
实施例7小肽a对成骨细胞alp(碱性磷酸酶)活力的影响
[0046]
采用碱性磷酸酶试剂盒检测小肽a对成骨细胞alp活力的影响。具体方法如下:将成骨细胞mc3t3
‑
e1消化后,采用α
‑
mem培养液配置成浓度为1
×
105个/ml的细胞悬液,接种于6孔板,每孔2ml。待mc3t3
‑
e1细胞生长至汇合后,除去培养液,将其在矿化诱导培养基(在购自美国sigma公司的odm中添加有终浓度为50μg/ml抗坏血酸和4mmβ
‑
甘油磷酸盐)中培养7、10天进行诱导分化,然后更换无血清培养液,同时加入终浓度为20μm的小肽a处理48h,设3个平行。同时设置对照组,无小肽a干预,其他不变。根据碱性磷酸酶试剂盒说明书步骤测定alp活力;用bca法检测细胞内总蛋白含量,校正alp活性。结果如图6所示,在分化7天时,对照组中alp的活性为13.68
±
0.30u/g,加入小肽a的孔中alp的活性为26.02
±
1.28u/g;在分化10天时,对照组中alp的活性为19.45
±
1.30u/g,加入小肽a的孔中alp的活性为54.64
±
2.48u/g。实验结果表明,在分化第7天和分化第10天,小肽a干预的成骨细胞的alp活性明显高于对照组(p<0.05),说明小肽a可以显著促进成骨细胞的分化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1