固定化融合酶及其制备方法和应用
本发明涉及固定化酶技术领域,特别涉及一种imac功能化的磁性纳米粒表面固定化有融合老黄酶和葡萄糖脱氢酶的固定化融合酶,同时,本发明也涉及上述固定化融合酶的制备方法和其应用。
背景技术:
寻找简单有效的策略来合成手性化合物是众多科研工作者的重要目标,目前手性化合物合成最广泛的方法之一是不对称还原c=c键得到手性化合物,且其可产生多达两个立体手性中心。这种c=c键的不对称还原可以通过金属催化或生物方法获得,同时与化学合成相比,生物催化过程也是环境友好的,反应亦可以在温和条件下进行,底物范围宽,并且产物的对映体纯度通常较为优异。
老黄酶广泛分布于微生物,尤其是细菌和低等真菌和植物中。老黄酶可以催化α,β-不饱和酮、醛、硝基烯烃、羧酸和衍生物的c=c键还原,利用其可提供具有多种生物技术和药物应用的产品,且它们还能减少硝酸酯、硝化甘油、硝基芳香炸药和环状三嗪,以用于爆炸物污染土壤的植物修复等。
利用老黄酶作为生物催化剂时,其对nadph的依赖是最大的挑战之一。因为nadph是一种昂贵的辅因子,所以原位辅因子再生回收是老黄酶催化c=c双键不对称还原实际应用的前提条件。现有典型的回收方法是使用辅因子回收酶,而葡萄糖脱氢酶便是这种nadph再生酶的一个很好的例子,这种酶催化廉价的葡萄糖氧化成葡萄糖酸,同时也将nadp+转化为nadph。
此外,对于酶偶联,融合蛋白的构建也已被开发为辅因子再生的有效方法。融合蛋白的邻近效应通常可减少中间产物的扩散距离,有助于实现更高效率的级联反应。而且用于连续反应的不同酶的活性位点可以非常接近,通过通道加速中间体的加工,融合蛋白能够极大地促进辅因子在催化酶和辅因子再生偶联酶的两个活性中心之间的转移,从而能够导致活性中心附近一定量的辅因子的积累,并且增强所需的生物催化反应。
另外,全细胞系统也开始用于原位辅因子的回收,不过全细胞生物催化通常受到产品毒性、副产物形成、底物吸收速率差,以及催化后产品回收困难的限制。
而目前融合酶的固定化应用具有多种潜在优势,其例如可提高反应稳定性,能够连续操作,催化剂可重复使用,能够降低成本以及简化产品分离工艺等,这些优势使得固定化融合酶在手性化合物的合成,例如共轭烯酮的不对称还原上,有着很好的工业催化剂的潜力。
技术实现要素:
有鉴于此,本发明旨在提出一种固定化融合酶,以能够实现融合酶的固定化应用。
为达到上述目的,本发明的技术方案是这样实现的:
一种固定化融合酶,所述固定化融合酶包括imac功能化的磁性介孔二氧化硅纳米粒,以及固定化在所述imac功能化的磁性介孔二氧化硅纳米粒表面的老黄酶-葡萄糖脱氢酶融合酶。
进一步的,所述老黄酶-葡萄糖脱氢酶融合酶通过自身氮端的组氨酸标签与所述磁性纳米粒表面的ni2+之间的特异性亲和作用定向固定化于所述磁性纳米粒的表面。
本发明同时也提出了上述固定化融合酶的制备方法,该制备方法包括:
a.制备老黄酶-葡萄糖脱氢酶融合酶的粗酶液;
b.制备imac功能化的磁性介孔二氧化硅纳米粒;
c.将imac功能化的磁性介孔二氧化硅纳米粒超声处理,并分散在磷酸钾缓冲液中,加入粗酶液在摇床中孵育,再磁性分离产物,且用含有咪唑的磷酸钾缓冲液洗涤后,收集沉淀得到固定化融合酶。
进一步的,步骤a的老黄酶-葡萄糖脱氢酶融合酶的粗酶液的制备包括:
a1.构建老黄酶和葡萄糖脱氢酶的融合表达基因,并利用柔性链接肽连接两个融合表达基因,构建融合酶基因序列;
a2.利用限制性内切酶ndeⅰ和ecorⅰ将融合酶基因序列连接到质粒上,构建出重组质粒;
a3.将构建的重组质粒转入感受态大肠杆菌中,并筛选出阳性的工程菌株;
a4.将工程菌株进行平板活化,并进行过夜培养,再按1%接种量接入新鲜lb培养基中,待od600达到0.8时,加入iptg进行诱导培养;
a5.对大肠杆菌进行离心洗涤,收集菌体使用磷酸钾缓冲液重悬洗涤,再加入磷酸钾缓冲液重悬菌体并采用均浆机进行破碎,将破碎后的菌液进行离心去除细胞残渣,收集的上清液为老黄酶-葡萄糖脱氢酶融合酶的粗酶液,并于4℃存储。
进一步的,步骤a3包括将构建完成的质粒转入感受态的大肠杆菌菌株,取出部分菌液涂布在含有卡那霉素的lb培养基平板上,正面培养并待菌液完全被培养基吸收后,于37℃培养箱中倒置培养12-16h,筛选出阳性的工程菌株,并于-80℃下储存。
进一步的,步骤a4包括将于-80℃储存的工程菌株进行lb平板活化,在37℃的生化培养箱中过夜培养,再挑取单菌落于包含卡那霉素的lb液体培养基中,在摇床中过夜培养,再按照1%的接菌量将培养的大肠杆菌液依次分装到多个装有新鲜lb液体培养基的容器中,进行扩大培养,待扩大培养的菌液od600达到0.8时,加入诱导剂iptg,且20℃诱导培养20h。
进一步的,步骤b的imac功能化的磁性介孔二氧化硅纳米粒的制备包括:
b1.制备磁性介孔二氧化硅纳米粒;
b2.将制备的磁性介孔二氧化硅纳米粒进行氨基化,并室温干燥;
b3.将氨基化的磁性介孔二氧化硅纳米粒加入容器中,再加入戊二醛,且室温下采用摇床孵化2h;
b4.磁性分离出产物,用磷酸钾缓冲液洗涤产物,并分散在磷酸钾缓冲液中,加入nα,nα-二羧甲基-l-赖氨酸水合物,反应8h,再加入硼氢化钠,反应2h后用磷酸钾缓冲液洗涤;
b5.加入niso4并振荡反应1h,将获得的产物用磷酸钾缓冲液洗涤后得到imac功能化的磁性介孔二氧化硅纳米粒。
进一步的,步骤b1的磁性介孔二氧化硅纳米粒的制备包括:
b11.将纳米fe3o4微球加入到容器中,再加入ctab、正丁醇和尿素水溶液,并进行超声处理得到反应溶液;
b12.将环己烷加入反应溶液中,置于25℃水浴锅中搅拌,并缓慢滴加正硅酸乙酯,在25℃水浴锅中搅拌30min后,升温到70℃反应24h;
b13.磁性分离上述反应溶液得到产物,用乙醇和超纯水洗涤产物,干燥后在550℃煅烧炉中煅烧5h得到磁性介孔二氧化硅纳米粒;
进一步的,步骤b2的磁性介孔二氧化硅纳米粒的氨基化包括:
b21.将磁性介孔二氧化硅纳米粒和正己烷加入容器中,超声处理后,加入3-氨丙基三乙氧基硅烷,并将容器置于80℃水浴锅中,冷凝回流12h得到产物;
b22.将得到的产物用磁铁分离,并用无水乙醇和超纯水洗涤后,得到氨基化的磁性介孔二氧化硅纳米粒。
此外,本发明还提出了上述固定化融合酶的应用,且所述固定化融合酶用于催化共轭烯酮的不对称还原反应中,且所述的共轭烯酮不对称还原过程包括葡萄糖脱氢酶再生nadph,以及老黄酶利用再生的nadph催化共轭烯酮化合物中的c=c双键的不对称还原。
相对于现有技术,本发明具有以下优势:
本发明所述的固定化融合酶,将老黄酶-葡萄糖脱氢酶融合酶固定化于imac功能化的磁性介孔二氧化硅纳米粒的表面,所得的固定化融合酶比粗酶液具有更高的稳定性和重复使用性能,且通过融合老黄酶和葡萄糖脱氢酶可形成双功能生物催化剂,其既具有老黄酶酶催化共轭烯酮化合物的不对称还原的功能,又能够通过葡萄糖脱氢酶实现辅酶再生完成nadph循环,能够创造自给自足的氧化还原生物催化剂。
而通过在磁性介孔二氧化硅纳米粒表面上的固定化,也可使固定化融合酶在共轭烯酮化合物不对称还原反应中表现出优异的催化效果,能够实现高纯度单一对映体的获得,可具有很好的应用效果。
附图说明
构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
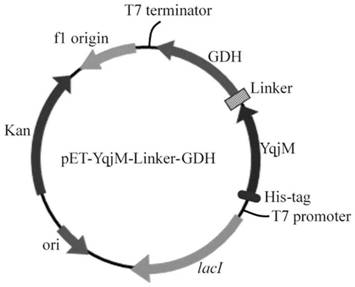
图1为实施例1所述的老黄酶和葡萄糖脱氢酶融合酶的质粒构建图;
图2为实施例2制备的imac功能化磁性介孔二氧化硅纳米粒的sem和tem图;
图3为实施例2制备的imac功能化磁性介孔二氧化硅纳米粒的tem-mapping图;
图4为实施例3所述的ni-nta-mmsn与总蛋白的质量比对蛋白的负载量和催化产率的影响;
图5为实施例3所述的吸附时间对负载量的影响;
图6为实施例3所述的固定化融合酶sds-page电泳分析图,各泳道分别为m:marker;1:融合酶粗酶液;2-3:30mm咪唑洗脱蛋白;4:500mm咪唑洗脱蛋白;
图7为本实施例制备的固定化融合酶催化共轭烯酮不对称还原反应时的数据图。
具体实施方式
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
另外,除本实施例特别说明之外,本实施例中所涉及的各术语及工艺依照现有技术中的一般认知及常规方法进行理解即可。
下面将参考附图并结合实施例来详细说明本发明。
本实施例涉及一种固定化融合酶,在构成上,该固定化融合酶包括imac功能化的磁性介孔二氧化硅纳米粒,以及固定化在所述imac功能化的磁性介孔二氧化硅纳米粒表面的老黄酶-葡萄糖脱氢酶融合酶。
其中,上述的imac即固定化金属离子亲和色谱,且在上述固定化融合酶中,老黄酶-葡萄糖脱氢酶融合酶也为通过自身氮端的组氨酸标签与磁性纳米粒表面的ni2+之间的特异性亲和作用,由此定向固定化于磁性纳米粒的表面。
而针对于本实施例上述的固定化融合酶的制备方法,在制备时,其制备方法在整体设计上主要包括:
步骤a.制备老黄酶-葡萄糖脱氢酶融合酶的粗酶液;
步骤b.制备imac功能化的磁性介孔二氧化硅纳米粒;
步骤c.将imac功能化的磁性介孔二氧化硅纳米粒超声处理,并分散在磷酸钾缓冲液中,加入粗酶液在摇床中孵育,再磁性分离产物,且用含有咪唑的磷酸钾缓冲液洗涤后,收集沉淀得到固定化融合酶。
基于以上制备方法的整体介绍,下面将以多个实施例具体说明本实施例的固定化融合酶的制备。
实施例1
本实施例涉及老黄酶-葡萄糖脱氢酶融合酶的粗酶液的制备。
(1).构建来自bacillussubtilis的老黄酶(yqjm),以及来自bacillusmegateriumiam1030的葡萄糖脱氢酶(gdh)的融合表达基因。利用柔性链接肽[ggggs]3连接两个酶的融合表达基因,构建融合酶基因序列,再利用限制性内切酶ndeⅰ和ecorⅰ将融合酶基因序列连接到质粒pet28b上,构建出重组质粒pet28a-yqjm-linker-gdh。
构建的质粒示意图如图1所示,yqjm、gdh和柔性链接肽[ggggs]3的蛋白序列见下述表1。
表1.yqjm、gdh和柔性链接肽蛋白序列
(2)将上述构建完成的质粒转入感受态的e.colibl21(de3)菌株中,取出部分菌液涂布在含有卡那霉素的lb培养基平板上,正面培养半个小时,待菌液完全被培养基吸收后于37℃培养箱中倒置培养12-16h。筛选出阳性并保存菌种储存于-80℃,即为工程菌ecolibl21(de3)/pet28b-yqjm-linker-gdh。
(3)将ecolibl21(de3)/pet28b-yqjm-linker-gdh从-80℃冰箱中取出,进行lb(10g/l蛋白胨、5g/l酵母膏、10g/lnacl和2%琼脂粉)平板活化,在37℃的生化培养箱中过夜培养。挑取单菌落于10ml包含50μg/ml卡那霉素的lb液体培养基(10g/l蛋白胨、5g/l酵母膏和10g/lnacl)中,在摇床中(37℃,180r/min)过夜培养。
(4)按照1%的接菌量将上述大肠杆菌液依次分装到多个装有50ml新鲜lb液体培养基的锥形瓶中,进行扩大培养(37℃,180r/min)。整个发酵过程均加入硫酸卡那霉素(50μg/ml),避免杂菌生长。待扩大培养的菌液od600达到0.8时,加入诱导剂iptg,终浓度为0.1mmol/l,20℃诱导培养20h(180rpm)。
(5)诱导培养结束后,对大肠杆菌进行离心洗涤(4℃,17500g),然后收集菌体。对收集的菌体使用磷酸钾缓冲溶液(100mm,ph7.5)进行3次重悬洗涤,加入磷酸钾缓冲溶液(100mm,ph7.5)再次重悬菌体,接着使用匀浆机(700-900kpa)进行破碎。将破碎后的菌液进行离心(4℃,17500g,30min),除去细胞残渣,保留上清液存储于4℃的冰箱中,该上清液即为老黄酶-葡萄糖脱氢酶融合酶的粗酶液。
实施例2
本实施例涉及imac功能化的磁性介孔二氧化硅纳米粒的制备。
(1).在250ml的三口烧瓶中加入40g纳米fe3o4微球、3gctab、3g正丁醇、135g尿素水溶液(0.4m)和60g环己烷,超声处理1h后,置于25℃水浴锅中搅拌。然后用注射器缓慢滴加3.0g正硅酸乙酯(teos),在25℃水浴锅中搅拌30min后,升温到70℃,反应24h。最后磁性分离产物,用乙醇和超纯水各洗三次,干燥后,在550℃电阻炉中煅烧5h,得到磁性介孔二氧化硅纳米粒(mmsn)。
(2).将1gmmsn和100ml正己烷加入到250ml圆底烧瓶中,超声30min后,加入1ml3-氨丙基三乙氧基硅烷(aptes),随后将圆底烧瓶置于80℃水浴锅中,冷凝回流12h得到产物。产物用磁铁分离,再用无水乙醇和超纯水各洗涤三次后,得到氨基化的mmsn(nh2-mmsn),且室温干燥备用。
(3).取50mgnh2-mmsn加入到10ml离心管中,再加入5ml戊二醛,室温下,180rpm摇床孵化2h。磁性分离产物后,用磷酸钾缓冲液(100mm,ph7.5)洗3次,并分散在1ml磷酸钾缓冲液(100mm,ph7.5)中,接着加入1.2mgnα,nα-二羧甲基-l-赖氨酸水合物(anta),反应8h,再加入0.5mg硼氢化钠,反应2h后,用磷酸钾缓冲液(100mm,ph7.5)洗涤3次。然后加入1.0mlniso4(0.1mol/l),振荡反应1h,获得的产物用磷酸钾缓冲液(100mm,ph7.5)洗涤3次,得到imac功能化的磁性介孔二氧化硅纳米粒(ni-nta-mmsn)。
本实施例2制备的imac功能化的磁性介孔二氧化硅纳米粒的sem和tem图如图2所示,且其tem-mapping图如图3所示,图3中的b、c、d、e分别表示n元素分布图、si元素分布图、fe元素分布图和ni元素分布图。
实施例3
本实施例涉及老黄酶-葡萄糖脱氢酶融合酶在imac功能化的磁性介孔二氧化硅纳米粒表面的一步纯化固定化。
将20mgni-nta-mmsn分散于1ml的磷酸钾缓冲液(100mm,ph7.5)中,超声处理10min,接着加入粗酶液,混合均匀后放置在摇床(25℃,180rpm)中,孵育0-3h后离心分离固定化酶,并用含有30mm的咪唑磷酸钾缓冲液(100mm,ph7.5)洗涤2次,得到的沉淀即为固定化融合酶(y-l-g@ni-nta-mmsn)。
本实施例3中,通过加入不同质量的粗酶液(ni-nta-mmsn与蛋白质的质量比分别为4:1、6:1、8:1、10:1、12:1、14:1),并检测ni-nta-mmsn与总蛋白的质量比对蛋白的负载量和催化产率的影响,检测结果如图4所示,由图4可见,当ni-nta-mmsn与粗酶液中的总蛋白的比例为12:1时,固定化融合酶的催化性能最好,且产率高达95%。
在ni-nta-mmsn与粗酶液中的总蛋白的比例为12:1时,通过检测吸附时间对负载量的影响,检测结果如图5所示,由图5可见在在孵育1.5h时吸附几乎达到平衡,最大负载量为41.5mg/gsupport。
本实施例中,为了验证imac功能化的磁性介孔二氧化硅纳米粒的纯化性能,在上述比例为12:1时制备的固定化融合酶中加入2ml含有500mm咪唑的磷酸钾缓冲液(100mm,ph7.5),混合均匀后,离心分离沉淀,并收集上清液,再通过sds-page电泳检测洗脱下来的样品,结果如图6所示。由图6可见本实施例的imac功能化的磁性介孔二氧化硅纳米粒有着较好的纯化性能。
此外,本实施例进一步也涉及上述固定化融合酶的应用,且该固定化融合酶用于催化共轭烯酮的不对称还原反应中,且所述的共轭烯酮不对称还原过程包括葡萄糖脱氢酶再生nadph,以及老黄酶利用再生的nadph催化共轭烯酮化合物中的c=c双键的不对称还原。
具体应用时,其应用例的具体步骤如下所示。
将20mgy-l-g@ni-nta-mmsn分散于1ml的磷酸钾缓冲液(100mm,ph7.5)中,漩涡震荡2min。再向上述溶液中加入共轭烯酮的底物(10mm),葡萄糖溶液(200mmol)和nadp+(0.2mmol),漩涡震荡使其混合均匀。接着,将反应混合物在摇床(25℃,180rpm)中反应4h。反应结束后取50μl的反应液于2ml的离心管中,加入200μl乙酸乙酯充分混合进行萃取,离心吸取有机相即可。
而对得到的有机相通过气相分析其产率和ee值,不同共轭烯酮底物的分析结果如图7所示,由图7可见本实施例的固定化融合酶在用于催化共轭烯酮的不对称还原反应时,其能够获得较好的产率与ee值,表示本实施例的固定化融合酶可获得较好的应用效果。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
sequencelisting
<110>河北工业大学
<120>固定化融合酶及其制备方法和应用
<130>2021.2.19
<160>3
<170>patentinversion3.5
<210>1
<211>1017
<212>dna
<213>人工序列(artificialsequence)
<400>1
atggccagaaaattatttacacctattacaattaaagatatgacgttaaaaaaccgcatt60
gtcatgtcgccaatgtgcatgtattcttctcatgaaaaggacggaaaattaacaccgttc120
cacatggcacattacatatcgcgcgcaatcggccaggtcggactgattattgtagaggcg180
tcagcggttaaccctcaaggacgaatcactgaccaagacttaggcatttggagcgacgag240
catattgaaggctttgcaaaactgactgagcaggtcaaagaacaaggttcaaaaatcggc300
attcagcttgcccatgccggacgtaaagctgagcttgaaggagatatcttcgctccatcg360
gcgattgcgtttgacgaacaatcagcaacacctgtagaaatgtcagcagaaaaagtaaaa420
gaaacggtccaggagttcaagcaagcggctgcccgcgcaaaagaagccggctttgatgtg480
attgaaattcatgcggcgcacggatatttaattcatgaatttttgtctccgctttccaac540
catcgaacagatgaatatggcggctcacctgaaaaccgctatcgtttcttgagagagatc600
attgatgaagtcaaacaagtatgggacggtcctttatttgtccgtgtatctgcttctgac660
tacactgataaaggcttagacattgccgatcacatcggttttgcaaaatggatgaaggag720
cagggtgttgacttaattgactgcagctcaggcgcccttgttcacgcagacattaacgta780
ttccctggctatcaggtcagcttcgctgagaaaatccgtgaacaggcggacatggctact840
ggtgccgtcggcatgattacagacggttcaatggctgaagaaattctgcaaaacggacgt900
gccgacctcatctttatcggcagagagcttttgcgggatccattttttgcaagaactgct960
gcgaaacagctcaatacagagattccggcccctgttcaatacgaaagaggctggtaa1017
<210>2
<211>932
<212>dna
<213>人工序列(artificialsequence)
<400>2
gatcatcatagcaggagtcatgttagggctcgccaaaagctaactaggagggtattaaca60
atgtataaagatttagaaggaaaagtagtggtcataacaggttcatctacaggtttggga120
aaatcaatggcgattcgttttgcgacagaaaaagccaaagtagttgtgaactatcgttct180
aaggaggacgaagctaacagcgttttagaagaaattaaaaaagttggcggagaagcaatt240
gctgtcaaaggtgatgtaacagttgagtctgacgttatcaatttagttcaatctgctatt300
aaagagtttggaaagctagacgttatgattaacaacgcagggttagaaaatccggtttca360
tctcatgaaatgtctttaagcgattggaataaagtcattgatacgaacttaacgggagct420
tttttaggcagccgtgaagcgattaaatattttgtggaaaatgatattaagggaacagtt480
attaacatgtcgagtgttcacgagaaaattccttggccattatttgttcattatgcagca540
agtaaaggcggtatgaagcttatgactgaaacactggcattagaatacgctccaaaaggt600
attcgtgtaaataacattggaccaggagcgattaatacaccgattaacgctgagaaattt660
gctgatcctgagcagcgtgcagatgtagaaagcatgattccaatgggatacatcggagag720
ccggaagaaattgcagcagttgctgcatggctagcttcttcagaggcgagttatgtaaca780
ggaattacgctctttgctgacggcggtatgacacagtacccatcattccaagcaggacgc840
ggataagaaaaaacgcactctatgatagagtgcgtttttttagttttcctgagctttttt900
ttggttcttaggagctgactggtgttgaattc932
<210>3
<211>35
<212>dna
<213>人工序列(artificialsequence)
<400>3
gcagtggtggtggtggtagcggtggtggtggcagc35
- 还没有人留言评论。精彩留言会获得点赞!