一种炔基化四氢异喹啉类化合物及其制备方法与应用
本发明涉及化合合成技术领域,具体涉及一种炔基化四氢异喹啉类化合物及其制备方法与应用。
背景技术:
不对称催化一直是有机催化反应中的研究热门话题。环胺α位的不对称交叉脱氢偶联反应(cdc)已成为研究热点之一,由于其手性产物很容易发生衍生化成为具有生物活性的物质,特别是四氢异喹啉类衍生物(thiqs)与相对较弱的炔烃亲核试剂之间的交叉脱氢偶联。相关技术中通过四氢异喹啉类化合物(thiqs)与末端炔烃的不对称交叉脱氢偶联反应(cdc),提供了中等的对映选择性(5%~74%ee)的c1位烷基化产物;同时还开发了一种需氧型氧化方法,但反应时间较长(24h~72h),反应效率不高。
近年来,有机电合成异军突起,电化学合成不仅可以避免危险和额外的化学计量氧化剂,而且由于氧化电位和电流的可调性,还可以控制反应速率和达到较好的选择性。在这种情况下,由于过渡金属配合物的氧化还原电位可以很容易地通过配体修饰进行调节,所以电化学和过渡金属催化的结合已经成为一种很有吸引力的策略来形成碳碳(c-c)和碳杂原子(c-x)键。因而相关技术中发展了一种四氢异喹啉类化合物(thiqs)与炔烃的交叉脱氢偶联不对称电催化过程。但是,该反应存在一些缺点,烷基炔烃的兼容性差,另外,乙炔、丙炔、丁炔是气体,储存危险,反应操作繁琐。
因此,需要开发一种炔基化四氢异喹啉类化合物及其制备方法,该方法操作简便且安全性高。
技术实现要素:
本发明要解决的第一个技术问题为:提供一种炔基化四氢异喹啉类化合物。
本发明要解决的第二个技术问题为:提供一种炔基化四氢异喹啉类化合物的制备方法,该方法操作简便且安全性高。
本发明要解决的第三个技术问题为:提供一种炔基化四氢异喹啉类化合物的应用。
为解决上述第一个技术问题,本发明提供的技术方案为:一种炔基化四氢异喹啉类化合物,包括如下式所示的化合物(iii);
式中,r1、r2、r3、r4和r5均独立选自烷基、氢、卤素原子、烷氧基、烯基或芳基;r1、r2、r3、r4和r5相同或不同;r3和r4之间能够成环。
根据本发明的一些实施方式,所述烷基为c1~20烷基;优选地,所述烷基为c1~10烷基;优选地,所述烷基为甲基、乙基、丙基、丁基和叔丁基中的至少一种。
根据本发明的一些实施方式,所述卤素原子为氟原子、氯原子、溴原子和碘原子中的至少一种;优选地,所述卤素原子为溴原子。
根据本发明的一些实施方式,所述烷氧基为c1~10烷氧基;优选地,所述烷氧基为c1~5烷氧基;优选地,所述烷氧基为甲氧基和乙氧基中的至少一种。
根据本发明的一些实施方式,所述烯基为c1~20烯基;优选地,所述烷基为c1~10烯基;优选地,所述烯基为乙烯基、丙烯基、丁烯基中的至少一种。
根据本发明的一些实施方式,所述芳基为c20以下的芳基;优选地,所述芳基为c10以下的芳基;优选地,所述芳基包括苯基。
根据本发明的一些实施方式,所述化合物(ⅲ)包括如下式所示化合物:
为解决上述第二个技术问题,本发明提供的技术方案为:一种炔基化四氢异喹啉类化合物的制备方法,包括以下步骤:在电解体系中,加入式(i)所示的四氢异喹啉类化合物和式(ii)所示的炔酸类化合物为原料,通过电催化脱羧反应,制备得到式(iii)所示的四氢异喹啉类化合物;
式中,r1、r2、r3、r4和r5均独立选自烷基、氢、卤素原子、烷氧基、烯基或芳基;r1、r2、r3、r4和r5相同或不同;r3和r4之间能够成环;
所述电解体系中包含碱、溶剂、催化剂、阳极和阴极。
反应物中选用炔酸,炔酸大多数是固体,便于运输,储存。
根据本发明的一些实施方式,所述烷基为c1~20烷基;优选地,所述烷基为c1~10烷基;优选地,所述烷基为甲基、乙基、丙基、丁基和叔丁基中的至少一种。
根据本发明的一些实施方式,所述卤素原子为氟原子、氯原子、溴原子和碘原子中的至少一种;优选地,所述卤素原子为溴原子。
根据本发明的一些实施方式,所述烷氧基为c1~10烷氧基;优选地,所述烷氧基为c1~5烷氧基;优选地,所述烷氧基为甲氧基和乙氧基中的至少一种。
根据本发明的一些实施方式,所述烯基为c1~20烯基;优选地,所述烷基为c1~10烯基;优选地,所述烯基为乙烯基、丙烯基、丁烯基中的至少一种。
根据本发明的一些实施方式,所述芳基为c20以下的芳基;优选地,所述芳基为c10以下的芳基;优选地,所述芳基包括苯基。
根据本发明的一些实施方式,所述化合物(ⅲ)包括如下所示化合物:
根据本发明的一些实施方式,所述化合物(i)与化合物(ii)化合物的摩尔比为1:1~2;优选地,所述化合物(i)与化合物(ii)化合物的摩尔比为1:1.1~1.3。
根据本发明的一些实施方式,所述电催化脱羧反应选用直流电流;优选地,所述直流电流大小为1ma~10ma。
根据本发明的一些实施方式,所述电催化脱羧反应温度为20℃~25℃,反应时间为10h~20h。
根据本发明的一些实施方式,所述电解质包括正丁基盐;优选地,所述正丁基盐包括正丁基六氟磷酸铵、正丁基四氟硼酸铵和正丁基醋酸铵中的至少一种;更优选地,所述正丁基盐包括正丁基六氟磷酸铵和正丁基四氟硼酸铵中的至少一种。
根据本发明的一些实施方式,所述碱包括有机碱和无机碱中的至少一种;优选地,所述有机碱包括有机胺;优选地,所述有机碱包括三乙胺;优选地,所述无机碱包括氢氧化钠和氢氧化钾中的至少一种。
根据本发明的一些实施方式,所述催化剂包括铜催化剂;优选地,所述铜催化剂包括有机铜催化剂和无机铜催化剂中的至少一种;优选地,所述有机铜催化剂包括三氟甲磺酸铜和醋酸铜中的至少一种;优选地,所述无机铜催化剂包括卤化铜和氧化铜;优选地,所述卤化铜包括氯化亚铜和碘化亚铜。
根据本发明的一些实施方式,所述溶剂包括四氢呋喃、二甲亚砜、乙腈、n-吡咯烷酮、n,n-二甲基甲酰胺、二氯甲烷、乙醇和甲醇中的至少一种;优选地,所述溶剂为乙腈。
根据本发明的一些实施方式,所述阳极和阴极均独立选自金属电极和碳电极;优选地,所述金属电极包括铂电极或镍电极。
根据本发明的一些实施方式,所述电解体系中还包括配体。
根据本发明的一些实施方式,所述配体包括吡啶类化合物;优选地,所述吡啶类化合物包括联吡啶化合物;优选地,所述联吡啶化合物包括烷基取代吡啶、烷氧基取代吡啶。
根据本发明的一些实施方式,所述配体包括4,4’-叔丁基联吡啶、4,4’-甲氧基联吡啶、2,2’-甲基联吡啶、3,3’-三氟甲基联吡啶和联吡啶中的至少一种。
配体的空间位阻和电子效应俊辉对产率明显的影响。
根据本发明的一些实施方式,所述催化剂与配体的摩尔比为1:1.1~1.2。
根据本发明实施方式的制备方法,至少具备如下有益效果:本发明选用四氢异喹啉类化合物(thiqs)与炔酸的脱羧偶联反应,一步法制得了炔基化四氢异喹啉类化合物,该制备方法反应条件温和,不需要使用危险的气体,制备步骤简单,能够实现炔基化四氢异喹啉类化合物的大规模生产。
为解决上述第三个技术问题,本发明提供的技术方案为:一种上述炔基化四氢异喹啉类化合物制备酶抑制剂或抗癌剂药物中的应用。
根据本发明的一些实施方式,所述应用为所述炔基化四氢异喹啉类化合物制备酶抑制剂中间体中的应用。
根据本发明的一些实施方式,所述酶抑制剂中间体的制备包括以下步骤:在室温条件下,以ch2cl2为溶剂,将化合物ⅲ、aupph3cl、agntf2和msoh(甲基磺酸)反应16h制得如下式所示化合物ⅳ;
根据本发明实施方式的应用,至少具备如下有益效果:本发明公开炔基化四氢异喹啉类化合物,结构新颖,具有良好的生物活性,在制备酶抑制剂或抗癌剂药物方面具备应用前景。
附图说明
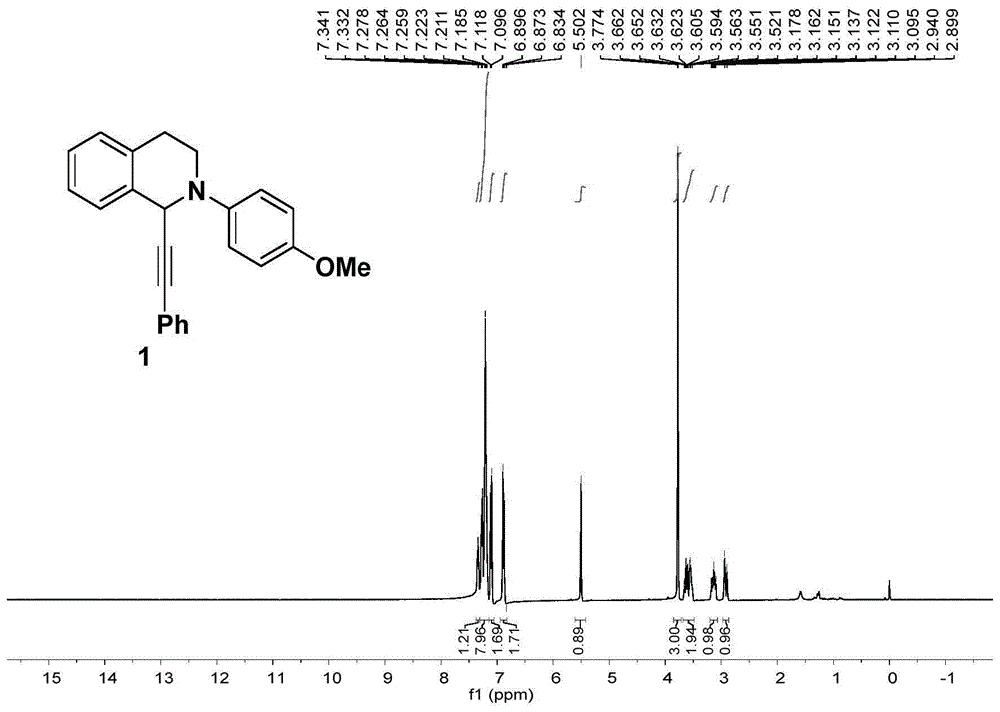
图1为本发明实施例一制得化合物1的核磁共振氢谱;
图2为本发明实施例一制得化合物1的核磁共振碳谱;
图3为本发明实施例二十四制得化合物2的核磁共振氢谱;
图4为本发明实施例二十四制得化合物2的核磁共振碳谱;
图5为本发明实施例二十五制得化合物3的核磁共振氢谱;
图6为本发明实施例二十五制得化合物3的核磁共振碳谱;
图7为本发明实施例二十六制得化合物4的核磁共振氢谱;
图8为本发明实施例二十六制得化合物4的核磁共振碳谱;
图9为本发明实施例二十七制得化合物5的核磁共振氢谱;
图10为本发明实施例二十七制得化合物5的核磁共振碳谱;
图11为本发明实施例二十八制得化合物6的核磁共振氢谱;
图12为本发明实施例二十八制得化合物6的核磁共振碳谱;
图13为本发明实施例二十九制得化合物7的核磁共振氢谱;
图14为本发明实施例二十九制得化合物7的核磁共振碳谱;
图15为本发明实施例三十制得化合物8的核磁共振氢谱;
图16为本发明实施例三十制得化合物8的核磁共振碳谱;
图17为本发明实施例三十一制得化合物9的核磁共振氢谱;
图18为本发明实施例三十一制得化合物9的核磁共振碳谱;
图19为本发明实施例三十二制得化合物10的核磁共振氢谱;
图20为本发明实施例三十二制得化合物10的核磁共振碳谱;
图21为本发明实施例三十三制得化合物11的核磁共振氢谱;
图22为本发明实施例三十三制得化合物11的核磁共振碳谱;
图23为本发明实施例三十四制得化合物12的核磁共振氢谱;
图24为本发明实施例三十四制得化合物12的核磁共振碳谱;
图25为本发明实施例三十五制得化合物13的核磁共振氢谱;
图26为本发明实施例三十五制得化合物13的核磁共振碳谱。
具体实施方式
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
本发明的实施例一为:一种炔基化四氢异喹啉类化合物的制备方法,包括以下步骤:
在未分隔电解槽中,加入cu(otf)2(10mol%)和配体l14,4’-叔丁基联吡啶(10mol%),n-bu4npf6(0.2mmol),四氢异喹啉1a(0.2mmol),苯丙炔酸1b(0.24mmol),et3n(0.24mmol),无水mecn(4ml),然后分别插入铂和镍电极分别作为反应的阳极和阴极,在1.5ma恒电流下电解10h,待反应结束后,乙酸乙酯萃取,收集有机相,然后将有机相混合,无水硫酸钠干燥,减压过滤浓缩得到粗产物,经硅胶柱层析纯化得到化合物1,产率为85%。
本发明实施例一制得的化合物1的表征结果如下(核磁共振氢谱见图1,碳谱见图2):
1hnmr(400mhz,cdcl3):7.34(dd,j=4.5,3.8hz,1h),7.31-7.15(m,8h),7.11(d,j=8.9hz,2h),6.88(d,j=8.9hz,2h),5.50(s,1h),3.77(s,3h),3.69-3.48(m,2h),3.20-3.07(m,1h),2.92(d,j=16.2hz,1h).
13cnmr(100mhz,cdcl3):δ154.2,144.1,135.4,134.0,131.7,129.1,128.1,128.0,127.5,127.1,126.1,123.0,120.2,114.4,88.4,85.5,55.6,54.4,44.2,29.0.
本发明的实施例二为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:配体替换为l24,4’-甲氧基联吡啶,所得化合物1的产率为80%。
本发明的实施例三为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:配体替换为l32,2’-甲基联吡啶,所得化合物1的产率为2%。
本发明的实施例四为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:配体替换为l43,3’-三氟甲基联吡啶,所得化合物1的产率为2%。
本发明的实施例五为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:配体替换为l5联吡啶,所得化合物1的产率为58%。
本发明的实施例六为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:催化剂替换为碘化亚铜,所得化合物1的产率为82%。
本发明的实施例七为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:催化剂替换为氯化亚铜,所得化合物1的产率为18%。
本发明的实施例八为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:催化剂替换为cu(oac)2,所得化合物1的产率为30%。
本发明的实施例九为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:催化剂替换为cuo,所得化合物1的产率为3%。
本发明的实施例十为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:cu(otf)2的用量为5mol%和配体l1的用量为5mol%,所得化合物1的产率为38%。
本发明的实施例十一为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:cu(otf)2的用量为2.5mol%和配体l1的用量为2.5mol%,所得化合物1的产率为6%。
本发明的实施例十二为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:不加入手性配体,所得化合物1的产率为28%。
本发明的实施例十三为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:不加入手性配体,所得化合物1的产率为28%。
本发明的实施例十四为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:et3n替换为氢氧化钠,所得化合物1的产率为78%。
本发明的实施例十五为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:et3n替换为氢氧化钾,所得化合物1的产率为5%。
本发明的实施例十六为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:mecn替换为thf,所得化合物1的产率为46%。
本发明的实施例十七为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:mecn替换为dmf,所得化合物1的产率为50%。
本发明的实施例十八为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:mecn替换为ch2cl2,所得化合物1的产率为70%。
本发明的实施例十九为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:将n-bu4npf6替换为n-bu4noac,所得化合物1的产率为4%。
本发明的实施例二十为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:将n-bu4npf6替换为n-bu4nbf4,所得化合物1的产率为78%。
本发明的实施例二十一为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:不添加n-bu4npf6,所得化合物1的产率为70%。
本发明的实施例二十二为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:将镍电极替换为铂电极,所得化合物1的产率为34%。
本发明的实施例二十三为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:将碳电极替换为铂电极,所得化合物1的产率为30%。
本发明的实施例二十四为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物2的产率为76%。
本发明实施例二十四制得的化合物2的表征结果如下(核磁共振氢谱见图3,碳谱见图4):
1hnmr(400mhz,cdcl3):δ7.32-7.24(m,2h),7.23-7.14(m,3h),7.14(s,1h),7.12-6.99(m,4h),6.88(d,j=8.8hz,2h),5.45(s,1h),3.77(s,3h),3.67-3.48(m,2h),3.16-3.00(m,1h),2.87(d,j=16.0hz,1h),2.34(s,3h).
13cnmr(100mhz,cdcl3):δ154.2,144.2,135.6,135.2,131.7,131.0,128.9,128.10,128.07,127.95,127.94,123.1,120.2,114.4,88.6,85.3,55.6,54.4,44.3,28.6,21.1.
ir(neat):2913,2833,1507,1441,1293,1244,1034,1033,971,949,818,751,689cm-1.
hrms(esi-tof)calcdforc25h24no,[m+h]+:354.1852,found354.1842.
本发明的实施例二十五为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物3的产率为41%。
本发明实施例二十五制得的化合物3的表征结果如下(核磁共振氢谱见图5,碳谱见图6):
1hnmr(400mhz,cdcl3):δ7.48(s,1h),7.31-7.17(m,6h),7.12-6.97(m,3h),6.88(d,j=8.8hz,2h),5.43(s,1h),3.78(s,3h),3.67-3.45(m,2h),3.12-2.98(m,1h),2.84(d,j=16.4hz,1h).
13cnmr(100mhz,cdcl3):δ154.5,143.8,137.5,133.1,131.7,130.8,130.3,128.2,128.1,122.8,120.4,119.5,114.4,87.6,86.1,55.6,54.1,44.1,28.5.
ir(neat):2921,2834,1505,1485,1241,1208,1034,923,823,777,753,733,532cm-1.
hrms(esi-tof)calcdforc24h20nobr,[m]:417.0723,found417.0729.
本发明的实施例二十六为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物4的产率为61%。
本发明实施例二十六制得的化合物4的表征结果如下(核磁共振氢谱见图7,碳谱见图8:
1hnmr(400mhz,cdcl3):δ7.36-7.16(m,5h),7.10(d,j=8.8hz,2h),6.88(d,j=9.2hz,2h),6.83(s,1h),6.65(s,1h),5.43(s,1h),3.92-3.83(m,6h),3.78(s,3h),3.68-3.48(m,2h),3.13-3.00(m,1h),2.81(d,j=15.6hz,1h).
13cnmr(100mhz,cdcl3):δ154.2,148.2,147.5,144.1,131.7,128.1,128.0,127.2,126.1,123.1,120.3,114.3,111.4,110.1,88.5,85.3,56.1,55.9,55.6,54.1,44.3,28.6.
本发明的实施例二十七为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物5(白色固体,33.6mg)的产率为40%。
本发明实施例二十七制得的化合物5的表征结果如下(核磁共振氢谱见图9,碳谱见图10):
m.p.:96.0-100.6℃.
1hnmr(400mhz,cdcl3):δ7.49(d,j=7.6hz,1h),7.35-7.17(m,6h),7.15-7.05(m,3h),6.89(d,j=9.2hz,2h),5.47(s,1h),3.79(s,3h),3.70-3.55(m,2h),3.04-2.94(m,2h).
13cnmr(100mhz,cdcl3):δ154.6,143.7,137.8,133.9,131.7,131.2,128.2,128.1,127.4,126.7,125.4,122.8,120.6,114.4,87.6,86.4,55.6,54.7,44.1,30.2.
ir(neat):2955,2834,1509,1441,1242,1177,1034,918,825,783,755,688,525cm-1.
hrms(esi-tof)calcdforc24h20nobr,[m]:417.0723,found417.0721.
本发明的实施例二十八为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物6的产率为45%。
本发明实施例二十八制得的化合物6的表征结果如下(核磁共振氢谱见图11,碳谱见图12):
1hnmr(400mhz,cdcl3):δ7.38-7.32(m,1h),7.31-7.25(m,2h),7.24-7.11(m,6h),7.06(d,j=8.4hz,1h),6.94(d,j=1.6hz,1h),6.88(dd,j=8.0hz,2.4hz,1h),5.58(s,1h),3.75-3.58(m,2h),3.20-3.05(m,1h),2.98-2.85(m,1h),2.26(s,3h),2.20(s,3h).
13cnmr(100mhz,cdcl3):δ147.9,137.1,135.6,134.3,131.8,130.2,129.0,128.2,128.1,128.0,127.5,127.1,126.2,123.2,119.2,114.9,88.8,85.1,53.0,43.7,29.0,20.3,18.9.
本发明的实施例二十九为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物7(31.5mg)的产率为43%。
本发明实施例二十九制得的化合物7的表征结果如下(核磁共振氢谱见图13,碳谱见图14):
1hnmr(400mhz,cdcl3):δ7.45-7.26(m,5h),7.25-7.15(m,6h),7.07(d,j=8.8hz,2h),5.61(s,1h),3.80-3.59(m,2h),3.21-3.05(m,1h),3.04-2.88(m,1h),1.31(s,9h).
13cnmr(100mhz,cdcl3):δ147.2,142.4,135.5,134.4,131.7,128.9,128.0,127.9,127.4,127.1,126.2,125.9,123.1,116.5,88.8,84.8,52.5,43.6,34.0,31.5,29.0.
ir(neat):2955,1608,1516,1489,1460,1376,1258,1222,1191,815,756,736,690,526cm-1.
hrms(esi-tof)calcdforc27h28n,[m+h]+:366.2216,found366.2213.
本发明的实施例三十为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物8的产率为62%。
本发明实施例三十制得的化合物8的表征结果如下(核磁共振氢谱见图15,碳谱见图16):
1hnmr(400mhz,cdcl3):δ7.40-7.33(m,1h),7.32-7.25(m,2h),7.24-7.11(m,8h),7.10-7.01(m,2h),5.59(s,1h),3.77-3.57(m,2h),3.21-3.05(m,1h),2.94(d,j=16.0hz,1h),2.60(q,j=14.8hz,7.6hz,2h),1.22(t,j=7.6hz,3h).
13cnmr(100mhz,cdcl3):δ147.8,135.9,135.6,134.5,131.9,129.1,128.6,128.2,128.1,127.6,127.3,126.3,123.2,117.5,88.8,85.1,53.0,43.8,29.1,28.2,16.0.
本发明的实施例三十一为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物9的产率为49%。
本发明实施例三十一制得的化合物9的表征结果如下(核磁共振氢谱见图17,碳谱见图18):
1hnmr(400mhz,cdcl3):δ7.77(d,j=9.6hz,1h),7.73(d,j=8.8hz,2h),7.45-7.35(m,3h),7.33-7.24(m,3h),7.23-7.13(m,3h),6.90(s,1h),6.72-6.62(m,1h),5.71(s,1h),3.91(s,3h),3.89-3.84(m,4h),3.77-3.67(m,1h),3.18-3.05(m,1h),2.93-2.83(m,1h).
13cnmr(100mhz,cdcl3):δ148.3,147.7,147.3,134.6,131.7,128.8,128.5,128.1,128.1,127.5,127.1,126.79,126.2,126.2,123.3,122.9,119.5,111.6,111.4,110.1,88.5,85.1,56.1,55.9,52.2,43.6,28.5.
ir(neat):2919,2846,1626,1596,1512,1462,1388,1345,1258,1211,1194,1114,988,749,688,515cm-1.
hrms(esi-tof)calcdforc29h26no2,[m+h]+:420.1958,found420.1952.
本发明的实施例三十二为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物10的产率为57%。
本发明实施例三十二制得的化合物10的表征结果如下(核磁共振氢谱见图19,碳谱见图20):
1hnmr(400mhz,cdcl3):δ7.33(dd,j=5.6hz,4.0hz,1h),7.30-7.26(m,2h),7.25-7.14(m,6h),6.82(d,j=8.8hz,1h),6.71-6.62(m,2h),5.50(s,1h),4.27-4.16(m,4h),3.66-3.52(m,2h),3.18-3.05(m,1h),2.97-2.86(m,1h).
13cnmr(100mhz,cdcl3):δ144.7,143.7,137.8,135.4,134.1,131.7,129.0,128.1,128.0,127.5,127.1,126.1,123.1,117.3,111.7,107.3,88.5,85.3,64.6,64.3,53.8,44.0,28.9,26.9.
本发明的实施例三十三为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物11的产率为44%。
本发明实施例三十三制得的化合物11的表征结果如下(核磁共振氢谱见图21,碳谱见图22):
1hnmr(400mhz,cdcl3):δ7.45-7.41(m,2h),7.40-7.34(m,2h),7.33-7.25(m,4h),7.23-7.17(m,3h),7.06(d,j=8.4hz,1h),6.93(d,j=1.6hz,1h),6.91-6.82(m,2h),6.78(d,j=2.0hz,1h),5.54(s,1h),5.04(s,2h),3.70-3.57(m,2h),3.15-3.03(m,1h),2.94-2.83(m,1h),2.26(s,3h),2.19(s,3h).
13cnmr(100mhz,cdcl3):δ157.8,147.9,137.1,135.7,131.7,130.1,128.6,128.5,128.2,128.15,128.05,128.0,127.9,127.5,123.2,119.2,114.9,114.5,113.4,89.0,84.9,70.0,52.5,43.6,29.3,20.3,18.9.
ir(neat):2918,2825,1606,1501,1455,1374,1327,1262,1233,1210,1166,1026,918,732,690,639,527cm-1.
hrms(esi-tof)calcdforc32h30no,[m+h]+:444.2322,found444.2320.
本发明的实施例三十四为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物12的产率为62%。
本发明实施例三十四制得的化合物12的表征结果如下(核磁共振氢谱见图23,碳谱见图24):
1hnmr(400mhz,cdcl3):δ7.39-7.35(m,1h),7.34-7.27(m,4h),7.25-7.18(m,6h),7.12(d,j=8.0hz,2h),6.88(t,j=7.6hz,1h),5.64(s,1h),3.80-3.64(m,2h),3.20-3.07(m,1h),3.04-2.95(m,1h).
13cnmr(100mhz,cdcl3):δ149.5,135.4,134.4,131.7,129.1,128.9,128.1,128.0,127.4,127.2,126.25,123.0,119.6,116.7,88.5,84.7,52.3,43.4,28.9.
本发明的实施例三十五为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例一的差别在于:如下式所示:
所得化合物13的产率为14%。
本发明实施例三十五制得的化合物13的表征结果如下(核磁共振氢谱见图25,碳谱见图26):
1hnmr(400mhz,cdcl3):δ7.32-7.27(m,1h),7.25-7.15(m,3h),7.07(d,j=8.8hz,2h),6.89(d,j=9.2hz,2h),5.34(d,j=1.6hz,1h),3.79(s,3h),3.58-3.50(m,2h),3.18-3.06(m,1h),2.95-2.85(m,1h),2.31(d,j=2.0hz,1h).
13cnmr(100mhz,cdcl3):δ154.3,143.7,134.8,133.9,129.1,127.3,127.2,126.2,119.9,114.4,82.5,73.5,55.5,53.6,43.9,28.8.
本发明的实施例三十六为:一种炔基化四氢异喹啉类化合物的制备方法,与实施例三十五的差别在于:将丙炔酸替换为丙炔二酸,所得化合物13的产率为15%。
本发明的实施例三十七为:一种酶抑制剂中间体的制备方法,包括以下步骤:在室温条件(25℃)下,以ch2cl2(75ml)为溶剂,将化合物1(0.1mol)、aupph3cl(10mol%)、agntf2)(10mol%)和msoh(0.11mol)反应16h制得如下式所示化合物14;
结合本发明的实施例一至三十六,得知四氢异喹啉上不同位置的取代基,都能以中等偏上的收率得到了炔基化产物,然而当四氢异喹啉上含有吸电子基团br时,产率有明显的下降。紧接着我们也考察了n-芳基上的取代基,同样也以50%左右收率得到了相应炔基化产物。遗憾的是,丙炔酸参与该反应仅以14%左右的产率得到了末端炔炔基化产物。使用丙二炔酸参与反应时,得到的产物与丙炔酸参与此反应得到的产物相同。
本发明实施例一至三十六反应的机理如下式所示:
四氢异喹啉底物a在阳极直接被氧化成亚胺正离子中间体b,中间体b不是很稳定,丙炔酸负离子可能进一步去稳定中间体b形成c,然后在路易斯酸的条件下形成稳定的中间体d。然而形成炔铜中间体有两种途径,如上式所示,一种是丙炔酸在阳极氧化下形成炔基自由基,然后在和铜催化剂形成炔铜中间体;另一种是丙炔酸和铜催化剂形成羧铜中间体,然后在阳极氧化下形成炔铜中间体。最后炔铜中间体进攻d形成最终产物e。
综上所述,本发明提供的合成方法选用四氢异喹啉类化合物(thiqs)与炔酸的脱羧偶联反应,一步法制得了炔基化四氢异喹啉类化合物,该制备方法反应条件温和,不需要使用危险的气体,制备步骤简单,能够实现炔基化四氢异喹啉类化合物的大规模生产。
上面结合说明书及附图内容对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
- 还没有人留言评论。精彩留言会获得点赞!