一种双分子罗丹明荧光探针R6G-PA及其制备方法和应用
一种双分子罗丹明荧光探针r6g
‑
pa及其制备方法和应用
技术领域
1.本发明涉及有机合成技术领域,具体涉及一种双分子罗丹明荧光探针r6g
‑
pa及其制备方法和应用。
背景技术:
2.铁是地壳含量第二高的元素,fe
3+
在自然界中广泛存在,并在人体新陈代谢过程中发挥着重要作用,是人体所必需的微量元素之一。然而,过多摄入fe
3+
会对肝、肾及dna造成损伤,若摄入不足,也会导致呼吸困难和贫血等疾病。因此,开发高灵敏度、高选择性的铁离子检测体系具有重要的意义。
3.目前检测fe
3+
所用的探针材料有有机染料、碳量子点、金纳米粒子等。有机小分子类比色/荧光探针因其设计简单,检测迅速、灵敏度高且检出限低等优点引起了国内外学者的广泛关注。在以香豆素类、萘酰亚胺类、花菁类、罗丹明类等为代表的有机小分子比色/荧光探针中,罗丹明b和罗丹明6g有优良的光学和化学特性。如长吸收与发射波长,高摩尔吸光系数,以及高量子产率,加之本身是闭合环状的酰胺结构,大多没有颜色,荧光强度很低,而在强酸或特定金属离子存在条件下,其内酰胺环便会打开,伴随着肉眼可见的颜色变化,实现快速检测,并且同时荧光强度增大,这种“关
‑
开”型荧光传感器使得离子检测更加简单。罗丹明类探针实现了通过比色/荧光提供两种不同光谱响应双通道检测一种或多种分析物。另外,铁离子的顺磁特性,使得大多fe
3+
荧光探针是淬灭型的。因此,基于光谱性能优越的罗丹明b和罗丹明6g发展一种“off
‑
on”型的比色/荧光响应型铁离子探针对铁离子的检测具有重要意义。
技术实现要素:
4.为了解决上述问题,本发提供一种双分子罗丹明荧光探针r6g
‑
pa、制备方法及其应用。本发明利用罗丹明6g乙二胺与对苯二甲醛的亲核加成反应,合成一种以芳烃为轴的含有两个对称结构的罗丹明6g骨架的fe
3+
荧光探针r6g
‑
pa。该探针在溶液中可以与fe
3+
以1:2的化学计量比进行配位,诱导探针内螺酰胺环开环,致使探针分子的骨架发生变化,溶液颜色变成橙红色,并在560nm处发出强烈的绿色荧光。即使在其它离子干扰下仍显示出对fe
3+
高度的选择性和灵敏性,该探针可以作为“裸眼”和荧光“开启”型探针特异性地检测fe
3+
,方便、快速、准确度高。
5.为了实现上述目的,本发明采用的第一个技术方案为:一种双分子罗丹明荧光探针r6g
‑
pa,所述双分子罗丹明荧光探针r6g
‑
pa的结构式如下所示:
。
6.本发明采用的技术方案之二为:一种本发明所述双分子罗丹明荧光探针r6g
‑
pa的制备方法,包括以下步骤:s1在乙醇溶液中罗丹明6g与乙二胺进行反应生成罗丹明6g乙二胺;s2:在乙醇溶液中罗丹明6g乙二胺与对苯二甲醛反应生成荧光探针r6g
‑
pa。
7.进一步地,包括以下步骤:s3:将罗丹明6g乙醇溶液缓慢加入乙二胺中,加热回流至荧光全部消失,抽滤,洗涤,用乙醇重结晶后得到白色固体,即罗丹明6g乙二胺;具体的为将罗丹明6g乙醇溶液缓慢加入乙二胺中,85℃回流反应12h,采用tlc跟踪反应进程,至荧光全部消失后表明反应结束,抽滤,将得到的固体进行水洗,对水洗得到的粗产物进行乙醇重结晶得到罗丹明6g乙二胺。
8.s4:将步骤s3中得到的罗丹明6g乙二胺溶解于无水乙醇中,加入对苯二甲醛,回流反应至原料消失,停止反应,冷却至室温后抽滤,用无水乙醇和水各洗涤三次,干燥后得到白色固体,即荧光探针r6g
‑
pa。
9.具体的为,罗丹明6g乙二胺溶解于无水乙醇中至罗丹明6g乙二胺完全溶解后加入对苯二甲醛,回流反应24h,采用tlc跟踪反应进程至反应为完全反应后冷却至室温,抽滤,用无水乙醇和水各清洗三次,干燥后得到荧光探针r6g
‑
pa。
10.进一步地,步骤s1中加入罗丹明6g与乙二胺的质量比为2:1。
11.更进一步地,步骤s2中加入罗丹明6g乙二胺与对苯二甲醛的质量比为6.8:1。
12.本发明采用的技术方案之三为:一种本发明所述的双分子罗丹明荧光探针r6g
‑
pa用于检测fe
3+
的用途。
13.本发明采用的技术方案之四为:一种本发明所述的双分子罗丹明荧光探针r6g
‑
pa在制备检测液体中fe
3+
的试剂中的应用。
14.进一步地,所述液体为含有fe
3+
的水溶液或血液。
15.本发明的有益效果:本发明制备的双分子罗丹明荧光探针r6g
‑
pa与现有技术相比具有以下优点:一、具有高度选择性和良好的抗干扰能力,在对溶液中fe
3+
检测时不受溶液中al
3+
、 cu
2+
、ag
+
、 ca
2+
、 cd
2+
、 k
+
、 na
+
、 mg
2+
、ni
2+
、 zn
2+
、 co
2+
等的干扰。
16.二、检出限低:过紫外吸收与荧光分光光度法检测fe
3+
的最低检出限分别为0.1μm和0.027μm。
17.三、肉眼可见检测效果:在采用本发明的探针对fe
3+
检测时,可以不借助其它工具观察到含有fe
3+
的溶液加入r6g
‑
pa变为粉红色。
18.四、响应速度快:r6g
‑
pa与fe
3+
在2min内易发生明显反应。
19.除了上面所描述的目的、特征和优点之外,本发明还有其它的目的、特征和优点。下面将参照图,对本发明作进一步详细的说明。
附图说明
20.构成本申请的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
21.图1是本发明实施例荧光探针r6g
‑
pa的合成路线图;图2是本发明实施例荧光探针r6g
‑
pa的核磁共振氢谱;图3是本发明实施例荧光探针r6g
‑
pa的核磁共振碳谱;图4是本发明实施例荧光探针r6g
‑
pa的红外光谱;图5是本发明实施例荧光探针r6g
‑
pa的高分辨质谱;图6是本发明实施例荧光探针r6g
‑
pa加入al
3+
/fe
3+
前后在不同ph溶液中的吸光度和荧光强度,其中a为吸光度,b为荧光强度;图7是本发明实施例加入不同金属离子的r6g
‑
pa的吸光度和荧光强度变化,其中a为吸光度,b为荧光强度;c为探针溶液加入不同离子后的颜色变化,d为探针溶液加入不同离子后在365nm紫外灯下的光学照片;图8是本发明实施例荧光探针r6g
‑
pa加入fe
3+
前后含其它金属离子的在560nm处的荧光强度,其中,1为al
3+
、2为cu
2+
、3为ag
+
、4为ca
2+
、5为cd
2+
、6为k
+
、7为na
+
、8为mg
2+
、9为ni
2+
、10为zn
2+
、11为co
2+
、12为hg
2+
、13为ba
2+
、14为1
‑
13所列的金属离子混合溶液;图9是本发明实施例加入50 μm fe
3+
后r6g
‑
pa的吸收光谱和荧光光谱随时间变化图,a为吸光光谱,b为荧光光谱;图10是本发明实施例的20μm r6g
‑
pa溶液在不同浓度fe
3+
中的吸收光谱和荧光光谱,其中a为吸光光谱,c为荧光光谱;b为不同fe
3+
浓度下530nm处的吸光度,d为不同fe
3+
浓度下560nm处的荧光强度;图11是本发明实施例在tris
‑
hcl缓冲溶液中,r6g
‑
pa与fe
3+
离子的job曲线;图12为本发明实施例的r6g
‑
pa溶液交替加入fe
3+
和edta后560nm处的荧光强度和荧光光谱,a为荧光强度,b为荧光光谱;图13为本发明实施例的fe
3+
与r6g
‑
pa的结合机理图。
具体实施方式
22.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
23.本申请以下实施例所用试剂溶液配制方法如下:r6g
‑
pa探针乙腈溶液的配制:称取一定量的实施例1制备的r6g
‑
pa溶于无水乙腈中,超声30s溶解,配置浓度为100
µ
m的溶液。
24.金属离子储备液的配制:称取一定量的pb(no3)2、agno3、ba(no3)2、ca(no3)2、cu(no3)2、 cd(no3)2、fe(no3)3、hg(no3)2、kno3、mg(no3)2、nano3、ni(no3)2、co(no3)2、zn(no3)2均
用三次水溶解,配制成5mm的金属离子储备液备用。
25.tris溶液配制:取一定量的tris,加入少量去离子水将其完全溶解,以乙腈/水(v/v=1:3)定容到50ml,得到10mm的tris溶液。
26.0.1mmhcl配制:量取一定体积的12m的浓盐酸,用去离子水稀释到0.1 mm。
27.10mmtris
‑
hcl缓冲溶液配制:取一定量定容后的tris,往其中缓慢滴加0.1mm的hcl,配制不同ph值的溶液,密封避光保存。
28.10mm的edta溶液配制:称取0.1821g的edta,用去离子水溶解定容50ml。
29.实施例1罗丹明6g乙二胺的合成:将1.6g罗丹明6g溶于50ml乙醇中,再逐滴缓慢加入乙二胺0.8g,85℃回流12h,tlc跟踪反应进程至荧光全部消失,抽滤,水洗得到粗产物,用乙醇重结晶后得到白色固体。
30.r6g
‑
pa的合成:50ml圆底烧瓶中加入罗丹明6g乙二胺0.228g,再加入20ml无水乙醇,待罗丹明6g乙二胺完全溶解后,加入对苯二甲醛0.0335g,回流反应24小时。tlc检测反应进度,待原料消失,停止反应,冷却到室温后抽滤,用无水乙醇及水各洗涤三次,干燥后得到白色固体,产率75%,反应式如图1所示。
31.将所得探针分子溶于cdcl3进行核磁测试,所得核磁共振氢谱如图2所示:1h nmr (400 mhz, chcl3)δ:ppm7.93(dd,j=10.6,8.3 hz, 4h), 7.52(s, 4h),7.46
–
7.39(m,4h),7.02(dd,j= 5.5, 2.3hz,2h),6.33(s,4h), 6.21(s, 4h),3.45
–
3.38(m,8h),3.21
–
3.15(m,8h),1.82(s,12h),1.31(t,j=7.1hz, 12h)。
32.所得核磁共振碳谱如图3所示:
13
c nmr(100 mhz, chcl3)δ:ppm 168.4, 161.7,153.8,151.7,147.3,137.8,132.4,131.0,128.5, 127.9, 123.8, 122.7, 117.8, 106.0, 96.6, 65.0, 59.1, 41.2, 38.3, 16.6, 14.7.采用溴化钾压片法测得本发明探针分子的红外光谱如图4所示:ir(kbr), v/cm
‑
1: 3420, 2972, 2369, 1688 (spirolactam ring c=o), 1518, 1376, 1212, 1006, 737。其中,3420cm
‑1为羟基o
‑
h伸缩振动,2972cm
‑1处为
‑
ch3及
‑
ch2的特征吸收峰;1688cm
‑1为羰基征振动吸收峰;1518cm
‑1为苯环特征振动峰。
33.对探针r6g
‑
pa进行高分辨质谱表征,如图5,hrms(esi): m/z [m+h]+ calcd. for c64h67n8o4: 1011.5285; found: 1011.5299.实施例2罗丹明6g乙二胺的合成:将16g罗丹明6g溶于500ml乙醇中,再逐滴缓慢加入乙二胺8g,85℃回流12h,tlc跟踪反应进程至荧光全部消失,抽滤,水洗得到粗产物,用乙醇重结晶后得到白色固体。
[0034]
r6g
‑
pa的合成:50ml圆底烧瓶中加入罗丹明6g乙二胺2.28g,再加入200ml无水乙醇,待罗丹明6g乙二胺完全溶解后,加入对苯二甲醛0.335g,回流反应24小时。tlc检测反应进度,待原料消失,停止反应,冷却到室温后抽滤,用无水乙醇及水各洗涤三次,干燥后得到白色固体。
[0035]
实施例3为研究溶液ph值对本申请制备的r6g
‑
pa探针分子与fe
3+
的配位作用的影响,并筛选出最佳的ph缓冲溶液:
在离心管中加入200
µ
l的探针储备液,再将配好的tris
‑
hcl缓冲溶液(ph=2
‑
9)分别加入离心管中,然后在每个ph的溶液中分别加入20
µ
l的fe(no3)3和al(no3)3溶液,充分反应后测定其紫外
‑
可见吸收光谱与荧光光谱,由图6a可知,游离的探针在ph2
‑
3时,530nm处的吸光度大幅度增加,当ph>3时强度逐渐降低;在ph>6时,几乎没有吸收。加入fe
3+
后,在ph=6处吸收增强;加入al
3+
后,在ph=6处有微弱的吸收增强。由图6b可以看出,560nm时游离的探针在ph2
‑
3时荧光强度大幅度增加,ph>3时强度逐渐降低,在ph>6时荧光淬灭。加入fe
3+
后,在ph=6时fe
3+
荧光增强明显;加入al
3+
后,在ph=6时显示很弱的荧光。因此,本发明的荧光探针需要在ph=6的tris
‑
hcl溶液中对fe
3+
进行检测。
[0036]
实施例4为了探究本发明的探针r6g
‑
pa对金属离子识别的选择性。如图7a所示,只有加入fe
3+
和al
3+
时,在530nm处出现了吸收峰,而其它金属离子未能引起r6g
‑
pa吸收光谱的变化。游离的r6g
‑
pa在540
‑
650nm范围内没有荧光信号,加入fe
3+
后在560nm处发射强烈的荧光,而加入al
3+
后在560nm处发射峰很弱,可以忽略不计,并没有造成干扰。从图7b也可以看出,其它金属离子对r6g
‑
pa荧光光谱影响很弱。加入al
3+
后吸收和荧光虽都有变化,但变化很弱,可以忽略,因此r6g
‑
pa并不能有效的识别al
3+
,所以对fe
3+
的识别不会产生明显的干扰。如图7c所示,观察在日光灯下的照片发现,加入fe
3+
和al
3+
溶液颜色都变成粉红色(因为专利中不能使用彩图,所以看不到粉红色,但在实际的实验过程中有肉眼可见粉红色),但fe
3+
溶液颜色明显比al
3+
溶液颜色深很多,表明fe
3+
的吸收强于al
3+
。如图7d所示,365nm的紫外灯下,只有加入fe
3+
的溶液发出强烈的绿色荧光,这可能是由于fe
3+
离子具有高的电荷数以及合适的离子半径,更适合与r6g
‑
pa配位,因此本发明的荧光r6g
‑
pa可以作为比色/荧光探针特异性识别fe
3+
。
[0037]
实施例5为探究其它金属离子存在时本发明的荧光探针r6g
‑
pa对fe
3+
的识别性能。在20
µ
m的r6g
‑
pa探针溶液中分别加入上述配制的不同金属离子溶液50
µ
m,测试荧光光谱,记录560nm处的荧光强度;然后加入10
µ
m的fe
3+
,进行荧光性质测试,结果如图8所示。加入fe
3+
前,r6g
‑
pa探针溶液和其它金属离子溶液的荧光强度都很弱,但是加入fe
3+
后溶液的荧光强度与fe
3+
单独存在时的强度很接近,证明其它金属离子的存在对fe
3+
的检测没有明显影响,说明本发明制备的r6g
‑
pa荧光探针检测fe
3+
时具有较强的抗干扰能力。
[0038]
实施例6在2ml离心管中加入200
µ
l的探针溶液,用ph=6的tris
‑
hcl的缓冲溶液稀释到2ml,再加入20
µ
l的fe
3+
储备液。每隔2min,测试吸收光谱与荧光光谱,如图9所示,分别为530nm的吸光度和560nm的荧光强度随时间变化的曲线图(箭头方向为时间从0
‑
20min的吸收光谱与荧光光谱图的方向)。随着时间延长,溶液吸光度和荧光强度不断增大。通过光谱图发现fe
3+
加入后,r6g
‑
pa的吸收强度与荧光强度均变化较快,14min后变化速度减慢,逐渐趋于稳定,20min后反应达到平衡。说明r6g
‑
pa与fe
3+
在2min内易发生明显反应,说明该探针对fe
3+
可快速响应。
[0039]
实施例7为了探究r6g
‑
pa检测fe
3+
的灵敏度,在2ml离心管中加入200
µ
l探针溶液,用ph=6的tris
‑
hcl缓冲溶液稀释到2ml,再加入一系列不同浓度的fe
3+
(0
‑
60
µ
m),反应20min后,测定
吸收与荧光光谱。未加fe
3+
前,r6g
‑
pa无色且无荧光,随着加入fe
3+
浓度的不断增大,溶液颜色逐渐变红,对应的r6g
‑
pa的吸收与荧光强度也不断增大,如图10a和10c。当fe
3+
浓度增加到60
µ
m时,r6g
‑
pa的吸收强度与荧光强度不再变化。在吸收光谱中,fe
3+
浓度在10
‑
50m范围内与r6g
‑
pa的吸收强度呈现良好的线性关系,r
2 = 0.9859,比色滴定检测fe
3+
的最低检出限为0.1
µ
m ,如图10b所示。在荧光光谱中,fe
3+
浓度在8
‑
45
µ
m范围内与r6g
‑
pa的荧光强度有着良好的线性关系,r2= 0.9855,荧光检测fe
3+
的最低检测限为0.027
µ
m ,如图10d所示。
[0040]
实施例8为进一步探究本发明r6g
‑
pa荧光探针对fe
3+
的检测机理,分别配置探针与fe
3+
的摩尔比从1:9变化到9:1,每个浓度比的混合溶液中探针r6g
‑
pa与fe
3+
的总浓度保持100
µ
m不变,测量不同化学计量比的荧光强度。以[fe
3+
]/([r6g
‑
pa]+[fe
3+
])为横坐标,对应荧光强度为纵坐标,绘制曲线,如图11所示。fe
3+
的摩尔分数从0.1到0.6,荧光强度逐渐增大,从0.6到0.9,荧光强度逐渐减小。故当fe
3+
的摩尔分数为0.6,荧光强度最大。表明r6g
‑
pa与fe
3+
的配位比为1:2。
[0041]
乙二胺四乙酸(ethylene diamine tetraacetic acid, edta)与很多金属离子配位形成络合物,因此常被用来检测探针的可逆性。在2ml的离心管中加入200
µ
l的探针溶液,用ph=6的tris
‑
hcl缓冲溶液稀释到2ml,再加入20
µ
l的fe
3+
。充分反应后,记录荧光强度。再往上述溶液中加入同体积10mm的edta溶液,固定混合液中fe
3+
浓度为50
µ
m,edta浓度为100
µ
m,测试荧光光谱。混合液中再依次交替加入20
µ
l的fe
3+
和20
µ
l 10mm的edta溶液,测试荧光光谱,循环测试5次。荧光强度变化如图12所示。第一次加入edta后溶液荧光强度大幅度降低近乎无荧光,而再次加入fe
3+
后荧光恢复,强度接近溶液中只存在fe
3+
的荧光强度。说明edta可以从r6g
‑
pa
‑
fe3+络合物中将fe
3+
释放出来,荧光淬灭。如此反复5个循环,荧光强度未发生明显衰减,可见r6g
‑
pa荧光探针可通过edta的配位竞争释放r6g
‑
pa络合的fe
3+
,并实现可逆检测。
[0042]
罗丹明类物质的内酰胺环在未打开前,一般都是无色且无荧光,与特异性物质结合后,会使得内螺酰胺环打开。在fe
3+
存在下,探针r6g
‑
pa的螺内酰胺打开,并伴随着溶液颜色的变化及荧光大幅度增强。推测机理可能是探针r6g
‑
pa的螺内酰胺环在fe
3+
的诱导下开环,然后与两当量的fe
3+
结合,r6g
‑
pa中的羰基o和亚氨基n是fe
3+
最可能的结合位点,具体过程如图13所示,r6g
‑
pa的螺内酰胺环开环后与fe
3+
配位形成络合物,是引起紫外
‑
可见吸收光谱和荧光光变化的内因。
[0043]
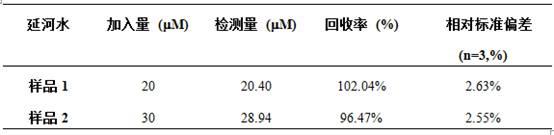
实施例9以延河水作为真实水样采用加标回收法验证探针r6g
‑
pa对水体中fe
3+
离子的检测。此时水中其他离子浓度很低,忽略不计,edta不影响结果的测定。将100μl和200μl的各种实际水样和r6g
‑
pa储备液混合,并通过tris
‑
hcl缓冲溶液(10mm,ph 6.0)稀释至2 ml,溶液中r6g
‑
pa的浓度为20μm。将已知浓度的fe
3+
离子分别添加到上述制备的含有r6g
‑
pa和真实水样的溶液中。充分反应后测其荧光光谱变化,测试重复三次。结果见表1所示,回收率为96.47%
‑
102.04%。
[0044]
表1为水样中fe
3+
的测定
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1