多酶体系供给α-酮戊二酸及其用于合成4-羟基异亮氨酸
本发明涉及多酶体系供给α-酮戊二酸及其用于合成4-羟基异亮氨酸,属于生物催化技术领域。
背景技术:
4-羟基异亮氨酸的化学结构为:
4-羟基异亮氨酸((2s,3r,4s)-4-hydroxyisoleucine,4-hil)来源于葫芦巴植物,是一种新型的胰岛素分泌促进剂,具有刺激β-胰岛细胞分泌胰岛素的作用,可用于治疗ii型糖尿病。
除了从葫芦巴种子中提取分离,4-hil的合成方法主要有化学-酶法和酶催化法。wang等发明八步化学-酶合成法合成4-hil:首先以2-甲基乙酰乙酸乙酯为原料,在地霉菌的作用下得到(2s,3s)-3-羟基-2-甲基丁酸乙酯,再经过7个步骤转变成4-hil。fulcrand等提出六步化学-酶合成法合成4-hil:第一步以溴乙酸叔丁酯为底物,在二苄胺的催化下得到二-n-苯甲基甘氨酸叔丁酯,经过开环、色层分析等步骤分离得到外消旋4-hil内酯,最后在青霉素酰基转移酶作用下水解n-苯乙酰内酯衍生物得到4-hil。
化学-酶法合成4-hil的步骤复杂,中间副产物多且转化效率较低。kodera等为了追求更有效率的4-hil合成方法,获得苏云金芽孢杆菌来源的具有l-异亮氨酸羟基化活性的l-异亮氨酸双加氧酶,可将l-异亮氨酸转变为4-hil。cn104152505a披露了通过筛选获得一株具有l-异亮氨酸双加氧酶活性的枯草芽孢杆菌,克隆了其异亮氨酸双加氧酶基因,然后构建带有目的基因的重组菌株,通过重组菌催化转化底物l-异亮氨酸得到4-hil。l-异亮氨酸双加氧酶属于fe(ii)/α-kg依赖型双加氧酶超家族,该家族酶利用分子氧激活c-h键来参加生物体内很多重要反应,包括羟基化、脱氧、扩环和去饱和等,这些反应常常同时伴随着α-酮戊二酸氧化脱羧形成co2+和琥珀酸。
在以l-异亮氨酸双加氧酶为催化中心的反应体系中需要提供大量的α-酮戊二酸,并且作为辅底物α-酮戊二酸的量直接影响酶的催化效率。考虑到过程经济性和工业可行性,耦联高效、低成本的α-酮戊二酸再生系统很有必要。smirnov等将4-hil的生成与三羧酸循环耦联起来,利用大肠杆菌产生l-异亮氨酸双加氧酶,以100mml-异亮氨酸为底物进行生物转化24h后,4-hil转化率可达82%。zhang等通过代谢工程对产生l-异亮氨酸双加氧酶的谷氨酸棒状杆菌进行改造,将工程菌株进行发酵转化64h后,4-hil产量为34.21g·l-1。目前,在生物催化工业生产体系中,以廉价的l-谷氨酸为底物,多采用l-谷氨酸脱氨酶或l-谷氨酸氧化酶来催化生产α-酮戊二酸。liu等报道了一种l-氨基酸氧化酶在α-酮戊二酸的生产中的应用,而laao对l-谷氨酸的活性较低,对底物和产物浓度较高有抑制作用。niu等公开了一种l-谷氨酸氧化酶催化生产α-酮戊二酸的方法,由于l-谷氨酸氧化酶催化l-谷氨酸生成α-酮戊二酸的同时伴随着h2o2的产生,因此需在体系中添加过氧化氢酶以消除h2o2的毒害作用。l-谷氨酸氧化酶对l-谷氨酸的活性高,在24小时内可将110g/l的l-谷氨酸转化为104.7g/l的α-酮戊二酸。
技术实现要素:
[技术问题]
本发明要解决的技术问题是,现有通过对菌株代谢工程改造实现α-酮戊二酸供给并用于4-hil合成的方法中,重构tca循环会抑制细胞生长,且对转化效率提高有限,反应周期较长。
[技术方案]
本发明基于fe(ii)/α-kg依赖型双加氧酶超家族催化c-h键氧化反应特征,构建一种由廉价底物出发的多酶级联体系以及该体系在合成4-hil中的应用。本发明不仅仅构建一种经济的多酶级联体系用于4-hil的合成,还通过精准调整和优化反应条件实现良好的反应相容性和反应的协同作用,进一步建立转化羟基氨基酸的高效共性的反应体系。
本发明目的是提供一种多酶级联体系转化生产4-hil的方法,以l-异亮氨酸及l-谷氨酸为底物,利用l-异亮氨酸双加氧酶、l-谷氨酸氧化酶和过氧化氢酶同步级联催化生成4-hil;具体是以一水合谷氨酸钠为底物,通过l-谷氨酸氧化酶将一水合谷氨酸钠转化为α-酮戊二酸作为共底物用于fe(ii)/α-kg依赖型双加氧酶超家族催化c-h键氧化反应,并利用过氧化氢酶消除伴随α-酮戊二酸生成的h2o2。所述方法采用下述(1)、(2)或(3)所示的转化体系:
(1)一锅法
l-异亮氨酸、一水合l-谷氨酸钠、l-抗坏血酸、feso4·7h2o、l-异亮氨酸双加氧酶、l-谷氨酸氧化酶和过氧化氢酶;所述l-异亮氨酸的浓度为100~500mm,所述l-异亮氨酸与一水合l-谷氨酸钠摩尔比为1:1~1.1,所述l-抗坏血酸的浓度为0~50mm,所述feso4·7h2o的浓度为0~5mm;所述l-异亮氨酸双加氧酶的浓度为1~2mg·ml-1(5.84±0.07u·mg-1),所述l-谷氨酸氧化酶的浓度为0.1~0.5mg·ml-1(2.67±0.09u·mg-1),所述过氧化氢酶的浓度为200~600u·ml-1,转化过程中将蛋l-异亮氨酸与一水合l-谷氨酸钠比为1:1~1.1一次性加入到转化体系中进行转化。
(2)两阶段转化法
l-异亮氨酸、一水合l-谷氨酸钠、l-抗坏血酸、feso4·7h2o、l-异亮氨酸双加氧酶、l-谷氨酸氧化酶和过氧化氢酶;所述l-异亮氨酸的浓度为100~500mm,所述一水合l-谷氨酸钠的浓度为100~550mm,所述l-抗坏血酸的浓度为0~50mm,所述feso4·7h2o的浓度为0~5mm;所述l-异亮氨酸双加氧酶的浓度为1~2mg·ml-1,所述l-谷氨酸氧化酶的浓度为0.1~0.5mg·ml-1,所述过氧化氢酶的浓度为200~600u·ml-1。转化过程分为两个阶段:第一阶段将一水合l-谷氨酸钠、l-谷氨酸氧化酶和过氧化氢酶按照上述浓度加入到转化体系中进行转化;第二阶段将与一水合l-谷氨酸钠等摩尔浓度的l-异亮氨酸及l-抗坏血酸、feso4·7h2o按照上述浓度一次性加入到转化体系中进行转化。
(3)两阶段分批次转化法
l-异亮氨酸、一水合l-谷氨酸钠、l-抗坏血酸、feso4·7h2o、l-异亮氨酸双加氧酶、l-谷氨酸氧化酶和过氧化氢酶;所述l-异亮氨酸的浓度为100~500mm,所述一水合l-谷氨酸钠的浓度为100~550mm,所述l-抗坏血酸的浓度为0~50mm,所述feso4·7h2o的浓度为0~5mm;所述l-异亮氨酸双加氧酶的浓度为1~2mg·ml-1,所述l-谷氨酸氧化酶的浓度为0.1~0.5mg·ml-1,所述过氧化氢酶的浓度为200~600u·ml-1。转化过程分为两个阶段:第一阶段将一水合l-谷氨酸钠、l-谷氨酸氧化酶和过氧化氢酶按照上述浓度加入到转化体系中进行转化;第二阶段将l-抗坏血酸、feso4·7h2o按照上述浓度一次性加入到转化体系,根据底物的消耗程度分批次加入l-异亮氨酸至与一水合l-谷氨酸钠等摩尔浓度进行转化(例如,第二阶段反应起始添加200mml-异亮氨酸为底物,每当体系中l-异亮氨酸浓度小于50mm时补加l-异亮氨酸)维持体系中l-异亮氨酸浓度为50~200mm。
进一步地,所述转化体系(1)、(2)或(3)将底物及酶添加到ph7.0~8.0的tris-hcl溶液中进行转化反应。
进一步地,所述转化体系(1)中转化的温度为25~35℃,ph为7.0~8.0,转化时间为0.5~2h,转速为200~400rpm。
进一步地,所述转化体系(2)中转化的温度为25~35℃,ph为7.0~8.0,第一阶段转化时间为2~5h,第二阶段转化时间为2~9h,转速为200~400rpm。
进一步地,所述转化体系(3)中转化的温度为25~35℃,ph为7.0~8.0,第一阶段转化时间为2~5h,第二阶段转化时间为2~9h,转速为200~400rpm。
进一步地,所述用于4-hil合成的l-异亮氨酸双加氧酶的来源包括但不限于枯草芽孢杆菌(bacillussubtilis)或者利用大肠杆菌表达得到,例如以大肠杆菌bl21(de3)为宿主,以pet28a为载体。进一步地,所述l-异亮氨酸双加氧酶的氨基酸序列如seqidno:3所示,编码所述l-异亮氨酸双加氧酶的基因的核苷酸序列如seqidno:1所示。
进一步地,转化过程中所述l-谷氨酸氧化酶的来源包括但不限于加纳链霉菌(streptomycesghanaensis)或者利用大肠杆菌表达得到,例如以大肠杆菌bl21(de3)为宿主,以pet28a为载体。进一步地,所述l-谷氨酸氧化酶的氨基酸序列如seqidno:4所示,编码所述l-谷氨酸氧化酶的基因的核苷酸序列如seqidno:2所示。
进一步地,所述过氧化氢酶来源于牛肝脏(bovineliver)。
[有益效果]
本发明利用酶催化合成α-酮戊二酸以促进双加氧酶介导的羟基化反应,并通过精准调整和优化反应条件实现良好的反应相容性和反应的协同作用,实现4-hil更经济的生物转化。
本发明利用多酶级联催化l-异亮氨酸生产4-hil,并通过分批补料解除底物抑制,4-hil达到465.61mm,最终转化率达到93.12%。根据fe(ii)/α-kg依赖型双加氧酶超家族催化c-h键氧化反应特征,共底物α-酮戊二酸由价格低廉的一水合谷氨酸钠出发,发酵后通过亲和层析大量制备转化所需的l-异亮氨酸双加氧酶和l-谷氨酸氧化酶,操作简便,副产物少,下游纯化简易,可建立一个高效共性的生物酶法合成4-hil的工艺。
附图说明
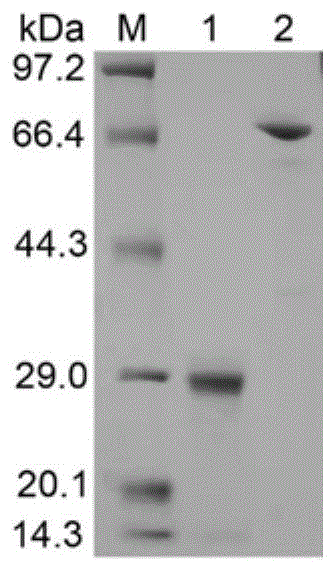
图1:多酶级联反应体系中蛋白纯化后的sds-page电泳结果;其中,m为蛋白分子量标准;1为l-异亮氨酸双加氧酶(ido)纯化后的sds-page电泳结果;2为l-谷氨酸氧化酶(lgox)纯化后的sds-page电泳结果;
图2:多酶级联反应体系合成4-hil的路线。
具体实施方式
样品预处理:取反应液于12000rpm离心10min收集上清液,配制4-hil及α-酮戊二酸标准溶液。将适度稀释后的反应上清液和标准溶液用高效液相色谱法检测。
反应液中氨基酸的含量测定。衍生方法:吸取上述离心后上清液,稀释到一定浓度范围后取250μl样品,加入250μl0.2mol·l-1(m)ph9.2的硼酸缓冲液,再加入500μl10mmol·l-1(mm)的fmoc-cl,摇匀后置于25℃金属浴上反应10min,然后加入500μl40mm的1-氨基金刚烷终止反应,用0.22μm的有机滤头过滤,用于检测分析。检测条件:采用diomansilc18柱,紫外检测波长263nm,温度25℃,流速1ml·min-1,进样量10μl。采用梯度洗脱方式,流动相a为:(50mm醋酸钠-冰醋酸缓冲,ph4.2):乙腈=50%:50%;流动相b:乙腈。
反应液中有机酸的含量测定:吸取上述离心后上清液,稀释到一定浓度范围后用0.22μm的水系滤头过滤进行检测。采用waterst3柱,紫外吸收波长210nm,柱温40℃,流动相:20mmkh2po4溶液,ph2.8,流速:0.8ml·min-1,进样量10μl。
重组l-异亮氨酸双加氧酶酶活测定方法:酶活测定体系:10mml-异亮氨酸,0.5mmfeso4·7h2o,10mm抗坏血酸,10mmα-酮戊二酸,50mmtris-hcl缓冲液(ph7.0),随后加入一定量重组l-异亮氨酸双加氧酶纯酶,于30℃条件下反应5min后,测定体系中4-hil含量。1个酶活力单位是指在30℃条件下,每分钟催化l-异亮氨酸羟基化反应生成1μmol4-hil所需的酶量。
重组l-谷氨酸氧化酶酶活测定方法:取在30℃下孵育的0.2ml反应液(含5mml-谷氨酸,6mm苯酚,6mm4-氨基安替比林,1u辣根过氧化物酶,0.1mtris-hcl,ph7.0),随后加入一定量的酶液,采用酶标仪进行吸光值的在线测定。1个酶活力单位是指在30℃下,每分钟生成1μmol过氧化氢所需要的酶量定义为一个酶活单位(u)。
表达l-异亮氨酸双加氧酶的工程菌e.colipet28a-l-异亮氨酸双加氧酶的构建:来源于bacillussubtilis(cctcc:m2013373)的l-异亮氨酸双加氧酶(l-异亮氨酸双加氧酶)的基因编码序列如seqidno:1所示,编码的氨基酸序列如seqidno:3所示。将人工合成的含有ncoi和sali酶切位点的l-异亮氨酸双加氧酶基因片段进行双酶切,将该基因连接至同样进行双酶切后的表达载体pet28a,得到表达质粒pet28a-l-异亮氨酸双加氧酶;将构建好的表达质粒pet28a-l-异亮氨酸双加氧酶导入e.colibl21(de3),在含有卡那霉素的lb平板中培养过夜,筛选阳性克隆进行测序验证,最终获得表达l-异亮氨酸双加氧酶的工程菌e.colipet28a-l-异亮氨酸双加氧酶构建成功。
表达l-谷氨酸氧化酶的工程菌e.colipet28a-l-谷氨酸氧化酶的构建:来源于streptomycesghanaensis(atcc14672)的l-谷氨酸氧化酶(genbank:efe71695.1)基因编码序列如seqidno:2所示,编码的氨基酸序列如seqidno:4所示。将人工合成的含有ncoi和xhoi酶切位点的l-谷氨酸氧化酶基因片段进行双酶切,将该基因连接至同样进行双酶切后的表达载体pet28a,得到表达质粒pet28a-l-谷氨酸氧化酶;将构建好的表达质粒pet28a-l-谷氨酸氧化酶导入e.colibl21(de3),在含有卡那霉素的lb平板中培养过夜,筛选阳性克隆进行测序验证,最终获得表达l-谷氨酸氧化酶的工程菌e.colipet28a-l-谷氨酸氧化酶构建成功。
实施例1:l-异亮氨酸双加氧酶、l-谷氨酸氧化酶的制备
1基因工程菌株的发酵培养
(1)重组大肠杆菌e.colipet28a-l-异亮氨酸双加氧酶的细胞培养
以2%(体积分数)的接种量转接至含有50mg/l卡那抗生素的50mllb培养基中,37℃,200r/min下培养od600至0.6~0.8;加入1mmiptg变温25℃诱导12~14h。在4℃,8000r/min下离心收集菌体,并用生理盐水洗涤菌体2次备用。
(2)重组大肠杆菌e.colipet28a-l-谷氨酸氧化酶的细胞培养
以2%(体积分数)的接种量转接至含有50mg/l卡那抗生素的50mllb培养基中,37℃,200r/min下培养od600至0.6~0.8;加入0.5mmiptg变温17℃诱导12~14h。在4℃,8000r/min下离心收集菌体,并用生理盐水洗涤菌体2次备用。
2重组蛋白的分离纯化
(1)l-异亮氨酸双加氧酶的分离纯化
将步骤1获得的重组菌e.colipet28a-l-异亮氨酸双加氧酶重悬于20mm、ph7.5的tris-hcl缓冲液,高压匀浆破碎后,12000r/min离心30min收集上清。采用ni-nta亲和层析法对重组蛋白分离纯化:在4℃条件下,先后用20ml乙醇和40ml去离子水冲洗层析柱,然后用20ml的结合缓冲液(40mm咪唑、0.3mmnacl、20mmtris-hcl,ph7.5)平衡层析柱;细胞破碎上清液经0.22μm滤膜过滤后缓慢注入层析柱中,先用洗脱缓冲液1(60mm咪唑、20mmtris、0.3mnacl,ph7.5)洗下杂蛋白后,利用洗脱缓冲液2(280mm咪唑、20mmtris、0.3mnacl,ph7.5)洗脱目的蛋白;目的蛋白洗脱液经脱盐柱和脱盐缓冲液(5mmdtt、10mmtris、0.1mnacl,ph7.5)处理后获得纯蛋白l-异亮氨酸双加氧酶(5.84±0.07u·mg-1)。
(2)l-谷氨酸氧化酶的分离纯化
将步骤1获得的重组菌e.colipet28a-l-谷氨酸氧化酶重悬于20mm、ph7.5的tris-hcl缓冲液,高压匀浆破碎后,12000r/min离心30min收集上清。采用ni-nta亲和层析法对重组蛋白分离纯化:在4℃条件下,先后用20ml乙醇和40ml去离子水冲洗层析柱,然后用20ml的结合缓冲液(40mm咪唑、0.3mmnacl、20mmtris-hcl,ph7.5)平衡层析柱;细胞破碎上清液经0.22μm滤膜过滤后缓慢注入层析柱中,先用洗脱缓冲液1(60mm咪唑、20mmtris、0.3mnacl,ph7.5)洗下杂蛋白后,利用洗脱缓冲液2(600mm咪唑、20mmtris、0.3mnacl,ph7.5)洗脱目的蛋白;目的蛋白洗脱液经脱盐柱和脱盐缓冲液(5mmdtt、10mmtris、0.1mnacl,ph7.5)处理后获得纯蛋白l-谷氨酸氧化酶(2.67±0.09u·mg-1)。
实施例2:过氧化氢酶浓度对α-酮戊二酸生成的影响
(1)将实施例1中获得的l-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为200mm一水合l-谷氨酸钠、0.5mg·ml-1l-谷氨酸氧化酶、200u/ml过氧化氢酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化2h后α-酮戊二酸的积累量为175.84mm,琥珀酸为14.43mm。
(2)将实施例1中获得的l-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为200mm一水合l-谷氨酸钠、0.5mg·ml-1l-谷氨酸氧化酶、300u/ml过氧化氢酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化2h后α-酮戊二酸的积累量为187.64mm,琥珀酸为12.10mm。
(3)将实施例1中获得的l-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为200mm一水合l-谷氨酸钠、0.5mg·ml-1l-谷氨酸氧化酶、400u/ml过氧化氢酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化2h后α-酮戊二酸的积累量为192.95mm,琥珀酸为6.41mm。
(4)将实施例1中获得的l-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为200mm一水合l-谷氨酸钠、0.5mg·ml-1l-谷氨酸氧化酶、500u/ml过氧化氢酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化2h后α-酮戊二酸的积累量为193.69mm,琥珀酸为6.19mm。
(5)将实施例1中获得的l-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为200mm一水合l-谷氨酸钠、0.5mg·ml-1l-谷氨酸氧化酶、600u/ml过氧化氢酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化2h后α-酮戊二酸的积累量为193.72mm,琥珀酸为4.81mm。
实施例3:底物浓度对α-酮戊二酸生成的影响
(1)将实施例1中获得的l-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为300mm一水合l-谷氨酸钠、0.5mg·ml-1l-谷氨酸氧化酶、200u/ml过氧化氢酶,50mmtris-hclbuffer(ph8.0),在200rpm、30℃条件下,转化2.5h后α-酮戊二酸的积累量为288.39mm,摩尔转化率为96.13%。
(2)将实施例1中获得的l-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为350mm一水合l-谷氨酸钠、0.5mg·ml-1l-谷氨酸氧化酶、200u/ml过氧化氢酶,50mmtris-hclbuffer(ph8.0),在200rpm、30℃条件下,转化3h后α-酮戊二酸的积累量为327.16mm,摩尔转化率为93.47%。
(3)将实施例1中获得的l-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为400mm一水合l-谷氨酸钠、0.5mg·ml-1l-谷氨酸氧化酶、200u/ml过氧化氢酶,50mmtris-hclbuffer(ph8.0),在200rpm、30℃条件下,转化4h后α-酮戊二酸的积累量为370.88mm,摩尔转化率为92.72%。
(4)将实施例1中获得的l-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为450mm一水合l-谷氨酸钠、0.5mg·ml-1l-谷氨酸氧化酶、200u/ml过氧化氢酶,50mmtris-hclbuffer(ph8.0),在200rpm、30℃条件下,转化4h后α-酮戊二酸的积累量为409.96mm,摩尔转化率为91.11%。
(5)将实施例4中获得的l-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为550mm一水合l-谷氨酸钠、0.5mg·ml-1l-谷氨酸氧化酶、200u/ml过氧化氢酶,50mmtris-hclbuffer(ph8.0),在200rpm、30℃条件下,转化5h后α-酮戊二酸的积累量为497.41mm,摩尔转化率为90.44%。
实施例4:底物浓度对4-hil生成的影响
(1)将实施例1中获得的l-异亮氨酸双加氧酶用于生成4-hil,转化体系为100mml-异亮氨酸、100mmα-酮戊二酸、50mm抗坏血酸、5mmfeso4·7h2o、1mg·ml-1l-异亮氨酸双加氧酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化3h后4-hil积累量为93.74mm,摩尔转化率为93.74%。
(2)将实施例1中获得的l-异亮氨酸双加氧酶用于生成4-hil,转化体系为200mml-异亮氨酸、200mmα-酮戊二酸、50mm抗坏血酸、5mmfeso4·7h2o、1mg·ml-1l-异亮氨酸双加氧酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化5h后4-hil积累量为183.72mm,摩尔转化率为91.86%。
(3)将实施例1中获得的l-异亮氨酸双加氧酶用于生成4-hil,转化体系为300mml-异亮氨酸、300mmα-酮戊二酸、50mm抗坏血酸、5mmfeso4·7h2o、1mg·ml-1l-异亮氨酸双加氧酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化6h后4-hil积累量为270.94mm,摩尔转化率为90.31%。
(4)将实施例1中获得的l-异亮氨酸双加氧酶用于生成4-hil,转化体系为500mml-异亮氨酸、500mmα-酮戊二酸、50mm抗坏血酸、5mmfeso4·7h2o、1mg·ml-1l-异亮氨酸双加氧酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化9h后4-hil积累量为443.27mm,摩尔转化率为88.65%。
实施例5:l-异亮氨酸双加氧酶浓度对4-hil生成的影响
(1)实施例1中获得的l-异亮氨酸双加氧酶用于生成4-hil,转化体系为500mml-异亮氨酸、500mmα-酮戊二酸、50mm抗坏血酸、5mmfeso4·7h2o、1mg·ml-1l-异亮氨酸双加氧酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化9h后4-hil积累量为443.27mm,摩尔转化率为88.65%,4-hil的生产强度为7.18g·(l·g·h)-1。
(2)实施例1中获得的l-异亮氨酸双加氧酶用于生成4-hil,转化体系为500mml-异亮氨酸、500mmα-酮戊二酸、50mm抗坏血酸、5mmfeso4·7h2o、2mg·ml-1l-异亮氨酸双加氧酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化9h后4-hil积累量为461.98mm,摩尔转化率为92.40%,4-hil的生产强度为4.85g·(l·g·h)-1。
实施例6:“一锅法”催化生产4-hil
(1)“一锅法”多酶级联合成4-hil(不添加fe2+)
将实施例1中获得的l-异亮氨酸双加氧酶及l-谷氨酸氧化酶用于催化生产4-hil,转化体系为100mml-异亮氨酸、50mm抗坏血酸、100mm一水合l-谷氨酸钠、1mg·ml-1l-异亮氨酸双加氧酶、0.5mg·ml-1l-谷氨酸氧化酶、400u/ml过氧化氢酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化2h。
将催化剂与底物一次性加于转化体系中,随着转化进行,由于体系中不添加fe2+,且l-谷氨酸氧化酶催化l-谷氨酸生成α-酮戊二酸的同时伴随着h2o2的产生,形成的氧化环境严重影响l-异亮氨酸双加氧酶的活性,在转化0.5h以后4-hil的浓度几乎不再增长,最终获得25.92mm4-hil。
(2)“一锅法”多酶级联合成4-hil(添加fe2+)
将实施例1中获得的l-异亮氨酸双加氧酶及l-谷氨酸氧化酶用于催化生产4-hil,转化体系为100mml-异亮氨酸、50mm抗坏血酸、100mm一水合l-谷氨酸钠、1mg·ml-1l-异亮氨酸双加氧酶、0.5mg·ml-1l-谷氨酸氧化酶、400u/ml过氧化氢酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化2h。同时,在混合物中加入5mmfeso4·7h2o,比较fe2+对级联反应的影响。反应过程中离心取上清,hplc检测l-异亮氨酸、l-谷氨酸、α-酮戊二酸及4-hil的含量。
将催化剂与底物一次性加于转化体系中,随着转化进行,由于l-谷氨酸氧化酶催化l-谷氨酸生成α-酮戊二酸的同时伴随着h2o2的产生,形成的氧化环境严重影响l-异亮氨酸双加氧酶的活性,在转化0.5h以后4-hil的浓度几乎不再增长,尽管此时体系中仍有α-酮戊二酸。同时可能是由于转化体系中添加fe2+,导致l-谷氨酸氧化酶蛋白活性明显降低,在反应0.5h后l-谷氨酸消耗速度减慢,最终获得28.33mm4-hil。
实施例7:分步级联催化生产4-hil
将实施例1中获得的l-异亮氨酸双加氧酶及l-谷氨酸氧化酶用于催化生产4-hil,转化体系为:第一阶段为将550mm一水合l-谷氨酸钠,0.5mg·ml-1l-谷氨酸氧化酶,400u/ml过氧化氢酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化5h;第二阶段为向转化体系中再加入500mml-异亮氨酸、50mm抗坏血酸、5mmfeso4·7h2o、1mg·ml-1l-异亮氨酸双加氧酶,第二阶段在30℃下继续反应9h。反应过程中离心取上清,hplc检测l-异亮氨酸、l-谷氨酸、α-酮戊二酸及4-hil的含量。
转化结果如下:第一阶段,550mm的一水合l-谷氨酸钠,转化5h,中间产物α-酮戊二酸的产量为497.41mm,转化率为90.4%。此时反应到达终点,进行第二阶段的反应,进一步转化6h,4-hil的产量为434.45mm;转化9h后4-hil为464.96mm,最终转化率为92.97%。
实施例8:分步级联催化生产4-hil
将实施例1中获得的l-异亮氨酸双加氧酶及l-谷氨酸氧化酶用于催化生产4-hil,转化体系为:第一阶段为将550mm一水合l-谷氨酸钠,0.5mg·ml-1l-谷氨酸氧化酶,400u/ml过氧化氢酶,50mmtris-hclbuffer(ph7.0),在200rpm、30℃条件下,转化5h;第二阶段为向转化体系中加入200mml-异亮氨酸、50mm抗坏血酸、5mmfeso4·7h2o、1mg·ml-1l-异亮氨酸双加氧酶,每两个小时通过分批补料添加150mml-异亮氨酸到转化体系中至终浓度为500mm,第二阶段在30℃下继续反应9h。反应过程中离心取上清,hplc检测l-异亮氨酸、l-谷氨酸、α-酮戊二酸及4-hil的含量。
转化结果如下:第一阶段,550mm的一水合l-谷氨酸钠,转化5h,中间产物α-酮戊二酸的产量为497.41mm,转化率为90.4%。此时反应到达终点,将体系ph调为7.0,进行第二阶段的反应,转化9h后4-hil为465.61mm,最终转化率为93.12%。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>多酶体系供给α-酮戊二酸及其用于合成4-羟基异亮氨酸
<130>baa210457a
<160>4
<170>patentinversion3.3
<210>1
<211>723
<212>dna
<213>枯草芽孢杆菌bacillussubtilis(cctcc:m2013373)
<400>1
atgaaaatgagtggctttagcatagaagaaaaggtacatgaatttgaatctaagggattc60
cttgaaatctcaaatgaaatctttttacaagaggaagagaatcatcgtttattaacacaa120
gcacagttagattattataatttggaagatgatgcgtacggtgaatgccgtgctggatct180
tattcaaggtatataaagtatgttgattcaccagattatattttagataatagtaatgat240
tacttccaatctaaagaatataactatgatgatggcggtaaagttagacagttccatagc300
ataaatgatagttttttatataatcctttaattcaaaatatcgtgcgtttcgatactgaa360
tttgcatttaaaacaaatataatagatacaagtaaagatttaattataggtttacatcaa420
gtaagatataaagctactaaagaaagaccatcttttagttcacctatttggttacataaa480
gatgatgaaccagtagtgtttttacaccttatgaatttaagtaatacagctattggcgga540
gataatttaatagctaattctccaagggaaattaatcagtttataagtttgaaggagcct600
ttagaaactttagtatttggacaaaaggttttccatgccgtaacgccacttggaacagaa660
tgtagtactgaagcttttcgtgatattttattagtaacattttcttataaggagacaaaa720
taa723
<210>2
<211>1995
<212>dna
<213>加纳链霉菌streptomycesghanaensis(atcc14672)
<400>2
atgactgaagatcacgcggtggtgcgttcggacggcggtctgtcccggaggagcttcgcg60
gcggtggccggcacagccacggtcgccacagccctgaccagcggtgtcgccgcggccctg120
cccgcaccggccgcctcgggcgacagccgtggcgccgacttcgaccggtgcctggccgtc180
gctcgcgcactcctcgtcctggactccgacgaccgccccctcgtcccgcgttaccagagc240
gtcctccagaagggactgccggctcaacgacggacacggcccaagaacgtcctggtcatc300
ggcgccggcccggccgggctggtggccgcctggttgctgaagagggcaggtcaccgggtg360
acggtgctggaggccaacggcaaccgagcgggcggacgcgtcaagaccttccggagcggt420
ggccacgaacgcgccgagcagcccttcgccgatccccgtcagtacgccgaagcgggcgcg480
atgcgcatcccgggcagccaccccctggtgatggagctgatcgaccagttcgagctgaag540
aagcggcgtttccactacgtcgacgtcgacagcgagggacgtcccgccaaccgcacctgg600
atccacgtcaacggcatccgcgtgcggcgcgccgactacgcccgcgcgccccggcgcgtg660
aaccggtccttcggtgtcccccgggcccactgggacacccccgccgccgccatcctgcgc720
tccgtgctggacccggtgcgcgacgagttcagccgcgtcggccgcgacggcaagcgggtc780
gacaagccgctcccggagcggctgcagggctgggcccgggtggtgcagcgcttcggtgac840
tggtcgatgttccgctttctcaccgaacacgccggcctcgacgaacggaccatcgacctg900
atcggcaccctggagaacctcacctcccgtctccctctgtccttcatccacagcttcatc960
ggctcctccctcatcagccccgacacgcccttctacgagctggagggcggcacggccgta1020
ctaccggacgccctgctggagcgcgtgcgcaaggacgtgcggttcgaccgccgtgtcacg1080
cgcatccagtaccaccaccccgaccgcccgtcgccggacgtcgagcaggtccggagcaag1140
ggcccgcacgtgtgggtggacaccgtgtcggagggccgcgacggacctgtcgtacgcgag1200
cagttcaccgcggacgtcgccgtggtcacggtgccgttctccggactgcgccacgtacag1260
atcgccccgcccctgtcgtacggcaagcgtcgggcggtctgcgagttgcactacgacagc1320
gcgaccaaggtgctgctggagttcagccgccgctggtgggagttcgacgaggccgactgg1380
aaacgggagctgcgcgccgtcgacccggggctgtacgacgcctaccgcaccggccgggcc1440
gccgcggacggcagcctgctcggcgcccatccctccgtgcccgccgggcacatcacagcg1500
ggtcagcgcacccactacgccgccaaccgcgcggtcgcgcgcgaccagccggaggccgtc1560
gacgtcgtagggggcggatcggtgtcggacaacgccaaccggttcatgttccatccctcc1620
catccggttccgggcagcgccgggggcgtggtcctggcctcctacagctgggcggacgac1680
gcgctgcgctgggactccctggacgacgaggcacggtacccccacgctctgtgcggcctc1740
cagcaggtctacggccagcgcatcgaggtcttctacaccggcgcgggccgcacgcagagc1800
tggttgcgcgacccctacgcctacggagaggcgtccgtgctcctgcccgggcagcacacg1860
gagttgttgtccgccatccccgtggctgaggggccgttgcacttcgccggggaccacacg1920
tccgtcaagccggcatggatcgagggagctgtggagtccgccgtgcgtgccgccttggag1980
atccacacagcgtga1995
<210>3
<211>240
<212>prt
<213>枯草芽孢杆菌bacillussubtilis(cctcc:m2013373)
<400>3
metlysmetserglypheserilegluglulysvalhisglupheglu
151015
serlysglypheleugluileserasngluilepheleuglngluglu
202530
gluasnhisargleuleuthrglnalaglnleuasptyrtyrasnleu
354045
gluaspaspalatyrglyglucysargalaglysertyrserargtyr
505560
ilelystyrvalaspserproasptyrileleuaspasnserasnasp
65707580
tyrpheglnserlysglutyrasntyraspaspglyglylysvalarg
859095
glnphehisserileasnaspserpheleutyrasnproleuilegln
100105110
asnilevalargpheaspthrgluphealaphelysthrasnileile
115120125
aspthrserlysaspleuileileglyleuhisglnvalargtyrlys
130135140
alathrlysgluargproserpheserserproiletrpleuhislys
145150155160
aspaspgluprovalvalpheleuhisleumetasnleuserasnthr
165170175
alaileglyglyaspasnleuilealaasnserproarggluileasn
180185190
glnpheileserleulysgluproleugluthrleuvalpheglygln
195200205
lysvalphehisalavalthrproleuglythrglucysserthrglu
210215220
alapheargaspileleuleuvalthrphesertyrlysgluthrlys
225230235240
<210>4
<211>664
<212>prt
<213>加纳链霉菌streptomycesghanaensis(atcc14672)
<400>4
metthrgluasphisalavalvalargseraspglyglyleuserarg
151015
argserphealaalavalalaglythralathrvalalathralaleu
202530
thrserglyvalalaalaalaleuproalaproalaalaserglyasp
354045
serargglyalaasppheaspargcysleualavalalaargalaleu
505560
leuvalleuaspseraspaspargproleuvalproargtyrglnser
65707580
valleuglnlysglyleuproalaglnargargthrargprolysasn
859095
valleuvalileglyalaglyproalaglyleuvalalaalatrpleu
100105110
leulysargalaglyhisargvalthrvalleuglualaasnglyasn
115120125
argalaglyglyargvallysthrpheargserglyglyhisgluarg
130135140
alagluglnprophealaaspproargglntyralaglualaglyala
145150155160
metargileproglyserhisproleuvalmetgluleuileaspgln
165170175
phegluleulyslysargargphehistyrvalaspvalaspserglu
180185190
glyargproalaasnargthrtrpilehisvalasnglyileargval
195200205
argargalaasptyralaargalaproargargvalasnargserphe
210215220
glyvalproargalahistrpaspthrproalaalaalaileleuarg
225230235240
servalleuaspprovalargaspglupheserargvalglyargasp
245250255
glylysargvalasplysproleuprogluargleuglnglytrpala
260265270
argvalvalglnargpheglyasptrpsermetpheargpheleuthr
275280285
gluhisalaglyleuaspgluargthrileaspleuileglythrleu
290295300
gluasnleuthrserargleuproleuserpheilehisserpheile
305310315320
glyserserleuileserproaspthrprophetyrgluleuglugly
325330335
glythralavalleuproaspalaleuleugluargvalarglysasp
340345350
valargpheaspargargvalthrargileglntyrhishisproasp
355360365
argproserproaspvalgluglnvalargserlysglyprohisval
370375380
trpvalaspthrvalsergluglyargaspglyprovalvalargglu
385390395400
glnphethralaaspvalalavalvalthrvalpropheserglyleu
405410415
arghisvalglnilealaproproleusertyrglylysargargala
420425430
valcysgluleuhistyraspseralathrlysvalleuleugluphe
435440445
serargargtrptrpglupheaspglualaasptrplysarggluleu
450455460
argalavalaspproglyleutyraspalatyrargthrglyargala
465470475480
alaalaaspglyserleuleuglyalahisproservalproalagly
485490495
hisilethralaglyglnargthrhistyralaalaasnargalaval
500505510
alaargaspglnproglualavalaspvalvalglyglyglyserval
515520525
seraspasnalaasnargphemetphehisproserhisprovalpro
530535540
glyseralaglyglyvalvalleualasertyrsertrpalaaspasp
545550555560
alaleuargtrpaspserleuaspaspglualaargtyrprohisala
565570575
leucysglyleuglnglnvaltyrglyglnargilegluvalphetyr
580585590
thrglyalaglyargthrglnsertrpleuargaspprotyralatyr
595600605
glyglualaservalleuleuproglyglnhisthrgluleuleuser
610615620
alaileprovalalagluglyproleuhisphealaglyasphisthr
625630635640
servallysproalatrpilegluglyalavalgluseralavalarg
645650655
alaalaleugluilehisthrala
660
- 还没有人留言评论。精彩留言会获得点赞!