一种分离纯化灵芝β-葡寡糖的方法
本申请属于天然药物化学技术领域,具体的说涉及一种分离纯化灵芝β-葡寡糖的方法。
背景技术:
灵芝自古就有“仙草”、“瑞草”之称,在古代灵芝常被人们认为可以延年益寿,灵芝营养丰富,药用价值很高,在我国已经有了超过4000年的中医药应用历史。灵芝β-葡聚糖作为灵芝中最丰富的成分之一,具有广泛的药理作用,如免疫调节、抗癌及抗炎等。灵芝β-葡寡糖是由灵芝β-葡聚糖降解得到的一系列分子量较低、水溶性较好的片段。β-葡寡糖的生物活性通常与其分子量、连接方式及聚合度等结构特征存在着较大的相关性,因此研究降解后的灵芝β-葡寡糖的活性尤为重要。由于所得灵芝β-葡寡糖的聚合度分布较广,且不同聚合度寡糖结构差异较小,导致其分离纯化较困难。
因此,需要研究开发一种高效的分离纯化灵芝β-葡寡糖的方法。
技术实现要素:
本发明目的在于提供一种分离纯化灵芝β-葡寡糖的方法,包括如下步骤:
(1)先向灵芝β-葡寡糖溶液中加入无水乙醇至乙醇终浓度为90%,搅拌均匀后于4℃下静置4h,离心收集上清;减压浓缩除去乙醇得到glpw-a组分
(2)步骤(1)中的沉淀中加入去离子水,搅拌至完全溶解,向溶液中加入无水乙醇至乙醇终浓度为85%,搅拌均匀后于4℃下静置4h,离心收集上清;减压浓缩除去乙醇得到glpw-b组分;
(3)步骤(2)中的沉淀中加入去离子水,搅拌至完全溶解,向溶液中加入无水乙醇至乙醇终浓度为80%,搅拌均匀后放置于4℃下4h,离心分离沉淀和上清,上清部分减压浓缩除去乙醇得到glpw-c组分;
(4)步骤(3)中的沉淀部分以去离子水复溶,除去乙醇冷冻干燥得到glpw-d组分;
其中,所述灵芝β-葡寡糖溶液的浓度为30-50mg/ml。
应用本发明提供的分离纯化灵芝β-葡寡糖的方法得到的四种灵芝β-葡寡糖组分,可以采用高效凝胶排阻色谱、高效阴离子色谱及质谱法对分离所得片段进行分析,确认得到特定聚合度的寡糖片段。
本发明通过采用逐级醇沉法对灵芝β-葡寡糖分离纯化,利用苯酚硫酸法测定产物纯度,高效凝胶排阻色谱法测定其分子量,高效阴离子色谱和质谱分析分离产物的聚合度分布,并提供了其在体外免疫方面的活性信息,体外药理实验表明,聚合度较高的片段与dectin-1受体相结合激活细胞免疫功能的活性较强,聚合度较低的片段抗炎活性较佳,可以应用于药品或保健品中。
本发明所具有的有益效果如下:
1)通过上述逐级醇沉法分离得到的灵芝β-葡寡糖重现性好,产品质量稳定。
2)本发明得到的寡糖产物的纯度好,得率高。
3)与传统的寡糖分离纯化法相比,本发明中逐级醇沉分离法可以有效提高灵芝β-葡寡糖分离纯化的效果,得到聚合度分布较窄的寡糖片段。
4)本发明为不同聚合度寡糖片段的免疫活性评价奠定了基础。
附图说明
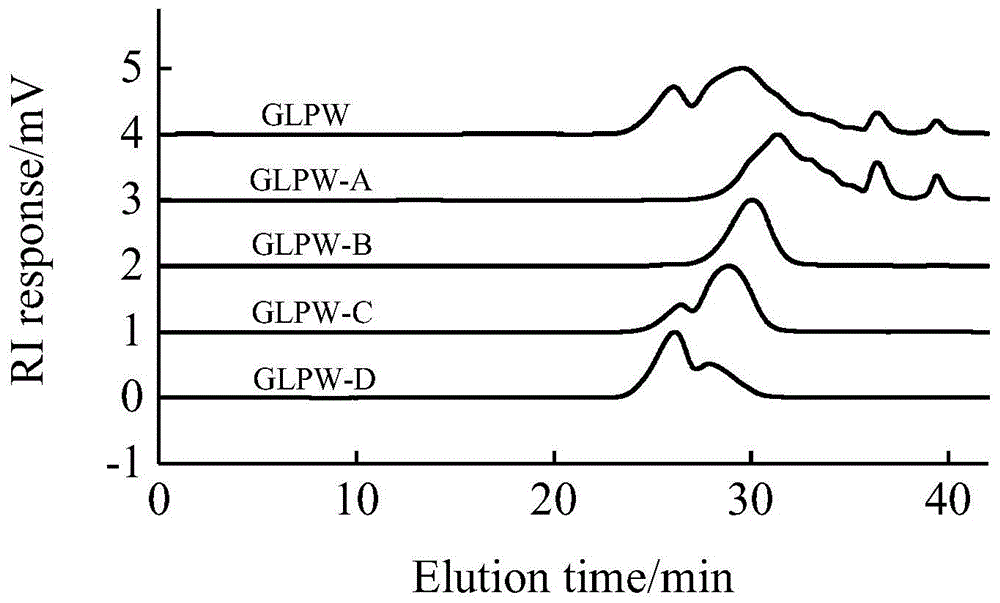
图1、实施例1中逐级醇沉分离灵芝β-葡寡糖产物的高效凝胶排阻色谱图。
图2、实施例2中逐级醇沉分离灵芝β-葡寡糖产物的高效阴离子色谱图。
图3、实施例3中逐级醇沉分离得到glpw-a的质谱图
图4、实施例3中逐级醇沉分离得到glpw-b的质谱图
图5、实施例3中逐级醇沉分离得到glpw-c的质谱图。
图6、实施例5中逐级醇沉分离灵芝β-葡寡糖产物增强免疫活性的测试结果
图7、实施例6中逐级醇沉分离灵芝β-葡寡糖产物的抗炎活性测试结果
具体实施方式
下面的实施例可以使本领域技术人员更全面地理解本申请,但不以任何方式限制本申请。除非另有说明,本申请中使用的试剂均为常用的商购试剂。
下列实施例中所用的灵芝β-葡寡糖是通过如下方法制备得到的:
用专利文献(cn105175575b,一种灵芝β-葡聚糖及其制备方法和用途)说明书中实施例1的方法制备得到的灵芝β-葡聚糖,配制成5mg/ml的灵芝β-葡聚糖溶液。将灵芝β-葡聚糖溶液置于微波消解仪中,设置微波功率为1000w,在140℃下降解40min,降解产物用离心机以8000rpm转速离心20分钟,取出上清液,冷冻干燥得到所需的灵芝β-葡寡糖(glpw)。
实施例1:灵芝β-葡寡糖的逐级醇沉分离纯化
称取灵芝β-葡寡糖glpw300mg加入10ml蒸馏水,配成30mg/ml的灵芝β-葡寡糖溶液,充分搅拌至溶解。
灵芝β-葡寡糖glpw的逐级醇沉分离:向溶液中缓慢加入90ml无水乙醇至乙醇终浓度为90%(v/v),充分搅拌均匀后于4℃下静置4h,离心收集上清,沉淀加50ml90%(v/v)乙醇洗涤,离心取上清,重复3遍之后合并上清,减压浓缩除去乙醇得到glpw-a组分,冷冻干燥。上述沉淀加10ml去离子水,充分搅拌至完全溶解,向溶液中缓慢加入57ml无水乙醇至乙醇终浓度为85%(v/v),充分搅拌均匀后于4℃下静置4h,以10000rpm离心20min,收集上清,沉淀以85%(v/v)乙醇洗涤三遍,离心合并上清,减压浓缩除去乙醇,冷冻干燥得到glpw-b组分。上述沉淀中继续加10ml去离子水,充分搅拌至完全溶解,向溶液中缓慢加入40ml无水乙醇至乙醇终浓度为80%(v/v),搅拌均匀后放置于4℃下4h,离心分离沉淀和上清,沉淀采用80%(v/v)乙醇继续洗涤3次,合并上清部分,减压浓缩除去乙醇得到glpw-c组分,沉淀部分以去离子水复溶后除去乙醇冷冻干燥得到glpw-d组分。
实施例2:灵芝β-葡寡糖的逐级醇沉分离纯化
称取灵芝β-葡寡糖glpw500mg加入10ml蒸馏水,配成50mg/ml的灵芝β-葡寡糖溶液,充分搅拌至溶解。
灵芝β-葡寡糖glpw的逐级醇沉分离:向溶液中缓慢加入90ml无水乙醇至乙醇终浓度为90%(v/v),充分搅拌均匀后于4℃下静置4h,离心收集上清,沉淀加50ml90%(v/v)乙醇洗涤,离心取上清重复3遍之后合并上清,减压浓缩除去乙醇得到glpw-a组分,冷冻干燥。上述沉淀加10ml去离子水,充分搅拌至完全溶解,向溶液中缓慢加入57ml无水乙醇至乙醇终浓度为85%(v/v),充分搅拌均匀后于4℃下静置4h,此时溶液中已有明显沉淀生成,以10000rpm离心20min,收集上清,沉淀以85%(v/v)乙醇洗涤三遍,离心合并上清,减压浓缩除去乙醇,冷冻干燥得到glpw-b组分。上述沉淀中继续加10ml去离子水,充分搅拌至完全溶解,向溶液中缓慢加入40ml无水乙醇至乙醇终浓度为80%(v/v),搅拌均匀后放置于4℃下4h,使沉淀充分析出,离心分离沉淀和上清,沉淀采用80%(v/v)乙醇继续洗涤3次,合并上清部分,减压浓缩除去乙醇得到glpw-c组分,沉淀部分以去离子水复溶后除去乙醇冷冻干燥后得到glpw-d组分。
实施例3:灵芝β-葡寡糖的逐级醇沉分离纯化
称取灵芝β-葡寡糖glpw400mg加入10ml蒸馏水,配成40mg/ml的灵芝β-葡寡糖溶液,充分搅拌至溶解。
灵芝β-葡寡糖glpw的逐级醇沉分离:向β-葡寡糖溶液中缓慢加入90ml无水乙醇至乙醇终浓度为90%(v/v),充分搅拌均匀后于4℃下静置4h,离心收集上清,沉淀加50ml90%(v/v)乙醇洗涤,离心取上清重复3遍之后合并上清,减压浓缩除去乙醇得到glpw-a组分,冷冻干燥。上述沉淀加10ml去离子水,充分搅拌至完全溶解,向溶液中缓慢加入57ml无水乙醇至乙醇终浓度为85%(v/v),充分搅拌均匀后于4℃下静置4h,此时溶液中已有明显沉淀生成,以10000rpm离心20min,收集上清,沉淀以85%(v/v)乙醇洗涤三遍,离心合并上清,减压浓缩除去乙醇,冷冻干燥得到glpw-b组分。上述沉淀中继续加10ml去离子水,充分搅拌至完全溶解,向溶液中缓慢加入40ml无水乙醇至乙醇终浓度为80%(v/v),搅拌均匀后放置于4℃下4h,使沉淀充分析出,离心分离沉淀和上清,沉淀采用80%(v/v)乙醇继续洗涤3次,合并上清部分,减压浓缩除去乙醇得到glpw-c组分,沉淀部分以去离子水复溶后除去乙醇冷冻干燥后得到glpw-d组分。
实验例4:灵芝β-葡寡糖的逐级醇沉分离纯化产物的分析
取实施例1中制备得到的glpw-a、glpw-b、glpw-c、glpw-d四种组分进行如下试验。
1.测定方法
1.1组分得率测定
各组分得率基于以下进行计算:y=a1/a2×100%,式中:a1为组分干燥后质量;a2为投入醇沉分离样品的总质量;y为得率(%)
1.2苯酚硫酸法测定糖含量
标准曲线的测定:称取10mg葡萄糖加至100ml容量瓶中定容至刻度,配制成0.1mg/ml葡萄糖标准液,准确吸取0、0.1、0.2、0.4、0.6、0.8、1ml,加水补足至1ml,分别加0.5ml5%的苯酚、2.5ml浓硫酸,混合均匀后,100℃水浴加热15min,490nm处检测紫外-可见吸光度。以紫外吸光度对葡萄糖标准溶液浓度作图,得葡萄糖浓度标准曲线及回归方程。
样品糖含量测定:分别称取1.0mg样品加入10ml超纯水配制成0.1mg/ml样品溶液,准确吸取1ml加入5%苯酚0.5ml,浓硫酸2.5ml,混合均匀后,100℃水浴加热15min,冷却至室温,490nm处检测紫外-可见吸光度。根据葡萄糖标准曲线回归方程计算样品糖含量。
1.3高效凝胶排阻色谱法测定产物分子量
分别称取5mg获得的寡糖片段glpw-a、glpw-b、glpw-c、glpw-d,加入1ml超纯水,采用高效凝胶排阻色谱对分子量进行测定。
具体条件为:示差检测器,色谱柱:tsk-gel系列g3000pwxl和g2500pwxl(7.8mm×300mm,日本tosoh公司)串联,流动相:0.15mol/l硝酸钠,0.05mol/l磷酸二氢钠,0.02%叠氮钠;柱温:30℃;流速:0.5ml/min;上样量:100μl
1.4高效阴离子色谱法分析降解产物组成
取上述5mg/ml寡糖溶液分别用超纯水稀释10倍,取1ml以高效阴离子色谱分析产物组成。
具体条件为:色谱柱:carbopactmpa-100柱(4mm×250mm,美国dionex公司),洗脱液:流动相a:150mmol/l氢氧化钠;流动相b:150mmol/lnaoh和500mmol/l醋酸钠;柱温和脉冲安培检测器的温度维持在30℃;进样量:25μl。梯度洗脱程序如下:0-5min,a/b,90/10(v/v);5-30min,a/b,80/20(v/v);30-30.1min,a/b,30/70(v/v);30.1-40min,a/b,0/100(v/v);40-45min,a/b,90/10(v/v)。
1.5质谱法分析产物的聚合度分布
取1μl待测样品与1μl基质混合均匀,吸取1μl混合液置于干净的maldi点样板上,室温条件下等待溶剂挥发后置于质谱系统中。
具体条件为:正离子模式;基质为:dhb基质(10mg/ml的2,5-二羟基苯甲酸溶于0.1%的tfa中);扫描分子量范围:200-4000g/mol。
2.分离后寡糖片段的测定结果
根据上述测定结果,对实施例1制备的各分子量段的灵芝β-葡寡糖分别进行测定,分离产物的得率及含量结果如表1所示,各组分的糖含量及得率均较高,其中glpw-b、glpw-c、glpw-d组分的糖含量均高于90%以上,表明分离过程中无明显杂质引入,且过程中寡糖损失较少。
对各片段的分子量特征进行分析,结果如表2所示,分离产物的聚合度特征如图1-5所示,可知所得的灵芝β-葡寡糖片段glpw-a、glpw-b、glpw-c、glpw-d在高效凝胶排阻色谱及阴离子色谱中的出峰时间表现出明显的差异,尽管各组分之间聚合度分布仍有交叉,但总体达到了分离效果,对其聚合度进行分析,其中glpw-a的平均分子量分别为1608.64g/mol,203.98g/mol,主要片段的聚合度为2-14;glpw-b的平均分子量为2726.24g/mol,主要片段的聚合度为6-21;glpw-c的平均分子量分别为1.19×104g/mol,4417.05g/mol,主要片段的聚合度为11-24;glpw-d组分已经超过阴离子色谱柱的分离范围,表明组分的聚合度较高,高效凝胶排阻色谱法测得其平均分子量分别为1.34×104g/mol,6594.47g/mol。质谱结果与液相及阴离子色谱的结果相符,均表明醇沉分离达到了对灵芝β-葡寡糖glpw粗分离为段的效果。
表1逐级醇沉产物的含量测定
表2醇沉分离产物的分子量特征
实验例5:寡糖片段体外激活免疫活性分析
1.样品的配制
精密称取样品约5mg,加入定量的无菌水溶液使其充分溶解后,以0.22μm的无菌水相滤膜除菌,稀释成一系列浓度备用。
2.细胞培养
hek-bluehdectin-1a细胞(购自invivogen公司)在含10%胎牛血清、100u/ml青霉素、100μg/ml链霉素、100μg/mlnormocin的dmem完全培养基(美国gibco公司)中,37℃、含5%co2条件下培养两代转入选择培养基(50mldmem完全培养基中含200mlhek-blueclrselection(美国invitrogen公司)),培养至对数生长期,计数并用检测培养基(hek-bluedetection溶于50ml无菌水中)稀释成3×105个/ml的细胞液,每孔加入180μl细胞悬液和20μl不同浓度的样品(10μg/ml、50μg/ml、200μg/ml),以20μl无菌水为阴性对照,以20μl作用浓度为100μg/ml的硬葡聚糖(法国elicityl-oligotech公司)为阳性对照,共同培养24h,在630nm处测定吸光度值。
3.实验结果
特定聚合度寡糖片段的体外刺激细胞增强免疫活性的测试结果如图6所示,较低聚合度的寡糖片段的免疫活性基本消失,而大分子量的寡糖片段表现出明显的活性,这表明样品与dectin-1受体结合增强免疫的活性与其聚合度存在着较大的关系,总体来讲聚合度越大,免疫活性越好。
实验例6:寡糖片段体外抗炎活性分析
1.样品的配制
精密称取样品约5mg,加入定量的无菌水溶液使其充分溶解后,以0.22μm的无菌水相滤膜除菌,稀释成一系列浓度(10μg/ml、50μg/ml、200μg/ml)备用。
2.thp-1细胞培养及巨噬细胞的诱导
细胞株thp-1(购自中国科学院上海细胞库)在含10%胎牛血清,1%青霉素、链霉素和0.5%β-巯基乙醇的rpmi1640完全培养基(美国gibco公司)中,37℃、含5%co2条件下培养到对数期后,计数并用无色1640培养基(美国gibco公司)稀释成5×105个/ml的细胞液。将细胞液按照每孔199μl的体积转入96孔板中,加入1μl6μg/mlpma(美国sigma公司)处理40h诱导细胞成巨噬细胞。
3.thp-1细胞诱导的巨噬细胞上清液中tnf-α含量的测定及比较
将上述诱导成巨噬细胞的培养液上清弃去,每孔加入160μl的rpmi-1640培养基、20μl作用浓度为50ng/ml的lps和20μl不同浓度的样品液,共同培养24h后取上清,利用北京四正柏公司的tnf-α测定用elisa试剂盒测定上清液中tnf-α的含量。
4.实验结果
特定聚合度寡糖片段的体外抗炎活性测试结果如图7所示,较低聚合度的寡糖片段的抗炎能力明显高于较高聚合度的寡糖片段。此外除glpw-b组分,其余片段随着样品作用浓度的增加,抗炎活性不断增强,呈现出剂量依赖。
在对寡糖片段的体外免疫活性研究中发现,分离后的片段中聚合度较高的glpw-d片段刺激dectin-1细胞的免疫活性最好,而较低聚合度的寡糖片段glpw-a表现出较好的体外抗炎活性。
本领域技术人员应理解,以上实施例仅是示例性实施例,在不背离本申请的精神和范围的情况下,可以进行多种变化、替换以及改变。
- 还没有人留言评论。精彩留言会获得点赞!