N-烷基取代芳基异喹啉酮化合物,其制备方法及药物组合物和应用
n-烷基取代芳基异喹啉酮化合物,其制备方法及药物组合物和应用
技术领域
1.本发明涉及药物化学和药物治疗学领域,具体讲,涉及一种n-烷基取代芳基异喹啉酮化合物,其制备方法及药物组合物和应用。
背景技术:
2.炎症是免疫系统对潜在的有害刺激(例如伤害,压力和感染)的初始反应。尽管其作为生理防御机制发生,但据报道其参与各种疾病的发病机理。类风湿性关节炎、炎症性肠病(ibd)、特应性皮炎、哮喘、阿尔茨海默氏病、动脉粥样硬化、2型糖尿病、代谢综合征和心血管疾病只是其中一部分疾病,涉及慢性炎症的发病机制。
3.在这些疾病中,ibd是一种慢性免疫介导的胃肠道炎症性疾病,会导致组织损伤以及对胃肠道结构和功能的长期损害,这通常是不可逆的。一般认为,ibd是由遗传缺陷引起的,遗传缺陷导致粘膜免疫系统的肠道上皮屏障发生变化,从而暴露于肠道菌群,并引发异常的微生物免疫反应。克罗恩病(cd)和溃疡性结肠炎(uc)是ibd的两种最常见表现。两者都是由免疫系统激活引起的慢性炎症和肠道溃疡,但是uc通常局限于从直肠到盲肠的结肠部位,cd通常是透壁的,延伸到更深的一层,甚至影响整个消化道和肛门。ibd的发病机制不是很清楚,并且受遗传因素的影响很大。ibd的患病率和发病率越来越普遍,并导致明显的发病率。疗法包括柳氮磺胺吡啶(sasp),5-氨基水杨酸(5-asa),免疫调节剂(im)和生物疗法。但是,到目前为止,还没有能够完全治愈ibd的药物。
4.像其他用于治疗炎症和自身免疫性疾病的药物一样,抗炎细胞因子药物,尤其是tnf抑制剂的应用,是ibd治疗中最重要的进展之一。1998年,针对关键炎症细胞因子tnfα的单克隆抗体(infliximab)上市了。英夫利昔单抗(ifx)是针对tnfα的嵌合igg1单克隆抗体,可与人可溶性或膜形式的tnfα形成稳定的复合物,从而终止其生物学活性。在随后的几年中,ifx已获得儿科cd(2006)和儿科uc(2011)的批准。此外,从2007年开始,可以通过sq递送的其他抗tnfα分子被批准用于ibd,包括阿达木单抗(cd和uc)、戈利木单抗(uc)和赛妥珠单抗(cd)。但是,这些药物的疗效不及预期,因此需要新的抗tnfα药物来满足临床需求。特别是开发可以口服的小分子药物,将大大克服生物制剂的缺点。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的第一发明目的在于提出一种n-烷基取代芳基异喹啉酮化合物。
7.本发明的第二发明目的在于提出该n-烷基取代芳基异喹啉酮化合物的制备方法。
8.本发明的第三发明目的在于提出含有该n-烷基取代芳基异喹啉酮化合物的药物组合物。
9.本发明的第四发明目的在于提出该种n-烷基取代芳基异喹啉酮化合物的应用。
10.为了实现上述发明目的,采用的技术方案为:
11.本发明涉及一种n-烷基取代芳基异喹啉酮化合物,或其立体异构体或药学上可接受的盐,结构式如式i所示:
[0012][0013]
其中,w、v各自独立地为氧或硫;
[0014]
r1、r2各自独立地选自卤素、取代或未取代的c1~c12烷基、取代或未取代的c1~c12烷氧基;或相邻的两个r1和与其相连接的苯环上的碳原子一起形成脂肪环、脂氧杂环、芳香环或芳氧杂环;或相邻的两个r2和与其相连接的苯环上的碳原子一起形成脂肪环、脂氧杂环、芳香环或芳氧杂环;所述脂肪环、所述脂氧杂环、所述芳香环或所述芳氧杂环分别为五元环或六元环;
[0015]
n为1~4的整数,m为1~5的整数;
[0016]
r3为取代或未取代的c6~c14芳基或取代或未取代的c4~c14杂芳基,优选为取代或未取代的c6~c10芳基或c4~c6杂芳基,更优选为取代或未取代的苯基、取代或未取代的吡啶基或取代或未取代的嘧啶基;
[0017]
r4为取代或未取代的c1~c12烷基;
[0018]
r5为氢、取代或未取代的c1~c12烷基或卤素;
[0019]
所述取代的取代基选自c1~c6烷基、卤素取代的c1~c6烷基、c1~c6烷氧基、卤素或硝基中的一种或多种。
[0020]
本发明还涉及上述n-烷基取代芳基异喹啉酮化合物,或其立体异构体或药学上可接受的盐的制备方法,至少包括以下四种方式:
[0021]
方式1:将式a所示化合物在碱性条件下与式b所示化合物发生开环加成反应,制备得到如式i-1所示化合物;
[0022][0023]
方式2:将式a所示化合物在碱性水溶液条件下发生开环反应生成中间体,纯化获得该中间体后与碱和式c所示化合物发生取代反应,制备得到如式i-2所示化合物;
[0024][0025]
方式3:将式a所示化合物与含氢氧根离子的碱反应,不经纯化直接与式c的化合物反应,制备得到如式i-2所示化合物;
[0026][0027]
方式4:将式a所示化合物在碱性条件和水分子存在条件下与式b所示化合物发生开环加成反应,制备得到如式i-1和i-2所示化合物;
[0028][0029]
其中,r1、r2、r3、r4、r5和v分别如相应的权利要求1-6中任一项所定义。
[0030]
本发明还涉及一种药物组合物,包含治疗有效量的一种或多种上述n-烷基取代芳基异喹啉酮化合物,或其立体异构体及药学上可接受的盐。
[0031]
本发明还涉及一种tnf-α抑制剂,其包含选自上述n-烷基取代芳基异喹啉酮化合物、其立体异构体或药学上可接受的盐中的一种或多种,或者包含上述药物组合物。
[0032]
本发明还涉及上述的n-烷基取代芳基异喹啉酮化合物,或其立体异构体及药学上可接受的盐在制备治疗炎症或自身免疫相关疾病的药物中的应用。
[0033]
本发明至少具有以下技术效果:
[0034]
本发明提出一种n-烷基取代芳基异喹啉酮类化合物,细胞活性测试表明本发明化合物具有很强的tnf-α抑制活性(ic
50
值达到14nm),对lps诱导的溃疡性结肠炎模型的动物实验表明本发明化合物具有体内抗炎活性,本发明的化合物具有潜在的治疗炎症及自身免疫相关疾病的用途。
附图说明
[0035]
图1为化合物16-r治疗dss诱导的溃疡性结肠炎时小鼠的体重变化图(数据显示为平均值
±
sem,与载体组相比,***p《0.001,**p《0.01,*p《0.05),
[0036]
图2为化合物16-r治疗dss诱导的溃疡性结肠炎时小鼠的疾病活动指数(dai)变化图,(数据显示为平均值
±
sem,与载体组相比,***p《0.001,**p《0.01,*p《0.05);
[0037]
图3为化合物16-r治疗dss诱导的溃疡性结肠炎时小鼠的大便一致性分数变化图,(数据显示为平均值
±
sem,与载体组相比,***p《0.001,**p《0.01,*p《0.05);
[0038]
图4为化合物16-r治疗dss诱导的溃疡性结肠炎时小鼠的潜血分数变化图,(数据显示为平均值
±
sem,与载体组相比,***p《0.001,**p《0.01,*p《0.05)。
具体实施方式
[0039]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。另外,为了更好的说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在一些实施例中,对于本领域技术人员熟知的原料、元件、方法、手段等未作详细描述,以便于凸显本发明的主旨。
[0040]
基团定义
[0041]
术语“c1~c12烷基”表示直链、支链或环状的含有1-12个碳原子的烷基。例如,直链支链烷基包含但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、异戊基、己基等。环状烷基包括但不限于环丙基、甲基环丙基、乙基环丙基、二甲基环丙基、环丁基、甲基环丁基、乙基环丁基、环戊基、环己基等。
[0042]
术语“c1~c12烷氧基”表示直链、支链或环状的含有1-12个碳原子的烷氧基,包含但不限于甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、叔丁氧基、戊氧基、异戊氧基、己基氧等。
[0043]
术语“芳基”表示具有芳香环结构性质的取代基,优选为“c6~c14芳基”,其表示具有6-14个碳原子的芳基。例如,包含但不限于苯基、取代的苯基、萘基、取代的萘基、蒽基等。
[0044]
术语“杂芳基”是指具有5-14个环原子的单环或多环基团,每个环含有4-6个原子,其中有一个或多个选自n、o或s的杂原子,其余为碳。“杂芳基”具有一定的芳香性。本文优选杂芳基为“c4~c9杂芳基”,其表示具有4~9个碳原子的杂芳基,例如包括但不限于,呋喃基、取代的呋喃基、苯并呋喃基、取代的苯并呋喃基、噻吩基、取代的噻吩基、苯并噻吩基、取代的苯并噻吩基、吲哚基、取代的吲哚基、异吲哚基、取代的异吲哚基、吡咯基、取代的吡咯基、噻唑基、取代的噻唑基、噁唑基、取代的噁唑基、吡唑基、取代的吡唑基、咪唑基、取代的咪唑基、吡喃基、取代的吡喃基、哒嗪基、取代的哒嗪基、吡嗪基、取代的吡嗪基、嘧啶基、取代的嘧啶基、吡啶基、取代的吡啶基、喹啉基、取代的喹啉基、异喹啉基、咔唑基、取代的咔唑基等。并优选含有氮原子的杂芳基。
[0045]
术语“脂肪环”为具有脂肪族性质的环烃,即形成闭合的碳环。
[0046]
术语“脂氧杂环”为具有脂肪族性质的、环上有至少一个氧原子的碳环,即氧原子和碳原子一起构成闭合的环状结构。
[0047]
术语“芳香环”为具有芳香族性质的环烃,即拥有共轭的平面环体系的碳环。
[0048]
术语“芳氧杂环”为具有芳香族性质的、环上有至少一个氧原子的碳环,即氧原子
和碳原子一起构成拥有共轭的平面环体系的环状结构。
[0049]
术语“卤素”包括氟、氯、溴、碘。
[0050]
术语“卤素取代的c1~c6烷基”是指被一个或多个卤素取代的c1~c6烷基。
[0051]
已知噁唑啉季铵盐dcz0358,通过双重抑制mtorc1和mtorc2发挥抗多发性骨髓瘤活性。本发明实施例通过将dcz0358与苯硫酚亲核试剂反应,获得了一类新型n-烷基取代芳基异喹啉酮产物,通过体内外抗炎活性评价,发现了这类化合物的生物活性与dcz0358完全不同,具有显著tnf-α抑制活性及体内抗溃疡性结肠炎活性,从而完成本发明。
[0052]
本发明实施例第一方面提出一种n-烷基取代芳基异喹啉酮化合物,或其立体异构体及药学上可接受的盐,结构式如式i所示:
[0053][0054]
其中,w、v各自独立为氧(-o-)或硫(-s-);
[0055]
r1、r2各自独立为取代或未取代的c1~12烷基、取代或未取代的c1~12烷氧基或卤素,优选取代或未取代的c1~6烷基、取代或未取代的c1~6烷氧基或卤素,更优选取代或未取代的c1~3烷基、取代或未取代的c1~3烷氧基或卤素;
[0056]
或相邻的两个r1和与其相连接的苯环上的碳原子一起形成脂肪环、脂氧杂环、芳香环或芳氧杂环,或相邻的两个r2和与其相连接的苯环上的碳原子一起形成脂肪环、脂氧杂环、芳香环或芳氧杂环;脂肪环、脂氧杂环、芳香环或芳氧杂环可为五元环或六元环;优选的,相邻的两个r1和与其相连接的苯环上的碳原子一起形成脂肪环或脂氧杂环,或相邻的两个r2可和与其相连接的苯环上的碳原子一起形成脂肪环或脂氧杂环;
[0057]
n为1~4的整数,例如1、2;m为1~5的整数,例如1、2;
[0058]
r3为取代或未取代的c6~14芳基或取代或未取代的c4~14杂芳基(优选含有氮原子的杂芳基),优选为取代或未取代的c6~c10芳基或c4~c6杂芳基(优选含有氮原子的杂芳基),更优选为取代或未取代的苯基、吡啶基或嘧啶基;取代基选自c1~6烷基、卤素取代的c1~6烷基、c1~6烷氧基、卤素或硝基中的一种或多种,优选c1~3烷基、卤素取代的c1~3烷基、c1~3烷氧基、卤素或硝基中的一种或多种,更优选甲基、乙基、卤素取代的甲基或乙基、甲氧基、乙氧基、卤素或硝基中的一种或多种,例如取代基可为1-3个;
[0059]
r4为取代或未取代的c1~12烷基,优选为取代或未取代的c1~6烷基;取代基选自c1~6烷基、卤素取代的c1~6烷基、c1~6烷氧基、卤素或硝基中的一种或多种,例如取代基可为1-3个;
[0060]
r5为氢、取代或未取代的c1~12烷基或卤素,优选为氢。
[0061]
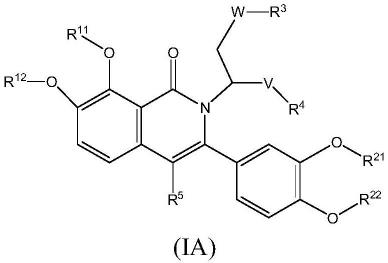
在一些实施方式中,n-烷基取代芳基异喹啉酮化合物的结构式如式ia所示:
[0062][0063]
其中,w、v各自独立为氧(-o-)或硫(-s-);
[0064]r11
、r
12
、r
21
、r
22
各自独立为取代或未取代的c1~c6烷基,优选为c1~c3烷基;
[0065]r11
和r
12
可形成脂氧杂环或芳氧杂环;r
21
和r
22
可形成脂氧杂环或芳氧杂环;脂氧杂环和芳氧杂环为五元环或六元环;
[0066]
r3为取代或未取代的苯基或c4~c14杂芳基(优选含有氮原子的杂芳基),更优选为取代或未取代的苯基或c4~c6杂芳基(优选含有氮原子的杂芳基),更优选为取代或未取代的苯基、吡啶基或嘧啶基;取代基选自c1~c6烷基、卤素取代的c1~c6烷基、c1~c6烷氧基、卤素或硝基中的一种或多种,优选c1~c3烷基、卤素取代的c1~c3烷基、c1~c3烷氧基、卤素或硝基中的一种或多种,更优选甲基、乙基、卤素取代的甲基或乙基、甲氧基、乙氧基、卤素或硝基中的一种或多种,例如取代基可为1-3个;
[0067]
r4为取代或未取代的c1~c6烷基,优选为取代或未取代的c1~c3烷基或卤素;取代基选自c1~c3烷基、卤素取代的c1~c3烷基、c1~c3烷氧基、卤素或硝基中的一种或多种,例如取代基可为1-3个;
[0068]
r5为氢、取代或未取代的c1~c6烷基或卤素;优选为氢。
[0069]
在一些实施方式中,n-烷基取代芳基异喹啉酮化合物的结构式如式ia1、ia2或ia3所示:
[0070][0071]
其中,w、v各自独立为氧(-o-)或硫(-s-);
[0072]r11
、r
12
、r
21
、r
22
各自独立为取代或未取代的c1~c6烷基;或者,r
11
、r
12
和与其相连接的苯环上的碳原子一起形成脂氧杂环或芳氧杂环;r
21
、r
22
和与其相连接的苯环上的碳原子形成脂氧杂环或芳氧杂环;脂氧杂环和所述芳氧杂环为五元环或六元环;
[0073]
r4为取代或未取代的c1~c6烷基,优选为取代或未取代的c1~c3烷基;
[0074]
r5为氢、取代或未取代的c1~c6烷基或卤素,优选为氢;
[0075]
r6选自c1~c6烷基、卤素取代的c1~c6烷基、c1~c6烷氧基、卤素或硝基,优选为c1~c3烷基、卤素取代的c1~c3烷基、c1~c3烷氧基、卤素或硝基;
[0076]
p1为0~5整数,例如0、1、2;p2为0~4整数,例如0、1、2;p3为0~3整数,例如0、1、2。
[0077]
在一些实施方式中,n-烷基取代芳基异喹啉酮化合物的结构式如式ia1a、ia2a或ia3a所示:
[0078][0079]
其中,w为氧(-o-)或硫(-s-);
[0080]
r4为取代或未取代的c1~c6烷基;
[0081]
r6选自c1~c6烷基、卤素取代的c1~c6烷基、c1~c6烷氧基、卤素或硝基,优选为
c1~c3烷基、卤素取代的c1~c3烷基、c1~c3烷氧基、卤素或硝基;
[0082]
p1为0~5整数,例如0、1、2;p2为0~4整数,例如0、1、2;p3为0~3整数,例如0、1、2。
[0083]
在一些实施方式中,同时与氮原子和v连接的碳原子为r构型或s构型,优选r构型。经药物活性试验发现,r构型化合物的生物学活性要远远高于s构型的化合物。
[0084]
在一些实施方式中,n-烷基取代芳基异喹啉酮化合物选自以下化学式所示的化合物:
[0085]
[0086][0087]
在一些实施方式中,本发明实施例的n-烷基取代芳基异喹啉酮化合物、其立体异构体或药学上可接受的盐可以以结晶水合物或溶剂合物的形式存在。这些结晶水合物或溶剂合物也包括在本发明的范围内。
[0088]
在获知本发明化合物的结构的基础上,本领域技术人员可以采用本领域中已知的反应设计并合成本发明的化合物。因此,对于合成本发明化合物的具体制备方法不做特别限制,只要能够得到本发明的化合物即可。进一步的,本发明实施例的第二方面对该类化合
物的制备方法进行了优化和扩展,包括以下三种方式:
[0089]
方式1:将式a所示化合物在碱性条件下与式b所示化合物发生开环加成反应,制备得到如式i-1所示化合物;
[0090][0091]
取代基的定义如前所述。
[0092]
在没有水分子的条件下,式a所示化合物在碱性条件下与硫酚类化合物b反应,获得如式i-1所示化合物。反应在无水有机溶剂中进行,有机溶剂可选自dmf,可添加碱性物质使反应环境呈碱性,具体可选自氢化钠。开环加成反应在温和条件下进行,常温反应即可,时间为8~12小时。反应结束后加淬灭剂猝灭反应,具体的淬灭剂可选饱和氯化铵溶液。淬灭反应后,可采用常规的萃取、清洗、干燥、分离等步骤获得目的化合物。
[0093]
在某些具体实施方式中,式a所示化合物与氢化钠的摩尔比为1:2~4,优选为1:3。
[0094]
方式2:将式a所示化合物在碱性水溶液条件下反应生成中间体,纯化获得该中间体后与式c所示化合物发生取代反应,制备得到如式i-2所示化合物;
[0095][0096]
取代基的定义如前所述。
[0097]
方式3:将式a所示化合物与含氢氧根离子的碱反应,不经纯化直接与式c的化合物反应,制备得到如式i-2所示化合物;
[0098][0099]
方式4:将式a所示化合物在碱性条件和水分子存在条件下与式b所示化合物发生开环加成反应,制备得到如式i-1和i-2所示化合物;
[0100][0101]
取代基的定义如前所述。
[0102]
在有水分子的条件下,例如开盖反应,利用空气中的水分子,式a所示化合物在碱性条件下与硫酚类化合物b反应,可同时获得如式i-1和式i-2所示的化合物。式i-1和式i-2化合物均具有良好的生物活性,实际应用时可不进行分离。本方式不要求反应体系完全无水,对反应条件不严苛。
[0103]
在一些实施方式中,对式i-1和/或i-2所示化合物进行分离,分别得到同时与氮原子和v连接的碳原子为s构型和r构型的化合物,优选r构型;更优选地,通过超临界二氧化碳色谱进行分离。
[0104]
本发明实施例第三方面提出一种药物组合物,包含治疗有效量的一种或多种如权利要求1所述的n-烷基取代芳基异喹啉酮化合物,或其立体异构体及药学上可接受的盐。药物组合物还可以包括一种或者多种药学上可接收的辅料、稀释剂、载体、赋形剂或佐剂。药物组合物可用于潜治疗炎症及自身免疫相关疾病。
[0105]
本发明实施例第四方面提出一种tnf-α抑制剂,其包含选自上述n-烷基取代芳基异喹啉酮化合物、其立体异构体、药学上可接受的盐中的一种或多种,或者包含上述药物组合物。
[0106]
本发明实施例第五方面提出上述n-烷基取代芳基异喹啉酮化合物或其立体异构体、药学上可接受的盐或者上述药物组合物的应用,应用选自:治疗炎症、治疗自身免疫相关疾病等,炎症优选炎症性肠病。
[0107]
制备实施实例
[0108]
制备实施例1
[0109]
3-(苯并[d][1,3]二氧杂-5-基)-7,8-二甲氧基-2-(1-甲氧基-2-(苯硫基)乙基)异喹啉-1(2h)-酮(化合物1)的合成
[0110][0111]
5-(苯并[d][1,3]二噁唑-5-基)-3,9,10-三甲氧基-2,3-二氢噁唑并[2,3-a]异喹啉-4-鎓(化合物a)(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入苯硫酚(22.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物25.0mg,产率52%。1h nmr(400mhz,chloroform-d)δ7.32(d,j=8.6hz,1h),7.29
–
7.24(m,2h),7.23
–
7.08(m,4h),6.87(d,j=1.7hz,1h),6.84
(d,j=7.9hz,1h),6.75(d,j=8.0hz,1h),6.17(s,1h),6.03(q,j=1.5hz,2h),5.77(d,j=28.6hz,1h),3.97(d,j=12.9hz,6h),3.60(s,2h),3.34(s,3h).
13
c nmr(125mhz,chloroform-d)δ161.75,151.90,147.91,147.23,140.98,135.62,131.77,129.57,128.77,126.12,123.50,121.76,120.32,119.28,110.34,108.67,107.87,101.39(ch2),89.28(ch),61.59,56.93,56.74,37.11(ch2).hrms(esi):c
27h25
o6nnas[m+na]
+
,cal.514.1295,found 514.1310.
[0112]
制备实施例2
[0113]
3-(苯并[d][1,3]二氧杂-5-基)-7,8-二甲氧基-2-(1-甲氧基-2-(((4-甲氧基苯基)硫代)乙基)异喹啉-1(2h)-酮(化合物2)的合成
[0114][0115]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入对甲氧基苯硫酚(28.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物26.0mg,产率50%。1h nmr(400mhz,chloroform-d)δ7.32
–
7.28(m,1h),7.27
–
7.19(m,2h),7.13(d,j=8.6hz,1h),6.90
–
6.81(m,2h),6.77(d,j=7.9hz,1h),6.73
–
6.65(m,2h),6.15(s,1h),6.03(q,j=1.4hz,2h),5.64(s,1h),3.96(d,j=10.5hz,6h),3.74(s,3h),3.49(d,j=3.4hz,2h),3.33(s,3h).
13
c nmr(125mhz,chloroform-d)δ161.24,158.44,151.31,147.39,146.72,140.55,133.03,131.28,129.30,124.86,122.92,121.19,119.84,118.62,113.88,109.76,108.06,107.38,100.92(ch2),88.94(ch),61.05,56.36,56.16,54.69,38.19(ch2).
[0116]
制备实施例3
[0117]
3-(苯并[d][1,3]二氧杂-5-基)-7,8-二甲氧基-2-(1-甲氧基-2-(对甲苯硫基)乙基)异喹啉-1(2h)-酮(化合物3)的合成
[0118][0119]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入对甲基苯硫酚(23.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物28.0mg,产率55%。1h nmr(400mhz,chloroform-d)δ7.33
–
7.28(m,1h),7.15(dd,j=10.3,8.3hz,3h),6.97(d,j=7.8hz,2h),6.88(d,j=1.7hz,1h),6.84(d,j=8.1hz,1h),6.76(d,j=8.1hz,1h),6.16(s,1h),6.03
(d,j=1.1hz,2h),5.69(s,1h),3.97(d,j=11.6hz,6h),3.50(d,j=4.0hz,2h),3.33(s,3h).
13
c nmr(125mhz,chloroform-d)δ161.75,151.82,150.03,147.89,147.21,141.01,136.34,131.77,131.55,130.49,129.78,129.53,123.51,121.72,120.31,119.12,110.40,109.83,107.87,101.38(ch2),89.32(ch),61.55,56.86,56.69,37.50(ch2).hrms(esi):c28 h28 n o6 s[m+h]
+
,cal.506.1632,found 506.1639.
[0120]
制备实施例4
[0121]
3-(苯并[d][1,3]二氧杂-5-基)-7,8-二甲氧基-2-(1-甲氧基-2-(((4-硝基苯基)硫代)乙基)异喹啉-1(2h)-酮(化合物4)的合成
[0122][0123]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入对硝基苯硫酚(31.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物22.0mg,产率40%。1h nmr(400mhz,chloroform-d)δ8.06
–
7.96(m,2h),7.35
–
7.30(m,3h),7.14(d,j=8.6hz,1h),6.90
–
6.80(m,3h),6.19(s,1h),6.05(q,j=1.3hz,2h),5.72(s,1h),4.01(s,3h),3.97(s,3h),3.75(d,j=29.0hz,2h),3.33(s,3h).
13
c nmr(125mhz,chloroform-d)δ161.70,152.09,150.00,148.10,147.41,146.07,145.25,140.45,131.47,129.60,127.23,123.70,123.47,121.82,120.19,119.31,110.20,108.89,108.00,101.57(ch2),89.34(ch),61.54,56.85,56.83,35.24(ch2).hrms(esi):c
27h25
n2o8s[m+h]
+
,cal.537.1326,found537.1332.
[0124][0125]
制备实施例5
[0126]
3-(苯并[d][1,3]二氧杂-5-基)-7,8-二甲氧基-2-(1-甲氧基-2-(((4-(三氟甲基)苯基)硫代)乙基)异喹啉-1(2h)-酮(化合物5)的合成
[0127][0128]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入对三氟甲基苯硫酚(36.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物30.0mg,产率54%。1h nmr(400mhz,chloroform-d)δ7.41(d,j=8.3hz,2h),7.36
–
7.29(m,3h),7.15(d,j=8.6hz,1h),6.85(d,j=7.5hz,2h),6.79(d,j=7.9hz,1h),6.18(s,1h),6.02(q,j=1.4hz,2h),5.72(s,1h),
3.98(d,j=14.6hz,6h),3.88
–
3.53(m,2h),3.33(s,3h).
13
c nmr(125mhz,chloroform-d)δ161.70,152.00,148.02,147.33,141.15,131.58,129.63,127.93,125.47,125.44,123.46,121.79,120.24,119.32,110.30,108.78,107.91,101.45(ch2),89.28(ch),61.53,56.83,56.78,35.67(ch2).hrms(esi):c28 h25 f3 n o6 s[m+h]
+
,cal.560.1349,found 560.1355.
[0129]
制备实施例6
[0130]
3-(苯并[d][1,3]二氧杂-5-基)-7,8-二甲氧基-2-(1-甲氧基-2-((3-(三氟甲基)苯基)硫代)乙基)异喹啉-1(2h)-酮(化合物6)的合成
[0131][0132]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入间三氟甲基苯硫酚(36.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物28.0mg,产率50%。1h nmr(400mhz,chloroform-d)δ7.49(d,j=1.8hz,1h),7.48
–
7.44(m,1h),7.37
–
7.33(m,2h),7.32(s,1h),7.16(d,j=8.6hz,1h),6.91
–
6.81(m,2h),6.77(d,j=8.0hz,1h),6.19(s,1h),6.03(s,2h),5.75(s,1h),3.99(s,3h),3.96(s,3h),3.70(d,j=61.9hz,2h),3.33(s,3h).
13
c nmr(125mhz,chloroform-d)δ161.41,151.67,149.80,147.70,146.99,140.41,137.02,131.94,131.35,128.80,125.27,124.51,123.08,122.35,121.53,119.90,119.05,109.89,108.49,107.55,101.13(ch2),89.00(ch),61.23,56.60,56.41,36.43(ch2).hrms(esi):c28 h25 f3 n o6 s[m+h]
+
,cal.560.1349,found 560.1347.
[0133]
制备实施例7
[0134]
3-(苯并[d][1,3]二氧杂-5-基)-2-(2-((3,5-双(三氟甲基)苯基)硫基)-1-甲氧基乙基)-7,8-二甲氧基异喹啉-1(2h)-酮(化合物7)的合成
[0135][0136]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入3,5-二三氟甲基苯硫酚(49.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物12.0mg,产率22%。1h nmr(400mhz,chloroform-d)δ7.71(s,2h),7.61(s,1h),7.35(d,j=8.6hz,1h),7.18(d,j=
8.6hz,1h),6.84(d,j=7.3hz,2h),6.78(d,j=8.0hz,1h),6.21(s,1h),6.03(s,2h),5.83(s,1h),4.01(s,3h),3.97(s,3h),3.67(s,2h),3.31(s,3h).
13
c nmr(125mhz,chloroform-d)δ161.45,151.79,149.82,147.79,147.05,139.64,131.74,131.47,131.26,129.29,127.77,123.80,122.94,121.58,119.78,119.16,109.64,108.73,107.53,101.19(ch2),88.86(ch),61.19,56.59,56.44,36.58(ch2).hrms(esi):c29 h24 f6 n o6 s[m+h]
+
,cal.628.1223,found 628.1243.
[0137]
制备实施例8
[0138]
3-(苯并[d][1,3]二氧杂-5-基)-2-(2-(((4-溴苯基)硫代)-1-甲氧基乙基)-7,8-二甲氧基异喹啉-1(2h)-酮(化合物8)的合成
[0139][0140]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入对溴苯硫酚(38.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物20.0mg,产率35%。1h nmr(400mhz,chloroform-d)δ7.34(s,1h),7.29
–
7.25(m,2h),7.20
–
7.08(m,3h),6.99
–
6.84(m,2h),6.80(d,j=7.8hz,1h),6.17(s,1h),6.05(q,j=1.4hz,2h),5.65(s,1h),3.98(d,j=8.8hz,6h),3.69(s,2h),3.33(s,3h).
13
c nmr(125mhz,chloroform-d)δ161.68,151.93,147.98,147.30,140.80,134.60,131.73,131.62,131.15,129.67,123.45,121.72,120.06,119.24,110.31,108.59,107.92,101.49(ch2),89.33(ch),61.53,56.84,56.73,36.63(ch2).hrms(esi):c27 h25 br n o6 s[m+h]
+
,cal.570.0580,found 570.0578.
[0141]
制备实施例9
[0142]
3-(苯并[d][1,3]二氧杂-5-基)-2-(2-((2-溴苯基)硫基)-1-甲氧基乙基)-7,8-二甲氧基异喹啉-1(2h)-酮(化合物9)的合成
[0143][0144]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入邻溴苯硫酚(38.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物18.0mg,产率33%。1h nmr(400mhz,chloroform-d)δ7.50(dd,j=7.9,1.4hz,1h),7.33(d,j=8.6hz,1h),7.25(dd,j=7.9,
1.6hz,1h),7.21
–
7.13(m,2h),6.99(td,j=7.6,1.6hz,1h),6.94
–
6.81(m,2h),6.75(d,j=8.0hz,1h),6.19(s,1h),6.13
–
5.95(m,2h),5.71(s,1h),3.98(d,j=16.8hz,6h),3.68(s,2h),3.33(s,3h).
13
c nmr(125mhz,chloroform-d)δ161.18,151.43,147.43,146.78,140.42,136.49,132.41,131.24,129.09,128.54,127.18,126.33,123.38,121.31,119.84,118.83,109.80,108.22,107.41,100.90(ch2),88.50(ch),61.10,56.42,56.27,35.76(ch2).hrms(esi):c27 h25 br n o6 s[m+h]
+
,cal.570.0580,found 570.0588.
[0145]
制备实施例10
[0146]
3-(苯并[d][1,3]二氧杂-5-基)-2-(2-((3-溴苯基)硫基)-1-甲氧基乙基)-7,8-二甲氧基异喹啉-1(2h)-酮(化合物10)的合成
[0147][0148]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入间溴苯硫酚(38.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物16.0mg,产率29%。1h nmr(400mhz,chloroform-d)δ7.37(t,j=1.8hz,1h),7.33(d,j=8.6hz,1h),7.26
–
7.12(m,3h),7.05(t,j=7.9hz,1h),6.91
–
6.81(m,2h),6.78(d,j=8.0hz,1h),6.19(s,1h),6.04(s,2h),5.71(s,1h),3.98(d,j=15.1hz,6h),3.54(d,j=27.7hz,2h),3.33(s,3h).
13
c nmr(125mhz,chloroform-d)δ161.22,151.45,147.49,146.81,140.31,137.56,131.20,131.17,129.55,128.58,127.33,122.92,122.08,121.36,119.76,118.80,109.68,108.23,107.43,100.97(ch2),88.79(ch),61.10,56.41,56.24,36.32(ch2).hrms(esi):c27 h25 br n o6s[m+h]
+
,cal.570.0580,found 570.0584.
[0149]
制备实施例11
[0150]
3-(苯并[d][1,3]二氧杂-5-基)-2-(2-(((4-氟苯基)硫基)-1-甲氧基乙基)-7,8-二甲氧基异喹啉-1(2h)-酮(化合物11)的合成
[0151][0152]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入对氟苯硫酚(26.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物23.0mg,产率45%。
[0153]1h nmr(400mhz,chloroform-d)δ7.28(dt,j=13.4,7.4hz,3h),7.14(d,j=
8.6hz,1h),6.84(q,j=16.3,12.8hz,5h),6.16(s,1h),6.04(s,2h),5.65(s,1h),3.96(d,j=11.5hz,7h),3.55(s,2h),3.32(s,3h).
13
c nmr(125mhz,chloroform-d)δ162.80,161.70,160.85,151.92,150.05,147.97,147.26,140.87,132.82,132.75,131.70,129.72,123.41,121.74,120.27,119.29,115.88,115.71,110.19,108.62,107.89,101.46(ch2),89.41(ch),61.52,56.89,56.67,38.11(ch2).hrms(esi):c27 h25 f n o6 s[m+h]
+
,cal.510.1381,found 510.137.
[0154]
制备实施例12
[0155]
3-(苯并[d][1,3]二氧杂-5-基)-7,8-二甲氧基-2-(1-甲氧基-2-(吡啶-2-基硫基)乙基)异喹啉-1(2h)-酮(化合物12)的合成
[0156][0157]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入2-巯基吡啶(22.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得白色固体产物15.0mg,产率31%。
[0158]1h nmr(400mhz,chloroform-d)δ8.34
–
8.24(m,1h),7.44(td,j=7.8,1.8hz,1h),7.33(d,j=8.6hz,1h),7.17(d,j=8.6hz,1h),7.12(d,j=8.1hz,1h),6.94(t,j=6.2hz,1h),6.83(s,2h),6.65(s,1h),6.17(s,1h),5.96(d,j=19.1hz,2h),5.69(s,1h),3.98(d,j=16.2hz,8h),3.40(s,3h).
13
c nmr(125mhz,chloroform-d)δ161.70,158.04,151.84,149.24,147.70,147.05,141.61,135.79,131.92,123.51,122.01,121.68,120.61,119.37,119.23,110.45,108.17,107.64,101.22(ch2),89.33(ch),61.62,57.00,56.80,29.70(ch2).hrms(esi):c26 h24 n2 na o6 s[m+na]
+
,cal.515.1247,found 515.1250.
[0159]
制备实施例13
[0160]
3-(苯并[d][1,3]二氧杂-5-基)-7,8-二甲氧基-2-(1-甲氧基-2-(嘧啶-2-基硫基)乙基)异喹啉-1(2h)-酮(化合物13)的合成
[0161][0162]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入2-巯基嘧啶(22.4mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得白色固体产物28.0mg,产率57%。
[0163]1h nmr(400mhz,chloroform-d)δ8.44(d,j=4.8hz,2h),7.33(d,j=8.6hz,1h),7.17(d,j=8.6hz,1h),6.94(t,j=4.8hz,1h),6.85(s,2h),6.68(s,1h),6.18(s,1h),6.04
–
5.89(m,2h),3.98(d,j=13.3hz,7h),3.83(d,j=39.5hz,1h),3.42(s,3h).
13
c nmr(125mhz,chloroform-d)δ171.74,161.76,157.16,151.89,150.21,147.72,147.03,141.40,131.88,129.80,123.73,121.73,120.59,119.37,116.37,110.56,108.39,107.66,101.24(ch2),88.76(ch),61.60,56.98,56.78,31.58(ch2).hrms(esi):c25 h23 n3 na o6 s[m+na]
+
,cal.516.1200,found 516.1209.
[0164]
制备实施例14
[0165]
3-(苯并[d][1,3]二氧杂-5-基)-2-(2-((4,6-二甲基嘧啶-2-基)硫基)-1-甲氧基乙基)-7,8-二甲氧基异喹啉-1(2h)-酮(化合物14)的合成
[0166][0167]
化合物a(42.0mg,0.1mmol)溶于dmf(3.0ml),加入氢化钠(12mg,0.3mmol 60%),搅拌反应10分钟,加入4,6-二甲基-2-巯基嘧啶(28.0mg,0.2mmol),密封反应过夜,加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得白色固体产物25.0mg,产率48%。
[0168]1h nmr(400mhz,chloroform-d)δ7.32(d,j=8.6hz,1h),7.16(d,j=8.6hz,1h),6.81(s,2h),6.66(s,1h),6.16(s,1h),5.95(d,j=16.4hz,2h),5.77(s,1h),3.98(d,j=16.4hz,7h),3.86
–
3.63(m,1h),3.46(s,3h),2.32(s,6h).
13
c nmr(125mhz,chloroform-d)δ170.34,166.96,161.68,151.83,147.55,146.95,141.52,131.95,129.96,123.57,121.72,120.64,119.34,115.52,110.47,109.16,107.48,101.21(ch2),88.60(ch),61.59,56.98,56.79,29.69(ch2),23.68.hrms(esi):c27 h27 n3 na o6 s[m+na]
+
,cal.544.1513,found 544.1521.
[0169]
制备实施例15
[0170]
化合物15-s、15-r、16-s、16-r的合成
[0171]
化合物a(10.0g,24.0mmol)溶于dmf(100ml),加入氢化钠(2.9g,72.0mmol 60%),搅拌反应10分钟,加入对硝基苯硫酚(7.4g,48.0mmol),开盖接触空气反应过夜,冰浴加饱和氯化铵溶液淬灭反应,反应液加水稀释,乙酸乙酯萃取,分离有机相、水洗、饱和氯化钠洗,无水硫酸钠干燥,减压蒸干,硅胶柱分离,得微黄色固体产物4.6g,粗产率35%。该固体经超临界二氧化碳色谱两次分离(仪器:thar 200preparative sfc(sfc-7)和thar350preparative sfc(sfc-6);色谱柱:chiralcel oj,300
×
50mm i.d.,10μm and chiralpak ad,300
×
50mm i.d.,10μm),获得4个单一构型化合物如下:
[0172][0173]
得到微黄色固体15-s共0.84g,ee》99%。1h nmr(400mhz,acetone-d6)δ8.13
–
8.06(m,2h),7.51(dd,j=8.8,7.5hz,3h),7.30(d,j=8.7hz,1h),7.05
–
6.97(m,2h),6.91(d,j=7.9hz,1h),6.25(s,1h),6.08(s,2h),5.76(s,1h),3.94(s,3h),3.88(s,3h),3.84(s,2h),3.29(s,3h).
13
c nmr(125mhz,acetone-d6)δ160.94,152.18,149.81,148.07,147.38,146.45,145.31,140.91,131.62,129.98,127.25,123.59,121.94,120.22,119.26,110.15,108.09,107.76,101.63(ch2),88.96,60.41,56.10,55.94,34.95(ch2).hrms(esi):c27h25 n2 o8 s[m+h]
+
,cal.537.1326,found 537.1319.[α]20d=71(c=0.100,meoh)。
[0174][0175]
得到微黄色固体15-r共0.71g,ee》99%。1h nmr(400mhz,acetone-d6)δ8.12
–
8.05(m,2h),7.51(dd,j=8.9,7.4hz,3h),7.30(d,j=8.6hz,1h),7.04
–
6.96(m,2h),6.91(d,j=7.9hz,1h),6.25(s,1h),6.08(d,j=1.1hz,2h),5.75(s,1h),3.94(s,3h),3.88(s,3h),3.84(s,2h),3.29(s,3h).
13
c nmr(125mhz,acetone-d6)δ160.95,152.18,149.80,148.07,147.39,146.45,145.31,140.90,131.62,129.98,127.25,123.59,121.94,120.22,119.26,110.15,108.09,107.76,101.63(ch2),88.96,60.41,56.10,55.94,34.95(ch2).hrms(esi):c27 h25 n2 o8 s[m+h]
+
,cal.537.1326,found 537.1316.[α]20d=-61(c=0.100,meoh)。
[0176][0177]
得到微黄色固体16-s共1.03g,ee》99%。1h nmr(400mhz,acetone-d6)δ8.26
–
8.20(m,2h),7.53(d,j=8.6hz,1h),7.35(d,j=8.7hz,1h),7.17
–
7.12(m,2h),7.09
–
7.04(m,2h),7.00
–
6.94(m,1h),6.32(s,1h),6.11(q,j=1.0hz,2h),5.83(s,1h),4.77(s,2h),3.95(s,3h),3.89(s,3h),3.27(s,3h).
13
c nmr(125mhz,acetone-d6)δ163.62,160.89,152.17,149.86,148.25,147.65,141.70,141.42,131.82,129.91,125.66,123.46,122.05,120.20,119.38,115.08,109.98,107.98,107.60,101.70(ch2),88.25,70.81(ch2),60.45,56.12,55.72.hrms(esi):c27 h25 n2 o9[m+h]
+
,cal.521.1555,found 521.1563.[α]20d=-21(c
lps刺激作用下,于37℃,5%co2培养箱中培养24h,另设无刺激剂本底对照及刺激对照孔,总体积为200μl。离心收取培养上清,采用tnf-αelisa检测试剂盒对培养上清中tnf-α进行检测。实验结果如表1和表2所示。
[0191]
表1:化合物对lps诱导巨噬细胞分泌tnfα的抑制活性
[0192][0193]
由表1的实验结果可知,本发明实施例的化合物对lps诱导巨噬细胞分泌的tnfα具有不同程度的抑制活性,远高于阳性对照药berberine。虽然本发明化合物的细胞生存率较阳性对照药berberine有所下降,但细胞生存率大于70%,说明本发明化合物的细胞毒性较低。
[0194]
表2:化合物15-s,15-r,16-s,16-r对巨噬细胞生存率及tnfα分泌的抑制活性
[0195]
化合物cc
50
(nm)tnfαic
50
(nm)15-s》2500》250015-r70415616-s》2500》1000016-r181814
[0196]
表2结果显示,单一立体构型的化合物15-r和16-r具有更强的tnfα抑制活性。
[0197]
实验例2本发明化合物动物体内抗炎活性。
[0198]
动物实验材料:c57bl/6纯系小鼠,雄性,8周龄,23-25g购自中国科学院上海实验动物中心,动物生产许可证号:scxk(沪)2013-0018号。动物饲养于中国科学院上海药物研究所spf级动物房,实验动物使用许可证号:syxk(沪)2013-0049号,动物至少适应饲养一周后进行实验,并每天监测实验动物健康状态。温度控制24
±
2℃,相对湿度控制50
±
10%,12h光暗循环。饲料和水均在消毒后由动物自由摄取,所有实验均严格按照美国国立卫生研究院发布的《实验动物的护理和使用指南》进行,并获得中国科学院上海药物研究所动物伦理委员会批准。
[0199]
对葡聚糖硫酸钠诱导的溃疡性结肠炎动物模型的药效学评价方法:
[0200]
将雄性c57bl/6小鼠按体重随机分组,分别为正常对照组、模型组、阳性药物治疗
组、化合物治疗组,每组6只动物。
[0201]
模型制备:为诱导溃疡性结肠炎动物模型,模型组及药物治疗组小鼠给予3%dss(w/v)饮用水,自由饮水持续7天。
[0202]
给药治疗时,本发明化合物16-r以0.5%羧甲基纤维素钠进行溶解或分散,每10g小鼠体重灌胃0.1ml,每天口服给药1次,共给药7天。在溃疡性结肠炎模型构建进程中,每天由3位实验人员双盲监测小鼠体重、粪便形态及隐血,并按表3所列标准计算uc疾病活动指数(disease activity index,dai)。
[0203]
表3溃疡性结肠炎疾病活动指数评分标准
[0204]
分数体重下降粪便形态粪便隐血0无正常阴性11-5%较软且成形弱阳性26-10%软阳性311-20%非常软且湿强阳性4》20%腹泻肛周出血
[0205]
实验结果如图1~4所示,图1为化合物16-r治疗dss诱导的溃疡性结肠炎时小鼠的体重变化图,以初始体重的百分比表示,图2为疾病活动指数(dai),图3为大便一致性分数,图4为潜血分数。其中,数据显示为平均值
±
sem。与模型组相比,***p《0.001,**p《0.01,*p《0.05。
[0206]
由图1~图4可知,与对照组小鼠相比,在c57bl/6j小鼠中3%dss处理可能导致严重的结肠炎症,包括腹泻,出血和体重减轻。结果表明,化合物16-r在体内具有显著的抗炎作用,并且30mg/kg剂量的化合物16-r可以降低疾病活动指数,优于临床上常用的抗ibd药物柳氮磺胺吡啶(sasp)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1