一种催化效率提高的环氧化物水解酶突变体及其制备方法与流程
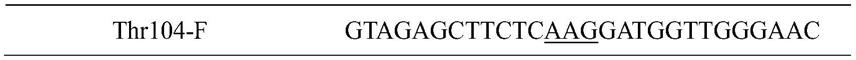
1.本发明涉及酶工程技术领域,特别涉及一种催化效率提高的环氧化物水解酶突变体及其制备方法。
背景技术:
2.环氧化物水解酶(epoxide hydrolase,eh,ec,3.3.2.
‑
)又称环氧化物水合酶或环氧水化酶,是一类催化水分子立体选择性的加成环氧化物水解为相应12
‑
二醇的水解酶,来源广泛,先是由brooks等人于40多年前发现,而后在细菌、酵母、霉菌、植物、昆虫以及哺乳动物等所有类型的有机体中均发现了其存在,研究表明该酶参与催化不需要辅酶并可以立体选择性的将环氧化物水解拆分为手性环氧化物及相应的邻二醇。通过分析来源于微生物的环氧化物水解酶的序列信息,发现其大多属于α/β折叠水解酶家族,且该类型酶高的对映体选择性使得它们对于制备各类手性药物和精细化学品具有重要意义。
3.目前,生产环氧化物水解酶的方法主要有两种,其中,化学法存在成本较高,副产物多,环境压力大等缺点。基因克隆表达技术虽然提高了微生物eh不对称拆分环氧化物的活力,但在提高对映体选择性方面的作用不显著,在研发生产中这将造成反应速度慢、敏感度低的问题,从而导致生产周期的延长,金钱、人力的消耗。
4.总之,现有发明提供的环氧化物水解酶组作用效果一般,敏感度较低,在65℃下的半衰期较野生型缩短,伴随着热稳定性的提高,催化效率却大大降低,在工业生产中酶催化效率降低将无法正常产出合格产品,对于生产的研发来说将会大大延长生产周期,在无形中对人力、金钱都造成了相当大的损耗。此外,相对于盲目筛菌或人工(自然)诱变等手段,现有改良技术虽然缩短了酶学性质改造时间,但在酸性ph环境和中低温环境范围内稳定有所下降。当环境发生变化时,生产产品质量得不到保障,会造成产率低、合格率低等问题。
技术实现要素:
5.为了解决现有技术中存在的问题,本发明的目的是提供一种不仅催化效率高,而且热稳定性好、酶活强的环氧化物水解酶突变体。
6.为了实现上述目的,本发明的技术方案为:
7.第一方面,本发明提供了一种环氧化物水解酶突变体,所述环氧化物水解酶突变体是将如seq id no.2所示氨基酸序列的第104位、第179位和第232位的氨基酸序列进行单点突变获得。
8.进一步地,所述环氧化物水解酶突变体为下列之一:
9.将seq id no.2所示的氨基酸序列第104位的苏氨酸突变为赖氨酸;
10.将seq id no.2所示的氨基酸序列第179位的异亮氨酸突变为亮氨酸;
11.将seq id no.2所示的氨基酸序列第232位的天冬氨酸突变为丝氨酸;
12.本发明还提供一种编码所述环氧化物水解酶突变体的基因,所述突变体基因的碱基序列是以seq id no.1为基础进行突变的。
13.本发明还提供一种携带所述环氧化物水解酶突变体基因的重组载体。
14.第二方面,本发明还提供一种环氧化物水解酶突变体的制备方法,包括如下步骤:
15.s1、将seq id no.1所示序列与pet
‑
28a(+)质粒连接,构成重组表达载体pet
‑
28a(+)
‑
ehj;
16.s2、以重组载体pet
‑
28a(+)
‑
ehj为模板,利用特异性定点突变引物构建环氧化物水解酶突变体重组表达载体;
17.s3、将重组载体pet
‑
28a(+)
‑
ehj及突变体载体热击转化感受态,涂布抗性lb固体培养基中,过夜培养后进行菌落pcr验证;
18.s4、将经过验证的阳性克隆子提取质粒,转化e.coli bl21(de3)后再次筛选出阳性克隆子,接种至含硫酸卡那霉素的lb培养基中,37℃振荡培养过夜,再按2%(v/v)的接种量接入装有100ml lb培养基的500ml三角瓶中,置于37℃、200rpm摇床振荡培养,当培养液od600达到合适值时,加入iptg作为诱导剂进行诱导表达。
19.进一步地,步骤s2所述特异性定点突变引物为:
20.thr104
‑
f:gtagagcttctcaaggatggttgggaac;
21.thr104
‑
r:gttcccaaccatccttgagaagctctac;
22.lle179
‑
f:gtgcagcgactttatcgggcattgctccgt;
23.lle179
‑
r:acggagcaatgcccgataaagtcgctgcac;
24.asp232
‑
f:cgactttctggtttcaagtataagcgaa;
25.asp232
‑
r:ttcgcttatacttgaaaccagaaagtcg。
26.进一步地,步骤s3所述感受态细胞为大肠杆菌dh5α感受态细胞,所述抗性lb固体培养基为含卡那霉素抗性的lb固体培养基。
27.进一步地,步骤s4所述含硫酸卡那霉素的lb培养基中硫酸卡那霉素的浓度为50mg/l。
28.进一步地,步骤s4所述培养液od600的合适值为0.6
‑
0.8。
29.进一步地,所述iptg诱导剂的浓度为0.5mm,诱导条件为28℃培养10h。将所述环氧化物水解酶突变体基因连接pet
‑
28a(+)载体,并转化e.coli bl21(de3)进行iptg诱导表达。
30.与现有技术相比,本发明的有益效果:
31.对环氧化物水解酶原有基因片段进行单点突变,得到环氧化物水解酶突变体,与野生型环氧化物水解酶相比,突变体的热稳定性与酶活均大大增强,可以提高工业化生产中环氧化物水解酶的适用寿命。
附图说明
32.利用附图对本发明作进一步说明,但附图中的实施例不构成对本发明的任何限制,对于本领域的普通技术人员,在不付出创造性劳动的前提下,还可以根据以下附图获得其它的附图。
33.图1为本发明一种环氧化物水解酶突变体的重组载体pet
‑
28a(+)
‑
ehj的重组质粒图;
34.图2为本发明一种环氧化物水解酶突变体的sds
‑
page图;
35.图3为本发明一种环氧化物水解酶突变体的稳定性与酶活性的变化图。
具体实施方式
36.下面结合附图对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
37.实施例1
38.环氧化物水解酶突变体的构建
39.将加上bamh i和xho i酶切位点后的核苷酸序列seq id no.1进行扩增,与质粒pet28a(+)同时用限制性内切酶bamh i和xho i过夜双酶切,次日经琼脂糖凝胶电泳纯化并利用琼脂糖回收试剂盒回收目标片段,将dna片段ehj与pet28a质粒片段使用t4 dna连接酶在16℃下过夜连接,得到重组表达载体pet
‑
28a(+)
‑
ehj(如图1所示),将构建好的重组表达载体pet
‑
28a(+)
‑
ehj热击转化大肠杆菌dh5α感受态,涂布含卡那霉素抗性lb固体培养基中,过夜培养后进行菌落pcr验证,阳性克隆即为环氧化物水解酶原始酶。
40.设计并合成特异性定点突变引物,如表1所示:
41.表1定点突变的引物序列
[0042][0043][0044]
以质粒pet
‑
28a(+)
‑
ehj为模板,使用如上定点突变引物进行定点突变(参考current protocols in protein science 2011,26.6.1
‑
26.6.10;anal,biochem.2008,375:376
‑
378),pcr体系为:10
×
pyrobest buffer 5ul,dntp 4ul,模板0.5ul,突变引物各0.5ul,pyrobest dna polymerase 0.5ul,补无菌水至50ul,pcr之后使用dpn i酶切去除模板质粒,将酶切产物dh5α转化大肠杆菌dh5α感受态,涂布含卡那霉素抗性lb固体培养基中,过夜培养后进行菌落pcr验证,阳性克隆即为环氧化物水解酶突变体。
[0045]
实施例2
[0046]
环氧化物水解酶原始酶和突变体菌株的诱导表达
[0047]
挑取实施例1中阳性克隆子接种至液体lb培养基,提取质粒,转化e.coli bl21(de3)感受态细胞,涂布含卡那霉素抗性的lb固体培养基,过夜培养挑取阳性克隆子,接种至硫酸卡那霉素终浓度50mg/l的lb培养基中,37℃振荡培养过夜,再按2%(v/v)的接种量接入装有100ml lb培养基的500ml三角瓶中,置于37℃、200rpm摇床振荡培养,当培养液od600达到0.6
‑
0.8时,加入终浓度为0.5mm的iptg作为诱导剂,28℃诱导10h,离心收集菌体。
[0048]
实施例3
[0049]
环氧化物水解酶原始酶和突变体的纯化
[0050]
利用ni
‑
nta纯化目标蛋白,具体纯化方法:
[0051]
将实施例2中的菌体置于冰浴中超声破碎细胞30min,离心收集上清液,膜过滤备用;
[0052]
净化管路之后用10个柱体积的平衡缓冲液(20mm na2hpo4
‑
nah2po4,500mm nacl,20mm咪唑,ph8.0),清洗ni
‑
nta柱;
[0053]
以1.5ml/min的流速上样粗酶液,再以20倍柱体积的平衡缓冲液洗脱除去未吸附的酶蛋白,再以洗脱缓冲液洗脱(20mm na2hpo4
‑
nah2po4,500mm nacl,500mm咪唑,ph8.0);
[0054]
收集目标蛋白,酶液在磷酸液缓冲液(20mm na2hpo4
‑
nah2po4,ph8.0)中冰浴透析48h;
[0055]
sds
‑
page检测收集到的蛋白样品,如图2所示,泳道1
‑
4分别是环氧化物水解酶原始酶、thr104突变体、iie179突变体以及asp232突变体。
[0056]
实施例4
[0057]
环氧化物水解酶原始酶和突变体的热稳定性检测
[0058]
温度是影响酶稳定性的一个重要指标,其中半衰期可以反映酶的热稳定性,具体步骤如下:
[0059]
配置反应体系1:100ul酶液和900ul磷酸盐缓冲液(200mm,ph8.0)组成1ml反应体系若干组;配置反应体系2:100ul酶液和900ul含有相应量醇类(甲醇、乙醇,v/v)的磷酸盐缓冲液混合物(200mm,ph8.0)组成1ml反应体系若干组。
[0060]
各组50℃下保温不同时间后,加入终浓度为100mmrac
‑
ech,180rpm振荡反应5min后取样200ul于800ul乙酸乙酯中萃取,取上层有机相无水硫酸钠干燥后,进行气相检测。
[0061]
则酶的失活符合方程:ln(e/e0)=kd
×
t,其中e为t时刻酶活,e0为初始时刻酶活,kd失活速率常数。
[0062]
以初始酶活为标准,计算不同时刻的相对酶活,ra=[e]/[e0],得出结果如图3所示。
[0063]
可以看出单突变体thr104、lle179、asp232的半衰期均较原始酶有很大提高,且thr104>lle179>asp232>原始酶。
[0064]
以上结合附图对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1