一种识别EB病毒gH糖蛋白的单克隆抗体及其应用
一种识别eb病毒gh糖蛋白的单克隆抗体及其应用
技术领域
1.本发明属于抗体技术领域,具体涉及一种识别eb病毒gh糖蛋白的单克隆抗体及其应用。
背景技术:
2.eb病毒(epstein
‑
barr virus,ebv)最早于1964年由epstein和barr从burkitt淋巴瘤细胞中成功培养并建株。ebv属于γ亚型疱疹病毒,是首个被发现的人类致癌病毒。ebv在人群中的感染非常普遍,据报道全球约有95%以上的成年人携带有ebv。在儿童和青少年中,ebv感染多造成传染性单核细胞增多症。ebv的潜伏感染与人类多种淋巴肿瘤和上皮肿瘤发生有关,如霍奇金淋巴瘤、伯基特淋巴瘤及nk/t细胞淋巴瘤等,上皮肿瘤包括鼻咽癌和大约10%的胃癌等。而对于器官移植病人以及艾滋病患者等免疫抑制病人来说,罹患ebv相关肿瘤的概率大大增加。据统计,全球每年新增约200000例ebv相关的肿瘤病例,美国国立卫生研究院nih已于2016年正式将ebv列入第14版致癌物名录。
3.目前针对eb病毒尚无有效的疫苗,由ebv感染引起的疾病也缺乏特异的治疗手段。传染性单核细胞增多症的治疗大多应用抗病毒药物如阿昔洛韦等,虽然可一定程度上缓解症状,但并不能消除b淋巴细胞内及咽喉部上皮的eb病毒。ebv相关肿瘤的治疗主要为化疗和放疗,但对于复发或转移的患者来说,疗效较差。
4.单克隆抗体可大量生产,其与抗原结合的高亲和性和高特异性,大大减少了临床应用时的不良反应。同时可以对抗体分子进行改造以增加其抗病毒效力。抗体以其特异性和使用的灵活性成为感染性疾病治疗中非常有前景的手段。而至今仍未有针对ebv囊膜糖蛋白的单克隆抗体上市。因此开发抗ebv的单克隆抗体,将为ebv感染相关疾病提供更有效的预防和治疗手段。
技术实现要素:
5.本发明第一方面的目的,在于提供一种单克隆抗体或其抗原结合片段。
6.本发明第二方面的目的,在于提供编码本发明第一方面的单克隆抗体或其抗原结合片段的核酸分子。
7.本发明第三方面的目的,在于提供一种包含本发明第二方面的核酸分子的载体。
8.本发明第四方面的目的,在于提供一种包含本发明第三方面的载体的宿主细胞。
9.本发明第五方面的目的,在于提供一种杂交瘤细胞株。
10.本发明第六方面的目的,在于提供一种包含本发明第一方面的单克隆抗体或其抗原结合片段的偶联物。
11.本发明第七方面的目的,在于提供本发明第一方面的单克隆抗体或其抗原结合片段和/或本发明第六方面的偶联物在制备产品中的应用。
12.本发明第八方面的目的,在于提供一种包含本发明第一方面的单克隆抗体或其抗原结合片段和/或本发明第六方面的偶联物的试剂盒。
13.本发明第九方面的目的,在于提供一种包含本发明第一方面的单克隆抗体或其抗原结合片段和/或本发明第六方面的偶联物的药物。
14.为了实现上述目的,本发明所采取的技术方案是:
15.本发明的第一个方面,提供一种单克隆抗体或其抗原结合片段,所述单克隆抗体或其抗原结合片段与gh蛋白的第573、625、627、655位氨基酸特异性结合;
16.所述gh蛋白的氨基酸序列为:mqllcvfclvllwevgaaslsevklhldieghashytipwtelmakvpglspealwreanvtedlasmlnrykliyktsgtlgialaepvdipavsegsmqvdaskvhpgvisglnspacmlsaplekqlfyyigtmlpntrphsyvfyqlrchlsyvalsingdkfqytgamtskflmgtykrvtekgdehvlslifgktkdlpdlrgpfsypsltsaqsgdyslvivttfvhyanfhnyfvpnlkdmfsravtmtaasyaryvlqklvllemkggcrepeldtetlttmfevsvaffkvghavgetgngcvdlrwlaksffeltvlkdiigicygatvkgmqsyglerlaamlmatvkmeelghlttekqeyalrlatvgypkagvysgliggatsvllsaynrhplfqplhtvmretlfigshvvlrelrlnvttqgpnlalyqllstalcsaleigevlrglalgtesglfspcylslrfdltrdkllsmapqeamldqaavsnavdgflgrlsleredrdawhlpaykcvdrldkvlmiiplinvtfiissdrevrgsalyeasttylssslflspvimnkcsqgavageprqipkiqnftrtqkscifcgfallsydekegletttyitsqevqnsilssnyfdfdnlhvhylllttngtvmeiaglyeerahvvlaiilyfiafalgiflvhkivmffl(seq id no.11)。
17.优选地,所述gh蛋白为ghgl蛋白中的gh蛋白。
18.优选地,所述单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区;
19.所述重链可变区包含cdr1、cdr2、cdr3;
20.所述重链可变区cdr1的氨基酸序列为:gfdfsryw(seq id no:12);
21.所述重链可变区cdr2的氨基酸序列为:inpdssti(seq id no:13);
22.所述重链可变区cdr3的氨基酸序列为:arspyyygssydv(seq id no:14);
23.所述轻链可变区包含cdr1、cdr2、cdr3;
24.所述轻链可变区cdr1的氨基酸序列为:qsllnsrtrkny(seq id no:15);
25.所述轻链可变区cdr2的氨基酸序列为:was(seq id no:16);
26.所述轻链可变区cdr3的氨基酸序列为:kqsynlpt(seq id no:17)。
27.优选地,所述重链可变区的氨基酸序列如seq id no.5所示;
28.所述轻链可变区的氨基酸序列如seq id no.6所示。
29.优选地,所述单克隆抗体或其抗原结合片段包含重链恒定区和轻链恒定区;
30.所述重链恒定区的氨基酸序列如seq id no.7所示;
31.所述轻链恒定区的氨基酸序列如seq id no.8所示。
32.本发明的第二个方面,提供编码本发明第一方面的单克隆抗体或其抗原结合片段的核酸分子。
33.本发明的第三个方面,提供一种载体,包含本发明第二方面的核酸分子。
34.本发明的第四个方面,提供一种宿主细胞,包含本发明第三方面的载体。
35.本发明的第五个方面,提供一种偶联物,包含本发明第一方面的单克隆抗体或其抗原结合片段及偶联部分,所述偶联部分为可检测的标记。
36.优选地,所述偶联部分为放射性同位素、发光物质、有色物质或酶。
37.优选地,所述发光物质为荧光物质。
38.本发明第六方面,提供本发明第一方面的单克隆抗体或其抗原结合片段和/或本
发明第五方面的偶联物在制备产品中的应用。
39.优选地,所述产品包括试剂盒、药物。
40.优选地,所述试剂盒用于检测:
41.a)gh蛋白在样品中的存在或水平;或
42.b)eb病毒。
43.优选地,所述gh蛋白为ghgl蛋白中的gh蛋白。
44.优选地,所述药物用于治疗和/或预防eb病毒感染所引起的疾病。
45.优选地,所述疾病包括:鼻咽癌、胃癌、霍奇金淋巴瘤、伯基特淋巴瘤、nk/t细胞淋巴瘤、淋巴组织增生性疾病、传染性单核细胞增多症。
46.本发明的第七个方面,提供一种试剂盒,包含本发明第一方面的单克隆抗体或其抗原结合片段和/或本发明第五方面的偶联物。
47.本发明的第八个方面,提供一种药物,包含本发明第一方面的单克隆抗体或其抗原结合片段和/或本发明第五方面的偶联物。
48.优选地,所述药物还包含药学上可接受的载体。
49.本发明的有益效果是:
50.本发明提供了一种单克隆抗体或其抗原结合片段,该单克隆抗体或其抗原结合片段的结合活性要优于其他的单克隆抗体(ammo1、m3和1d8,ec50为13.36ng/ml);对glgh蛋白有较高亲和力(平衡解离常数(k
d
)为2.80nm);在上皮细胞和b细胞感染模型中均有较强中和活性:在上皮细胞感染模型的ic50分别为0.1084μg/ml;对细胞膜融合具有显著抑制效果;该单克隆抗体或其抗原结合片段与gh蛋白的第573、625、627、655位氨基酸特异性结合,不同于其他已报道的glgh中和抗体的识别、结合表位。
附图说明
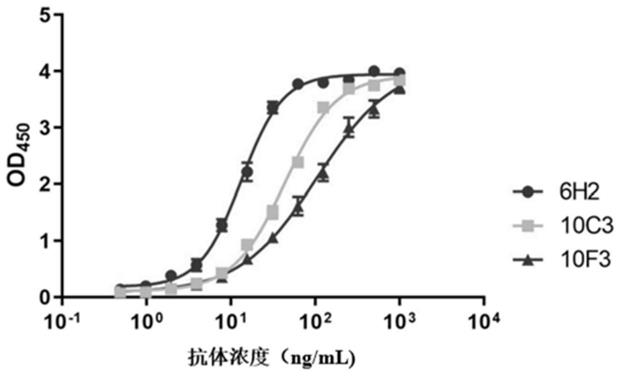
51.图1是不同单抗(6h2、10c3、10f3)的ec50检测结果图。
52.图2是不同单抗(6h2、ammo1、m3、1d8)的ec50检测结果图。
53.图3是单抗6h2与glgh蛋白结合的动力学分析图。
54.图4是不同单抗(6h2、migg)与共转了gh、gl蛋白全长基因质粒的293t细胞反应活性鉴定结果图。
55.图5是不同单抗的表位竞争结果图。
56.图6是不同单抗在ebv感染的上皮细胞模型的中和结果图。
57.图7是不同单抗在细胞融合模型的阻断结果图。
58.图8是嵌合单抗c6h2的ec50检测结果图。
59.图9是嵌合单抗c6h2与glgh蛋白结合的动力学分析图。
60.图10是嵌合单抗c6h2在ebv感染的上皮细胞模型的中和结果图。
61.图11是nsg人源小鼠模型构建及抗体治疗实验流程图。
62.图12是不同治疗方案的小鼠外周血中dna拷贝数变化图:其中,a是经单抗c6h2治疗后的小鼠外周血中dna拷贝数变化图;b是经单抗ammo1治疗后的小鼠外周血中dna拷贝数变化图;c是经单抗2g4治疗后的小鼠外周血中dna拷贝数变化图;d是经pbs治疗后的小鼠外周血中dna拷贝数变化图。
63.图13是不同治疗方案的小鼠体重变化图:其中,**表示p<0.01;****表示p<0.0001;ns表示p≥0.05。
64.图14是不同治疗方案的小鼠生存率变化图:其中,***表示p<0.001;ns表示p≥0.05。
65.图15是不同治疗方案的小鼠脾脏形态变化、h&e染色和eber原位杂交结果图。
66.图16是glgh蛋白特异性中和抗体的识别表位比较图。
67.图17是单抗6h2的识别表位分析图。
68.图18是单抗6h2与丙氨酸点突变的glgh蛋白elisa反应结果图。
具体实施方式
69.以下通过具体的实施例对本发明的内容作进一步详细的说明。
70.应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
71.下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。本实施例中所使用的材料、试剂等,如无特别说明,为从商业途径得到的试剂和材料。
72.实施例1抗eb病毒glgh蛋白单克隆抗体(单抗)的制备
73.(1)蛋白抗原的制备:参考eb病毒m81毒株全基因序列(kf373730.1)将gl蛋白膜外区序列(对应病毒bkrf2基因aa24
‑
aa137)c端通过柔性氨基酸序列连接gh蛋白膜外区序列(对应病毒bxlf2基因aa19
‑
aa678),gl蛋白的n端连接上信号肽编码序列,gh蛋白的c端连接上便于亲和层析纯化的多聚组氨酸多肽(6
×
his),将以上序列构建到合适的真核表达载体,把构建成功的重组质粒转染至293f细胞表达并进行纯化,最终获得glgh蛋白(glgh蛋白的氨基酸序列如seq id no.1所示,包括:gh蛋白(氨基酸序列如seq id no.11所示),链接序列(氨基酸序列为ggggsggggsggggs,seq id no.18),gl蛋白(氨基酸序列如seq id no.19所示),标签蛋白(氨基酸序列为hhhhhh,seq id no.20)。
74.(2)杂交瘤的制备:采用标准的体内免疫方式和peg融合方法获得单克隆抗体(详细方法参见ed harlow et al.,“antibodies a laboratory manual”,cold spring harbor laboratory 1988),简要过程如下:
75.1)小鼠免疫:将步骤(1)制备得到的glgh蛋白按照100μg/只剂量对小白鼠(6周龄雌性balb/c鼠,由厦门大学实验动物中心提供)进行免疫:将glgh蛋白与弗氏完全佐剂(cfa)等体积混合乳化,经皮下多点注射,每只小鼠共注射400μl,首次免疫后,分别于第14、28d,将glgh蛋白与弗氏不完全佐剂(ifa)等体积混合后进行加强免疫,经皮下多点注射,每只小鼠共注射400μl;最后于第42d对小鼠进行脾脏免疫加强,免疫原为上述glgh蛋白,按照50μg/只剂量注射,每只小鼠注射100μl,3d后取小鼠脾脏进行融合实验;
76.2)细胞融合及杂交瘤筛选:取小鼠脾脏研磨得到脾细胞悬液,与处于对数生长期的小鼠骨髓瘤细胞sp2/0混合,经peg1500作用下进行细胞融合,融合细胞重悬于200ml融合培养基(含hat和20%fbs的rpmi1640完全筛选培养基),分装到10块96孔细胞培养板中培养,经3次克隆化后,通过elisa方法筛选得到稳定的单克隆抗体细胞株a1、a2、a3;
77.3)杂交瘤的培养:将步骤2)得到的稳定的单克隆抗体细胞株a1、a2、a3先在二氧化碳培养箱中扩增培养,经96孔转移至24孔,再转移至50ml细胞培养瓶扩增培养然后收集细
id no.24);pcr反应体系:takara taq(r500a)0.25μl;10x pcr buffer 5μl;模板50ng;上/下游引物各1μl(10nm);灭菌水至50μl;pcr反应程序:95℃10s;98℃10s,55℃30s,72℃30s,30次循环;72℃10min;4℃保存。回收目的片段并克隆至pmd 18
‑
t载体,送至厦门铂瑞公司测序,测序结果通过vbase2数据库(http://www.vbase2.org/)分析抗体cdr区(complementary determinant region,互补决定区)序列;单克隆抗体6h2的重链可变区(vh)为:evkllesggglvqpggslklscaasgfdfsrywmtwvrqapgqglewigeinpdsstinytpslkdkfiisrdnakntlylqvsklrsedtalyycarspyyygssydvwgagtavtvss(seq id no.5),下划线部分为cdr区;单克隆抗体6h2的轻链可变区(vh)为:divmsqspsslavsagekvtmnckssqsllnsrtrknylawyqqkpgqspklliywastresgvpdrftgsgsgtdftltissvqaedlafyyckqsynlptfgggtkleik(seq id no.6)。
83.实施例3中和抗体6h2与其他抗体ammo1、m3、1d8的ec50对比
84.将glgh蛋白用cb缓冲液(nahco3/na2co3缓冲液,终浓度为50mm,ph值为9.6)稀释,终浓度为2μg/ml;在96孔酶标板每孔中加入100μl的包被液,37℃包被2小时;用pbst洗涤液(20mm pbs7.4,150mm nacl,0.1%tween20)洗涤1次;然后每孔加入200μl的封闭液(含有20%小牛血清及1%酪蛋白的ph值为7.4的20mm na2hpo4/nah2po4缓冲液溶液),放入37℃封闭2小时;弃去封闭液;干燥后装入铝箔袋2
‑
8℃保存备用。分别取单克隆抗体6h2、ammo1(ammo1制备方法参考文献snijder et al.,2018,immunity 48,799
–
811;ammo1轻链的pdb:6c5v_l;ammo1轻链的pdb:6c5v_h)、m3(已在专利文献cn111548411a中公开)、1d8(已在专利文献cn111690056a中公开),以20mm pbs缓冲液从1μg/ml为起始浓度开始2倍梯度稀释,共稀释12个梯度;取已包被glgh蛋白的酶标板,每孔加入100μl已稀释的抗体,置于37℃温箱反应30min。将酶标板用pbst洗液(20mm pbs7.4,150mm nacl,0.1%tween20)洗涤5遍,每孔加入100μl hrp标记的羊抗鼠igg反应液,置于37℃温箱反应30min。完成酶标记物反应步骤后,将酶标板用pbst洗液(20mm pbs7.4,150mm nacl,0.1%tween20)洗涤5遍,每孔加入tmb显色剂(购自北京万泰生物药业股份有限公司)各50μl,置于37℃温箱反应15min。完成显色反应步骤后,在反应完的酶标板中每孔加入终止液(购自北京万泰生物药业股份有限公司)50μl,并于酶标仪上检测各孔的od450/630值,结果如图2所示:单抗6h2、ammo1、m3、1d8的ec50分别为13.36ng/ml、25.46ng/ml、105.40ng/ml、20.57ng/ml;表明6h2的结合活性要优于ammo1、m3和1d8。
85.实施例4抗eb病毒glgh蛋白6h2单克隆抗体对glgh蛋白的亲和力检测
86.采用biacore 8k系统对单克隆抗体(6h2)和抗原进行结合的动力学分析(具体方法参照说明书),所有步骤都在pbs缓冲液下进行,采用该公司配套的protein a芯片捕获稀释为1μg/ml的单克隆抗体,使用glgh蛋白作为检测抗原,检测6h2对glgh蛋白的亲和力时抗原分别稀释为50nm、25nm、12.5nm、6.75nm、3.125nm,检测按照下述程序进行:捕获(captue)60s,分析(analyte)300s,解离(dissociation)600s,再生(regeneration)60s。采用仪器配套数据采集和分析软件进行抗体平衡解离常数的计算。
87.结果如图3所示,单抗6h2对glgh蛋白的平衡解离常数(k
d
)为2.80nm,有较高亲和力。
88.实施例5抗eb病毒glgh蛋白6h2单克隆抗体用于检测细胞中表达的glgh蛋白
89.(1)将293t接种到10cm细胞培养板中,待细胞汇合率达到60~80%时进行转染。
90.(2)a管:2ml opti
‑
mem中分别加入30μg gh、gl蛋白全长基因的真核表达质粒(ptt5
‑
gh质粒,序列如seq id no.25所示;ptt5
‑
gl质粒,序列如seq id no.26所示)。
91.(3)b管:2ml opti
‑
mem中加入60μl诺唯赞公司transfection reagent。
92.(4)将a、b管分别轻柔混匀,室温静置5min,再将稀释好的质粒(a管)滴加至稀释的转染试剂(b管)中,轻柔混匀,室温孵育10min。
93.(5)将质粒
‑
转染试剂复合物滴加至细胞中,置于5%co2浓度,37℃细胞培养箱中培养。
94.(6)转染48h后,用胰酶消化细胞,按照5x105细胞/管标准加入3μg单抗(以migg作为对照组,migg对照为72a1,已在文献:monoclonal antibody against a 250,000
‑
dalton glycoprotein of epstein
‑
barr virus identifies a membrane antigen and a neutralizing antigen中公开,通过杂交瘤细胞株hb
‑
168细胞(atcc)得到)并用pbs补足到100μl,4℃孵育30min,每管加入1ml pbs缓冲液洗涤细胞,1500rpm,5min,4℃离心,弃去上清保留细胞,共洗涤3次。
95.(7)每管样品中加入fitc荧光染料标记的羊抗鼠igg二抗2μl,4℃避光孵育30min,每管加入1ml pbs缓冲液洗涤细胞,1500rpm,5min,4℃离心,弃去上清保留细胞,共洗涤3次。
96.(8)用1ml pbs重悬细胞,使用bd公司的流式细胞仪lsrfortessax
‑
20检测fitc阳性细胞比例。
97.结果如图4所示,单抗6h2对共转了gh、gl蛋白全长基因质粒的293t细胞有明显反应,而对照组(ctrl migg)没有反应性,说明6h2能特异识别表达在细胞表面的天然gh、gl蛋白。
98.实施例6抗eb病毒glgh蛋白6h2单克隆抗体与其他glgh蛋白中和抗体(ammo1)表位竞争鉴定
99.(1)辣根过氧化物酶(hrp)偶联抗体制备:以浓度为1mg/ml的目的抗体(6h2、ammo1)1mg在4℃条件透析至cb缓冲液(nahco3/na2co3缓冲液,终浓度为50mm,ph值为9.6),每隔4小时换液一次,共换液两次;分别将hrp干粉和naio4干粉,用超纯水溶解至20mg/ml,再将两种溶液按照体积比1:1混匀,4℃避光孵育30min进行hrp活化,加入乙二醇终止hrp活化,按照20mg hrp中加入20μl乙二醇为标准加入相应量乙二醇,室温避光孵育30min;往抗体溶液中加入1mg终止活化后的hrp,混合均匀后在4℃条件透析至cb缓冲液,每隔4小时换液一次,共换液两次;使用超纯水配制浓度为20mg/ml的nabh4溶液,在以上抗体溶液中加入10μl nabh4溶液终止酶标反应,在4℃条件下,每隔30min混匀一次,共混匀3次;加入等体积饱和硫酸铵溶液沉降酶标抗体,12000rpm离心10min,弃去上清,用pbs缓冲液配制成的终浓度为50%甘油,10%nbs(新生牛血清)的缓冲液重悬溶解饱和硫酸铵沉淀的抗体。
100.(2)反应板的制备:将glgh蛋白用cb缓冲液(nahco3/na2co3缓冲液,终浓度为50mm,ph值为9.6)稀释,终浓度为0.1μg/ml;在96孔酶标板每孔中加入100μl的包被液,37℃包被2小时;用pbst洗涤液(20mm pb7.4,150mm nacl,0.1%tween20)洗涤1次;然后每孔加入200μl的封闭液(含有20%小牛血清及1%酪蛋白的ph值为7.4的20mm na2hpo4/nah2po4缓冲液溶液),放入37℃封闭2h后弃去封闭液;干燥后装入铝箔袋2~8℃保存备用。
101.(3)glgh蛋白中和抗体表位竞争检测:取步骤(1)得到的辣根过氧化物酶(hrp)偶联抗体标记的单克隆抗体(6h2、ammo1),以20mm pbs缓冲液按照1:100比例开始稀释,并5倍梯度稀释,共稀释8个梯度;取已包被glgh蛋白的酶标板,每孔加入100μl已稀释的抗体样品,置于37℃温箱反应30min;将酶标板用pbst洗液(20mm pb7.4,150mm nacl,0.1%tween20)洗涤5遍,每孔加入tmb显色剂(购自北京万泰生物药业股份有限公司)各50μl,置于37℃温箱反应15min;完成显色反应步骤后,在反应完的酶标板中每孔加入终止液(购自北京万泰生物药业股份有限公司)50μl,并于酶标仪上检测各孔的od450/630值。选择od值在1左右对应的hrp标记抗体的稀释倍数作为后续使用的稀释倍数。
102.(4)取单抗6h2、已报道抗体72a1(针对eb病毒gp350糖蛋白的鼠源中和单抗,已在文献:monoclonal antibody against a 250,000
‑
dalton glycoprotein of epstein
‑
barr virus identifies a membrane antigen and a neutralizing antigen中公开,通过杂交瘤细胞株hb
‑
168细胞(atcc)得到)、ammo1(针对eb病毒glgh糖蛋白的人源中和单抗,ammo1制备方法参考文献snijder et al.,2018,immunity 48,799
–
811)、vrc01(针对hiv病毒gp120糖蛋白的人源中和单抗,已在文献:rational design of envelope identifies broadly neutralizing human monoclonal antibodies to hiv
‑
1中公开,其重链可变区的genbank:gu980702.1,轻链可变区的genbank:gu980703.1),以20mm pbs缓冲液分别稀释为10μg/ml,取已包被glgh蛋白的酶标板,每孔加入100μl已稀释的抗体样品(6h2、72a1、ammo1、vrc01),命名为“primary antibody(一抗),”置于37℃温箱反应30min;将酶标板用pbst洗液(20mm pb7.4,150mm nacl,0.1%tween20)洗涤5遍,每孔加入100μl 1000倍稀释后的hrp标记抗体(6h2、ammo1),命名为“secondary antibody”(二抗),置于37℃温箱反应30min;完成hrp标记抗体反应步骤后,将酶标板用pbst洗液(20mm pb7.4,150mm nacl,0.1%tween20)洗涤5遍,每孔加入tmb显色剂(购自北京万泰生物药业股份有限公司)各50μl,置于37℃温箱反应15min。完成显色反应步骤后,在反应完的酶标板中每孔加入终止液(购自北京万泰生物药业股份有限公司)50μl,并于酶标仪上检测各孔的od450/630值。抗体的竞争率计算公式为:竞争率%=[od
(
‑
primary/+secondary)
-od
(+primary/+secondary)
]/od
(
‑
primary/+secondary)
x100,od
(
‑
primary/+secondary)
表示单纯二抗的反应值,od
(+primary/+secondary)
表示预先加入一抗孵育后再加入二抗孵育的反应值;结果如图5所示:表明6h2识别表位不同于已报道的glgh中和抗体ammo1。
[0103]
实施例7抗eb病毒glgh蛋白6h2单克隆抗体在病毒感染模型的中和能力
[0104]
(1)ebv的上皮细胞中和模型:采用10%fbs dmem培养基将hne1细胞按照160μl体积,5000细胞每孔标准铺板到96孔板中,置于37℃培养箱培养24小时,待细胞贴壁后,以dmem无血清培养基稀释单抗(6h2、ammo1、10c3),从100μg/ml为起始浓度开始2倍梯度稀释,共稀释12个梯度;吸取20μl不同浓度的稀释抗体(对照组加入等量dmem无血清培养基)与20μl akata细胞生产的ebv病毒悬液(制备方法参照文献:development of a robust,higher throughput green fluorescent protein(gfp)
‑
based epstein
‑
barr virus(ebv)micro
‑
neutralization assay)充分混合,37℃孵育3小时,得到混合液;将抗体与病毒的混合液加入铺有hne1细胞的96孔板中,置于37℃培养箱中培养,48小时后,消化96孔板中的hne1细胞,使用bd公司的流式细胞仪lsrfortessax
‑
20检测表达gfp绿色荧光蛋白的hne1细胞比例,与感染对照组相比抗体处理组的gfp阳性细胞数量减少比例,计算抗体在上皮细胞感染
模型的抑制率(%),结果如图6所示:单抗6h2、ammo1在上皮细胞感染模型的ic50分别为0.1084μg/ml,0.0828μg/ml,对照抗体10c3则无中和效果。
[0105]
上述结果表明:单克隆抗体6h2在上皮细胞和b细胞感染模型中均有较强中和活性。
[0106]
实施例8抗eb病毒glgh蛋白6h2单克隆抗体在细胞融合模型的阻断能力分析
[0107]
(1)将293t接种到10cm细胞培养板中,待细胞汇合率达到60~80%时进行转染。
[0108]
(2)a板:使用pei为转染试剂,分别准备2.5μg的携带全长gb、gh、gl基因以及t7 rna poly merase的真核表达质粒(分别为pcaggs
‑
gb(gb的登录号:bau51603.1;载体:pcaggs)、pcaggs
‑
gh(gh的登录号:bau51590.1;载体:pcaggs)、pcaggs
‑
gl(gl的登录号:bau51568.1,载体:pcaggs)、pcagss
‑
t7(t7的登录号:cp053597.1,载体:pcaggs),具体构建方法参考文献:fusion of epithelial cells by epstein
–
barr virus proteins is triggered by binding of viral glycoproteins ghgl to integrinsαvβ6orαvβ8)并进行转染。
[0109]
(3)b板:使用pei为转染试剂,在293t细胞中转染10μg含t7启动子控制的luciferase基因的真核表达质粒(pcagss
‑
t7
‑
luc(luciferase的登录号:m15077.1,载体:pcaggs)具体构建方法参考文献:fusion of epithelial cells by epstein
–
barr virus proteins is triggered by binding of viral glycoproteins ghgl to integrinsαvβ6orαvβ8)。
[0110]
(4)转染24小时后,消化a板的293t细胞,并按照每组2x105个细胞的比例分装到ep管中,分别加入200μl0.5、0.1、0.02、0.004μg/μl的抗体(6h2、ammo1以及igg(阴性对照组),空白对照组加入等量的pbs),置于37℃培养箱孵育30min后转移到24孔板中。
[0111]
(5)将b板细胞提前消化,在上述24孔板每孔中加入2x105个细胞,37℃培养24小时。
[0112]
(6)取promega公司的dual
‑
glo luciferase assay system试剂盒中的萤火虫荧光素酶底物100μl加入24孔板中,室温裂解20min,每孔取80μl的细胞裂解上清进行化学发光定量检测。
[0113]
计算出与未处理的空白对照组相比,抗体处理组的化学发光读值减少的比例,计算抗体在细胞融合模型的阻断效率(%)。
[0114]
结果如图7所示,单抗6h2、ammo1对细胞膜融合具有显著抑制效果,6h2在抗体用量只有0.8μg条件下,也能完全抑制膜融合(图7中cell(luc)表示细胞单纯转染含t7启动子控制的luciferase基因的真核表达质粒;cell(gb)表示细胞单纯转染携带全长gb基因的真核表达质粒)。
[0115]
实施例9抗eb病毒glgh蛋白6h2单克隆抗体嵌合抗体改造及评价
[0116]
构建包含鼠源单抗6h2可变区序列和人源igg1亚型恒定区序列基因的嵌合抗体:采用gibson装配方法将鼠源单抗6h2轻重链可变区基因构建到相应真核表达载体ptt5
‑
higg1
‑
h、ptt5
‑
higg1
‑
k,其中,ptt5
‑
higg1
‑
h包含编码人源igg1亚型单抗重链恒定区的核酸序列,ptt5
‑
higg1
‑
k包含编码人源igg1亚型单抗κ轻链恒定区的核酸序列,将构建成功的轻重链重组质粒按照1:1比例转染至293f细胞表达并通过protein a柱进行纯化,将构建后的嵌合单抗命名为c6h2:c6h2的重链可变区的氨基酸序列如seq id no.5所示,c6h2的轻链
可变区的氨基酸序列如seq id no.6所示,c6h2的重链恒定区为:astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no.7),c6h2的轻链恒定区为:rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdsalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no.8);即c6h2的重链序列如seq id no.27所示;c6h2的轻链序列如seq id no.28所示。
[0117]
采用实施例1中步骤5)的方法测定嵌合单抗c6h2与glgh蛋白的结合活性,结果如图8所示:c6h2与glgh蛋白的ec50为26.62ng/ml,具有高结合活性;采用实施例4的方法测定嵌合单抗c6h2的平衡解离常数,结果如图9所示:单抗c6h2与glgh蛋白保持高亲和力,平衡解离常数(k
d
)达到11.5nm;采用实施例7的方法测定嵌合单抗c6h2在eb病毒感染上皮细胞的中和效果,结果如图10所示:c6h2在上皮细胞感染模型中具有高中和活性。
[0118]
实施例10抗eb病毒glgh蛋白的嵌合单抗c6h2在人源化小鼠模型中的保护效果
[0119]
(1)嵌合单抗在人源化小鼠模型中的治疗流程(如图11所示):取nsg小鼠人源化模型(由北京艾德摩生物技术有限公司构建:方法如下:取人脐带血外周血单个核细胞(peripheral blood mononuclear cell,pbmc)来源的cd34阳性细胞,通过尾静脉注射方式接种至预先用白消安清髓处理的4~5周龄的nsg小鼠中,经过8周时间的人源免疫系统重构,采集nsg小鼠眼眶血,鉴定其人源免疫细胞的比例,当人源cd45阳性的免疫细胞比例在10%~20%时,nsg小鼠人源化模型构建成功)后,按照每只小鼠10mg/kg的剂量在小鼠腹腔注射抗体(6h2、ammo1、2g4(序列为专利文献(dnaantibody construts for use against ebolavirus,us2020/0216519a1)中seq id no.1)、pbs(对照组)),每组设置8只小鼠,抗体注射后24h,通过尾静脉注射100μl的1000td50(50%transforming dose)剂量的akata来源eb病毒(制备方法参照文献:development of a robust,higher throughput green fluorescent protein(gfp)
‑
based epstein
‑
barr virus(ebv)micro
‑
neutralization assay);病毒注射后每隔一周按照每只小鼠10mg/kg的剂量在小鼠腹腔注射抗体,连续注射4周。每周采集小鼠眼眶血,并监测体重。病毒注射后6~7周对nsg小鼠进行安乐死处理,并观察小鼠脾脏大小变化及是否出现癌变组织。使用eb病毒balf5基因特异性引物(上游引物:ggtcacaatctccacgctga(seq id no.9);下游引物:caacgaggctgacctgatcc(seq id no.10))进行实时荧光定量pcr鉴定采集的小鼠外周血中的eb病毒dna拷贝数;使用商品化试剂盒对小鼠脾脏组织切片进行eber原位杂交检测,鉴定脾脏细胞或者肿瘤细胞是否病毒阳性。
[0120]
结果如图12所示:经c6h2和ammo1单抗治疗后的nsg人源化小鼠的外周血中dna拷贝数增长趋势较慢,并且保持在较低水平,使用对照抗体人源单抗2g4治疗和注射了pbs溶液的感染对照组小鼠的外周血中dna拷贝数持续增加,在第5周,对照组的病毒拷贝数是c6h2和ammo1治疗组小鼠的病毒拷贝数100倍以上;说明glgh蛋白特异性的嵌合抗体c6h2具有阻断eb病毒在人源化小鼠中感染和减少病毒血症发生的效果。
[0121]
不同处理后的nsg人源化小鼠体重如图13所示:经c6h2和ammo1单抗治疗后的nsg人源化小鼠体重保持稳定,没有明显下降,使用对照抗体人源单抗2g4治疗和注射了pbs溶
液的感染对照组小鼠从第4周开始体重出现明显下降。
[0122]
不同处理的nsg人源化小鼠的生存率如图14所示:经c6h2和ammo1单抗治疗后的nsg人源化小鼠直到实验终点都未发生小鼠死亡,使用人源单抗2g治疗和注射了pbs溶液的感染对照组的小鼠分别出现6只和7只小鼠死亡。
[0123]
小鼠安乐死处理后,解剖获得小鼠脾脏,进行h&e染色和eber原位杂交,结果如图15所示:2g4对照抗体和pbs处理的小鼠脾脏出现明显肿大和病变情况,同时通过rna原位杂交方法检测到eb病毒的eber存在,说明脾脏组织中存在病毒,而c6h2和和ammo1两株单克隆抗体治疗后的小鼠脾脏均保持正常形态和大小,只能检测到较低水平eber,说明脾脏中病毒含量较低。
[0124]
以上结果表明c6h2能有效保护人源化小鼠免受致死剂量eb病毒感染引起的疾病发生。
[0125]
实施例11抗eb病毒glgh蛋白当克隆抗体6h2识别表位分析
[0126]
(1)通过木瓜蛋白酶对6h2单抗酶切,并使用protein a柱吸附抗体可结晶段(fragment crystallizable,fc),在穿透液中获得抗体的抗原结合片段(fragment of antigen binding,fab)。
[0127]
(2)参考eb病毒m81毒株全基因序列(kf373730.1)将gp42蛋白膜外区序列(对应病毒bzlf2基因aa34
‑
aa223)的n端连接上信号肽编码序列,c端连接上便于亲和层析纯化的多聚组氨酸多肽(6
×
his),将以上序列构建到合适的真核表达载体,把构建成功的重组质粒转染至293f细胞表达并进行纯化,最终获得gp42蛋白(氨基酸序列为:mvsfkqvrvplftaialvivlllayflpprvrgggrvaaaaitwvpkpnvevwpvdppppvnfnktaeqeygdkevklphwtptlhtfqvpqnytkanctycntreytfsykgccfyftkkkhtwngcfqacaelypctyfygptpdilpvvtrnlnaieslwvgvyrvgegnwtsldggtfkvyqifgshctyvskfstvpvshhecsflkpclcvsqrsns,seq id no.2)。
[0128]
(3)6h2
‑
fab、glgh、gp42按摩尔比1:1:1的比例混合并于37℃孵育2小时制备6h2
‑
fab+glgh+gp42多元复合物,并通过冷冻电子显微镜技术(electron cryo
‑
microscopy,cryo
‑
em)解析复合物结构,并确定6h2结合表位。
[0129]
结果如图16、图17所示:通过pymol软件对多个抗体复合物进行叠加,可发现单抗6h2结合表位不同于已报道的eb病毒glgh蛋白特异性中和抗体cl40、e1d1、ammo1的表位(其中,文献“inhibition of ebv
‑
mediated membrane fusion by anti
‑
ghgl antibodies”公开了cl40的表位(5w0k);文献“structural basis for epstein
–
barr virus host cell tropism mediated by gp42 and ghgl entry glycoproteins”公开了e1d1的表位(5t1d);文献“an antibody targeting the fusion machinery neutralizes dual
‑
tropic infection and defines a site of vulnerability on epstein
‑
barr virus”公开了ammo1的表位(6c5v),进一步结构分析显示单抗6h2主要识别位于gh第570位、第620位和第650位的三个loop环;以上结果表明单抗6h2识别一个全新表位。
[0130]
实施例12抗eb病毒glgh蛋白当克隆抗体6h2识别关键位点鉴定
[0131]
(1)根据mut express ii fast mutagenesis kit v2(购自诺唯赞公司)试剂盒说明进行引物设计,并开展点突变克隆,将对应位点的氨基酸突变成丙氨酸,通过测序验证点突变克隆是否构建正确,将正确点突变克隆瞬转293f细胞进行真核表达,通过镍柱纯化获得点突变蛋白(d489a表示gh蛋白中第489位氨基酸突变为丙氨酸的ghgl蛋白;k490a表示gh
蛋白中第490位氨基酸突变为丙氨酸的ghgl蛋白;s493a表示gh蛋白中第493位氨基酸突变为丙氨酸的ghgl蛋白;t570a表示gh蛋白中第570位氨基酸突变为丙氨酸的ghgl蛋白;t571a表示gh蛋白中第571位氨基酸突变为丙氨酸的ghgl蛋白;t572a表示gh蛋白中第572位氨基酸突变为丙氨酸的ghgl蛋白;l573a表示gh蛋白中第573位氨基酸突变为丙氨酸的ghgl蛋白;s574a表示gh蛋白中第574位氨基酸突变为丙氨酸的ghgl蛋白;e624a表示gh蛋白中第624位氨基酸突变为丙氨酸的ghgl蛋白;k625a表示gh蛋白中第625位氨基酸突变为丙氨酸的ghgl蛋白;e626a表示gh蛋白中第626位氨基酸突变为丙氨酸的ghgl蛋白;g627a表示gh蛋白中第627位氨基酸突变为丙氨酸的ghgl蛋白;d652a表示gh蛋白中第652位氨基酸突变为丙氨酸的ghgl蛋白;n653a表示gh蛋白中第653位氨基酸突变为丙氨酸的ghgl蛋白;l654a表示gh蛋白中第654位氨基酸突变为丙氨酸的ghgl蛋白;h655a表示gh蛋白中第655位氨基酸突变为丙氨酸的ghgl蛋白;v656a表示gh蛋白中第656位氨基酸突变为丙氨酸的ghgl蛋白)。
[0132]
(2)分别将点突变glgh蛋白用ph9.6的50mm cb缓冲液(nahco3/na2co3缓冲液,终浓度为50mm,ph值为9.6)稀释,终浓度为2μg/ml;在96孔酶标板每孔中加入100μl的包被液,37℃包被2小时;用pbst洗涤液(20mm pb7.4,150mm nacl,0.1%tween20)洗涤1次;然后每孔加入200μl的封闭液(含有20%小牛血清及1%酪蛋白的ph值为7.4的20mm na2hpo4/nah2po4缓冲液溶液),放入37℃封闭2小时;弃去封闭液;干燥后装入铝箔袋2
‑
8℃保存备用。
[0133]
(3)单抗6h2以20mm pbs缓冲液从5μg/ml为起始浓度开始2倍梯度稀释,共稀释15个梯度;取已包被glgh蛋白的酶标板,每孔加入100μl已稀释的抗体,置于37℃温箱反应30min;将酶标板用pbst洗液(20mm pb7.4,150mm nacl,0.1%tween20)洗涤5遍,每孔加入100μl hrp标记的羊抗鼠igg反应液,置于37℃温箱反应30min;完成酶标记物反应步骤后,将酶标板用pbst洗液(20mm pb7.4,150mm nacl,0.1%tween20)洗涤5遍,每孔加入tmb显色剂(购自北京万泰生物药业股份有限公司)各50μl,置于37℃温箱反应15min;完成显色反应步骤后,在反应完的酶标板中每孔加入终止液(购自北京万泰生物药业股份有限公司)50μl,并于酶标仪上检测各孔的od450/630值。
[0134]
elisa结果如图18所示:部分位点突变之后影响了单抗6h2与glgh蛋白的结合能力;第573、625、627、655位氨基酸突变成丙氨酸后显著影响了6h2与glgh蛋白的结合活性,说明gh蛋白第573位亮氨酸,第625位赖氨酸,第627位甘氨酸、第655位组氨酸为单抗6h2识别的关键位点。
[0135]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1