黄酮类化合物在诱导肌源性细胞体外高效分化中的应用
1.本发明涉及黄酮类化合物在诱导肌源性细胞体外高效分化中的应用,属于动物细胞培养及细胞培养肉技术领域。
背景技术:
2.细胞培养肉技术是一项新兴的未来食品生产技术,它通过从活体动物获得干细胞体外大量扩增,然后利用生物支架和3d打印等技术分化并构建肌肉组织,最后经过食品化处理形成风味、营养和形态完整的肉制品。随着社会发展和国家经济实力的提升,人们对肉类的需求也逐渐增大。此外,依赖传统农业的肉类生产方式与资源环境之间的矛盾日益突出,禽畜饲养需要消耗大量的水、土地等资源,并排放大量温室气体,对环境造成污染,同时还存在着动物伦理和公共健康等问题。相比于传统肉类的生产方式,细胞培养的方式可以减少7%~45%的能源消耗,降低78%~96%的温室气体排放量,降低99%的土地使用,减少82%~96%的用水量等。因此,以细胞培育为主的高效环保的肉类生产方式将成为未来满足人类肉类需求的有效解决方案之一。
3.培养肉的大规模生产面临着两大关键问题,一是如何在体外快速、大量获得肌源性细胞;二是如何使肌源性细胞高效分化产生蛋白含量高、营养丰富的肌纤维。前一问题已得到较多的关注,包括在生长培养基中添加细胞因子、小分子化合物等策略被证实有效。但后者仍然缺少合适的解决策略。目前在公认的体外分化培养基即含有马血清的dmem培养基中,小鼠成肌细胞的分化率不到30%,融合率不足20%,猪、牛等物种肌源性细胞的分化率约40%~60%,并且产生的肌纤维中蛋白质含量低,无法满足生产培养肉的数量、营养等方面的需求。因此,亟需一种能够提高肌源性细胞体外分化效率的策略。
技术实现要素:
4.本发明的目的是针对培养肉生产过程中肌源性细胞分化效率低下的现状,将黄酮类化合物添加至肌源性细胞的分化体系中,显著提升了细胞的分化效率。
5.本发明提供了一种诱导肌源性干细胞体外分化的方法,所述方法是将肌源性干细胞在含有黄酮类化合物的体系中进行分化培养。
6.在一种实施方式中,所述黄酮类化合物包括柚皮素、表儿茶素、金雀异黄酮、木犀草素和/或槲皮苷。
7.在一种实施方式中,所述黄酮类化合物的含量为0.1-50μm。
8.在一种实施方式中,在所述体系中,所述柚皮素的含量为1-10μm、表儿茶素的含量为5-20μm、金雀异黄酮的含量为0.1-1μm、木犀草素的含量为1-10μm、槲皮苷的含量为1-10μm。
9.在一种实施方式中,所述柚皮素的含量优选为10μm;所述表儿茶素的含量优选为10μm;所述金雀异黄酮的含量优选为100nm;所述木犀草素的含量优选为10μm;所述槲皮苷的含量优选为1μm。
10.在一种实施方式中,所述肌源性干细胞包括猪成肌细胞。
11.本发明提供了一种用于肌源性干细胞分化的培养基,所述培养基中含有黄酮类化合物。
12.在一种实施方式中,培养基中还含有dmem培养基、马血清、青霉素和链霉素。
13.在一种实施方式中,培养基中还含有97vol%dmem培养基、2vol%马血清、1vol%青霉素-链霉素双抗溶液。
14.在一种实施方式中,所述青霉素-链霉素双抗溶液中,青霉素含量为10000u/ml,链霉素含量为10mg/ml。
15.本发明提供了一种诱导肌源性干细胞分化的方法,所述方法是将肌源性干细胞在含有黄酮类化合物的体系中进行分化。
16.在一种实施方式中,所述黄酮类化合物包括柚皮素、表儿茶素、金雀异黄酮、木犀草素或槲皮苷。
17.本发明提供了黄酮类化合物在诱导肌源性干细胞体外分化中的应用。
18.在一种实施方式中,所述黄酮类化合物包括柚皮素、表儿茶素、金雀异黄酮、木犀草素和/或槲皮苷。
19.在一种实施方式中,所述肌源性干细胞包括猪成肌细胞。
20.在一种实施方式中,所述肌源性细胞的来源包括但不限于猪、牛、兔、鼠、人或禽类。
21.在一种实施方式中,所述黄酮类化合物在促进肌源性细胞高效分化中的使用浓度为0.1-50μm。
22.在一种实施方式中,所述木犀草素的使用浓度为1-20μm,槲皮苷的使用浓度为0.1-5μm,金雀异黄酮的使用浓度为1-10μm,表儿茶素的使用浓度为1-30μm,柚皮素的使用浓度为0.5-20μm。
23.在一种实施方式中,所述柚皮素的使用浓度优选为10μm;所述表儿茶素的使用浓度优选为10μm;所述金雀异黄酮的使用浓度优选为100nm;所述木犀草素的使用浓度优选为10μm;所述槲皮苷的使用浓度优选为1μm。
24.本发明的有益效果:
25.本发明提供的黄酮类化合物,能够有效促进肌源性细胞在体外高效分化产生肌纤维,使肌源性细胞体外分化效率提高1.2-2倍,同时在提高肌肉特异性蛋白myhc表达量方面也展现出优异效果。不仅可以高效获得培养来源的各类动物肌纤维供基础研究,更重要的是有效缓解了培养肉生产中优质蛋白质合成量有限的问题,利用细胞培养肉工业化生产中的肌纤维的高效生产,为人类提供优质动物源蛋白质、营养物质的需要。
附图说明
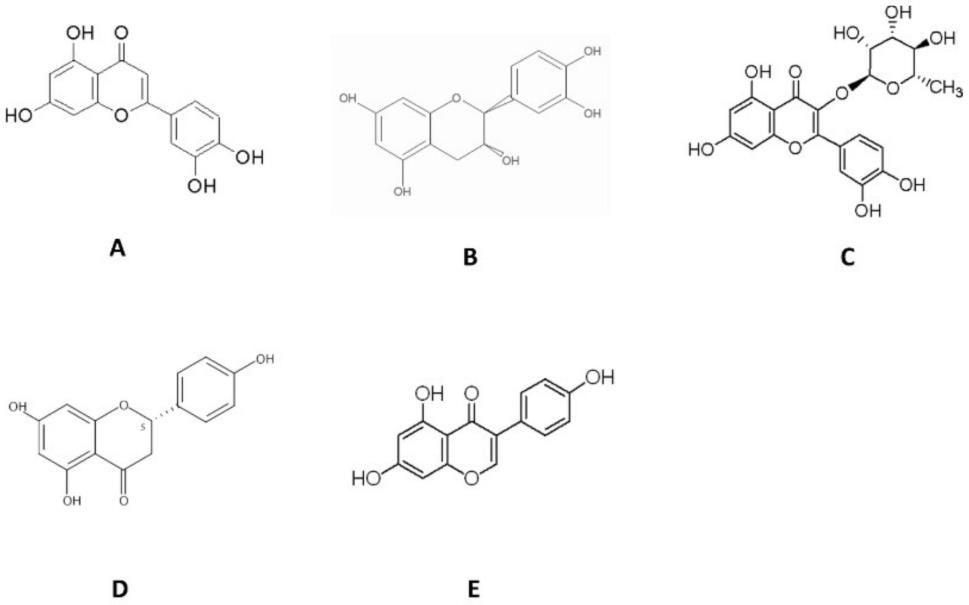
26.图1为促成肌分化黄酮类化合物的化学结构式;a-e分别为木犀草素、表儿茶素、槲皮苷、柚皮素及金雀异黄酮。
27.图2为肌源性细胞分化后的显微形态(4
×
视野);a为基础分化组,b-f分别为各自添加柚皮素、表儿茶素、金雀异黄酮、木犀草素、槲皮苷的分化组。
28.图3为肌源性细胞在不同条件下肌管数量的统计学分析。
29.图4为肌源性细胞分化后的免疫荧光染色鉴定(10
×
视野);a为基础分化组,b-f分别为各自添加柚皮素、表儿茶素、金雀异黄酮、木犀草素、槲皮苷的分化组。
30.图5为肌源性细胞在不同条件下分化率和融合率的统计学分析;分化率为表达myhc细胞的细胞核数与总细胞核数之比,融合率为3核及以上表达myhc细胞的细胞核数与表达myhc细胞的细胞核数之比;a图表示不同黄酮类化合物作用下的细胞分化率,图b表示不同黄酮类化合物作用下的细胞融合率。
31.图6为利用蛋白免疫印迹检测肌纤维特异性蛋白myhc的表达量;a为蛋白免疫印迹结果,a为对照组细胞,b为添加黄酮类化合物处理后细胞;b为以gapdh标准化后的myhc表达量统计结果。
具体实施方式
32.下述实例采用的生长培养基为:10vol%胎牛血清、79vol%dmem培养基、1vol%青霉素-链霉素双抗溶液,所述青霉素-链霉素双抗溶液中,青霉素含量为10000u/ml,链霉素含量为10mg/ml。
33.下述实例采用的肌源性分化培养基为:2vol%马血清、97vol%dmem培养基、1vol%青霉素链霉素双抗溶液,所述青霉素-链霉素双抗溶液中,青霉素含量为10000u/ml,链霉素含量为10mg/ml。
34.下述实例中采用的培养条件为5%(v/v)co2培养箱,37℃培养。
35.实施例1肌源性细胞体外成肌分化操作步骤
36.取新鲜猪肌肉组织进行分离,消化后通过流式细胞仪获得cd31-cd45-cd56
+
cd29
+
细胞,即猪肌肉干细胞。
37.将猪肌肉干细胞按4
×
10
4-1
×
105个/ml密度孔量接种于细胞培养板中,培养板预先用胶原蛋白包被。添加生长培养基(1.5ml)培养24h-48h,待细胞汇合度达70%-90%时,将细胞分别接种分别含1-10μm柚皮素、5-20μm表儿茶素、0.1-1μm金雀异黄酮、1-10μm木犀草素、1-10μm槲皮苷或不含黄酮类化合物的分化培养基(分别为1.5ml),继续培养5-10天,每日更换培养基,并每天于倒置显微镜下观察分化过程中细胞形态的变化,各黄酮类化合物最佳作用浓度下的细胞肌源性分化状态如图2所示。
38.经过7天的分化,通过显微镜可以观察到细胞形态又初始的纺锤形转换成长条形,说明细胞迁移、融合,形成肌管和成熟肌纤维。如图3所示,与对照组相比,在各黄酮类化合物的最佳作用浓度处理组的细胞,肌管数目明显增多,添加10μm柚皮素、10μm表儿茶素、100nm金雀异黄酮、10μm木犀草素、1μm槲皮苷处理后的肌管数目分别是对照组肌管数的206%、138%、69%、169%、156%。
39.实施例2免疫荧光鉴定成肌分化的效果
40.将分化后的细胞用pbs清洗3次,4%多聚甲醛固定15min,再次用pbs清洗3次。0.5%triton-x100通透15min,pbs清洗3次。封闭液(1%bsa、22.52mg/ml甘氨酸、0.1vol%tween20的pbs)封闭30min,pbs清洗3次加入1:100稀释的myhc一抗250μl,4℃孵育过夜。用pbs清洗3次后,避光加入1:200二抗,37℃孵育1h。pbs清洗3次,dapi室温孵育7min。pbs清洗3次后于倒置荧光显微镜下观察采集图像。
41.各组形成肌纤维的免疫荧光染色结果如图4所示,在此基础上计算细胞的分化率
及融合率以表征分化水平,统计结果如图5所示,添加柚皮素、表儿茶素、金雀异黄酮、木犀草素、槲皮苷处理后细胞的分化率分别为20.72%、15.04%、12.33%、17.80%、19.29%,均比基础分化培养基分化率(10.6%)提高1.2倍以上。在融合率方面,添加柚皮素、表儿茶素、金雀异黄酮、木犀草素、槲皮苷处理后细胞的融合率分别为54.60%、40.98%、37.22%、49.20%、37.67%,均比基础分化培养基分化率(25.4%)提高1.5倍以上。以上结果充分证明了上述黄酮类化合物在促进肌源性细胞体外高效分化形成肌纤维中的显著作用。
42.实施例3蛋白质免疫印迹检测肌纤维特异性蛋白的表达量
43.取分化后的细胞,消化离心后加入western细胞裂解液,冰上裂解7min,离心取上清。按照碧云天bca蛋白定量试剂盒检测总蛋白浓度,按照3:1(v:v)加入4
×
loading buffer,混匀后95℃蛋白变性5min。
44.sds-page凝胶电泳:配置好电泳缓冲液,将样品加入10%变性琼脂糖预制凝胶板,取含50μg蛋白加至上样孔中,设置电压160v电泳50min。
45.转膜:配置好转膜液,并于冰上提前预冷1h。将pvdf膜于甲醇活化10s后,同凝胶、滤纸在转膜液中浸泡5min。按照黑色海绵、双层滤纸、凝胶、pvdf膜、双层滤纸、白色海绵的顺序放置,夹紧后,放入槽中以300ma电流转膜90min。
46.封闭:将转膜完成的pvdf膜用含0.1vol%tween 20tbst清洗3次,每次5min。加入封闭液(1%bsa的tbst)封闭15min,封闭结束后将膜晾干备用。
47.一抗和二抗孵育:分别按1:1000稀释myhc抗体、1:20000稀释gapdh抗体;将膜放入含有一抗的液体中、4℃孵育过夜。孵育后回收一抗,利用含0.1vol%tween 20tbst将膜清洗3次,每次5min,加入1:20000稀释的二抗与膜共同孵育,37℃摇床孵育1h,结束后用含0.1vol%tween 20tbst清洗3次,每次5min。
48.显影:使用ecl显影液暗处覆盖pvdf膜,于凝胶成像仪下拍照。并使用image j分析软件进行灰度分析。
49.蛋白质免疫印迹结果如图6所示,表明在肌源性细胞体外分化过程中添加黄酮类化合物(10μm木犀草素),形成肌纤维中特异性蛋白myhc表达显示出明显的提升,myhc是肌肉中关键蛋白(肌球蛋白)的特异性标志,该结果可以说明在肌源性细胞体外分化过程中添加黄酮类化合物,产生肌纤维的蛋白质营养成分含量显著升高(提升约51%)。
50.虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1