具有螺三环骨架的双二氢呋喃并吡咯酮衍生物的合成方法
1.本发明属于有机合成技术领域,特别涉及一种铜盐催化下基于o
‑
酰基肟和环状1,3
‑
二碳基化合物合成具有螺三环骨架的双二氢呋喃并吡咯酮衍生物的方法。
背景技术:
2.o
‑
酰基肟类化合物易于从相应的羰基化合物获得,并且n
‑
o键非常容易断裂,因此o
‑ꢀ
酰基肟类化合物具有非常高的反应活性。近十年来,o
‑
酰基肟被证明是一类非常高效的有机合成子,其在钌、铑、钯、铜等过渡金属催化下可用于制备多种含氮杂环化合物,比如吡咯、恶唑、噻唑、咪唑、吡唑、三氮唑以及吡啶等。
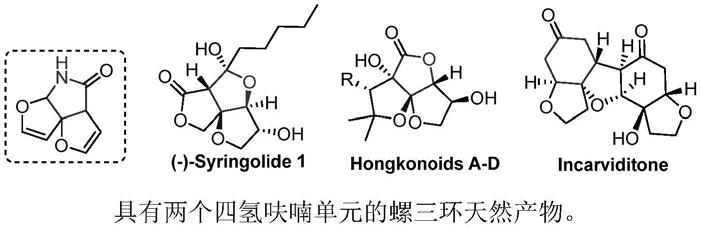
3.从植物中提取的天然产物是药物发现的重要来源,因此,化学家们在天然产物的合成上投入了大量的时间和精力。双二氢呋喃并吡咯酮骨架衍生物是一种新型的螺三环骨架结构,至今没有此类结构化合物的报道,螺三环的骨架结构中存在拥挤的季碳中心,所以对其合成产生重大挑战。在许多天然产物中发现具有类似的螺三环骨架结构,例如(—)
‑
丁香内酯1[j. org.chem.1993,58,2940
‑
2945;j.org.chem.1997,62,4780
‑
4784]、抗坏血酸萜类化合物a
‑
d 类化合物[j.am.chem.soc.2018,140,2485
‑
2492]和incarviditone[chem.biodiversity.2009,6, 779
‑
783;org.lett.2012,14,4878
‑
4881]。丁香内酯在化学和生物学上都是非常特殊的分子,它们的结构和它们作为植物过敏的非蛋白选择性因子的作用证明了这一点。抗坏血酸萜类化合物a
‑
d类化合物具有独特的化学结构和生物活性。具有螺三环骨架的双二氢呋喃并吡咯酮衍生物具有前所未有的结构和潜在的生物活性,有望为新陈代谢紊乱和心血管疾病的治疗医药方面做出贡献。
[0004]
技术实现要素:
[0005]
本发明基于丙二酸酯取代的o
‑
酰基肟与双分子环状1,3
‑
二羰基化合物为原料,铜盐为催化剂和外加氧化剂条件下,在有机溶剂中进行反应,首次制备出了具有螺三环骨架的双二氢呋喃并吡咯酮衍生物,并提供了一种合成具有螺三环骨架的双二氢呋喃并吡咯酮衍生物的新方法。
[0006]
本发明的目的是提供一种具有螺三环骨架的双二氢呋喃并吡咯酮衍生物。它们的分子结构稳定,化学性质优良,具有潜在的生物活性。
[0007]
为实现上述目的,本发明提供的具有螺三环骨架的双二氢呋喃并吡咯酮衍生物的结构通式如3所示:
[0008][0009]
其中r选自烷基、苯基、各类取代的苯基;无取代或取代的杂环;其中,苯基上的取代基选自甲基、甲氧基、溴原子、氯原子、氟原子、硝基、三氟甲基;杂环的取代基选自溴原子。
[0010]
其中,环状1,3
‑
二羰基化合物选自达米酮、1,3
‑
环己二酮、6,6
‑
二甲基二氢
‑
2h
‑
吡喃
‑
2,4(3h)
‑ꢀ
二酮、5
‑
甲基
‑
1,3
‑
环己烷二酮、1,3
‑
环戊二酮、1,3
‑
环庚二酮、1,3
‑
茚满二酮、4
‑
羟乙酰乙酸内酯、乙酰丙酮、二苯甲酰基甲烷。
[0011]
本发明的又一目的是提供一种合成具有螺三环骨架的双二氢呋喃并吡咯酮衍生物的简洁方法。该方法使用的原料简单易得、催化剂价格低廉、官能团容忍性好、底物适应性好、操作步骤简单。除此之外,该方法还具有反应条件温和、合成路线短、后处理方便、应用前景广等优点,在合成具有螺三环骨架的双二氢呋喃并吡咯酮衍生物的方法上有重要的应用价值。
[0012]
本发明提供的双二氢呋喃并吡咯酮骨架衍生物的合成方法具体为:以铜盐作为催化剂,以丙二酸酯取代的o
‑
酰基肟与环状1,3
‑
二羰基化合物为原料,在溶剂中进行反应,纯化后得到产物。其反应过程如下所示:
[0013][0014]
上述铜盐催化剂选自醋酸铜、氯化亚铜、溴化亚铜、碘化亚铜、三氟醋酸铜、三氟甲烷磺酸铜中的一种。
[0015]
如果用催化量的铜盐,则反应需外加氧化剂,氧化剂为叔丁基过氧化物。
[0016]
有机溶剂为乙腈、二氧六环、1,2
‑
二氯乙烷、乙二醇二甲醚、n,n
‑
二甲基甲酰胺、二甲基亚砜中的一种。
[0017]
丙二酸酯取代的o
‑
酰基肟、环状1,3
‑
二羰基化合物、铜盐催化剂、以及外加氧化剂的摩尔比为1.0:1.0
‑
2.0:0.2
‑
2.5:3.0,反应温度为60
‑
80℃。
[0018]
丙二酸酯取代的o
‑
酰基肟的通式如1所示:
[0019][0020]
其中,r1选自烷基、苯基、各类取代的苯基;无取代或取代的杂环;其中,苯基上的
取代基选自甲基、甲氧基、溴原子、氯原子、氟原子、硝基、三氟甲基;杂环的取代基选自溴原子。
[0021]
环状1,3
‑
二羰基化合物选自达米酮、1,3
‑
环己二酮、6,6
‑
二甲基二氢
‑
2h
‑
吡喃
‑
2,4(3h)
‑
二酮、5
‑
甲基
‑
1,3
‑
环己烷二酮、1,3
‑
环戊二酮、1,3
‑
环庚二酮、1,3
‑
茚满二酮、4
‑
羟乙酰乙酸内酯、乙酰丙酮、二苯甲酰基甲烷。
[0022]
本发明的有益效果:以丙二酸酯取代的o
‑
酰基肟与双分子环状1,3
‑
二羰基化合物为原料,铜盐为催化剂,通过加入合适的氧化剂,在有机溶剂中进行反应,通过一步反应构筑了五个新的化学键,首次实现了具有螺三环骨架的双二氢呋喃并吡咯酮衍生物的简便合成。以简单易得的丙二酸酯取代的o
‑
酰基肟作为具有邻位双亲电中心的二氢吡咯酮前体,环状1,3
‑ꢀ
二羰基化合物作为具有双亲核位点的亲核试剂,使得该反应可以顺利进行。本发明具有选用的原料简单易得、催化剂廉价易得、官能团容忍性好、反应条件温和、合成路线短等特点。
[0023]
本发明采用mtt法对三个典型化合物进行抗癌活性测试,结果显示化合物3ba、3ca在 50μm时对hepg2具有较好的抑制效果及选择性。
附图说明
[0024]
图1、2为化合物3aa1h
‑
nmr(300mhz,cdcl3)谱图和
13
c
‑
nmr(75mhz,cdcl3)谱图;
[0025]
图3、4为化合物3ba1h
‑
nmr(400mhz,cdcl3)谱图和
13
c
‑
nmr(100mhz,cdcl3)谱图;
[0026]
图5、6为化合物3ca1h
‑
nmr(400mhz,cdcl3)谱图和
13
c
‑
nmr(100mhz,cdcl3)谱图;
[0027]
图7、8为化合物3da1h
‑
nmr(300mhz,cdcl3)谱图和
13
c
‑
nmr(75mhz,cdcl3)谱图;
[0028]
图9、10为化合物3ea1h
‑
nmr(400mhz,cdcl3)谱图和
13
c
‑
nmr(100mhz,cdcl3)谱图;
[0029]
图11、12为化合物3fa1h
‑
nmr(300mhz,cdcl3)谱图和
13
c
‑
nmr(75mhz,cdcl3)谱图;
[0030]
图13、14为化合物3ga1h
‑
nmr(300mhz,cdcl3)谱图和
13
c
‑
nmr(75mhz,cdcl3)谱图;
[0031]
图15、16为化合物3ha的1h
‑
nmr(400mhz,d6‑
dmso)谱图和
13
c
‑
nmr(100mhz, d6‑
dmso)谱图;
[0032]
图17、18为化合物3ia的1h
‑
nmr(400mhz,d6‑
dmso)谱图和
13
c
‑
nmr(100mhz, d6‑
dmso)谱图;
[0033]
图19、20为化合物3ja的1h
‑
nmr(300mhz,cdcl3)谱图和
13
c
‑
nmr(75mhz,cdcl3) 谱图;
[0034]
图21、22为化合物3ka的1h
‑
nmr(300mhz,cdcl3)谱图和
13
c
‑
nmr(75mhz,cdcl3) 谱图;
[0035]
图23、24为化合物3la的1h
‑
nmr(300mhz,cdcl3)谱图和
13
c
‑
nmr(75mhz,cdcl3) 谱图;
[0036]
图25、26为化合物3ma的1h
‑
nmr(300mhz,cdcl3)谱图和
13
c
‑
nmr(75mhz,cdcl3) 谱图;
[0037]
图27、28为化合物3na的1h
‑
nmr(400mhz,d6‑
dmso)谱图和
13
c
‑
nmr(100mhz, d6‑
dmso)谱图;
[0038]
图29、30为化合物3oa的1h
‑
nmr(300mhz,cdcl3)谱图和
13
c
‑
nmr(75mhz,cdcl3) 谱图;
[0039]
图31、32为化合物3pa的1h
‑
nmr(400mhz,d6‑
dmso)谱图和
13
c
‑
nmr(100mhz, d6‑
dmso)谱图;
[0040]
图33、34为化合物3ab的1h
‑
nmr(400mhz,d6‑
dmso)谱图和
13
c
‑
nmr(100mhz, d6‑
dmso)谱图。
[0041]
图35、36为化合物3bb的1h
‑
nmr(400mhz,d6‑
dmso)谱图和
13
c
‑
nmr(100mhz, d6‑
dmso)谱图。
[0042]
图37、38为化合物3eb的1h
‑
nmr(400mhz,d6‑
dmso)谱图和
13
c
‑
nmr(100mhz, d6‑
dmso)谱图。
具体实施方式
[0043]
以下通过具体实施方式对本发明进行进一步的说明和描述,但不限于此。
[0044]
实施例1
[0045]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)
2 (0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150 mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3aa,产率为65%。
[0046][0047]
对所得产物进行测试,测试所用的仪器为:avance 300mhz型核磁共振仪(bruker公司,tms为内标);sgw x
‑
4显微熔点仪(温度计未经校正)。以下实施例测试方法与本实施例相同。
[0048]
3aa(white solid,73.9mg,65%,mp 224
‑
226℃):1h nmr(300mhz,d6
‑
dmso)δ7.59(br, 1h),7.36
‑
7.46(m,3h),7.25
‑
7.32(m,2h),4.00
‑
4.18(m,2h),2.58(s,2h),2.29(s,2h),2.25(d,j =16.0hz,1h),2.15(d,j=16.0hz,1h),2.01(d,j=18.0hz,1h),1.33(d,j=18.0hz,1h), 1.18
‑
1.24(m,9h),1.06(s,1h),0.91(s,1h);
13
c nmr(75mhz,d6
‑
dmso)δ193.0,191.9,179.1, 175.9,170.4,166.9,133.2,130.2,128.6,126.6,111.7,107.8,105.6,102.5,64.3,62.7,51.7,51.5, 38.2,37.2,34.0,33.7,29.3,28.7,28.6,27.5,13.8;hrms(esi)m/z[m+h]
+
calcd for c
29
h
32
no
7 506.2179,found 506.2177.
[0049]
实施例2
[0050]
将丙二酸二乙酯取代的4
‑
甲氧基苯乙酮的肟酯1b(0.3mmol)、达米酮2a(0.45mmol)、 cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。 tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3) 萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3ba,产率为54%。
[0051][0052]
3ba(white solid,65.1mg,54%,mp 209
‑
211℃):1h nmr(400mhz,d6
‑
dmso)δ7.19(d,j =8.9hz,2h),7.03(br,1h),6.90(d,j=8.9hz,2h),4.14(dq,j=10.7,7.2hz,1h),4.06(dq,j= 10.7,7.2hz,1h),3.83(s,3h),2.58(d,j=18.3hz,1h),2.53(d,j=18.3hz,1h),2.28(s,2h), 2.27(d,j=16.0hz,1h),2.17(d,j=16.0hz,1h),2.07(d,j=17.8hz,1h),1.45(d,j=17.8hz, 1h),1.22(t,j=7.3hz,3h),1.22(s,3h),1.20(s,3h),1.07(s,3h),0.94(s,3h);
13
c nmr(100 mhz,d6‑
dmso)δ192.3,190.6,179.2,174.9,169.1,166.5,160.3,128.0,125.2,113.6,111.2, 106.8,106.0,101.6,63.8,61.4,55.4,51.2,50.8,37.0,36.3,33.4,33.2,28.7,28.5,27.2,26.7,13.6; hrms(esi)m/z[m+h]
+
calcd for c
30
h
34
no
8 536.2284,found 536.2280.
[0053]
实施例3
[0054]
将丙二酸二乙酯取代的4
‑
甲基苯乙酮的肟酯1c(0.3mmol)、达米酮2a(0.45mmol)、 cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。 tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3) 萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3ca,产率为61%。
[0055][0056]
3ca(white solid,70.9mg,61%,mp 211
‑
213℃):1h nmr(400mhz,d6
‑
dmso)δ7.20(d,j =8.3hz,2h),7.14(d,j=8.3hz,2h),6.91(br,1h),4.15(dq,j=10.7,7.2hz,1h),4.06(dq,j =10.7,7.2hz,1h),2.59(d,j=18.1hz,1h),2.54(d,j=18.1hz,1h),2.39(s,3h),2.29(s,2h), 2.27(d,j=16.0hz,1h),2.16(d,j=16.0hz,1h),2.05(d,j=17.8hz,1h),1.41(d,j=17.9hz, 1h),1.23(t,j=7.2hz,3h),1.22(s,3h),1.21(s,3h),1.07(s,3h),0.94(s,3h);
13
c nmr(75 mhz,d6
‑
dmso)δ193.0,191.9,179.0,176.0,170.3,166.9,140.2,130.2,129.2,126.5,111.6, 107.8,105.7,102.4,64.3,62.7,51.7,51.4,38.2,
37.3,33.9,33.7,29.4,28.7,28.6,27.4,21.4,13.8; hrms(esi)m/z[m+h]
+
calcd for c
30
h
34
no
7 520.2335,found 520.2328.
[0057]
实施例4
[0058]
将丙二酸二乙酯取代的4
‑
氟苯乙酮的肟酯1d(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。 tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3) 萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3da,产率为45%。
[0059][0060]
3da(white solid,53.3mg,45%,mp 222
‑
223℃):1h nmr(300mhz,d6
‑
dmso)δ7.58(br, 1h),7.32(dd,j=8.8,5.1hz,2h),7.09(t,j=8.5hz,2h),4.00
‑
4.19(m,2h),2.57(s,2h),2.29(s, 2h),2.26(d,j=15.9hz,1h),2.18(d,j=15.9hz,1h),2.06(d,j=17.9hz,1h),1.42(d,j= 18.2,1h),1.18
‑
1.25(m,9h),1.07(s,3h),0.94(s,3h);
13
c nmr(75mhz,d6
‑
dmso)δ193.0, 192.4,179.0,175.9,170.4,166.9,165.3,163.7(d,j
1c
‑
f
=250.3hz),129.1(d,j
4c
‑
f
=3.2hz), 129.0(d,j
3c
‑
f
=8.6hz),115.5(d,j
2c
‑
f
=21.9hz),111.8,107.7,105.6,102.2,64.3,62.6,51.7, 51.4,38.2,37.2,33.9,33.7,29.3,28.7,28.5,27.3,13.8;hrms(esi)m/z[m+h]
+
calcd for c
29
h
31
fno
7 524.2085,found 524.2080.
[0061]
实施例5
[0062]
将丙二酸二乙酯取代的4
‑
氯苯乙酮的肟酯1e(0.3mmol)、达米酮2a(0.45mmol)、 cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。 tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3) 萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3ea,产率为40%。
[0063][0064]
3ea(white solid,48.6mg,40%,mp 224
‑
225℃):1h nmr(400mhz,d6
‑
dmso)δ7.54(br, 1h),7.38(d,j=8.6hz,2h),7.27(d,j=8.6hz,2h),4.01
‑
4.17(m,2h),2.57(s,2h),
2.29(s,2h),2.26(d,j=15.8hz,1h),2.19(d,j=15.8hz,1h),2.06(d,j=18.0hz,1h),1.44(d,j=18.0,1h),1.18
‑
1.25(m,9h),1.07(s,3h),0.95(s,3h);
13
cnmr(100mhz,d6
‑
dmso)δ193.0,192.4,179.0,175.9,170.3,166.9,136.3,131.9,128.7,128.4,111.8,107.8,105.4,102.4,64.4,62.7,51.7,51.4,38.2,37.3,33.9,33.8,29.4,28.8,28.5,27.3,13.8;hrms(esi)m/z[m+h]
+
calcdforc
29
h
31
clno7540.1789,found540.1788.
[0065]
实施例6
[0066]
将丙二酸二乙酯取代的4
‑
溴苯乙酮的肟酯1f(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌4h。tlc监测反应结束后,向反应液中加入20mlh2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。
[0067]
残余物通过柱色谱法纯化得到3fa,产率为43%。
[0068][0069]
3fa(whitesolid,56.8mg,43%,mp211
‑
213℃):1hnmr(300mhz,d6
‑
dmso)δ7.56(br,1h),7.54(d,j=8.6hz,2h),7.20(d,j=8.6hz,2h),4.00
‑
4.19(m,2h),2.57(s,2h),2.29(s,2h),2.26(d,j=15.8hz,1h),2.19(d,j=15.8hz,1h),2.06(d,j=18.1hz,1h),1.44(d,j=18.1,1h),1.19
‑
1.24(m,9h),1.07(s,3h),0.95(s,3h);
13
cnmr(100mhz,d6‑
dmso)δ192.3,190.6,179.2,174.7,169.1,166.4,132.9,131.4,128.8,123.3,111.2,106.8,105.3,101.7,63.9,61.5,51.1,50.8,36.9,36.3,33.4,33.3,28.7,28.6,27.1,26.6,13.6;hrms(esi)m/z[m+h]
+
calcdforc
29
h
31
brno7584.1284,found584.1283.
[0070]
实施例7
[0071]
将丙二酸二乙酯取代的4
‑
硝基苯乙酮的肟酯1g(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌2h。tlc监测反应结束后,向反应液中加入20mlh2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。
[0072]
残余物通过柱色谱法纯化得到3ga,产率为35%。
[0073]
[0074]
3ga(white solid,43.6mg,35%,mp 251
‑
253℃):1h nmr(300mhz,d6
‑
dmso)δ7.26(d,j =8.9hz,2h),7.91(br,1h),7.67(d,j=8.9hz,2h),4.00
‑
4.19(m,2h),2.63(d,j=18.3hz, 1h),2.57(d,j=18.3hz,1h),2.31(s,2h),2.26(d,j=16.3hz,1h),2.21(d,j=16.3hz,1h), 2.03(d,j=17.8hz,1h),1.37(d,j=17.9hz,1h),1.18
‑
1.26(m,9h),1.05(s,3h),0.94(s,3h);
13
c nmr(100mhz,d6‑
dmso)δ192.3,190.7,179.2,174.8,169.1,166.3,148.5,140.4,128.2, 123.6,111.2,106.8,104.9,102.1,64.1,61.6,51.1,50.8,36.9,36.2,33.4,33.4,28.6,28.6,27.0, 26.6,13.6;hrms(esi)m/z[m+h]
+
calcd for c
29
h
31
n2o
9 551.2030,found 551.2024.
[0075]
实施例8
[0076]
将丙二酸二乙酯取代的4
‑
三氟甲基苯乙酮的肟酯1h(0.3mmol)、达米酮2a(0.45mmol)、 cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。 tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3) 萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3ha,产率为47%。
[0077][0078]
3ha(white solid,60.4mg,47%,mp 251
‑
253℃):1h nmr(400mhz,d6‑
dmso)δ10.31(s, 1h),7.86(d,j=8.3hz,2h),7.50(d,j=8.3hz,2h),3.86
‑
3.99(m,2h),2.86(d,j=18.1hz, 1h),2.58(d,j=18.1hz,1h),2.31(d,j=16.0hz,1h),2.17(d,j=15.0hz,1h),2.13(d,j= 16.0hz,1h),2.07(t,j=15.0,1h),2.03(t,j=18.0,1h),1.18(d,j=18.0hz,1h),1.13(s,3h), 1.12(s,3h),1.11(t,j=7.1hz,3h),0.96(s,3h),0.83(s,3h);
13
c nmr(100mhz,d6‑
dmso)δ 192.3,190.6,179.3,174.6,169.1,166.3,138.0,130.2(d,j
2c
‑
f
=32.0hz),127.7,125.3,125.3(d, j
3c
‑
f
=3.5hz),123.9(d,j
1c
‑
f
=272.6hz),111.3,106.8,105.0,102.0,63.9,61.6,51.1,50.8,36.9, 36.2,33.4,33.2,28.7,28.5,27.1,26.6,13.6;hrms(esi)m/z[m+h]
+
calcd for c
30
h
31
f3no
7 574.2053,found 574.2049.
[0079]
实施例9
[0080]
将丙二酸二乙酯取代的4
‑
氧酰基苯乙酮的肟酯1i(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌1.5h。 tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3) 萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3ia,产率为45%。
[0081][0082]
3ia(white solid,57.5mg,45%,mp 226
‑
228℃):1h nmr(400mhz,d6‑
dmso)δ10.20(s, 1h),7.28(d,j=8.7hz,2h),7.13(d,j=8.7hz,2h),3.84
‑
3.99(m,2h),2.83(d,j=18.0hz, 1h),2.56(d,j=18.1hz,1h),2.29(d,j=15.9hz,1h),2.28(s,3h),2.12(d,j=15.9hz,1h), 2.10(d,j=15.3hz,1h),2.05(d,j=15.3hz,1h),2.00(d,j=18.0hz,1h),1.28(d,j=17.8hz, 1h),1.12(s,3h),1.11(s,3h),1.11(t,j=7.2hz,3h),0.96(s,3h),0.85(s,3h);
13
c nmr(100 mhz,d6‑
dmso)δ192.3,190.6,179.4,174.8,169.2,169.0,166.4,151.6,130.8,128.1,121.9, 111.3,106.8,105.4,101.7,63.7,61.5,51.1,50.8,36.1,33.4,33.1,28.6,28.5,27.1,26.7,20.8,13.6; hrms(esi)m/z[m+h]
+
calcd for c
31
h
34
no
9 564.2234,found 564.2232.
[0083]
实施例10
[0084]
将丙二酸二乙酯取代的4
‑
苯基苯乙酮的肟酯1j(0.3mmol)、达米酮2a(0.45mmol)、 cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。 tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3) 萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3ja,产率为52%。
[0085][0086]
3ja(white solid,68.1mg,52%,mp 211
‑
213℃):1h nmr(300mhz,d6
‑
dmso)δ7.63(d,j =8.4hz,2h),7.59(d,j=7.3hz,2h),7.48(t,j=7.3hz,2h),7.40(t,j=7.2hz,1h),7.35(d,j =8.3hz,2h),7.12(br,1h),4.01
‑
4.20(m,2h),2.62(d,j=18.2hz,1h),2.56(d,j=18.2hz, 1h),2.30(s,2h),2.28(d,j=16.1hz,1h),2.17(d,j=16.1hz,1h),2.06(d,j=17.9hz,1h), 1.41(d,j=17.9hz,1h),1.19
‑
1.27(m,9h),1.06(s,3h),0.92(s,3h);
13
c nmr(75mhz, d6‑
dmso)δ192.2,190.5,179.3,174.8,169.1,166.5,141.4,139.1,132.5,129.1,128.0,127.2, 126.8,126.5,111.3,106.9,105.7,101.8,63.9,61.4,51.1,50.8,37.0,36.3,33.4,33.2,28.6,28.5, 27.2,26.7,13.6;hrms(esi)m/z[m+h]
+
calcd for c
35
h
36
no
7 582.2492,found 582.2483.
[0087]
实施例11
[0088]
将丙二酸二乙酯取代的3
‑
硝基苯乙酮的肟酯1k(0.3mmol)、达米酮2a(0.45mmol)、 cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌4h。tlc 监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。
[0089]
残余物通过柱色谱法纯化得到3ka,产率为37%。
[0090][0091]
3ka(white solid,45.5mg,37%,mp 193
‑
195℃):1h nmr(300mhz,d6
‑
dmso)δ8.31 (ddd,j=8.2,2.2,1.0hz,1h),8.18(t,j=1.9hz,2h),7.87(br,1h),7.84(ddd,j=7.8,1.7,1.1 hz),7.64(t,j=8.0hz,1h),4.00
‑
4.19(m,2h),2.67(d,j=18.2hz,1h),2.58(d,j=18.2hz, 1h),2.34(d,j=16.5hz,1h),2.29(d,j=16.5hz,1h),2.28(d,j=16.3hz,1h),2.22(d,j= 16.3hz,1h),2.04(d,j=18.0hz,1h),1.37(d,j=18.0hz,1h),1.24(s,6h),1.21(t,j=7.2hz, 3h),1.06(s,3h),0.93(s,3h);
13
c nmr(100mhz,d6‑
dmso)δ192.4,190.6,179.3,174.6,169.1, 166.2,147.7,135.6,133.6,130.5,125.1,120.8,111.2,106.8,104.7,101.9,63.9,61.7,51.0,50.7, 36.9,36.1,33.5,33.2,28.6,28.1,27.0,26.8,13.6;hrms(esi)m/z[m+h]
+
calcd for c
29
h
31
n2o
9 551.2030,found 551.2028.
[0092]
实施例12
[0093]
将丙二酸二乙酯取代的2
‑
氟苯乙酮的肟酯1l(0.3mmol)、达米酮2a(0.45mmol)、 cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。 tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3) 萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3la,产率为54%。
[0094][0095]
3la(white solid,63.9mg,54%,mp 240
‑
242℃):1h nmr(300mhz,d6
‑
dmso)δ7.70(br, 1h),7.35
‑
7.49(m,2h),7.17(t,j=7.7hz,1h),7.10(dd,j=11.2,8.1hz,1h),4.01
‑
4.19(m,2h), 2.53(d,j=18.1hz,1h),18.2(d,j=18.1hz,1h),2.32(d,j=16.3hz,1h),
2.26(d,j=16.3hz,1h),2.22(d,j=16.0hz,1h),2.11(d,j=17.9hz,1h),2.09(d,j=16.0hz,1h),1.28(d,j=18.1hz,1h),1.21(t,j=7.2hz,3h),1.20(s,3h),1.19(s,3h),1.03(s,3h),0.80(s,3h);
13
cnmr(100mhz,d6‑
dmso)δ192.2,190.5,178.8,174.9,168.6,166.2,160.5(d,j
1c
‑
f
=251.6hz),132.8(d,j
3c
‑
f
=8.6hz),128.3,124.3(d,j
3c
‑
f
=2.4hz),120.6(d,j
2c
‑
f
=11.4hz),116.3(d,j
2c
‑
f
=22.1hz),110.8,107.1,104.6,101.5,63.7,61.5,51.0,50.8,37.1,36.1,33.7,33.0,28.2,27.9,27.4,27.1,13.7;hrms(esi)m/z[m+h]
+
calcdforc
29
h
31
fno7524.2085,found524.2083.
[0096]
实施例13
[0097]
将丙二酸二乙酯取代的2,4
‑
二氯苯乙酮的肟酯1m(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌4h。tlc监测反应结束后,向反应液中加入20mlh2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3ma,产率为45%。
[0098][0099]
3ma(whitesolid,58.5mg,45%,mp223
‑
225℃):1hnmr(300mhz,d6
‑
dmso)δ7.69(br,1h),7.67(d,j=8.7hz,1h),7.46(d,j=2.1hz,1h),7.31(dd,j=8.6,2.1hz,1h),4.06
‑
4.16(m,2h),2.54(d,j=18.5hz,1h),2.47(d,j=18.5hz,1h),2.34(d,j=16.0hz,1h),2.26(d,j=16.2hz,1h),2.08
‑
2.24(m,3h),1.33(d,j=17.9hz,1h),1.22(t,j=7.2hz,3h),1.21(s,3h),1.18(s,3h),1.05(s,3h),0.85(s,3h);
13
cnmr(100mhz,d6‑
dmso)δ192.4,190.6,179.1,174.9,168.2,166.2,135.7,134.8,131.0,130.9,129.6,127.3,110.7,108.1,104.7,101.9,63.7,61.6,51.0,50.7,37.2,36.2,33.7,33.1,28.4,28.1,27.7,26.9,13.7;hrms(esi)m/z[m+h]
+
calcdforc
29
h
30
cl2no7574.1399,found574.1398.
[0100]
实施例14
[0101]
将丙二酸二乙酯取代的2,4
‑
二甲基苯乙酮的肟酯1n(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。tlc监测反应结束后,向反应液中加入20mlh2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3na,产率为64%。
cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌4h。tlc 监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。
[0111]
残余物通过柱色谱法纯化得到3pa,产率为33%。
[0112][0113]
3pa(white solid,36.6mg,33%,mp 191
‑
193℃):1h nmr(400mhz,d6‑
dmso)δ10.23(s, 1h),7.82(dd,j=1.8,0.8hz,1h),6.58(dd,j=3.4,0.8hz,1h),6.55(dd,j=3.4,1.8hz,1h), 3.84
‑
3.96(m,2h),2.71(d,j=18.0hz,1h),2.53(d,j=18.0hz,1h),2.28(d,j=16.0hz,1h), 2.23(d,j=17.7hz,1h),2.15(s,2h),2.09(d,j=16.0hz,1h),1.72(d,j=17.7hz,1h),1.10(t, j=7.2hz,3h),1.09(s,3h),1.08(s,3h),1.03(s,3h),0.95(s,3h);
13
c nmr(100mhz, d6‑
dmso)δ192.1,190.5,178.8,175.3,169.2,166.3,145.7,145.6,111.4,111.0,111.0,107.0, 101.8,101.4,64.1,61.5,51.1,50.7,37.0,36.3,33.5,28.4,28.1,27.1,27.1,13.6;hrms(esi)m/z [m+h]
+
calcd for c
27
h
30
no
8 496.1971,found 496.1967.
[0114]
实施例17
[0115]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、1,3环己二酮2b(0.45mmol)、 cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌5h。tlc 监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到5ab,产率为59%。
[0116][0117]
3ab(white solid,59.7mg,59%,mp 238
‑
241℃):1h nmr(400mhz,d6‑
dmso)δ10.17(s, 1h),7.42
‑
7.51(m,3h),7.24
‑
7.31(m,2h),3.86
‑
3.97(m,2h),2.89(ddd,j=18.2,7.6,5.5hz,1h), 2.70(dt,j=18.1,5.6hz,1h),2.06
‑
2.40(m,6h),1.93
‑
2.05(m,1h),1.72
‑
1.84(m,1h),1.59
‑
1.71 (m,1h),1.07
‑
1.18(m,4h);
13
c nmr(100mhz,d6‑
dmso)δ193.1,190.8,180.4,175.9,169.0, 166.0,133.4,129.8,128.2,126.6,112.4,108.0,105.6,101.3,63.9,61.4,37.0,36.7,23.7,22.8,20.8, 20.5,13.7;hrms(esi)m/z[m+h]
+
calcd for c
25
h
24
no
7 450.1553,found 450.1549.
[0118]
实施例18
[0119]
将丙二酸二乙酯取代的4
‑
甲氧基苯乙酮的肟酯1b(0.3mmol)、1,3环己二酮2b(0.45 mmol)、cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌 1h。tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3) 萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3bb,产率为41%。
[0120][0121]
3bb(white solid,44.5mg,41%,mp 241
‑
249℃):1h nmr(400mhz,d6‑
dmso)δ10.14(s, 1h),7.16(d,j=9.0hz,2h),7.00(d,j=8.8hz,2h),3.83
‑
3.95(m,2h),3.76(s,3h),2.85(ddd, j=18.2,7.6,5.6hz,1h),2.65(dt,j=18.3,5.6hz,1h),2.33(ddd,j=16.7,9.0,4.8hz,1h), 2.04
‑
2.28(m,5h),1.91
‑
2.03(m,1h),1.73
‑
1.85(m,1h),1.59
‑
1.72(m,1h),1.25(dt,j=18.0,5.7 hz,1h),1.10(t,j=7.2hz,3h);
13
c nmr(100mhz,d6‑
dmso)δ193.7,191.5,180.8,176.5, 169.3,166.3,160.6,128.3,125.3,113.8,112.6,108.2,106.0,101.3,64.0,61.7,55.6,37.2,36.9, 24.0,23.1,21.1,20.8,13.9;hrms(esi)m/z[m+h]
+
calcd for c
26
h
26
no
8 480.1658,found 480.1654.
[0122]
实施例19
[0123]
将丙二酸二乙酯取代的4
‑
氯苯乙酮的肟酯1e(0.3mmol)、1,3环己二酮2b(0.45mmol)、 cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌2h。 tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3) 萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3eb,产率为53%。
[0124][0125]
3eb(white solid,57.7mg,53%,mp 282
‑
289℃):1h nmr(400mhz,d6‑
dmso)δ10.21(s, 1h),7.54(d,j=8.6hz,2h),7.31(d,j=8.6hz,2h),3.85
‑
3.97(m,2h),2.88(ddd,j=18.2,7.6, 5.6hz,1h),2.69(dt,j=18.1,5.8hz,1h),2.34(ddd,j=16.7,9.0,5.0hz,1h),2.17
‑
2.30(m, 4h),2.05
‑
2.17(m,1h),1.92
‑
2.05(m,1h),1.76
‑
1.88(m,1h),1.64
‑
1.76(m,
1h),1.25(dt,j=17.9, 5.5hz,1h),1.10(t,j=7.1hz,3h);
13
c nmr(100mhz,d6‑
dmso)δ193.1,190.9,180.3,175.8, 169.0,165.9,134.7,132.5,128.7,128.3,112.4,108.0,105.1,101.3,63.9,61.4,37.0,36.6,23.7, 22.9,20.8,20.5,13.7;hrms(esi)m/z[m+h]
+
calcd for c
25
h
23
clno
7 484.1163,found 484.1161.
[0126]
实施例20
[0127]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、6,6
‑
二甲基二氢
‑
2h
‑
吡喃
‑
2,4(3h)
‑ꢀ
二酮2c(0.45mmol)、cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于 60℃油浴搅拌1h。tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3ac,产率为53%。
[0128][0129]
3ac(white solid,60.9mg,53%,mp 227
‑
230℃):1h nmr(400mhz,d6‑
dmso)δ10.45(s, 1h),7.46
‑
7.52(m,3h),7.25
‑
7.33(m,2h),3.93
‑
4.06(m,2h),3.26(d,j=18.1hz,1h),2.93(d,j =18.1hz,1h),2.41(d,j=18.1hz,1h),1.62(d,j=18.1hz,1h),1.50(s,3h),1.48(s,3h), 1.34(s,3h),1.23(s,3h),1.13(t,j=7.1hz,3h);
13
c nmr(100mhz,d6‑
dmso)δ175.7,170.8, 168.7,166.3,161.1,160.1,132.8,130.2,128.5,126.5,106.9,102.1,101.7,97.2,80.4,79.6,63.3, 62.0,34.1,33.3,28.1,27.9,26.8,26.4,13.6;hrms(esi)m/z[m+h]
+
calcd for c
27
h
28
no
9 510.1764,found 510.1759.
[0130]
实施例21
[0131]
将丙二酸二乙酯取代的4
‑
甲氧基苯乙酮的肟酯1b(0.3mmol)、6,6
‑
二甲基二氢
‑
2h
‑
吡喃
‑
2,4(3h)
‑
二酮2c(0.45mmol)、cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及 3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。tlc监测反应结束后,向反应液中加入20ml h2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3bc,产率为48%。
[0132][0133]
3bc(white solid,58.0mg,48%,mp 232
‑
234℃):1h nmr(400mhz,d6‑
dmso)δ10.39
(s,1h),7.20(d,j=8.9hz,2h),7.02(d,j=8.9hz,2h),3.93
‑
4.05(m,2h),3.79(s,3h),3.23(d,j=18.6hz,1h),2.90(d,j=18.6hz,1h),2.44(d,j=17.7hz,1h),1.72(d,j=17.7hz,1h),1.49(s,3h),1.47(s,3h),1.35(s,3h),1.24(s,3h),1.12(t,j=7.2hz,3h);
13
cnmr(100mhz,d6‑
dmso)δ175.6,170.8,168.6,166.3,161.1,160.5,160.1,128.0,124.5,113.8,107.1,101.9,101.7,97.1,80.3,79.6,63.3,62.0,55.4,34.1,33.3,28.0,27.9,26.8,26.4,13.6;hrms(esi)m/z[m+h]
+
calcdforc
28
h
30
no
10
540.1870,found540.1862.
[0134]
实施例22
[0135]
将丙二酸二乙酯取代的4
‑
甲氧基苯乙酮的肟酯1e(0.3mmol)、6,6
‑
二甲基二氢
‑
2h
‑
吡喃
‑
2,4(3h)
‑
二酮2c(0.45mmol)、cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌1h。tlc监测反应结束后,向反应液中加入20mlh2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3ec,产率为41%。
[0136][0137]
3ec(whitesolid,50.6mg,41%,mp234
‑
237℃):1hnmr(400mhz,d6‑
dmso)δ10.50(s,1h),7.57(d,j=8.7hz,2h),7.32(d,j=8.6hz,2h),3.99(q,j=7.1hz,2h),3.26(d,j=18.2hz,1h),2.91(d,j=18.2hz,1h),2.45(d,j=17.9hz,1h),1.80(d,j=17.7hz,1h),1.49(s,3h),1.47(s,3h),1.35(s,3h),1.25(s,3h),1.12(t,j=7.2hz,3h);
13
cnmr(100mhz,d6‑
dmso)δ176.0,171.2,169.1,166.7,161.5,160.5,135.5,132.4,129.1,129.0,106.8,102.5,102.2,97.7,80.9,80.2,63.9,62.5,34.5,33.8,28.6,28.4,27.2,26.8,14.1;hrms(esi)m/z[m+h]
+
calcdforc
27
h
27
clno9544.1374,found544.1370.
[0138]
实施例23
[0139]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、5
‑
甲基环己烷
‑
1,3
‑
二酮2d(0.45mmol)、cu(oac)2(0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。tlc监测反应结束后,向反应液中加入20mlh2o,并把以上的混合物用etoac(30ml
×
3)萃取。把所有萃取的有机相合并到一起,用无水na2so4进行干燥,然后过滤,最后在进行真空浓缩。残余物通过柱色谱法纯化得到3ad,产率为51%。
[0140][0141]
3ad(mixture of four stereoisomers,white solid,54.9mg,51%)hrms(esi)m/z[m+h]
+ calcd for c
27
h
28
o
7 478.1866,found 478.1859.
[0142]
实施例24
[0143]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cucl(0.12 mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌3h。tlc监测反应,得到3aa,产率为43%。
[0144]
实施例25
[0145]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cubr(0.12 mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌3h。tlc监测反应,得到3aa,产率为26%。
[0146]
实施例26
[0147]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cui(0.12 mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌3h。tlc监测反应,得到3aa,产率为34%。
[0148]
实施例27
[0149]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.6mmol)、cu(oac)
2 (0.75mmol)以及3ml分析纯dmso放入试管中,在氮气氛围下,置于60℃油浴搅拌1h。 tlc监测反应,得到3aa,产率为54%。
[0150]
实施例28
[0151]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)
2 (0.45mmol)以及3ml的无水dmso放入试管中,在空气中,置于60℃油浴搅拌1h。 tlc监测反应,得到3aa,产率为63%。
[0152]
实施例29
[0153]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)
2 (0.45mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌1h。tlc监测反应,得到3aa,产率为66%。
[0154]
实施例30
[0155]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)
2 (0.12mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌3h。tlc监测反应,到3aa,产率为39%。
[0156]
实施例31
[0157]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)
2 (0.06mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌3h。tlc监测反应,到3aa,产率为21%。
[0158]
实施例32
[0159]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)
2 (0.09mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150 mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌2h。tlc监测反应,到3aa,产率为55%。
[0160]
实施例33
[0161]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)
2 (0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150 mm,将装有氯化钙的干燥试管连接到试管顶部),在氮气氛围下,置于80℃油浴搅拌0.5h。 tlc监测反应,得到3aa,产率为42%。
[0162]
实施例34
[0163]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)
2 (0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml分析纯dmf放入试管中,在氮气氛围下(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌0.5h。 tlc监测反应,得到3aa,产率为45%。
[0164]
对比实施例1
[0165]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)
2 (0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150 mm,将装有氯化钙的干燥试管连接到试管顶部),在氮气氛围下,置于40℃油浴搅拌4h。 tlc监测反应,只得到痕量的3aa。
[0166]
对比实施例2
[0167]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cu(oac)
2 (0.12mmol)、二叔丁基过氧化物(0.9mmol)以及3ml分析纯甲苯放入试管中(φ18
×
150 mm,将装有氯化钙的干燥试管连接到试管顶部),在氮气氛围下,置于60℃油浴搅拌3h。 tlc监测反应,得到3aa,产率为10%。
[0168]
对比实施例3
[0169]
将丙二酸二乙酯取代的苯乙酮的肟酯1a(0.3mmol)、达米酮2a(0.45mmol)、cucl2(0.12 mmol)、二叔丁基过氧化物(0.9mmol)以及3ml的无水dmso放入试管中(φ18
×
150mm,将装有氯化钙的干燥试管连接到试管顶部),置于60℃油浴搅拌4h。tlc监测反应,只得到痕量的3aa。
[0170]
体外抗癌活性测试
[0171]
抗癌活性研究:选取h460(肺癌细胞)、hepg2(肝癌细胞)、a549(肺癌细胞)3种癌细胞为测试细胞株,对三种典型化合物3ba、3ab、3bc做体外抗癌活性测试,并以5
‑
氟尿嘧啶作阳性对照。将对数生长期的癌细胞,离心后用1640完全培养基1ml将细胞吹打均匀。根据每孔加入100μl培养基,每孔加入1.2
×
104要求,计算所需细胞量,然后将细胞液重悬,取出所
需量用含10%fbs的1640培养基稀释,接种于96孔板,放入37℃,5%co2培养箱进行孵育16~18h。待细胞密度达到70%~80%时,进行药物干预。加入50μm的待测化合物 60μl,继续孵育72h,每个干预物设置3个复孔,每块板中均设置空白对照及阳性对照。孵育72h,加入50μl 10%mtt继续孵育4h。将96孔板吸去mtt,加入dmso 100μl/孔,震荡10min,放入酶标仪,测570nm处od值。根据od值,计算化合物50μm时对癌细胞的抑制率。结果见表1。测试结果表明,三个化合物50μm时对a549抑制效果无明显区别,但3ba、3bc对hepg2具有明显的选择性。当与6,6
‑
二甲基二氢
‑
2h
‑
吡喃
‑
2,4(3h)
‑
二酮2c反应时,对hepg2抑制效果明显得到改善。
[0172]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1