一种线性探针及利用其检测miRNA的方法与流程
一种线性探针及利用其检测mirna的方法
技术领域
1.本发明涉及核酸检测技术领域,尤其涉及一种线性探针及利用其检测mirna的方法。
背景技术:
2.核酸检测已经广泛应用于临床检测、环境监测、传染病预防与控制等方面。其中,mirna(mir)是一类由20
‑
25个核苷酸组成的单链非编码rna,它通过与靶信使rna的3’端非翻译区结合,降解靶信使rna或者抑制其翻译,在转录或转录后水平调控编码蛋白基因的表达,从而调控细胞分化、生长、增殖、代谢、凋亡等。mirna的核酸检测具有重要意义。
3.传统的mirna检测方法如northern印迹法,也是目前检测mirna的金标准。该方法通过探针与靶目标杂交后转膜,显影检测mirna。该方法灵敏度不高且要求rna样本量大。研制夹板连接同位素探针技术检测mirna,但需要应用page电泳分离、放射自显影等复杂操作。随着新技术的不断引入和学科的交叉研究,新型mirna分析方法被不断研发。如mirna原位杂交分析,使用荧光标记探针与细胞或组织中的mirna杂交,通过显色或荧光成像检测mirna表达,直观展现mirna的时空表达模式,但由于mirna序列短,mirna在杂交及洗脱过程中易丢失,易出现假阴性;微阵列芯片法通过固定探针,使mirna目标分子与微阵列杂交,采用同位素、荧光、化学发光或电化学进行检测,实现高通量、多组分同时检测,但其灵敏度和特异性有待进一步加强。
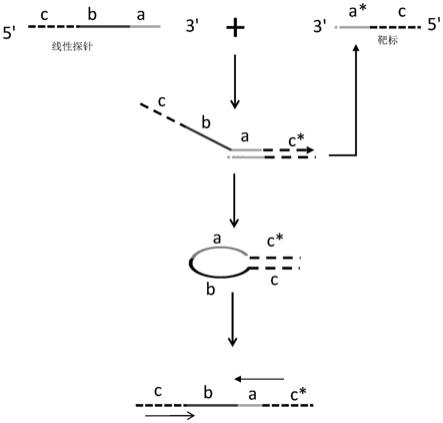
4.pcr法是核酸检测灵敏度最高的方法之一,但是由于mirna太短,以其直接作为模板不能有效设计pcr引物。研究人员开发线性探针rt
‑
pcr法和茎环探针rt
‑
pcr方法,用于mirna的检测。已有的线性探针rt
‑
pcr法,采用一条3’末端含有与靶标mirna的3’端互补碱基的线性探针,通过互补和聚合延伸进行逆转录,延长逆转录产物cdna的长度,使pcr引物设计成为可能,从而实现pcr扩增,但是该方法由于仅识别靶标的3’端,对于5’端突变不能有效识别,检测特异性和灵敏度有待进一步加强,或由于空间位阻不利于cdna形成,逆转录反应时间较长;茎环探针rt
‑
pcr法,设计一个茎环结构的检测探针,通过碱基互补配对,逆转录出靶标mirna的5’端核苷酸序列,形成cdna,通过pcr扩增实现mirna的检测。该茎环探针通过增加空间构象,增强了检测的特异性,但是由于检测探针有双链结构,在用染料法检测时背景信号偏高,同样该方法也不能有效识别靶标5’端突变,存在检测特异性不足问题。最重要的一点是,无论是线性探针rt
‑
pcr法和茎环探针rt
‑
pcr方法,其逆转录反应需要比较长的时间(一般45分钟以上),在核酸检测中存在明显应用限制。
技术实现要素:
5.本发明的目的在于克服现有技术的不足,提供一种线性探针及利用其检测mirna的方法,克服现有rt
‑
pcr检测mirna方法中逆转录时间长、灵敏度或特异性不足等缺点。
6.本说明书所用术语“解离”是指双链核苷酸变为单链核苷酸的过程。
7.本说明书中所用术语“自身互补配对”是指寡核苷酸自身含有互补配对的核苷酸
序列,自身发生碱基互补配对。
8.本说明书所用术语“茎环”结构,是指一种寡核苷酸分子,其可形成一种包括双链区域(茎部)的二级结构,所述的双链区域由该寡核苷酸分子内部的两个区域形成,其还包括至少一个“环”结构,即非互补的核苷酸分子(单链区域)。
9.为实现上述目的,本发明采取的技术方案为:提供一种线性探针,所述线性探针至少包括a、b和c三个区域;所述b区域的3’端和a区域的5’端相连,所述c区域的3’端和b区域的5’端相连;所述a区域的核苷酸序列和靶标核酸互补配对,b区域的核苷酸序列可协助成环,c区域的核苷酸序列和靶标核酸5’端相同。
10.本发明线性探针的检测原理是:在有靶标存在时,线性探针a区域聚合延伸形成c*区,形成的a+c*区在反应温度下与靶标模板动态解离;探针延伸形成的c*区与探针原有序列c互补配对,在b区域核苷酸通过减少空间位阻协助成环,快速形成自身茎环结构的cdna;同时靶标模板得到释放,循环参与下一轮cdna反应,形成更多cdna,所需逆转录时间更短,同时实现低浓度靶标有效逆转录;然后以cdna为模板进行pcr扩增,实现靶标快速、灵敏特异检测。
11.本发明的线性探针在逆转录形成cdna时,线性探针不仅识别靶标的3’端,同时也识别靶标的5’端,通过经历两次识别来增加检测特异性:首先线性探针的3’端与靶标识别配对(第一重识别),聚合延伸出靶标的5’端(c*区),聚合延伸的5’端(c*区)与线性探针c区域识别配对(第二重识别),形成有具有环b+a的茎环结构的cdna,作为后续pcr扩增模板;同时,靶标得到释放,循环参与逆转录反应,实现低丰度靶标逆转录,提高检测灵敏度。同时,由于b区域核苷酸序列通过减少空间位阻协助成环,快速形成茎环结构的cdna,产生更多的茎环结构的cdna,所需逆转录反应时间短。
12.作为本发明所述线性探针的优选实施方式,所述b区域是随机核苷酸序列,60≥核苷酸数目≥0,可通过调节gc含量,以使上下游引物退火温度相近。
13.更进一步的是,所述b区域是随机核苷酸序列,所述b区域核苷酸为10~40bp。
14.作为本发明所述线性探针的优选实施方式,所述靶标核酸包括rna和dna。
15.作为本发明所述线性探针的优选实施方式,所述线性探针还包括d区域;所述d区域的3’端与c区域的5’端相连;所述d区域是延长所述线性探针的核苷酸序列,所述d区域是随机核苷酸序列,通过调节gc含量,以使上下游引物退火温度相近。
16.本发明的线性探针不仅仅局限于a、b、c和d四个区域,也可含有多个协助成环的核苷酸序列和延长探针长度的核苷酸序列。
17.作为本发明所述线性探针的优选实施方式,所述d区域的5’端还可以包含c区域核苷酸序列。
18.本发明同时提供一种利用线性探针检测mirna的方法,所述方法包括以下步骤:
19.(1)采用所述的线性探针将靶标mirna循环逆转录为cdna;
20.(2)以步骤(1)中得到的cdna设计pcr引物,pcr扩增进行检测。
21.作为本发明所述检测mirna的方法的优选实施方式,所述步骤(1)具体包括以下步骤:
22.(i)所述线性探针3’端的a区域与靶标mirna的3’端的a*区域退火;
23.(ii)逆转录酶以退火后的线性探针的a区域3’末端为合成起点,以靶标mirna未发
生互补配对的c为模板,进行合成反应;
24.(iii)产生的线性探针延伸产物在反应温度下自身退火并和靶标mirna发生解离,在b区域核苷酸通过减少空间位阻协助成环作用下,形成含有b+a环的茎环结构的cdna,同时靶标mirna得到解离,循环参与下一轮逆转录过程。
25.作为本发明所述检测mirna的方法的优选实施方式,所述步骤(2)还包括检测扩增产物的步骤,所述检测扩增产物的方法包括荧光染料检测法、分子信标检测法或taqman探针检测法。
26.荧光染料检测法:本发明的线性探针,是一种线性结构。sybr green染料是一种结合于双链dna的具有绿色激发波长的染料。在没有靶标模板存在时,由于探针为线性,没有双链结构,染料不能有效插入,背景信号微弱。在有靶标存在的条件下,该线性探针通过对靶标的3’端和5’端进行双重识别后进行延伸,同时,协助成环b区域减少成环时空间位阻,得到大量具有环b+a的茎环结构的cdna,同时,靶标得到释放,循环参与下一次cdna形成。在pcr过程中,以cdna为模板进行pcr扩增,染料不断与扩增产物结合发出明亮荧光,根据荧光信号实现靶标特异灵敏检测。
27.分子信标检测法:是针对扩增产物,设计带荧光基团和淬灭基团的分子信标。当没有扩增产物时,分子信标的荧光基团和淬灭基团相互靠近,荧光被淬灭;当有扩增产物时,分子信标与扩增产物互补结合,分子信标的荧光基团和淬灭基团分开,释放出荧光信号。
28.taqman探针检测法:是针对扩增产物,设计带荧光基团和淬灭基团的taqman探针。当没有扩增产物时,taqman探针的荧光基团和淬灭基团相互靠近,荧光被淬灭;当有靶标进行pcr扩增时,taq酶的5'-3'外切酶活性将taqman探针降解,使报告荧光基团和淬灭荧光基团分离,释放出荧光信号。
29.作为本发明所述检测mirna的方法的优选实施方式,所述mirna包括合成的mirna样品、从细胞或组织中纯化的含mirna的样品或含有mirna的提取液。
30.本发明还提供一种利用线性探针检测靶标核酸的试剂盒,所述试剂盒包括所述的线性探针。
31.本发明的有益效果:
32.(1)本发明的线性探针,有协助成环的核苷酸序列(b区),减少逆转录过程中cdna成环时的空间位阻,反应速度更快,逆转录反应时间更短。
33.(2)靶标需要经过双重识别后,才能形成为茎环结构的cdna,检测特异性更好。
34.(3)本发明的线性探针形成茎环结构的cdna时,靶标核酸得到释放,循环参与下一轮cdna生成,实现低浓度的靶标核酸检测,检测灵敏度更高,能灵敏特异检测到3拷贝的靶标核酸。
35.(4)本发明的线性探针,在没有靶标核酸时,保持探针线性结构,降低荧光背景信号。
附图说明
36.图1为本发明原理示意图,
37.图2为实施例1可行性实验的荧光信号图。其中,曲线1为靶标mirna155体系的荧光信号图,曲线2为阴性对照mirna122体系的荧光信号图,曲线3为空白对照体系的荧光信号
图,
38.图3为实施例1可行性实验的电泳图。其中,条带1为靶标mirna155体系的泳带,条带2为阴性对照mirna122体系的泳带,条带3为空白对照体系的泳带,
39.图4为实施例2不同浓度mirna155检测的荧光信号图。其中,曲线1
‑
8分别是3
×
107至3copy的靶标mirna155体系的荧光信号图,曲线9是阴性对照mirna122体系的荧光信号图,曲线10是空白对照体系的荧光信号图,
40.图5为实施例2不同浓度mirna检测的线性方程图,
41.图6为实施例5抗干扰能力实验的荧光信号图。其中,曲线1是加10ng大肠杆菌rna的let7a体系的荧光信号图,曲线2是let7a体系的荧光信号图,曲线3是加10ng大肠杆菌rna的mirna122阴性对照体系的荧光信号图,曲线4是mirna122阴性对照体系的荧光信号图,曲线5是空白对照体系的荧光信号图,
42.图7为实施例6不同靶标检测的荧光信号图。其中,曲线1为三种靶标(mirna199a、mirna1a
‑
3p和mirna92a)和其对应探针/引物体系的荧光信号图,曲线2为mirna199a和其对应探针/引物体系的荧光信号图,曲线3为mirna1a
‑
3p和其对应探针/引物体系的荧光信号图,曲线4为mirna92a和其对应探针/引物的体系荧光信号图,曲线5为以mirna122代替靶标,加入三种靶标的探针/引物的阴性对照体系的荧光信号图,曲线6为以水代替靶标,加入三种靶标的探针/引物的空白对照体系的荧光信号图,
43.图8为实施例7粪便mirna检测的荧光信号图。其中,曲线1
‑
3是三个结直肠癌患者体系的荧光信号图,曲线4和5是两个正常人体系的荧光信号图,曲线6是空白对照体系的荧光信号图,
44.图9为实施例8不同浓度博卡病毒检测的荧光信号图。其中,曲线1
‑
4分别是10ug/ul、1ug/ul、100ng/ul、10ng/ul博卡病毒体系的荧光信号图,曲线5是阴性对照大肠杆菌体系的荧光信号图,曲线6是空白对照体系的荧光信号图。
具体实施方式
45.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均在常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
46.在实施例中的逆转录反应基础液,是指逆转录反应中的反应基础液,其中各物质及浓度为:200mmol/l三(羟甲基)氨基甲烷(ph 8.5)、100mmol/l氯化钾、20mmol/l氯化镁、15mmol/l二硫苏糖醇、0.6mmol/l dntps、200nmol/l线性探针、5u amv逆转录酶。
47.在实施例中的pcr扩增反应基础液,是指pcr扩增反应中的反应基础液,其中各物质及浓度为:100nmol/l线性探针对应的pcr
‑
f(上游引物),100nmol/l线性探针对应的pcr
‑
r(下游引物),0.6mmol/l dntps、4u taq聚合酶、1
×
聚合酶缓冲液、0.5
×
sybr green染料。
48.在实施例中核苷酸序列方向为:5
’‑3’
。
49.除特别说明外,反应过程中,逆转录和pcr扩增在pcr仪上进行,pcr仪为abi7300实时荧光定量pcr仪。
50.实施例1验证方法的可行性
51.本发明的线性探针包括a、b和c三个区域。所述b区域的3’端和a区域的5’端相连,所述c区域的3’端和b区域的5’端相连;a区域的核苷酸序列和靶标核酸互补配对,b区域的核苷酸序列通过减少空间位阻协助成环,c区域的核苷酸序列和靶标核酸5’端相同。本实施例利用mirna155作为靶标mirna(序列为:uuaaugcuaauugugauaggggu,即seq id no.1),设计mirna155线性探针1(序列为:ttaatgctaattggcatgaaaccagtgctgagtgtcagagacccctatcac,即seq id no.2,线性探针的a、b、c三区域见表1)、pcr
‑
f1(序列为:ttaatgctaattggcatgaaac,即seq id no.3)和pcr
‑
r1(序列为:ttaatgctaattgtgataggggt,即seq id no.4)进行逆转录和pcr扩增反应,同时设计两个对照体系,一个是阴性对照以mirna122(序列为:uggagugugacaaugguguuug,即seq id no.5)代替靶标,一个是空白对照以水代替靶标。通过荧光信号和电泳验证方法的可行性。具体步骤如下:
52.1、逆转录:
ⅰ
)配制逆转录反应基础液15ul;
ⅱ
)在不同反应管中,分别加入5ul终浓度为100pmol/l的mirna155、mirna122或水,混匀反应液;
ⅲ
)置于pcr仪上,42℃反应15min,85℃5min灭活逆转录酶活性。
53.2、定量pcr扩增:
ⅰ
)配制pcr扩增反应基础液20ul;
ⅱ
)在不同反应管中,分别加入5ul上述逆转录产物,混匀反应液;
ⅲ
)置于pcr仪上,94℃2min,40个循环(94℃45秒,58℃45秒)。
54.3、电泳:pcr扩增产物用1%的琼脂糖电泳,点样5ul,电压80v,电泳60分钟。
55.表1 mirna155线性探针1
[0056][0057]
注:线性探针中,双划线碱基为a区域,波浪线碱基为b区域,间隔线碱基为c区域。
[0058]
荧光信号图如图2,其中,曲线1为靶标mirna155体系的荧光信号图,曲线2为阴性对照mirna122体系的荧光信号图,曲线3为空白对照体系的荧光信号图。荧光信号图显示,曲线1靶标体系的cq值为18.39,曲线2阴性对照体系的cq值为38.21,曲线3空白对照体系没有明显的cq值。靶标体系和对照体系的cq值相差显著,说明本发明的线性探针在短的逆转录反应时间(15分钟),有效实现逆转录,并通过pcr扩增实现靶标的检测,验证本发明方法是可行的。
[0059]
图3是图2中扩增产物对应的电泳结果图。条带1为靶标mirna155体系的泳带,条带2为阴性对照mirna122体系的泳带,条带3为空白对照体系的泳带。可以看出,在阴性对照和空白对照体系的条带中没有明显扩增产物条带,而在靶标体系的条带1中,有一条明亮的扩增产物条带,电泳结果也证实本发明方法是可行的。
[0060]
实施例2利用线性探针检测不同浓度mirna
[0061]
本实施例利用mirna155作为靶标(即seq id no.1),利用mirna155线性探针1(即seq id no.2)、pcr
‑
f1(即seq id no.3)、pcr
‑
r1(即seq id no.4)进行逆转录和pcr扩增反应,通过荧光信号检测不同浓度靶标mirna155。以mirna122(即seq id no.5)为阴性对照,以水代替靶标为空白对照。具体步骤如下:
[0062]
1、逆转录:
ⅰ
)配制逆转录反应基础液15ul;
ⅱ
),在不同反应管中,分别加入5ul终浓度为3
×
107、3
×
106、3
×
105、3
×
104、3
×
103、3
×
102、3
×
101、3copy的靶标mirna155,混匀反应液;
ⅲ
)置于pcr仪上,42℃反应15min,85℃5min灭活逆转录酶活性。
[0063]
2、定量pcr扩增:同实施例1。
[0064]
荧光信号图如图4,其中曲线1
‑
8分别是3
×
107至3copy的靶标mirna155体系的荧光信号图,曲线9是阴性对照mirna122体系的荧光信号图,曲线10是空白对照体系的荧光信号图。可以看出:当靶标浓度降低时,cq值依次增大。但是即使靶标浓度降至3copy时cq值为28.35,也显著小于阴性对照cq值(37.54),说明本发明能够检测到3copy靶标。实验还发现本发明方法有比较宽的检测范围(从3
×
107至3copy),由图5可以得出其线性方程为y=36.32216
‑
2.53243x,r2=0.992,说明本发明方法具有较好的线性检测范围。
[0065]
实施例3验证线性探针d区域和b区域的作用
[0066]
本发明的线性探针包括a、b和c三个区域,还可以包括d区域。a区域的核苷酸序列和靶标核酸互补配对,b区域的核苷酸序列通过减少空间位阻协助成环,c区域的核苷酸序列和靶标核酸5’端相同。d区域的核苷酸序列是延长该探针长度的核苷酸序列。通过调节d区域和b区域的gc含量,以使上下游pcr引物退火温度相近。
[0067]
本实施例利用mirna155作为靶标mirna(即seq id no.1),设计相应的线性探针及其pcr引物进行逆转录和pcr扩增反应,通过荧光信号验证探针d区域和b区域的作用。同时以mirna122(即seq id no.5)为阴性对照,以水代替靶标为空白对照。
[0068]
(一)线性探针d区域的作用
[0069]
设计5条线性探针(即mirna155线性探针1~5,其d区域长度不同,b区域长度固定为30bp)及其对应pcr引物进行逆转录和pcr扩增反应,通过荧光信号验证探针d区域的作用。
[0070]
1)mirna155线性探针1(d区域核苷酸序列为0,序列见表2,即seq id no.2),pcr
‑
f1(ttaatgctaattggcatgaaac,即seq id no.3)、pcr
‑
r1(ttaatgctaattgtgataggggt,即seq id no.4);
[0071]
2)mirna155线性探针2(d区域核苷酸序列为10,序列见表2,即seq id no.6),pcr
‑
f2(ggctagcgatttaatgctaattg,即seq id no.7)、pcr
‑
r2(ttaatgctaattgtgatagggat,即seq id no.8);
[0072]
3)mirna155线性探针3(d区域核苷酸序列为20,序列见表2,即seq id no.9),pcr
‑
f3:ggcgactgagctgtagcg(seq id no:10),pcr
‑
r3(ttaatgctaattgtgataggg,即seq id no.11);
[0073]
4)mirna155线性探针4(d区域核苷酸序列为20,且5’端含c区域核苷酸序列,序列见表2,即seq id no.12),pcr
‑
f4:ttaatgctaattgtagcgattt(seq id no:13),pcr
‑
r4(ttaatgctaattgtgatagggac,即seq id no.14);
[0074]
5)mirna155线性探针5(d区域核苷酸序列为40,序列见表2,即seq id no.15),pcr
‑
f5:ggcgagctgacgggactg(seq id no:16),pcr
‑
r5(ttaatgctaattgtgatagggca,即seq id no.17)。
[0075]
表2 mirna155线性探针1~5序列
[0076][0077]
注:线性探针中,双划线碱基为a区域,波浪线碱基为b区域,间隔线碱基为c区域,单划线碱基为d区域。
[0078]
具体步骤如下:
[0079]
1、逆转录:
ⅰ
)配制逆转录反应液10ul,除不加线性探针外,其他与逆转录反应基础液相同;
ⅱ
)在不同反应管中,分别加入5ul终浓度200nmol/l的mirna155线性探针1、线性探针2、线性探针3、线性探针4、线性探针5,混匀反应液;
ⅲ
)分别加入5ul终浓度为200pmol/l的靶标mirna155,混匀反应液;iv)置于pcr仪上,42℃反应15min,85℃5min灭活逆转录酶活性。
[0080]
2、定量pcr扩增:同实施例1。
[0081]
检测结果如表3所示:探针没有d区域核苷酸序列时,cq值为13.89,探针d区域核苷酸序列分别为10、20和40时,cq值分别为13.83、13.67(13.68)、13.71,而对照体系的cq值大于35。实验发现:探针有d区域核苷酸序列时与没有d区域时相比,cq值没有明显差异(仅相差0.06~0.23)。实验证实d区域作为延长探针的核苷酸序列,在0~40个核苷酸范围内对检测没有明显影响,这是由于d区域的延长探针功能可以被b区域核苷酸替代。这说明b区域不仅可以协助成环,而且还有延长探针长度的功能。在表3同时发现,在d区域5’端含有c区域核苷酸序列时和不含有c区域核苷酸序列时,cq值分别为13.67和13.68,两者没有明显差别,这说明d区域的核苷酸序列组成对检测没有明显影响,增加了d区域设计的灵活性。
[0082]
表3不同d区域长度线性探针检测结果
[0083][0084]
(二)线性探针b区域的作用
[0085]
设计4条线性探针(即mirna155线性探针6~9,见表格4,b区域长度不同,d区域长度固定为30bp)及pcr引物进行逆转录和pcr扩增反应,通过荧光信号验证探针b区域的作用。采用的pcr引物为:pcr
‑
f3:ggcgactgag ctgtagcg(seq id no:10),pcr
‑
r3(ttaatgctaattgtgataggg,即seq id no.11)。同时以mirna122(即seq id no.5)为阴性对照,以水代替靶标为空白对照。
[0086]
表4 mirna155线性探针6~9序列
[0087][0088]
注:线性探针中,双划线碱基为a区域,波浪线碱基为b区域,间隔线碱基为c区域,单划线碱基为d区域。
[0089]
具体步骤如下:
[0090]
1、逆转录:
ⅰ
)配制逆转录反应液10ul,除不加线性探针外,其他与逆转录反应基础液相同;
ⅱ
)不同反应管中,分别加入5ul终浓度200nmol/l的mirna155线性探针6、线性探针7、线性探针8、线性探针9,混匀反应液;
ⅱ
)分别加入5ul终浓度为200pmol/l的靶标mirna155,混匀反应液;iv)置于pcr仪上,42℃反应15min,85℃5min灭活逆转录酶活性。
[0091]
2、定量pcr扩增:同实施例1。
[0092]
检测结果如表5所示,在探针没有b区域核苷酸序列时,cq值为20.37,在探针有b区域核苷酸序列为10、20和40时,cq值分别为13.76,13.61和13.84,而对照体系的cq值大于35。实验结果表明:线性探针没有b区域时,也能对靶标进行检测,但是与有b区域的线性探针相比,其cq值明显大。这说明有b区域核苷酸序列时,线性探针体系检测信号出现更早,检
单碱基突变,还能检测5’单碱基突变,具有很高的检测特异性。
[0101]
表6 let7家族序列及检测结果
[0102][0103][0104]
实施例5本发明方法在复杂体系中抗背景干扰能力的测定
[0105]
本实施例利用let7a作为靶标mirna(即seq id no.22),设计线性探针、pcr
‑
f和pcr
‑
r进行逆转录和pcr扩增反应,通过在体系中加入10ng大肠杆菌rna检测本发明方法的抗干扰能力。
[0106]
设计let7a线性探针(即seq id no.23)、pcr
‑
f
let7a
(即seq id no.24)、pcr
‑
r
let7a
(即seq id no.25)。选择mirna122(即seq id no.5)为阴性对照,以水代替靶标为空白对照。具体步骤如下:
[0107]
1、逆转录:
ⅰ
)配制逆转录反应基础液15ul;
ⅱ
)不同反应管中,分别加入5ul终浓度100pmol/l靶标let7a或阴性对照,含有10ng大肠杆菌rna的终浓度100pmol/l靶标let7a或对照,混匀反应液;
ⅲ
)置于pcr仪上,42℃反应15min,85℃5min灭活逆转录酶活性。
[0108]
2、定量pcr扩增:同实施例1。
[0109]
结果如图6所示,曲线1是加10ng大肠杆菌rna的let7a体系的荧光信号图,曲线2是let7a体系的荧光信号图,曲线3是加10ng大肠杆菌rna的mirna122阴性对照体系的荧光信号图,曲线4是mirna122阴性对照体系的荧光信号图,曲线5是空白对照体系的荧光信号图。可以看出:加入大肠杆菌核酸后,靶标let7a体系和阴性对照体系的荧光信号图没有明显变化。说明本发明具有较好的抗干扰能力。
[0110]
实施例6体系对多靶标的检测能力
[0111]
本实施例利用mirna199a(序列为:acaguagucugcacauugguua,即seq id no.29),mirna1a
‑
3p(序列为:uggaauguaaagaaguauguau,即seq id no.30)和mirna92a(序列为:uauugcacuugucccggccugu,即seq id no.31)作为靶标,设计相应的线性探针、pcr
‑
f和pcr
‑
r进行逆转录和pcr扩增反应,验证本方法对多靶标检测能力。
[0112]
(1)mirna199a线性探针(序列见表7,即seq id no.32)、pcr
‑
f
199a
(序列为:gcctgaaggctatccggtac,即seq id no.33)、pcr
‑
r
199a
(序列为:acagtagtctgcacattggtgc,即seq id no.34);
[0113]
(2)mirna1a
‑
3p线性探针(序列见表7,即seq id no.35)、pcr
‑
f
1a
‑
3p
(序列为:gtgcaacaactggctg tggaatg,即seq id no.36)、pcr
‑
r
1a
‑
3p
(序列为:
tggaatgtaaagaagtatgtc,即seq id no.37);
[0114]
(3)mirna92a的线性探针(序列见表7,即seq id no.38)、pcr
‑
f
92a
(序列为:gaacttattaaggcagtattgc,即seq id no.39)、pcr
‑
r
92a
(序列为:tattgcacttgtcccggccgag,即seq id no.40)。
[0115]
选择mirna122(即seq id no.5)为阴性对照,以水代替靶标作为空白对照。
[0116]
表7线性探针序列
[0117][0118]
注:线性探针中,双划线碱基为a区域,波浪线碱基为b区域,间隔线碱基为c区域,单划线碱基为d区域。
[0119]
具体步骤如下:
[0120]
1、逆转录:
[0121]
ⅰ
)配制逆转录反应液10ul,除不加线性探针外,其他与逆转录反应基础液相同;
[0122]
ⅱ
)6个不同反应管中,分别加入:
[0123]
①
5ul的mirna199a的线性探针(200nmol/l)和5ul的10pmol/l的对应靶标mirna199a(10pmol/l)、
②
5ul的mirna1a
‑
3p的线性探针(200nmol/l)和5ul的mirna1a
‑
3p(10pmol/l)、
③
5ul的mirna92a的线性探针(200nmol/l)和5ul的mirna92a(10pmol/l)、
④
5ul的三种靶标的线性探针(200nmol/l)和5ul的三种靶标(10pmol/l)、
⑤
5ul的三种靶标的线性探针(200nmol/l)和5ul的mirna122(10pmol/l)、
⑥
5ul的三种靶标的线性探针(200nmol/l)和5ul的水。
[0124]
ⅲ
)置于pcr仪上,42℃反应15min,85℃5min灭活逆转录酶活性。
[0125]
2、定量pcr扩增:
ⅰ
)配制pcr反应液15ul,除不加引物外,其他与pcr扩增反应基础液相同;
ⅱ
)分别加入5ul上述逆转录产物及对应pcr引物(2.5ul的100nmol/l的pcr
‑
f和pcr
‑
r),混匀反应液;
ⅲ
)置于pcr仪上,94℃2min,40个循环(94℃40秒,58℃40秒)。
[0126]
结果见图7所示,其中曲线1为三种靶标(mirna199a、mirna1a
‑
3p和mirna92a)和其对应探针/引物体系的荧光信号图,曲线2为mirna199a和其对应探针/引物体系的荧光信号图,曲线3为mirna1a
‑
3p和其对应探针/引物体系的荧光信号图,曲线4为mirna92a和其对应探针/引物的体系荧光信号图,曲线5为以mirna122代替靶标,加入三种靶标的探针/引物的阴性对照体系的荧光信号图,曲线6为以水代替靶标,加入三种靶标的探针/引物的空白对照体系的荧光信号图。从结果可以得出:与阴性对照和空白对照相比,mirna199a、mirna1a
‑
3p和mirna92a三种靶标都能被特异检测,同时,含有mirna199a、mirna1a
‑
3p和mirna92a混合靶标体系的荧光信号较单独含有其中任意一个靶标体系的荧光信号出现的早,这个结果说明本发明可以实现在同一个反应体系中,实现多个靶标的同时检测,减少检测多个靶标
的工作量。
[0127]
实施例7本发明方法对人粪便mirna提取液的检测能力
[0128]
mirna92a在结直肠癌患者粪便中含量高,而在正常人粪便中含量很低,mirna92a可作为结直肠癌早期诊断的标志物之一。本实施例设计mirna92a的线性探针、pcr
‑
f和pcr
‑
r进行逆转录和pcr扩增反应,通过分子信标检测法验证本方法检测人粪便中mirna92a的能力。
[0129]
mirna92a的线性探针(即seq id no.38),pcr
‑
f
92a
(即seq id no.39)、pcr
‑
r
92a
(即seq id no.40)。分子信标序列为:tam
‑
gcaggcacgatatcgcatgtcctagtgcctgc
‑
dabcyl,即seq id no.41)。mirna提取试剂盒提取3个结直肠癌患者和2个正常人粪便mirna,空白对照以水代替靶标。具体步骤如下:
[0130]
1、逆转录:
ⅰ
)配制逆转录反应基础液15ul;
ⅱ
)不同反应管中,分别加入结直肠癌患者粪便提取mirna、正常人粪便提取mirna或水5ul,混匀反应液;
ⅲ
)置于pcr仪上,42℃反应15min,85℃5min灭活逆转录酶活性。
[0131]
2、定量pcr扩增:
ⅰ
)配制pcr扩增反应液20ul,除不加sybr green染料外,其他与pcr扩增反应基础液相同;
ⅱ
)分别加入4ul上述逆转录产物和1ul(500nmol/l)的分子信标,混匀反应液;
ⅲ
)置于pcr仪上,94℃2min,40个循环(94℃40秒,59℃40秒)。
[0132]
检测结果如图8。其中,曲线1
‑
3是三个结直肠癌患者体系的荧光信号图,曲线4和5是两个正常人体系的荧光信号图,曲线6是空白对照体系的荧光信号图。实可以看出:空白对照曲线6没有明显的cq值,肠癌患者体系曲线1
‑
3的cq值分别为21.36、22.73和21.15,而正常人体系曲线4和5的cq值分别为30.29和29.72。实验结果表明结直肠癌患者和正常人体系有明显差别。说明本发明方法能够有效区分肠癌患者和正常人体系,对区分癌症患者和正常人有好的检测能力。
[0133]
实施例8本发明方法对博卡病毒dna检测能力
[0134]
本发明不仅能检测rna,而且能检测dna。本实施例选择单链dna的博卡病毒为检测靶标。设计博卡病毒的线性探针、pcr
‑
f和pcr
‑
r进行扩增反应,验证本发明方法检测dna的能力。
[0135]
博卡病毒靶标(序列为:ccaatcagaattgagtattaaacctatataagctgctgcacttcctgattcaatcagactgcatccggtc,即seq id no.42),博卡病毒线性探针(序列为:ggcaagcttgccaatcagaagttctagaagtgacagtgggtctgatcggataatactcaa,seq id no.43),pcr
‑
f
博卡
(序列为:ggcaagcttg ccaatcagaag,即seq id no.44)、pcr
‑
r
博卡
(序列为:ccaatcagaattgagtattatcc,即seq id no.45)。选择大肠杆菌核酸为阴性对照,以水代替靶标为空白对照。具体步骤如下:
[0136]
1、聚合反应:
ⅰ
)配制聚合反应液15ul,其中包括;100mmol/l三(羟甲基)氨基甲烷(ph 8.5)、30mmol/l氯化镁、10mmol/l二硫苏糖醇、0.6mmol/l dntps、200nmol/l线性探针、5u klenow大片段酶;
ⅱ
)不同反应管中,分别加入5ul的10ug/ul、1ug/ul、100ng/ul、10ng/ul博卡病毒核酸提取物,混匀反应液;
ⅲ
)置于pcr仪上,37℃反应20min,85℃5min灭活klenow大片段酶活性。
[0137]
2、定量pcr扩增:
ⅰ
)配制pcr扩增反应基础液20ul;
ⅱ
)分别加入5ul上述聚合产物,混匀反应液;
ⅲ
)置于pcr仪上,94℃2min,40个循环(94℃40秒,59℃45秒)。
[0138]
实验结果如图9所示。其中,曲线1
‑
4分别是10ug/ul、1ug/ul、100ng/ul、10ng/ul博卡病毒体系的荧光信号图,曲线5是阴性对照大肠杆菌体系的荧光信号图,曲线6是空白对照体系的荧光信号图。可以看出,不同浓度的博卡病毒体系的荧光信号比大肠杆菌阴性对照体系出现时间明显早,这说明本方法能够有效检测博卡病毒。
[0139]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1