吩噻嗪半抗原、完全抗原及其制备方法和应用与流程
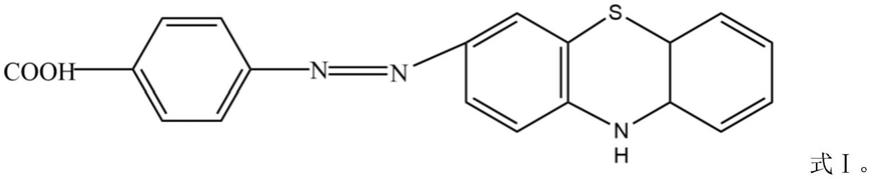
1.本发明涉及抗原制备技术领域,具体地说是一种吩噻嗪半抗原、完全抗原及其制备方法和应用。
背景技术:
2.吩噻嗪药物在人体内消除速率较慢,容易在体内产生药物残留,特别是食用动物中残留的吩噻嗪类镇定剂经食物链进入人体后,可对人体的内分泌、运动和循环等系统以及肝脏器官造成不良影响,引起白细胞减少、肝功能障碍、粒细胞缺乏症、接触性皮炎和皮疹等毒副作用,给人体健康带来很大风险。检测动物源性食品中吩噻嗪残留常用仪器分析方法,免疫学检测方法应用较少,但相比于仪器分析方法,免疫学检测方法成本较低,检测时间短,适用于大批量样品现场检测。完全抗原作为免疫学检测方法的基础至关重要。为充实针对食品中吩噻嗪残留的免疫学检测方法,本发明成功制备吩噻嗪完全抗原,为之后建立相关的免疫学检测方法做基础。
3.由于吩噻嗪本身结构的特殊性,导致吩噻嗪合成抗原困难加重,现有的针对吩噻嗪合成抗原的方法大多操作复杂,制备过程费时费力,且充满危险性。为简化制备过程,降低危险性,本发明重新研究设计吩噻嗪合成完全抗原的合成路线,并设计此吩噻嗪完全抗原鉴定方法,以确保此完全抗原合成成功。
技术实现要素:
4.本发明的目的就是提供一种吩噻嗪半抗原、完全抗原及其制备方法和应用,以为吩噻嗪的免疫学检测提供一种完全抗原。
5.本发明的目的是这样实现的:一种吩噻嗪半抗原,其分子结构式如式ⅰ所示:
[0006][0007]
上述的吩噻嗪半抗原的制备方法,包括以下步骤:
[0008]
(a)在2
‑
6℃条件下,用hcl溶液调节对氨基苯甲酸溶液ph值至1
‑
3,漩涡搅拌至溶液完全溶解;
[0009]
(b)将所得酸性的对氨基苯甲酸溶液与亚硝酸钠溶液混合,得到浅黄色溶液,并于2
‑
6℃冷藏20
‑
40min;其中,对氨基苯甲酸与亚硝酸钠的摩尔比为1∶2
‑
3;
[0010]
(c)在步骤(b)所得溶液中加入吩噻嗪,其中,吩噻嗪与对氨基苯甲酸的摩尔比为1∶1,然后在暗室中磁力搅拌10
‑
14h,即得所述吩噻嗪半抗原。
[0011]
一种吩噻嗪完全抗原,其是由上述的吩噻嗪半抗原与载体蛋白protein制备而成,其分子结构式如式ⅱ所示:
[0012][0013]
上述的吩噻嗪完全抗原的制备方法,其通过混合酸酐法制备而成:
[0014]
(a)在冰浴环境下,在吩噻嗪半抗原溶液中加入1,4
‑
二氧六环和n
‑
n
‑
二甲基甲酰胺,震荡混合1
‑
3min,静置5
‑
15min后,加入三乙胺,再静置5
‑
15min后加入氯甲酸异丁酯,然后移除冰浴,磁力搅拌20
‑
40min;其中,吩噻嗪半抗原∶1,4
‑
二氧六环∶n
‑
n
‑
二甲基甲酰胺∶三乙胺∶氯甲酸异丁酯=0.1mmol∶1
‑
2ml∶1
‑
2ml∶0.1
‑
0.3nmol∶0.1
‑
0.2nmol;
[0015]
(b)取载体蛋白
‑
硼酸钠溶液与步骤(a)所得反应液混合,其中,载体蛋白
‑
硼酸钠:吩噻嗪半抗原=12mg∶0.1mmol,然后于2
‑
6℃下反应10
‑
14h,装入透析袋,在pbs缓冲液中透析60
‑
80h,每隔4
‑
8h换透析液,透析完成后即得所述吩噻嗪完全抗原。
[0016]
上述的吩噻嗪完全抗原的制备方法,其通过碳二亚胺法制备而成:
[0017]
(a)在吩噻嗪半抗原溶液中加入n,n
‑
二甲基甲酰胺,然后搅拌加入二环己基碳二亚胺和n
‑
羟基丁二酰亚胺,磁力搅拌过夜,之后离心取上清液,记作a液;其中,吩噻嗪半抗原∶n,n
‑
二甲基甲酰胺∶二环己基碳二亚胺∶n
‑
羟基丁二酰亚胺=0.1mmol∶1
‑
2nmol∶0.1
‑
0.2mmol∶0.1
‑
0.2mmol;
[0018]
(b)称取载体蛋白溶于pbs缓冲液中,记作b液,其中,载体蛋白
‑
硼酸钠:吩噻嗪半抗原=12mg∶0.1mmol;
[0019]
(c)将a液加入到b液中,磁力搅拌10
‑
14h;然后离心取上清液装入透析袋中,在pbs缓冲液中透析60
‑
80h,每隔4
‑
8h换透析液,透析完成后即得所述吩噻嗪完全抗原。
[0020]
所述载体蛋白为牛血清白蛋白,所述pbs缓冲液为0.01mol/l,ph7.4。
[0021]
上述的吩噻嗪完全抗原的鉴定方法,其特征是,采用高效液相色谱法进行鉴定,其中,流动相为甲醇
‑
水,样品溶剂采用水。
[0022]
上述的吩噻嗪完全抗原在制备吩噻嗪药物的多克隆抗体中的应用。
[0023]
本发明制备的吩噻嗪完全抗原免疫效果好,动物免疫后获得的抗血清经间接酶联免疫测定抗体效价可达1:3000,本发明制备方法简单,成本低,适宜大规模推广应用。
附图说明
[0024]
图1是标准曲线图。
[0025]
图2是完全抗原1紫外光谱图。
[0026]
图3是完全抗原2紫外光谱图。
[0027]
图4是完全抗原1凝胶电泳结果。
[0028]
图5是完全抗原2凝胶电泳结果。
[0029]
图6是不同流动相测得bsa色谱图。
[0030]
图7是不同流动相测得完全抗原1色谱图。
[0031]
图8是不同流动相测得完全抗原2色谱图。
[0032]
图9是不同溶剂测bsa色谱图。
[0033]
图10是不同溶剂测完全抗原1色谱图。
[0034]
图11是不同溶剂测完全抗原2色谱图。
[0035]
图12是完全抗原1与bsa对比色谱图。
[0036]
图13是完全抗原2与bsa对比色谱图。
[0037]
图14是三次免疫效果结果图。
[0038]
图15是效价测定结果图。
具体实施方式
[0039]
下面结合具体实施例对本发明的技术方案进行详细说明。本发明实施例中未提到的试验条件和操作均按本领域常规方法或制造商建议的条件进行。
[0040]
实施例1:半抗原修饰
[0041]
利用重氮化法对吩噻嗪进行分子修饰,引入羧基。步骤如下:
[0042]
步骤一:4℃下,用1.2mol/l的hcl溶液调节0.1mol/l的对氨基苯甲酸溶液ph值至2,漩涡搅拌至溶液完全溶解。
[0043]
步骤二:取1ml酸性的对氨基苯甲酸溶液加入100μl 0.01mol/l亚硝酸钠溶液混合,溶液变至浅黄色,4℃冷藏30min。
[0044]
步骤三:将0.1mmol吩噻嗪加入到重氮化的溶液中,暗室中,磁力搅拌12h。
[0045]
此时,半抗原分子修饰完成,可与载体蛋白合成完全抗原。半抗原修饰路线如下所示:
[0046][0047]
实施例2混合酸酐法合成完全抗原
[0048]
反应原理是半抗原分子末端的羧基与载体蛋白结构上的氨基发生脱水缩合反应而以肽键的形式相连。具体的操作步骤如下:
[0049]
步骤一:冰浴环境下,在修饰好的半抗原中加入各1ml的1,4
‑
二氧六环和n,n
‑
二甲基甲酰胺,旋涡震荡2min,10min后加入26.5μl三乙胺,10min后加入16μl的氯甲酸异丁酯,
此时移除冰浴,磁力搅拌30min。
[0050]
步骤二:取2ml 0.6mg/ml的牛血清白蛋白
‑
硼酸钠溶液与上述溶液混合,4℃下反应12h后装入透析袋,在0.01m磷酸盐缓冲液(pbs)中透析72h,每隔6h换透析液。透析完成后置于
‑
20℃下保存。此为完全抗原1,完全抗原1合成路线如下所示。
[0051][0052]
实施例3碳二亚胺法合成完全抗原
[0053]
步骤一:在修饰好的半抗原中加入200μl n,n
‑
二甲基甲酰胺,搅拌加入20.633mg二环己基碳二亚胺和11.509mg n
‑
羟基丁二酰亚胺,磁力搅拌过夜,10000r/min离心10min,取上清液记作a液。
[0054]
步骤二:精准称量12mg bsa溶于5ml pbs中记作b液。
[0055]
步骤三:将a液加入到b液中,磁力搅拌12h。10000r/min离心10min,离心后取上清液装入透析袋中,在pbs中透析72h,每隔6h换透析液。透析完成后置于
‑
20℃下保存。此为完全抗原2,合成路线如下所示:
[0056][0057]
实施例4完全抗原的鉴定
[0058]
1、考马斯亮蓝法测定完全抗原浓度
[0059]
步骤一:配置1mg/ml牛血清白蛋白溶液。
[0060]
步骤二:取六只试管,分别加入如下表1的溶液。分别加入4ml考马斯亮蓝溶液混匀,室温条件下反应5min,用分光光度计在595nm出测量吸光度。
[0061]
表1试管溶液组成
[0062]
序号牛血清白蛋白溶液/ml水/ml10.01.0
20.20.830.40.640.60.450.80.261.00.0
[0063]
步骤三:以蛋白质浓度为横坐标,吸光度为纵坐标,作标准曲线。
[0064]
步骤四:将完全抗原1、2稀释10倍,分别取1.0ml溶于试管7、8中,以同样的方法测量吸光度,代入标准曲线,计算完全抗原浓度。用分光光度计测六种不同蛋白质浓度的溶液在595nm处的吸光度,测出的结果如下:
[0065]
表2不同浓度蛋白质所得吸光度
[0066][0067]
根据所得数据以蛋白质浓度为横坐标,吸光度为纵坐标,制作标准曲线,计算标准方程。如图1所示。计算得到回归方程为y=0.0563x+2.8882,相关系数为0.9753。
[0068]
将完全抗原1和2稀释10倍,测出吸光度,根据方程,计算出完全抗原的蛋白质浓度。
[0069]
表3完全抗原的吸光度
[0070][0071]
测得完全抗原1的吸光度为2.890a,根据标准方程,计算得到x=0.1421mg/ml,则完全抗原1的浓度为1.421mg/ml。完全抗原2的吸光度为2.889a,根据标准方程,计算得到x=0.125mg/ml,则完全抗原2中的浓度为1.25mg/ml。
[0072]
2、紫外分光光度法鉴定
[0073]
通过紫外分光光度计测定合成的完全抗原的最大吸收峰,并将其与载体蛋白bsa以及半抗原吩噻嗪的最大吸收峰进行比较,观察是否有差异,以此评估完全抗原是否合成成功。
[0074]
步骤一:以超纯水做溶剂配置1mg/ml的牛血清白蛋白溶液;用甲醇做溶剂配置0.3mg/ml的吩噻嗪溶液;完全抗原用超纯水稀释至与牛血清白蛋白溶液浓度一致。
[0075]
步骤二:用超纯水基线校正,在200
‑
400nm,依次扫描牛血清白蛋白溶液和完全抗原溶液。用甲醇做基线校正,在200
‑
400nm,扫描吩噻嗪溶液。结果见图2和图3
[0076]
牛血清白蛋白用超纯水配制成1mg/ml进行测定,结果表明牛血清白蛋白的特征吸收峰在278
‑
280nm之间。用甲醇作溶剂配制浓度为0.3mg/ml的吩噻嗪溶液,经测定吸收峰杂乱,对吩噻嗪溶液进行多次稀释,最终浓度为0.003mg/ml,结果显示吩噻嗪的特征吸收峰有两个分别在253nm和318nm处,最大吸收峰在318nm处。完全抗原1吸取300μl,加水至5ml,结果表明在247nm和334nm处有特征吸收峰,最大吸收峰在334nm处。完全抗原2吸取300μl加水至5ml,测定吸收峰不明显,吸取600μl加水至5ml,结果表明完全抗原2只有一个特征吸收峰,在251nm处。在图2中,完全抗原1相对于吩噻嗪和bsa的最大吸收峰均有明显差异,可初步证明完全抗原1偶联成功。在图3中,完全抗原2相对于吩噻嗪和bsa的最大吸收峰均有明显差距,可初步证明完全抗原2偶联成功。
[0077]
3、sds
‑
page电泳法鉴定
[0078]
蛋白质物质的分子量不同导致其在电泳情况下的迁移率不同,sds
‑
page电泳法利用浓缩胶将所有蛋白质分子压缩在同一水平线上,利用分离胶分离蛋白质分子。其具体实验过程如下:
[0079]
步骤一:配置浓度为10%的分离胶10ml,分别添加超纯水4.1ml,4x分离胶缓冲液2.5ml,30%丙烯酰胺3.3ml,10%过硫酸铵100μl,四甲基丁二胺5μl、将分离胶添加至电泳槽胶板内,加至胶板体积3/4处,添加完毕后用超纯水封胶,静置30min,待分离胶和水层之间出现一个清晰的界面后,表明凝胶已经聚合。
[0080]
步骤二:配置浓度为5%的浓缩胶4ml,分别添加超出水2.28ml,4x浓缩胶缓冲液1ml,30%丙烯酰胺0.68ml,10%过硫酸铵40μl,四甲基丁二胺4μl。将浓缩胶添加到胶板中,避免产生气泡,直至凝胶到达玻璃板顶端,插入梳子,静置10
‑
20min,待凝胶聚合后,小心拔出梳子,以免破坏加样孔。
[0081]
步骤三:蛋白质变质,根据测得的完全抗原浓度,将其浓度与载体蛋白浓度一致。将上样缓冲液与样品按体积比1:4比例混匀,然后置于沸水浴中加热3
‑
5min。待冷却至室温,与离心机中2000r/min离心30s,取上清液。
[0082]
步骤四:将上清液加入凝胶加样孔中,载体蛋白与完全抗原加入10μl/孔,蛋白marker加入5μl/孔,加入5倍稀释的电泳缓冲液,开始电泳。浓缩胶电压为80v,30min后,条带跑至分离胶后,换120v电压电泳,1h结束。
[0083]
步骤五:电泳结束切下分离胶,置于考马斯亮蓝快速染色液中染色15min,后置于脱色液脱色至透明,在凝胶成像系统中拍照保存。
[0084]
蛋白质分子量的大小决定了其在电泳条件下迁移大小,分子量越大,迁移速度越小。完全抗原是在载体蛋白上偶联吩噻嗪小分子,所以完全抗原的分子量比载体蛋白的分子量大,理论上,完全抗原的条带会慢于载体蛋白条带或比载体蛋白条带有明显的拖尾现象。如图4和图5所示。图4中左侧条带是bsa的结果,右侧条带是完全抗原1的结果。结果表明合成的完全抗原1与bsa相比有明显的拖尾现象,偶联物蛋白的泳动速度小于bsa,说明其分子量大于bsa,进而表明bsa与半抗原吩噻嗪偶联成功。图5中左侧条带是bsa的结果,右侧条
带是完全抗原2的结果。结果显示合成的完全抗原2与bsa相比有明显拖尾现象,偶联物蛋白的泳动速度小于bsa,说明其分子量大于bsa,进而表明成功合成了完全抗原2。
[0085]
4、高效液相色谱法
[0086]
色谱条件:柱温:30℃;检测波长:230nm;流速:1.0ml/min。
[0087]
(1)流动相的选择
[0088]
流动相:a甲醇,b水或磷酸盐缓冲溶液;梯度洗脱:0
‑
6min,a的量55
‑
80%;6
‑
15min,a的量80%;15
‑
16min,a的量80
‑
90%;16
‑
21min,a的量90%;21
‑
24min,a的量90
‑
95%;24
‑
35min,a的量55%。
[0089]
以水为溶剂配置0.3mg/ml的牛血清白蛋白溶液和完全抗原溶液。选择用甲醇
‑
水以及甲醇
‑
磷酸盐缓冲液分别做流动相,观察色谱图选择最佳流动相。
[0090]
图6中,上下图分别为甲醇
‑
磷酸盐缓冲液、甲醇
‑
水为流动相测得的bsa的峰图,两图除流动相不同外,其余条件完全相同。明显观察到以甲醇
‑
水为流动相比以甲醇
‑
缓冲液为流动相所测得的出峰时间不同,下图出峰时间为24.147min,上图并不明显。而且下图中峰形更好,上图中出峰情况杂乱,推测是缓冲液中杂质太多,所以并不能得到对应的吸收峰。
[0091]
图7中,上下图分别为甲醇
‑
磷酸盐缓冲液、甲醇
‑
水为流动相测得的完全抗原1的峰图,下图测得的吸收峰时间在25.106min,但上图并未出现明显的吸收峰甚至并未出峰。
[0092]
图8中,上下图分别为甲醇
‑
磷酸盐缓冲液、甲醇
‑
水为流动相测得的完全抗原2的峰图。下图测得的吸收峰时间在32.166min,但上图并未出现明显的吸收峰,出峰混乱。
[0093]
通过对比可以明显看出,三种物质以甲醇
‑
水为流动相更合适,所以舍弃以甲醇
‑
缓冲液做流动相这一选择。
[0094]
(2)溶剂的选择
[0095]
考虑到甲醇会使蛋白质变性,所以分别用水和磷酸盐缓冲液做溶剂配制储备液。
[0096]
图9中,下图为水作溶剂,上图为缓冲液作溶剂,可以看出,缓冲液作溶剂bsa并没有明显的吸收峰,但是以水作溶剂bsa是有吸收峰的,所以推测缓冲液对bsa的测定有影响。
[0097]
图10中,下图为水作溶剂,上图为缓冲液作溶剂,可以看出,缓冲液作溶剂测出的完全抗原1杂乱无章。
[0098]
图11中,下图为水作溶剂,上图为缓冲液作溶剂,可以看出,缓冲液作溶剂测出两个吸收峰,经对比,第一个吸收峰为bsa,第二个为完全抗原2。
[0099]
bsa与完全抗原1经对比,在以缓冲液作溶剂时并不稳定,缓冲液的影响非常显著,但是完全抗原2反而在缓冲液中的吸收峰更好。综合考虑三种物质的吸收峰情况,用水作溶剂更合适。
[0100]
(3)偶联情况鉴定
[0101]
以甲醇
‑
水为流动相,水做溶剂,对比完全抗原与载体蛋白的吸收峰情况。
[0102]
在图12中,上图为bsa的吸收峰图,最大吸收峰出峰时间为24.147min。下图为完全抗原1的吸收峰图,最大吸收峰出峰时间为25.106min。在图13中,上图为bsa的吸收峰图,最大吸收峰出峰时间为24.147min。下图为完全抗原2的吸收峰图,最大吸收峰出峰时间为32.166min。两种物质出峰时间不相同,峰形也不同。
[0103]
通过对比观察,完全抗原与bsa的吸收峰不同,可以得出完全抗原1与完全抗原2合
成成功。
[0104]
5完全抗原的免疫效果检测
[0105]
动物免疫是检验抗原是否合成成功最有效的手段之一。用间接酶联免疫方法检测经动物免疫获得的多克隆抗体的效价。效价高低代表了完全抗原的有效性。
[0106]
(1)动物免疫
[0107]
采用皮下注射方法免疫新西兰大耳白兔,准确量取0.1ml完全抗原,溶于磷酸盐缓冲液中,与等体积的弗氏完全佐剂混合进行初次免疫.再次免疫采用弗氏非完全佐剂与完全抗原等体积混合的方法,于初次免疫后的第22、37、52、67天分别免疫,在47、62天,在兔耳边缘静脉采血,在第78天,取心脏血,4℃下静置分层后,取上清液以3000r/min离心15min,获得抗血清。
[0108]
(2)抗体纯化
[0109]
将制备的兔抗血清利用饱和硫酸铵盐析沉淀法进行纯化。各取3ml制备的血清和生理盐水,两者充分混匀后,向其中缓慢滴加饱和硫酸铵溶液6ml,边滴加边摇匀,4℃冰箱过夜。5000rpm低温离心20min,收集沉淀;向离心后的上清液中加入3ml的生理盐水和1.5ml的饱和硫酸铵,调节其浓度为33%,继续离心,将两次离心后的沉淀混在一起,向沉淀中加入2ml 0.01mol的磷酸盐缓冲液,充分混匀后置于透析袋中,4℃透析72h,最后用奈氏试剂进行测定,当检测不出铵根离子时,说明抗血清已纯化完全,分装,于
‑
86℃冷冻保存。
[0110]
(3)间接酶联免疫法测抗体效价
[0111]
(a)包被:用包被缓冲液稀释包被抗原溶液为10μg/ml,包被于96孔酶标板150μl/well,37℃包被3h,洗涤液(pbst)洗板3次,300μl/well,每次1min,将板拍干。
[0112]
(b)封闭:加入封闭液,150μl/well,37℃培养箱中孵育1.5h,pbst洗板步骤同上。
[0113]
(c)加样:将磷酸盐缓冲液作为空白对照,其余各行依次为梯度稀释的抗血清(1:100、1:500、1:1000、1:3000、1:5000),100μl/well,做三次平行实验,37℃孵育1h,pbst洗板3次,拍干。
[0114]
(d)加酶标二抗:将酶标二抗用封闭液做1:1000稀释,150μl/well,37℃温箱孵育1h,pbst洗板3次,拍干。
[0115]
(e)底物显色:加入邻苯二胺显色剂(现配现用),150μl/well,37℃避光反应20min。
[0116]
(f)终止:加入2mol/l h2so4溶液,50μl/well,终止反应。
[0117]
(g)测定od值:反应终止后酶标仪测定,在490nm处,当吸光值达到1.0时的血清稀释倍数作为血清效价。
[0118]
免疫动物试验中,抗血清的效价会随着动物多次免疫呈现上升趋势,但长期对动物进行免疫,机体对人工合成抗原产生抗免疫能力,免疫应答会减弱,抗血清效价就会降低。因此分别在每次免疫后的第10天抽取兔耳边缘静脉血。由图14可知,随着免疫次数的增加,抗血清效价逐渐上升,直至第三次免疫后测定抗血清吸光度可达1.124。由图15可知,吩噻嗪抗体效价为1:3000,能够满足实验要求,说明吩噻嗪多克隆抗血清中含有针对rb的特异性抗体,从而也进一步证明了所合成的人工抗原是正确的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1