一种编辑核酸的系统及方法与流程
1.本技术涉及基因工程和分子生物学领域。特别地,本技术涉及用于编辑核酸的系统和试剂盒及其用途,以及编辑核酸的方法。本技术的系统、试剂盒和方法可用于断裂双链靶核酸并在其末端(特别是断裂的末端)形成悬突,并且可用于在感兴趣的核酸分子(例如基因组dna)中插入靶核酸或将感兴趣的核酸分子(例如基因组dna)中的核苷酸片段置换为靶核酸。
背景技术:
2.基因编辑技术是生物医学研究的热门领域,在遗传性疾病的临床治疗、动物模型的构建、农作物的遗传育种等方面具有广阔的应用前景。基因编辑技术包括在基因组特异位点上,对单个核苷酸或一段dna序列进行删除、添加和替换等操作。外源基因的定点敲入可以通过同源重组(hdr,homologous dependent recombination)实现:在外源基因的两侧各引入一段500-3000bp的同源臂,可以实现外源基因精确的定点整合,但其效率极低,只有0.01%左右。通过人工构建的核酸酶如zfn(zinc-finger nucleases)、talen(transcription activator-like effector nucleases)或crispr/cas9(clustered regularly interspaced short palindromic repeats/crispr-associated protein-9nuclease)在基因组的靶向位点进行切割,产生dna双链断裂(dsb,double strand break),可以促进同源重组介导的外源基因的定点敲入。但由于大多数哺乳动物细胞主要依靠nhej(non-homologous end joining)进行dsb修复,基于核酸酶和同源重组的定点敲入效率依然很低,一般在1%左右。此外,由于同源重组只发生在细胞周期的s/g2期,对于处于终末分化阶段的大多数体细胞则无法通过以上方法实现外源基因的定点整合。
3.以线性单链dna为供体也可以实现外源dna片段的定点整合。单链dna供体的两端各有一段30-50nt的同源臂,核酸酶在基因组的特异位点切割后,单链依靠sdsa(synthesis dependent strand annealing)的方式整合到dsb位点,从而实现基因组特异位点的整合。线性单链dna相比hdr更加高效,但不够精确:单链dna的5’端的接头处常常发生额外的碱基插入和缺失。此外,长片段的线性dna单链化学合成的成本很高,不易获得。因此,这种方法不适用于大片段(大于1kb)的外源基因的定点敲入。除此之外,当插入片段超过1kb,其整合效率也会显著降低。
4.基于nhej的定点敲入,如hiti(homology-independent target integration)技术,不依赖外源基因两端的同源臂,其中,核酸酶在切割基因组上特异位点的同时也切割供体载体,随后线性化的外源基因dna片段通过nhej dna修复通路插入到基因组的断裂位点。基于nhej的定点敲入不具有方向性,且接头的位置常常不精确,容易产生额外的碱基插入或缺失。基于mmej的定点敲入方法是在nhej基础上,在外源基因的两端引入微同源臂,但效率仍然很低。
5.prime editing是一种新型基因编辑方法。该方法使用由具有h840a突变的spcas9(ncas9)与逆转录酶mlv-rt(murine leukemia virus-reverse transcriptase)构成的融
合蛋白,以及由grna(guide rna)改造而来的pegrna(prime editing guide rna),可以实现任意单碱基的转换/颠换或者小片段dna的删除、添加及替换。pegrna是在grna的3’端引入一段pbs(prime binding site)序列以及一段模板序列而产生的,其中,模板序列含有编辑序列和一段基因组dsb位点的同源序列。在该方法中,由ncas9与pegrna形成的复合物结合到基因组靶向位点并切割pam链,随后pegrna上的pbs序列与pam链上游离出来的3’末端互补配对,然后mlv-rt以pegrna的模板序列为模板,在pam链切口处的3’末端逆转录延伸出编辑序列和同源序列。随后,经过dna单链的置换和错配修复等过程,可以在切口处完成修复并将编辑序列整合到靶向位点。由于h840a ncas9只切割双链dna的一条链(即pam链),不会产生dsb引发nhej,因此,该方法不易引入额外的碱基缺失或插入,编辑的精确度高。但是,由于pegrna上模板序列的长度限制了可编辑序列的长度,prime editing仅适用于小于100bp的碱基序列的删除或敲入。
6.因此,建立一种能够高效进行基因定点敲入和置换的方法,特别是能够高效进行大片段(大于1kbp)外源基因的插入和置换的方法,对于拓展基因编辑技术在生产以及医疗中的应用至关重要。
技术实现要素:
7.在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的核酸化学实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
8.术语“cas蛋白”或“cas核酸酶”是一种rna引导的核酸酶。cas蛋白也被称为casn1核酸酶或crispr相关核酸酶。crispr(聚簇规则间隔短回文重复)是一种适应性免疫系统,其提供针对移动遗传元件(病毒、转座元件和接合质粒)的保护。crispr簇含有重复序列(repeat)和间隔序列(spacer),其中,间隔序列是与移动遗传元件互补的序列,能够靶向侵入核酸。crispr簇被转录并加工成crispr rna(crrna)。在ii型crispr系统中,对pre-crrna的正确加工还需要反式编码的小rna(tracrrna)的参与。因此,在自然界中,ii型crispr系统对dna的切割需要cas蛋白和两种rna。但是,通过工程化可以将crrna和tracrrna并入单一引导rna(简称“sgrna”或“gnra”)中。参见例如jinek m.,chylinski k.,fonfara i.,hauer m.,doudna j.a.,charpentier e.science 337:816-821(2012),其全部内容通过引用并入本文。
9.如本文中所使用的,术语“互补”意指,两条核酸序列能够根据碱基配对原则(waston-crick原则)在彼此之间形成氢键,并由此形成双链体。在本技术中,术语“互补”包括“实质上互补”和“完全互补”。如本文中所使用的,术语“完全互补”意指,一条核酸序列中的每一个碱基都能够与另一条核酸链中的碱基配对,而不存在错配或缺口。如本文中所使用的,术语“实质上互补”意指,一条核酸序列中的大部分碱基都能够与另一条核酸链中的碱基配对,其允许存在错配或缺口(例如,一个或数个核苷酸的错配或缺口)。通常,在允许核酸杂交、退火或扩增的条件下,“互补”(例如实质上互补或完全互补)的两条核酸序列将选择性地/特异性地发生杂交或退火,并形成双链体。
10.如本文中所使用的,术语“dna聚合酶”是指,能够以一条核酸链(例如dna链或rna链)为模板合成另一条核酸链(dna链)的酶。在本技术中,dna聚合酶可以是依赖于dna的dna
聚合酶(即,能够以dna链为模板合成互补的dna链的酶),也可以是依赖于rna的dna聚合酶(即,能够以rna链为模板合成互补的dna链的酶)。在某些实施方案中,本技术所使用的dna聚合酶为依赖于rna的dna聚合酶,例如逆转录酶。
11.如本文中所使用的,术语“逆转录酶(rt)”是指能够以rna链为模板合成互补的dna链的酶。本技术的逆转录酶包括但不限于,来自逆转录病毒或其它病毒或细菌的逆转录酶,以及具有逆转录活性的dna聚合酶,如tth dna聚合酶,taq dna聚合酶,tne dna聚合酶,tma dna聚合酶等。来自逆转录病毒的逆转录酶包括但不限于,来自moloney鼠白血病病毒(m-mlv),人免疫缺陷病毒(hiv),禽肉瘤-白血病病毒(aslv),rous肉瘤病毒(rsv),禽成髓细胞增多症病毒(amv),禽成红细胞增多症病毒辅助病毒,禽粒细胞瘤病毒mc29辅助病毒,禽网状内皮组织增生病毒辅助病毒,禽肉瘤病毒ur2辅助病毒,禽肉瘤病毒y73辅助病毒,rous相关病毒和成髓细胞增多相关病毒(mav)的逆转录酶。逆转录酶的具体实例还可参见例如,美国专利申请2002/0198944(其全文通过引用方式并入本文)。另外,本技术的逆转录酶包括但不限于任何形式,例如,天然存在的逆转录酶,天然存在的突变体逆转录酶,工程化突变体逆转录酶或其它变体(例如,保留其逆转录活性的截短变体)。
12.如本文中所使用的,术语“杂交”和“退火”意指,互补的单链核酸分子形成双链核酸的过程。在本技术中,“杂交”和“退火”具有相同的含义,并且可互换使用。通常,完全互补或实质上互补的两条核酸序列可发生杂交或退火。两条核酸序列发生杂交或退火所需要的互补性取决于所使用的杂交条件,特别是温度。
13.如本文中所使用的,“允许核酸杂交的条件”具有本领域技术人员通常理解的含义,并且可通过常规的方法来确定。例如,具有互补序列的两条核酸分子可在合适的杂交条件下发生杂交。此类杂交条件可涉及下列因素:温度,杂交缓冲液的ph值、成分和离子强度等,并且可根据互补的两条核酸分子的长度和gc含量来确定。例如,当互补的两条核酸分子的长度相对较短和/或gc含量相对较低时,可采用低严紧的杂交条件。当互补的两条核酸分子的长度相对较长和/或gc含量相对较高时,可采用高严紧的杂交条件。此类杂交条件是本领域技术人员熟知的,并且可参见例如joseph sambrook,et al.,molecular cloning,a laboratory manual,cold spring harbor laboratory press,cold spring harbor,n.y.(2001);和m.l.m.anderson,nucleic acid hybridization,springer-verlag new york inc.n.y.(1999)。在本技术中,“杂交”和“退火”具有相同的含义,并且可互换使用。相应地,表述“允许核酸杂交的条件”和“允许核酸退火的条件”也具有相同的含义,并且可互换使用。
14.如本文中所使用的,术语“上游”用于描述两条核酸序列(或两个核酸分子)的相对位置关系,并且具有本领域技术人员通常理解的含义。例如,表述“一条核酸序列位于另一条核酸序列的上游”意指,当以5'至3'方向排列时,与后者相比,前者位于更靠前的位置(即,更接近5'端的位置)。如本文中所使用的,术语“下游”具有与“上游”相反的含义。
15.如本文中所使用的,术语“接头”是指,用于连接两个实体元件(例如两个核酸或两个多肽)的化学实体。例如,用于连接两个多肽的接头可以为肽接头(例如,包含多个氨基酸残基的接头);用于连接两个核酸的接头可以为核酸接头(例如,包含多个核苷酸的接头)。
16.如本文中所使用的,术语“引导序列”是指导向rna包含的靶向序列。在某些情况下,引导序列是与靶序列具有足够互补性,从而能够与所述靶序列杂交并引导crispr/cas
复合物与所述靶序列的特异性结合的多核苷酸序列。在某些实施方案中,引导序列与其相应靶序列之间的互补程度为至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、或至少99%。确定两条核酸序列的互补性的方法在本领域普通技术人员的能力范围内。例如,存在公开和可商购的比对算法和程序,诸如但不限于clustalw、matlab中的史密斯-沃特曼算法(smith-waterman)、bowtie、geneious、biopython以及seqman。
17.如本文中所使用的,术语“支架序列”是指导向rna中被cas蛋白识别并结合的序列。在某些情况下,支架序列可包含或者由crispr的重复序列组成。
18.如本文中所使用的,术语“功能性复合物”是指,导向rna(guide rna或grna)与cas蛋白结合所形成的复合体,其能够识别并切割与该导向rna的多核苷酸。
19.如本文中所使用的,术语“靶核酸”或“靶序列”是指导向序列所靶向的多核苷酸,例如与该导向序列具有互补性的序列。导向序列与靶序列的完全互补性不是必需的,只要存在足够互补性以引起二者杂交并且促进crispr/cas复合物的结合即可。靶序列可以包含任何多核苷酸,如dna或rna。在某些情况下,所述靶序列位于细胞的细胞核或细胞质中。在某些情况下,该靶序列可位于真核细胞的一个细胞器例如线粒体或叶绿体内。
20.在本发明中,表述“靶序列”或“靶核酸”对细胞(例如,真核细胞)而言,可以是任何内源或外源的多核苷酸。例如,靶核酸可以是存在于真核细胞的细胞核中的多核苷酸(例如基因组dna),也可以是外源导入细胞中的多核苷酸(例如载体dna)。例如,靶核酸可以是编码基因产物(例如蛋白质)的序列或非编码序列(例如,调节多核苷酸或无用dna)。在某些情况下,靶核酸或靶序列包含原间隔序列临近基序(pam)或与之相邻。对pam的精确序列和长度的要求取决于使用的cas蛋白。通常,pam为crispr簇中临近原间隔序列的2-5个碱基对的序列。本领域技术人员能够鉴定与给定的cas蛋白一起使用的pam序列。
21.如本文中所使用的,术语“载体”是指,可将多聚核苷酸插入其中的一种核酸运载工具。当载体能使插入的多核苷酸编码的蛋白获得表达时,载体称为表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得表达。载体是本领域技术人员公知的,包括但不限于:质粒;噬菌粒;柯斯质粒;纳米脂质体颗粒;外泌体;人工染色体,例如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。可用作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。一种载体可以含有多种控制表达的元件,包括但不限于,启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位点。本领域技术人员将理解,表达载体的设计可取决于诸如待转化的宿主细胞的选择、所希望的表达水平等因素。当载体携带拟整合到宿主基因组上的外源dna以及与外源dna整合相关的非蛋白表达元件时,载体称为供体载体。外源dna包括但不限于完整的基因或基因片段,启动子序列、转录起始序列、增强子序列、选择元件及蛋白编码序列。与外源dna整合相关的非蛋白表达元件包括但不限于拟插入位点的同源序列、工具酶的靶向切割序列等。腺相关病毒载体包括但不限于aav1,aav2,aav3,aav4,aav5,aav6,aav7,aav8,aav9,aav-dj等不同血清型的腺相关病毒以及其他改造的血清型的腺相关病毒。
22.本发明中,所述“内含肽”是指一类可以介导翻译后的蛋白进行剪接的内部蛋白原
件。内含肽位于多肽序列的中间,经过加工后切除,并催化两端的蛋白质外显肽连接为成熟的蛋白质分子。所述“内含肽拆分系统”是一种利用内含肽对较大的蛋白质分子进行高效的拆分和拼接的系统。内含肽可以分开为n端段和c端段。将目的蛋白拆分为n端段和c端段两部分,分别与内含肽的n端段和c端段连接,形成融合蛋白。只有当n端部分和c端部分两融合蛋白相遇时,拆分的前体蛋白中的内含肽发生蛋白剪接去除,目的蛋白的n端段和c端段实现拼接,进而形成有功能的目的蛋白。本发明中适用的内含肽来自但不限于synechocystis sp.pcc6803以及nostoc punctiforme pcc73102(npu)的dnae dna聚合酶。
23.如本文中所使用的,术语“宿主细胞”是指,可用于导入载体的细胞,其包括但不限于,如大肠杆菌或枯草菌等的原核细胞,如酵母细胞或曲霉菌等的真菌细胞,如s2果蝇细胞或sf9等的昆虫细胞,或者如纤维原细胞,cho细胞,cos细胞,nso细胞,hela细胞,bhk细胞,hek 293细胞或人细胞等的动物细胞。
24.在第一方面,本技术提供了一种系统或试剂盒,其包含下述四种组分:
25.(1)第一cas蛋白或含有编码所述第一cas蛋白的核苷酸序列的核酸分子a1,其中,所述第一cas蛋白能够切割或断裂第一双链靶核酸;
26.(2)依赖于模板的第一dna聚合酶或含有编码所述第一dna聚合酶的核苷酸序列的核酸分子b1;
27.(3)第一grna或含有编码所述第一grna的核苷酸序列的核酸分子c1,其中,所述第一grna能够与所述第一cas蛋白结合,并形成第一功能性复合物;所述第一功能性复合物能够将第一双链靶核酸的两条链断裂,形成断裂的靶核酸片段;
28.(4)第一标签引物或含有编码所述第一标签引物的核苷酸序列的核酸分子d1,其中,所述第一标签引物含有第一标签序列和第一靶结合序列,所述第一标签序列位于所述第一靶结合序列的上游或5’端;并且,在允许核酸杂交或退火的条件下,所述第一靶结合序列能够杂交或退火至所述断裂的靶核酸片段的一条核酸链的3’端,形成双链结构,且,所述第一标签序列不与所述靶核酸片段结合,处于游离的单链状态。
29.在某些实施方案中,所述第一cas蛋白选自但不限于cas9蛋白、cas12a蛋白、cas12b蛋白、cas12c蛋白、cas12d蛋白、cas12e蛋白、cas12f蛋白、cas12g蛋白、cas12h蛋白、cas12i蛋白、cas14蛋白、cas13a蛋白、cas1蛋白、cas1b蛋白、cas2蛋白、cas3蛋白、cas4蛋白、cas5蛋白、cas6蛋白、cas7蛋白、cas8蛋白、cas10蛋白、csy1蛋白、csy2蛋白、csy3蛋白、cse1蛋白、cse2蛋白、csc1蛋白、csc2蛋白、csa5蛋白、csn2蛋白、csm2蛋白、csm3蛋白、csm4蛋白、csm5蛋白、csm6蛋白、cmr1蛋白、cmr3蛋白、cmr4蛋白、cmr5蛋白、cmr6蛋白、csb1蛋白、csb2蛋白、csb3蛋白、csx17蛋白、csx14蛋白、csx10蛋白、csx16蛋白、csax蛋白、csx3蛋白、csx1蛋白、csx15蛋白、csf1蛋白、csf2蛋白、csf3蛋白、csf4蛋白及其同源物或其修饰形式。
30.在某些实施方案中,所述第一cas蛋白能够断裂第一双链靶核酸,并产生粘末端或平末端。
31.在某些实施方案中,所述第一cas蛋白为cas9蛋白,例如酿脓链球菌(s.pyogenes)的cas9蛋白(spcas9)。
32.在某些实施方案中,所述第一cas蛋白具有seq id no:1示的氨基酸序列。
33.各种cas蛋白的序列和结构是本领域技术人员熟知的。目前,已经在多种物种中报道了多种cas9蛋白及其同源物,包括但不限于酿脓链球菌和嗜热链球菌。基于本发明所公
开的内容,其它适合的cas9蛋白对于本领域技术人员将是显而易见的,例如,chylinski,rhun,and charpentier.the tracrrna and cas9 families of type ii crispr-cas immunity systems.(2013)rna biology 10:5,726-737(其全部内容通过引用并入本文)中公开的cas9蛋白。
34.在一些实施方案中,cas9是来自以下物种的cas9:溃疡棒状杆菌(ncbi refs:nc_015683.1,nc_017317.1);白喉棒状杆菌(ncbi refs:nc_016782.1,nc_016786.1);spiroplasma syrphidicola(ncbi ref:nc_021284.1);中间普雷沃菌(ncbi ref:nc_017861.1);spiroplasma taiwanense(ncbi ref:nc_021846.1);海豚链球菌(ncbi ref:nc_021314.1);belliella baltica(ncbi ref:nc_018010.1);psychrof lexus torq uisi(ncbi ref:nc_018721.1);嗜热链球菌(ncbi ref:yp_820832.1);无害利斯特菌(ncbi ref:np_472073.1);酿脓链球菌(ncbi ref:nc_017053.1)。
35.在某些实施方案中,所述第一dna聚合酶选自但不限于依赖于dna的dna聚合酶和依赖于rna的dna聚合酶。
36.在某些实施方案中,所述第一dna聚合酶为依赖于rna的dna聚合酶。
37.在某些实施方案中,所述第一dna聚合酶为逆转录酶,例如上文列举的逆转录酶,例如莫洛尼氏鼠白血病病毒的逆转录酶。
38.在某些实施方案中,所述第一dna聚合酶具有seq id no:4所示的氨基酸序列。
39.在某些实施方案中,所述第一cas蛋白与所述第一dna聚合酶相连接。
40.在某些实施方案中,所述第一cas蛋白通过接头或者不通过接头与所述第一dna聚合酶共价相连接。
41.在某些实施方案中,所述接头为肽接头,例如柔性肽接头;例如,所述接头具有seq id no:51所示的氨基酸序列。
42.在某些实施方案中,所述第一cas蛋白通过肽接头或者不通过肽接头与所述第一dna聚合酶融合,形成第一融合蛋白。
43.在某些实施方案中,所述第一cas蛋白任选地通过接头连接或融合至所述第一dna聚合酶的n端;或者,所述第一cas蛋白任选地通过接头连接或融合至所述第一dna聚合酶的c端。
44.在某些实施方案中,所述第一融合蛋白具有seq id no:52所示的氨基酸序列。
45.在一些实施方案中,所述接头为肽接头。在一些实施方案中,所述肽接头的长度为5-200个氨基酸,例如5,6,7,8,9,10,15,20,25,30,30-40,40-50,50-60,60-70,70-80,80-90,90-100,100-150或150-200个氨基酸。
46.在某些实施方案中,所述第一融合蛋白或所述第一cas蛋白可以通过内含肽拆分系统拆分为两个部分。易于理解,所述内含肽拆分系统可以在第一融合蛋白或所述第一cas蛋白的任意氨基酸位置拆分。例如,在某些实施方案中,所述内含肽拆分系统在所述的第一cas蛋白的内部进行拆分。因此,在某些实施方案中,所述第一cas蛋白被拆分为n端段和c端段。例如,所述第一cas蛋白的n端段和c端段可以分别与内含肽的n端段和c端段(或者分别与内含肽的c端段和n端段)融合,并且二者在细胞内能够重构成具有活性的第一cas蛋白。在某些实施方案中,所述第一cas蛋白的n端段和c端段在分离的状态下各自不具有活性,但在细胞内能够重构成具有活性的第一cas蛋白。相应地,在某些实施方案中,所述核酸分子
a1可以被拆分为两个部分,其分别包含编码所述第一cas蛋白的n端段和c端段的核苷酸序列。此外,易于理解,在所述第一融合蛋白中,所述第一dna聚合酶可以融合至所述第一cas蛋白的n端段或c端段。在某些实施方案中,所述第一dna聚合酶融合至所述第一cas蛋白的c端段。
47.在某些实施方案中,所述第一grna含有第一引导序列,并且,在允许核酸杂交或退火的条件下,所述第一引导序列能够杂交或退火至第一双链靶核酸的一条核酸链。
48.在某些实施方案中,所述第一引导序列的长度为至少5nt,例如5-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
49.在某些实施方案中,所述第一grna还含有第一支架序列,其能够被所述第一cas蛋白识别并结合,从而形成第一功能性复合物。
50.在某些实施方案中,所述第一支架序列的长度为至少20nt,例如20-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
51.在某些实施方案中,所述第一引导序列位于所述第一支架序列的上游或5’端。
52.在某些实施方案中,所述第一功能性复合物在所述第一引导序列与第一双链靶核酸结合后,能够将第一双链靶核酸的两条链断裂。
53.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第一靶结合序列能够杂交或退火至所述断裂的靶核酸片段的一条核酸链的3’端,并且所述3’端是因所述第一功能性复合物断裂所述第一双链靶核酸而形成的。
54.在某些实施方案中,所述第一靶结合序列的长度为至少5nt,例如5-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
55.在某些实施方案中,所述第一标签序列的长度为至少4nt,例如4-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
56.在某些实施方案中,在所述第一靶结合序列杂交或退火到所述断裂的靶核酸片段的一条核酸链的3’端后,所述第一dna聚合酶能够以第一标签引物为模板,延伸所述核酸链的3’端。在某些实施方案中,所述延伸形成第一悬突。
57.在某些实施方案中,所述第一标签引物为单链脱氧核糖核酸或者单链核糖核酸。
58.在某些实施方案中,所述第一标签引物为单链核糖核酸,并且所述第一dna聚合酶为依赖于rna的dna聚合酶;或者,所述第一标签引物为单链脱氧核糖核酸,并且所述第一dna聚合酶为依赖于dna的dna聚合酶。
59.在某些实施方案中,所述第一引导序列结合的核酸链与所述第一靶结合序列结合的核酸链是不同的。在某些实施方案中,所述第一引导序列结合的核酸链是所述第一靶结合序列结合的核酸链的相对链。
60.在某些实施方案中,所述第一标签引物与所述第一grna相连接。
61.在某些实施方案中,所述第一标签引物通过接头或者不通过接头与所述第一grna共价相连接。
62.在某些实施方案中,所述第一标签引物任选地通过接头连接至所述第一grna的3’端。
63.在某些实施方案中,所述接头为核酸接头(例如核糖核酸接头或脱氧核糖核酸接头)。
64.在某些实施方案中,所述第一标签引物为单链核糖核酸,并且,其通过核糖核酸接头或者不通过核糖核酸接头与所述第一grna的3’端相连接,形成第一pegrna。
65.在某些实施方案中,所述核酸分子a1能够在细胞中表达所述第一cas蛋白。在某些实施方案中,所述核酸分子b1能够在细胞中表达所述第一dna聚合酶。在某些实施方案中,所述核酸分子c1能够在细胞中转录出所述第一grna。在某些实施方案中,所述核酸分子d1能够在细胞中转录出所述第一标签引物。
66.在某些实施方案中,所述核酸分子a1包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子a1为含有编码所述第一cas蛋白的核苷酸序列的表达载体(例如,真核表达载体)。
67.在某些实施方案中,所述核酸分子b1包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子b1为含有编码所述第一dna聚合酶的核苷酸序列的表达载体(例如,真核表达载体)。
68.在某些实施方案中,所述核酸分子c1包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子c1为含有编码所述第一grna的核苷酸序列的表达载体(例如,真核表达载体)。
69.在某些实施方案中,所述核酸分子d1包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子d1为含有编码所述第一标签引物的核苷酸序列的表达载体(例如,真核表达载体)。
70.在某些实施方案中,所述核酸分子a1和核酸分子b1包含于相同或不同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子a1和核酸分子b1在细胞中能够表达分离的所述第一cas蛋白和所述第一dna聚合酶,或者能够表达含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白。
71.在某些实施方案中,所述核酸分子c1和核酸分子d1包含于相同的表达载体(例如,真核表达载体)中;在某些实施方案中,所述核酸分子c1和核酸分子d1在细胞中能够转录出含有所述第一grna和所述第一标签引物的第一pegrna。
72.在某些实施方案中,所述核酸分子a1、b1、c1和d1中的两个、三个或四个包含于相同的表达载体(例如,真核表达载体)中。
73.在某些实施方案中,所述系统或试剂盒包含:
74.(m1-1)含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白,或者,含有编码所述第一融合蛋白的核苷酸序列的核酸分子;或,(m1-2)分离的所述第一cas蛋白和第一dna聚合酶,或者,能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子;和,
75.(m2)含有所述第一grna和第一标签引物的第一pegrna,或者,含有编码所述第一pegrna的核苷酸序列的核酸分子。
76.在某些实施方案中,所述系统或试剂盒还包含:
77.(5)第二grna或含有编码所述第二grna的核苷酸序列的核酸分子c2,其中,所述第二grna能够与第二cas蛋白结合,并形成第二功能性复合物;所述第二功能性复合物能够将第二双链靶核酸的两条链断裂,形成断裂的靶核酸片段。
78.在某些实施方案中,所述第二cas蛋白与所述第一cas蛋白相同或者不同。在某些实施方案中,所述第二cas蛋白与所述第一cas蛋白相同。
79.在某些实施方案中,所述第二grna含有第二引导序列,并且,在允许核酸杂交或退火的条件下,所述第二引导序列能够杂交或退火到第二双链靶核酸的一条核酸链。
80.在某些实施方案中,所述第二功能性复合物在所述第二引导序列与第二双链靶核酸结合后,将第二双链靶核酸的两条链断裂。
81.在某些实施方案中,所述第二引导序列与所述第一引导序列不同。
82.在某些实施方案中,所述第二双链靶核酸与所述第一双链靶核酸相同或者不同。
83.在某些实施方案中,所述第二双链靶核酸与所述第一双链靶核酸是相同的,并且,所述第二功能性复合物与所述第一功能性复合物在不同的位置断裂所述相同的双链靶核酸。
84.在某些实施方案中,所述第二功能性复合物与所述第一功能性复合物断裂相同的双链靶核酸,并且,所述第一引导序列结合的核酸链与所述第二引导序列结合的核酸链是不同的;在某些实施方案中,所述第一引导序列结合的核酸链是所述第二引导序列结合的核酸链的相对链。
85.在某些实施方案中,所述第二引导序列的长度为至少5nt,例如5-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
86.在某些实施方案中,所述第二grna还含有第二支架序列,其能够被所述第二cas蛋白识别并结合,从而形成第二功能性复合物。
87.在某些实施方案中,所述第二支架序列的长度为至少20nt,例如20-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
88.在某些实施方案中,所述第二支架序列与所述第一支架序列相同或者不同;在某些实施方案中,所述第二支架序列与所述第一支架序列相同。
89.在某些实施方案中,所述第二引导序列位于所述第二支架序列的上游或5’端。
90.在某些实施方案中,所述核酸分子c2能够在细胞中转录出所述第二grna。
91.在某些实施方案中,所述核酸分子c2包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子c2为含有编码所述第二grna的核苷酸序列的表达载体(例如,真核表达载体)。
92.在某些实施方案中,所述第二cas蛋白与所述第一cas蛋白不同;并且,所述系统或试剂盒还包含:
93.(6)所述第二cas蛋白或含有编码所述第二cas蛋白的核苷酸序列的核酸分子a2,其中,所述第二cas蛋白能够切割或断裂第二双链靶核酸。
94.在某些实施方案中,所述第二cas蛋白能够断裂第二双链靶核酸,并产生粘末端或平末端。
95.在某些实施方案中,所述第二cas蛋白选自但不限于cas9蛋白、cas12a蛋白、cas12b蛋白、cas12c蛋白、cas12d蛋白、cas12e蛋白、cas12f蛋白、cas12g蛋白、cas12h蛋白、cas12i蛋白、cas14蛋白、cas13a蛋白、cas1蛋白、cas1b蛋白、cas2蛋白、cas3蛋白、cas4蛋白、cas5蛋白、cas6蛋白、cas7蛋白、cas8蛋白、cas10蛋白、csy1蛋白、csy2蛋白、csy3蛋白、cse1蛋白、cse2蛋白、csc1蛋白、csc2蛋白、csa5蛋白、csn2蛋白、csm2蛋白、csm3蛋白、csm4蛋白、csm5蛋白、csm6蛋白、cmr1蛋白、cmr3蛋白、cmr4蛋白、cmr5蛋白、cmr6蛋白、csb1蛋白、csb2蛋白、csb3蛋白、csx17蛋白、csx14蛋白、csx10蛋白、csx16蛋白、csax蛋白、csx3蛋白、
csx1蛋白、csx15蛋白、csf1蛋白、csf2蛋白、csf3蛋白、csf4蛋白及其同源物或其修饰形式。
96.在某些实施方案中,所述第二cas蛋白为cas9蛋白,例如酿脓链球菌(s.pyogenes)的cas9蛋白(spcas9)。
97.在某些实施方案中,所述第二cas蛋白具有seq id no:1所示的氨基酸序列。
98.在某些实施方案中,所述核酸分子a2能够在细胞中表达所述第二cas蛋白。
99.在某些实施方案中,所述核酸分子a2包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子a2为含有编码所述第二cas蛋白的核苷酸序列的表达载体(例如,真核表达载体)。
100.在某些实施方案中,所述系统或试剂盒还包含:
101.(7)第二标签引物或含有编码所述第二标签引物的核苷酸序列的核酸分子d2,其中,所述第二标签引物含有第二标签序列和第二靶结合序列,所述第二标签序列位于所述第二靶结合序列的上游或5’端;并且,在允许核酸杂交或退火的条件下,所述第二靶结合序列能够杂交或退火到所述断裂的靶核酸片段的一条核酸链的3’端,形成双链结构,且,所述第二标签序列不与所述靶核酸片段结合,处于游离的单链状态。
102.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第二靶结合序列能够杂交或退火到所述断裂的靶核酸片段的一条核酸链的3’端,并且所述3’端是因所述第二功能性复合物断裂第二双链靶核酸而形成的。
103.在某些实施方案中,所述第二靶结合序列的长度为至少5nt,例如5-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
104.在某些实施方案中,所述第二靶结合序列与所述第一靶结合序列不同。在某些实施方案中,所述第二靶结合序列结合的核酸链与所述第一靶结合序列结合的核酸链是不同的。在某些实施方案中,所述第二靶结合序列结合的核酸链是所述第一靶结合序列结合的核酸链的相对链。
105.在某些实施方案中,所述第二标签序列的长度为至少4nt,例如4-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
106.在某些实施方案中,所述第二标签序列与所述第一标签序列相同或不同。在某些实施方案中,所述第二标签序列与所述第一标签序列不同。
107.在某些实施方案中,在所述第二靶结合序列杂交或退火到所述断裂的靶核酸片段的一条核酸链的3’端后,第二dna聚合酶能够以第二标签引物为模板,延伸所述核酸链的3’端。在某些实施方案中,所述延伸形成第二悬突。
108.在某些实施方案中,所述第二dna聚合酶与所述第一dna聚合酶相同或者不同。在某些实施方案中,所述第二dna聚合酶与所述第一dna聚合酶相同。
109.在某些实施方案中,所述第二标签引物为单链脱氧核糖核酸或者单链核糖核酸。
110.在某些实施方案中,所述第二标签引物为单链核糖核酸,并且所述第二dna聚合酶为依赖于rna的dna聚合酶;或者,所述第二标签引物为单链脱氧核糖核酸,并且所述第二dna聚合酶为依赖于dna的dna聚合酶。
111.在某些实施方案中,所述第二引导序列结合的核酸链与所述第二靶结合序列结合的核酸链是不同的。在某些实施方案中,所述第二引导序列结合的核酸链是所述第二靶结合序列结合的核酸链的相对链。
112.在某些实施方案中,所述第二引导序列与所述第一靶结合序列结合相同的核酸链,并且,所述第二引导序列的结合位置位于所述第一靶结合序列的结合位置的上游或5’端。
113.在某些实施方案中,所述第一引导序列与所述第二靶结合序列结合相同的核酸链,并且,所述第一引导序列的结合位置位于所述第二靶结合序列的结合位置的上游或5’端。
114.在某些实施方案中,所述第一悬突和第二悬突包含于相同的靶核酸片段上,且彼此位于相对的核酸链上。
115.在某些实施方案中,所述核酸分子d2能够在细胞中转录出所述第二标签引物。
116.在某些实施方案中,所述核酸分子d2包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子d2为含有编码所述第二标签引物的核苷酸序列的表达载体(例如,真核表达载体)。
117.在某些实施方案中,所述第二dna聚合酶与所述第一dna聚合酶不同;并且,所述系统或试剂盒还包含:
118.(8)所述第二dna聚合酶或含有编码所述第二dna聚合酶的核苷酸序列的核酸分子b2。
119.在某些实施方案中,所述第二dna聚合酶选自但不限于依赖于dna的dna聚合酶和依赖于rna的dna聚合酶。
120.在某些实施方案中,所述第二dna聚合酶为依赖于rna的dna聚合酶。
121.在某些实施方案中,所述第二dna聚合酶为逆转录酶,例如上文列举的逆转录酶,例如莫洛尼氏鼠白血病病毒的逆转录酶。
122.在某些实施方案中,所述第二dna聚合酶具有seq id no:4所示的氨基酸序列。
123.在某些实施方案中,所述核酸分子b2能够在细胞中表达所述第二dna聚合酶。
124.在某些实施方案中,所述核酸分子b2包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子b2为含有编码所述第二dna聚合酶的核苷酸序列的表达载体(例如,真核表达载体)。
125.在某些实施方案中,其中,所述第二标签引物与所述第二grna相连接。
126.在某些实施方案中,所述第二标签引物通过接头或者不通过接头与所述第二grna共价相连接。
127.在某些实施方案中,所述第二标签引物任选地通过接头连接至所述第二grna的3’端。
128.在某些实施方案中,所述接头为核酸接头(例如核糖核酸接头或脱氧核糖核酸接头)。
129.在某些实施方案中,所述第二标签引物为单链核糖核酸,并且,其通过核糖核酸接头或者不通过核糖核酸接头与所述第二grna的3’端相连接,形成第二pegrna。
130.在某些实施方案中,所述核酸分子c2和核酸分子d2包含于相同的表达载体(例如,真核表达载体)中;在某些实施方案中,所述核酸分子c2和核酸分子d2在细胞中能够转录出含有所述第二grna和所述第二标签引物的第二pegrna。
131.在某些实施方案中,所述系统或试剂盒包含:含有所述第二grna和所述第二标签
引物的第二pegrna,或者,含有编码所述第二pegrna的核苷酸序列的核酸分子。
132.在某些实施方案中,所述第二cas蛋白与所述第二dna聚合酶是分离的或者相连接的。
133.在某些实施方案中,所述第二cas蛋白通过接头或者不通过接头与所述第二dna聚合酶共价相连接。
134.在某些实施方案中,所述接头为肽接头,例如柔性肽接头;例如,所述接头具有seq id no:51所示的氨基酸序列。
135.在某些实施方案中,所述第二cas蛋白通过肽接头或者不通过肽接头与所述第二dna聚合酶融合,形成第二融合蛋白。
136.在某些实施方案中,所述第二cas蛋白任选地通过接头连接或融合至所述第二dna聚合酶的n端;或者,所述第二cas蛋白任选地通过接头连接或融合至所述第二dna聚合酶的c端。
137.在某些实施方案中,所述第二融合蛋白具有seq id no:52所示的氨基酸序列。
138.在某些实施方案中,所述第二融合蛋白或所述第二cas蛋白可以通过内含肽拆分系统拆分为两个部分。易于理解,所述内含肽拆分系统可以在第二融合蛋白或所述第二cas蛋白的任意氨基酸位置拆分。例如,在某些实施方案中,所述内含肽拆分系统在所述的第二cas蛋白的内部进行拆分。因此,在某些实施方案中,所述第二cas蛋白被拆分为n端段和c端段。例如,所述第二cas蛋白的n端段和c端段可以分别与内含肽的n端段和c端段(或者分别与内含肽的c端段和n端段)融合,并且二者在细胞内能够重构成具有活性的第二cas蛋白。在某些实施方案中,所述第二cas蛋白的n端段和c端段在分离的状态下各自不具有活性,但在细胞内能够重构成具有活性的第二cas蛋白。相应地,在某些实施方案中,所述核酸分子a1可以被拆分为两个部分,其分别包含编码所述第二cas蛋白的n端段和c端段的核苷酸序列。此外,易于理解,在所述第二融合蛋白中,所述第二dna聚合酶可以融合至所述第二cas蛋白的n端段或c端段。在某些实施方案中,所述第二dna聚合酶融合至所述第二cas蛋白的c端段。
139.在某些实施方案中,所述核酸分子a2和核酸分子b2包含于相同或不同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子a2和核酸分子b2在细胞中能够表达分离的所述第二cas蛋白和所述第二dna聚合酶,或者能够表达含有所述第二cas蛋白和所述第二dna聚合酶的第二融合蛋白。
140.在某些实施方案中,所述系统或试剂盒包含,含有所述第二cas蛋白和所述第二dna聚合酶的第二融合蛋白,或者,含有编码所述第二融合蛋白的核苷酸序列的核酸分子。或者,分离的所述第二cas蛋白和第二dna聚合酶,或者,能够表达分离的所述第二cas蛋白和第二dna聚合酶的核酸分子。
141.在某些实施方案中,所述第一和第二cas蛋白是相同的cas蛋白,所述第一和第二dna聚合酶是相同的dna聚合酶;并且,所述系统或试剂盒包含:
142.(m1-1)含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白,或者,含有编码所述第一融合蛋白的核苷酸序列的核酸分子;或,(m1-2)分离的所述第一cas蛋白和第一dna聚合酶,或者,能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子;
143.(m2)含有所述第一grna和第一标签引物的第一pegrna,或者,含有编码所述第一
pegrna的核苷酸序列的核酸分子;
144.(m3)含有所述第二grna和第二标签引物的第二pegrna,或者,含有编码所述第二pegrna的核苷酸序列的核酸分子。
145.在某些实施方案中,所述系统或试剂盒还包含核酸载体。
146.在某些实施方案中,所述核酸载体是双链的。
147.在某些实施方案中,所述核酸载体是环状双链载体。
148.在某些实施方案中,所述核酸载体包含能够与所述第一引导序列杂交或退火的第一引导结合序列(例如,所述第一引导序列的互补序列),和/或,能够与所述第二引导序列杂交或退火的第二引导结合序列(例如,所述第二引导序列的互补序列)。在某些实施方案中,所述核酸载体在所述第一引导结合序列与所述第二引导结合序列之间还包含限制性酶切位点。
149.在某些实施方案中,所述第一引导结合序列与所述第二引导结合序列位于所述核酸载体的相对链上。
150.在某些实施方案中,所述核酸载体还包含所述第一cas蛋白识别的第一pam序列,和/或,所述第二cas蛋白识别的第二pam序列。
151.在某些实施方案中,所述第一功能性复合物能够通过所述第一引导结合序列和所述第一pam序列,结合并断裂所述核酸载体;和/或,所述第二功能性复合物能够通过所述第二引导结合序列和所述第二pam序列,结合并断裂所述核酸载体。
152.在某些实施方案中,所述核酸载体还包含目的基因。
153.在某些实施方案中,所述目的基因位于所述第一引导结合序列与所述第二引导结合序列之间。
154.在某些实施方案中,所述第一功能性复合物和所述第二功能性复合物断裂所述核酸载体,导致产生含有目的基因的核酸片段。
155.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第一标签引物能够通过所述第一靶结合序列与所述核酸片段的一条核酸链的3’端杂交或退火,形成双链结构,并且,所述第一标签引物的所述第一标签序列处于游离状态;在某些实施方案中,所述第一靶结合序列杂交或退火的核酸链是含有所述第一引导结合序列的核酸链的相对链。
156.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第二标签引物能够通过所述第二靶结合序列与所述核酸片段的一条核酸链的3’端杂交或退火,形成双链结构,并且,所述第二标签引物的所述第二标签序列处于游离状态;在某些实施方案中,所述第二靶结合序列杂交或退火的核酸链是含有所述第二引导结合序列的核酸链的相对链。
157.在某些实施方案中,所述第一靶结合序列杂交或退火的核酸链是所述第二靶结合序列杂交或退火的核酸链的相对链。
158.在某些实施方案中,所述核酸载体还包含第一靶序列;其中,在允许核酸杂交或退火的条件下,所述第一标签引物能够通过所述第一靶结合序列与所述第一靶序列杂交或退火,形成双链结构,并且,所述第一标签引物的所述第一标签序列处于游离状态。在某些实施方案中,所述第一靶序列位于所述第一引导结合序列与所述第二引导结合序列之间。在某些实施方案中,所述第一靶序列位于所述第一引导结合序列的相对链。在某些实施方案中,在所述第一功能性复合物断裂所述核酸载体后,含有第一靶序列的核酸链能够以退火
至第一靶序列的第一标签引物为模板进行延伸(在某些实施方案中,形成第一悬突)。在某些实施方案中,所述第一功能性复合物断裂所述核酸载体的位点位于所述第一靶序列的3’末端或者3’部分。在某些实施方案中,所述第一靶序列位于所述含有目的基因的核酸片段的一条核酸链的3’末端。
159.和/或,
160.所述核酸载体还包含第二靶序列;其中,在允许核酸杂交或退火的条件下,所述第二标签引物能够通过所述第二靶结合序列与所述第二靶序列杂交或退火,形成双链结构,并且,所述第二标签引物的所述第二标签序列处于游离状态;在某些实施方案中,所述第二靶序列位于所述第一引导结合序列与所述第二引导结合序列之间。在某些实施方案中,所述第二靶序列位于所述第二引导结合序列的相对链。在某些实施方案中,在所述第二功能性复合物断裂所述核酸载体后,含有第二靶序列的核酸链能够以退火至第二靶序列的第二标签引物为模板进行延伸(在某些实施方案中,形成第二悬突)。在某些实施方案中,所述第二功能性复合物断裂所述核酸载体的位点位于所述第二靶序列的3’末端或者3’部分;在某些实施方案中,所述第二靶序列位于所述含有目的基因的核酸片段的一条核酸链的3’末端。
161.在某些实施方案中,含有第一靶序列的核酸链位于含有第二靶序列的核酸链的相对链。
162.在某些实施方案中,所述核酸载体在所述第一靶序列与所述第二靶序列之间还包含限制性酶切位点。
163.在某些实施方案中,所述核酸载体在所述第一靶序列与所述第二靶序列之间还包含目的基因。
164.在某些实施方案中,所述系统或试剂盒还包含:
165.(9)第三grna或含有编码所述第三grna的核苷酸序列的核酸分子c3,其中,所述第三grna能够与第三cas蛋白结合,并形成第三功能性复合物;所述第三功能性复合物能够将第三双链靶核酸的两条链断裂,形成断裂的核苷酸片段a1和a2。
166.在某些实施方案中,所述第三cas蛋白与所述第一cas蛋白或第二cas蛋白相同或者不同;在某些实施方案中,所述第一、第二和第三cas蛋白是相同的cas蛋白。
167.在某些实施方案中,所述第三grna含有第三引导序列,并且,在允许核酸杂交或退火的条件下,所述第三引导序列能够杂交或退火到第三双链靶核酸的一条核酸链。
168.在某些实施方案中,所述第三功能性复合物在所述第三引导序列与第三双链靶核酸结合后,将第三双链靶核酸的两条链断裂。
169.在某些实施方案中,所述第三引导序列与所述第一引导序列或第二引导序列相同或者不同。在某些实施方案中,所述第一、第二和第三引导序列彼此不同。
170.在某些实施方案中,所述第三双链靶核酸与所述第一双链靶核酸或第二双链靶核酸相同或者不同。在某些实施方案中,所述第二双链靶核酸与所述第一双链靶核酸是相同的,并且,所述第三双链靶核酸与所述第一和第二双链靶核酸是不同的。在某些实施方案中,所述第三双链靶核酸为基因组dna。
171.在某些实施方案中,所述第三引导序列的长度为至少5nt,例如5-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
172.在某些实施方案中,所述第三grna还含有第三支架序列,其能够被所述第三cas蛋白识别并结合,从而形成第三功能性复合物。
173.在某些实施方案中,所述第三支架序列的长度为至少20nt,例如20-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
174.在某些实施方案中,所述第三支架序列与所述第一支架序列或第二支架序列相同或者不同。在某些实施方案中,所述第一、第二和第三支架序列是相同的。
175.在某些实施方案中,所述第三引导序列位于所述第三支架序列的上游或5’端。
176.在某些实施方案中,所述核酸分子c3能够在细胞中转录出所述第三grna。
177.在某些实施方案中,所述核酸分子c3包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子c3为含有编码所述第三grna的核苷酸序列的表达载体(例如,真核表达载体)。
178.在某些实施方案中,所述第三功能性复合物能够将第三双链靶核酸的两条链断裂,形成断裂的核苷酸片段a1和a2。
179.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第一标签序列或其互补序列或所述第一悬突能够与断裂的核苷酸片段a1杂交或退火。在某些实施方案中,所述第一标签序列或其互补序列或所述第一悬突能够在第三功能性复合物断裂第三双链靶核酸所形成的末端处与断裂的核苷酸片段a1杂交或退火。在某些实施方案中,所述第一标签序列的互补序列或所述第一悬突能够杂交或退火到断裂的核苷酸片段a1的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第三功能性复合物断裂所述第三双链靶核酸而形成的。
180.在某些实施方案中,所述第一标签序列的互补序列或所述第一悬突能够杂交或退火到断裂的核苷酸片段a1的一条核酸链的3’部分,且所述核苷酸片段a1的3’部分与所述第三双链靶核酸所形成的断裂末端之间具有第一间隔区域。
181.在某些实施方案中,所述第一间隔区域的长度为1nt-200nt,例如1-10nt,10-20nt,20-30nt,30-40nt,40-50nt,50-100nt或100-200nt。
182.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第二标签序列或其互补序列或所述第二悬突能够与断裂的核苷酸片段a2杂交或退火。在某些实施方案中,所述第二标签序列或其互补序列或所述第二悬突能够在第三功能性复合物断裂第三双链靶核酸所形成的末端处与断裂的核苷酸片段a2杂交或退火。在某些实施方案中,所述第二标签序列的互补序列或所述第二悬突能够杂交或退火到断裂的核苷酸片段a2的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第三功能性复合物断裂所述第三双链靶核酸而形成的。
183.在某些实施方案中,所述第二标签序列的互补序列或所述第二悬突能够杂交或退火到断裂的核苷酸片段a2的一条核酸链的3’部分,且所述核苷酸片段a2的3’部分与所述第三双链靶核酸所形成的断裂末端之间具有第二间隔区域。
184.在某些实施方案中,所述第二间隔区域的长度为1nt-200nt,例如1-10nt,10-20nt,20-30nt,30-40nt,40-50nt,50-100nt或100-200nt。
185.在某些实施方案中,所述第三cas蛋白与所述第一cas蛋白或第二cas蛋白不同;并且,所述系统或试剂盒还包含:
186.(10)所述第三cas蛋白或含有编码所述第三cas蛋白的核苷酸序列的核酸分子a3,其中,所述第三cas蛋白能够切割或断裂第三双链靶核酸。
187.在某些实施方案中,所述第三cas蛋白选自但不限于cas9蛋白、cas12a蛋白、cas12b蛋白、cas12c蛋白、cas12d蛋白、cas12e蛋白、cas12f蛋白、cas12g蛋白、cas12h蛋白、cas12i蛋白、cas14蛋白、cas13a蛋白、cas1蛋白、cas1b蛋白、cas2蛋白、cas3蛋白、cas4蛋白、cas5蛋白、cas6蛋白、cas7蛋白、cas8蛋白、cas10蛋白、csy1蛋白、csy2蛋白、csy3蛋白、cse1蛋白、cse2蛋白、csc1蛋白、csc2蛋白、csa5蛋白、csn2蛋白、csm2蛋白、csm3蛋白、csm4蛋白、csm5蛋白、csm6蛋白、cmr1蛋白、cmr3蛋白、cmr4蛋白、cmr5蛋白、cmr6蛋白、csb1蛋白、csb2蛋白、csb3蛋白、csx17蛋白、csx14蛋白、csx10蛋白、csx16蛋白、csax蛋白、csx3蛋白、csx1蛋白、csx15蛋白、csf1蛋白、csf2蛋白、csf3蛋白、csf4蛋白及其同源物或其修饰形式。
188.在某些实施方案中,所述第三cas蛋白能够断裂第三双链靶核酸,并产生粘末端或平末端。
189.在某些实施方案中,所述第三cas蛋白为cas9蛋白,例如酿脓链球菌(s.pyogenes)的cas9蛋白(spcas9)。
190.在某些实施方案中,所述第三cas蛋白具有seq id no:1所示的氨基酸序列。
191.在某些实施方案中,所述核酸分子a3能够在细胞中表达所述第三cas蛋白。
192.在某些实施方案中,所述核酸分子a3包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子a3为含有编码所述第三cas蛋白的核苷酸序列的表达载体(例如,真核表达载体)。
193.在某些实施方案中,所述第一、第二和第三cas蛋白是相同的cas蛋白,所述第一和第二dna聚合酶是相同的dna聚合酶;并且,所述系统或试剂盒包含:
194.(m1-1)含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白,或者,含有编码所述第一融合蛋白的核苷酸序列的核酸分子;或,(m1-2)分离的所述第一cas蛋白和第一dna聚合酶,或者,能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子;
195.(m2)含有所述第一grna和第一标签引物的第一pegrna,或者,含有编码所述第一pegrna的核苷酸序列的核酸分子;
196.(m3)含有所述第二grna和第二标签引物的第二pegrna,或者,含有编码所述第二pegrna的核苷酸序列的核酸分子;
197.(m4)所述第三grna或含有编码所述第三grna的核苷酸序列的核酸分子。
198.在某些实施方案中,所述系统或试剂盒还包含:如前述中所定义的核酸载体。
199.在某些实施方案中,所述系统或试剂盒还包含:
200.(11)第三标签引物或含有编码所述第三标签引物的核苷酸序列的核酸分子d3,其中,所述第三标签引物含有第三标签序列和第三靶结合序列,所述第三标签序列位于所述第三靶结合序列的上游或5’端;并且,在允许核酸杂交或退火的条件下,所述第三靶结合序列能够杂交或退火到所述断裂的核苷酸片段a1或a2的一条核酸链的3’端,形成双链结构,且,所述第三标签序列不与所述核苷酸片段a1或a2结合,处于游离的单链状态。
201.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第三靶结合序列能够杂交或退火到所述断裂的核苷酸片段a1或a2的一条核酸链的3’端,并且所述3’端是因所述第三功能性复合物断裂第三双链靶核酸而形成的。
202.在某些实施方案中,所述第三靶结合序列结合的核酸链与所述第三引导序列结合的核酸链是不同的;在某些实施方案中,所述第三靶结合序列结合的核酸链是所述第三引导序列结合的核酸链的相对链。
203.在某些实施方案中,所述第三靶结合序列的长度为至少5nt,例如5-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
204.在某些实施方案中,所述第三靶结合序列与所述第一或第二靶结合序列不同。
205.在某些实施方案中,在所述第三靶结合序列杂交或退火到所述断裂的核苷酸片段a1或a2的一条核酸链的3’端后,第三dna聚合酶能够以第三标签引物为模板,延伸所述核酸链的3’端;在某些实施方案中,所述延伸形成第三悬突。
206.在某些实施方案中,所述第三标签序列的长度为至少4nt,例如4-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
207.在某些实施方案中,所述第三标签序列与所述第一或第二标签序列相同或不同。在某些实施方案中,所述第三标签序列与所述第一或第二标签序列不同。
208.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第三标签序列的互补序列或所述第三悬突能够与含有第一悬突或者第二悬突的核酸链杂交或退火;在某些实施方案中,所述第三标签序列的互补序列或所述第三悬突与所述第一悬突或者第二悬突或其上游核苷酸序列杂交或退火。
209.在某些实施方案中,所述第三dna聚合酶与所述第一或第二dna聚合酶相同或者不同;在某些实施方案中,所述第一、第二和第三dna聚合酶是相同的dna聚合酶。
210.在某些实施方案中,所述第三标签引物为单链脱氧核糖核酸或者单链核糖核酸。
211.在某些实施方案中,所述第三标签引物为单链核糖核酸,并且所述第三dna聚合酶为依赖于rna的dna聚合酶;或者,所述第三标签引物为单链脱氧核糖核酸,并且所述第三dna聚合酶为依赖于dna的dna聚合酶。
212.在某些实施方案中,所述核酸分子d3能够在细胞中转录出所述第三标签引物。
213.在某些实施方案中,所述核酸分子d3包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子d3为含有编码所述第三标签引物的核苷酸序列的表达载体(例如,真核表达载体)。
214.在某些实施方案中,所述第三dna聚合酶与所述第一或第二dna聚合酶不同;并且,所述系统或试剂盒还包含:
215.(12)所述第三dna聚合酶或含有编码所述第三dna聚合酶的核苷酸序列的核酸分子b3。
216.在某些实施方案中,所述第三dna聚合酶选自但不限于依赖于dna的dna聚合酶和依赖于rna的dna聚合酶。
217.在某些实施方案中,所述第三dna聚合酶为依赖于rna的dna聚合酶。
218.在某些实施方案中,所述第三dna聚合酶为逆转录酶,例如上文列举的逆转录酶,例如莫洛尼氏鼠白血病病毒的逆转录酶。
219.在某些实施方案中,所述第三dna聚合酶具有seq id no:4所示的氨基酸序列。
220.在某些实施方案中,所述核酸分子b3能够在细胞中表达所述第三dna聚合酶。
221.在某些实施方案中,所述核酸分子b3包含于表达载体(例如,真核表达载体)中,或
者,所述核酸分子b3为含有编码所述第三dna聚合酶的核苷酸序列的表达载体(例如,真核表达载体)。
222.在某些实施方案中,所述第三标签引物与所述第三grna相连接。
223.在某些实施方案中,所述第三标签引物通过接头或者不通过接头与所述第三grna共价相连接。
224.在某些实施方案中,所述第三标签引物任选地通过接头连接至所述第三grna的3’端。
225.在某些实施方案中,所述接头为核酸接头(例如核糖核酸接头或脱氧核糖核酸接头)。
226.在某些实施方案中,所述第三标签引物为单链核糖核酸,并且,其通过核糖核酸接头或者不通过核糖核酸接头与所述第三grna的3’端相连接,形成第三pegrna。
227.在某些实施方案中,所述核酸分子c3和核酸分子d3包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c3和核酸分子d3在细胞中能够转录出含有所述第三grna和所述第三标签引物的第三pegrna。
228.在某些实施方案中,所述系统或试剂盒包含:含有所述第三grna和所述第三标签引物的第三pegrna,或者,含有编码所述第三pegrna的核苷酸序列的核酸分子。
229.在某些实施方案中,所述第三cas蛋白与所述第三dna聚合酶是分离的或者相连接的。
230.在某些实施方案中,所述第三cas蛋白通过接头或者不通过接头与所述第三dna聚合酶共价相连接。
231.在某些实施方案中,所述接头为肽接头,例如柔性肽接头;例如,所述接头具有seq id no:51所示的氨基酸序列。
232.在某些实施方案中,所述第三cas蛋白通过肽接头或者不通过肽接头与所述第三dna聚合酶融合,形成第三融合蛋白。
233.在某些实施方案中,所述第三cas蛋白任选地通过接头连接或融合至所述第三dna聚合酶的n端;或者,所述第三cas蛋白任选地通过接头连接或融合至所述第三dna聚合酶的c端。
234.在某些实施方案中,所述第三融合蛋白具有seq id no:52所示的氨基酸序列。
235.在某些实施方案中,所述第三融合蛋白或所述第三cas蛋白可以通过内含肽拆分系统拆分为两个部分。易于理解,所述内含肽拆分系统可以在第三融合蛋白或所述第三cas蛋白的任意氨基酸位置拆分。例如,在某些实施方案中,所述内含肽拆分系统在所述的第三cas蛋白的内部进行拆分。因此,在某些实施方案中,所述第三cas蛋白被拆分为n端段和c端段。例如,所述第三cas蛋白的n端段和c端段可以分别与内含肽的n端段和c端段(或者分别与内含肽的c端段和n端段)融合,并且二者在细胞内能够重构成具有活性的第三cas蛋白。在某些实施方案中,所述第三cas蛋白的n端段和c端段在分离的状态下各自不具有活性,但在细胞内能够重构成具有活性的第三cas蛋白。相应地,在某些实施方案中,所述核酸分子a1可以被拆分为两个部分,其分别包含编码所述第三cas蛋白的n端段和c端段的核苷酸序列。此外,易于理解,在所述第三融合蛋白中,所述第三dna聚合酶可以融合至所述第三cas蛋白的n端段或c端段。在某些实施方案中,所述第三dna聚合酶融合至所述第三cas蛋白的c
端段。
236.在某些实施方案中,所述核酸分子a3和核酸分子b3包含于相同或不同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子a3和核酸分子b3在细胞中能够表达分离的所述第三cas蛋白和所述第三dna聚合酶,或者能够表达含有所述第三cas蛋白和所述第三dna聚合酶的第三融合蛋白。
237.在某些实施方案中,所述系统或试剂盒包含,含有所述第三cas蛋白和所述第三dna聚合酶的第三融合蛋白,或者,含有编码所述第三融合蛋白的核苷酸序列的核酸分子。或者,分离的所述第三cas蛋白和第三dna聚合酶,或者,能够表达分离的所述第三cas蛋白和第三dna聚合酶的核酸分子。
238.在某些实施方案中,所述第一、第二和第三cas蛋白是相同的cas蛋白,所述第一、第二和第三dna聚合酶是相同的dna聚合酶;并且,所述系统或试剂盒包含:
239.(m1-1)含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白,或者,含有编码所述第一融合蛋白的核苷酸序列的核酸分子;或,(m1-2)分离的所述第一cas蛋白和第一dna聚合酶,或者,能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子;
240.(m2)含有所述第一grna和第一标签引物的第一pegrna,或者,含有编码所述第一pegrna的核苷酸序列的核酸分子;
241.(m3)含有所述第二grna和第二标签引物的第二pegrna,或者,含有编码所述第二pegrna的核苷酸序列的核酸分子;
242.(m4)含有所述第三grna和第三标签引物的第三pegrna,或者,含有编码所述第三pegrna的核苷酸序列的核酸分子。
243.在某些实施方案中,所述系统或试剂盒还包含:如前述中所定义的核酸载体。
244.在某些实施方案中,所述系统或试剂盒还包含:
245.(13)第四grna或含有编码所述第四grna的核苷酸序列的核酸分子c4,其中,所述第四grna能够与第四cas蛋白结合,并形成第四功能性复合物;所述第四功能性复合物能够将第四双链靶核酸的两条链断裂,形成断裂的靶核酸片段b1和b2。
246.在某些实施方案中,所述第四cas蛋白与所述第一、第二或第三cas蛋白相同或者不同;在某些实施方案中,所述第一、第二、第三和第四cas蛋白是相同的cas蛋白。
247.在某些实施方案中,所述第四grna含有第四引导序列,并且,在允许核酸杂交或退火的条件下,所述第四引导序列能够杂交或退火到第四双链靶核酸的一条核酸链。
248.在某些实施方案中,所述第四功能性复合物在所述第四引导序列与第四双链靶核酸结合后,将第四双链靶核酸的两条链断裂。
249.在某些实施方案中,所述第四引导序列与所述第一、第二或第三引导序列相同或者不同。在某些实施方案中,所述第一、第二、第三和第四引导序列彼此不同。
250.在某些实施方案中,所述第四双链靶核酸与所述第一、第二或第三双链靶核酸相同或者不同。在某些实施方案中,所述第二双链靶核酸与所述第一双链靶核酸是相同的,并且,所述第四双链靶核酸与所述第三双链靶核酸是相同的,但与第一或第二双链靶核酸不同。在某些实施方案中,所述第四功能性复合物与所述第三功能性复合物在不同的位置断裂所述相同的双链靶核酸。
251.在某些实施方案中,所述第四功能性复合物与所述第三功能性复合物断裂相同的
双链靶核酸,并且,所述第四引导序列结合的核酸链与所述第三引导序列结合的核酸链是不同的。在某些实施方案中,所述第四引导序列结合的核酸链是所述第三引导序列结合的核酸链的相对链。
252.在某些实施方案中,所述第四双链靶核酸为基因组dna。
253.在某些实施方案中,所述第四引导序列的长度为至少5nt,例如5-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
254.在某些实施方案中,所述第四grna还含有第四支架序列,其能够被所述第四cas蛋白识别并结合,从而形成第四功能性复合物。
255.在某些实施方案中,所述第四支架序列的长度为至少20nt,例如20-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
256.在某些实施方案中,所述第四支架序列与所述第一、第二或第三支架序列相同或者不同。在某些实施方案中,所述第一、第二、第三和第四支架序列是相同的。
257.在某些实施方案中,所述第四引导序列位于所述第四支架序列的上游或5’端。
258.在某些实施方案中,所述核酸分子c4能够在细胞中转录出所述第四grna。
259.在某些实施方案中,所述核酸分子c4包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子c4为含有编码所述第四grna的核苷酸序列的表达载体(例如,真核表达载体)。
260.在某些实施方案中,所述第四双链靶核酸与所述第三双链靶核酸是相同的,并且,所述第三和第四功能性复合物在不同的位置断裂所述相同的双链靶核酸,形成断裂的核苷酸片段a1、a2和a3;其中,在断裂之前,在所述相同的双链靶核酸中,核苷酸片段a1、a2和a3依次排列(即,核苷酸片段a1通过核苷酸片段a2与核苷酸片段a3相连);在某些实施方案中,所述第三和第四功能性复合物分别导致核苷酸片段a1和a2的分离以及核苷酸片段a2和a3的分离。
261.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第一标签序列或其互补序列或所述第一悬突能够与断裂的核苷酸片段a1杂交或退火;在某些实施方案中,所述第一标签序列或其互补序列或所述第一悬突能够在第三功能性复合物断裂第三双链靶核酸所形成的末端处与断裂的核苷酸片段a1杂交或退火。在某些实施方案中,所述第一标签序列的互补序列或所述第一悬突能够杂交或退火到断裂的核苷酸片段a1的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第三功能性复合物断裂所述第三双链靶核酸而形成的。
262.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第二标签序列或其互补序列或所述第二悬突能够与断裂的核苷酸片段a3杂交或退火。在某些实施方案中,所述第二标签序列或其互补序列或所述第二悬突能够在第四功能性复合物断裂第三双链靶核酸所形成的末端处与断裂的核苷酸片段a3杂交或退火。在某些实施方案中,所述第二标签序列的互补序列或所述第二悬突能够杂交或退火到断裂的核苷酸片段a3的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第四功能性复合物断裂所述第三双链靶核酸而形成的。
263.在某些实施方案中,所述第四cas蛋白与所述第一、第二或第三cas蛋白不同;并且,所述系统或试剂盒还包含:
264.(14)所述第四cas蛋白或含有编码所述第四cas蛋白的核苷酸序列的核酸分子a4,其中,所述第四cas蛋白能够切割或断裂第四双链靶核酸。
265.在某些实施方案中,所述第四cas蛋白选自但不限于cas9蛋白、cas12a蛋白、cas12b蛋白、cas12c蛋白、cas12d蛋白、cas12e蛋白、cas12f蛋白、cas12g蛋白、cas12h蛋白、cas12i蛋白、cas14蛋白、cas13a蛋白、cas1蛋白、cas1b蛋白、cas2蛋白、cas3蛋白、cas4蛋白、cas5蛋白、cas6蛋白、cas7蛋白、cas8蛋白、cas10蛋白、csy1蛋白、csy2蛋白、csy3蛋白、cse1蛋白、cse2蛋白、csc1蛋白、csc2蛋白、csa5蛋白、csn2蛋白、csm2蛋白、csm3蛋白、csm4蛋白、csm5蛋白、csm6蛋白、cmr1蛋白、cmr3蛋白、cmr4蛋白、cmr5蛋白、cmr6蛋白、csb1蛋白、csb2蛋白、csb3蛋白、csx17蛋白、csx14蛋白、csx10蛋白、csx16蛋白、csax蛋白、csx3蛋白、csx1蛋白、csx15蛋白、csf1蛋白、csf2蛋白、csf3蛋白、csf4蛋白及其同源物或其修饰形式。
266.在某些实施方案中,所述第四cas蛋白能够断裂第四双链靶核酸,并产生粘末端或平末端。
267.在某些实施方案中,所述第四cas蛋白为cas9蛋白,例如酿脓链球菌(s.pyogenes)的cas9蛋白(spcas9)。
268.在某些实施方案中,所述第四cas蛋白具有seq id no:1所示的氨基酸序列。
269.在某些实施方案中,所述核酸分子a4能够在细胞中表达所述第四cas蛋白。
270.在某些实施方案中,所述核酸分子a4包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子a4为含有编码所述第四cas蛋白的核苷酸序列的表达载体(例如,真核表达载体)。
271.在某些实施方案中,所述第一、第二、第三和第四cas蛋白是相同的cas蛋白,所述第一和第二dna聚合酶(以及任选的第三dna聚合酶)是相同的dna聚合酶;并且,所述系统或试剂盒包含:
272.(m1-1)含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白,或者,含有编码所述第一融合蛋白的核苷酸序列的核酸分子;或,(m1-2)分离的所述第一cas蛋白和第一dna聚合酶,或者,能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子;
273.(m2)含有所述第一grna和第一标签引物的第一pegrna,或者,含有编码所述第一pegrna的核苷酸序列的核酸分子;
274.(m3)含有所述第二grna和第二标签引物的第二pegrna,或者,含有编码所述第二pegrna的核苷酸序列的核酸分子;
275.(m4)所述第三grna或含有编码所述第三grna的核苷酸序列的核酸分子;或者,含有所述第三grna和第三标签引物的第三pegrna,或,含有编码所述第三pegrna的核苷酸序列的核酸分子;
276.(m5)所述第四grna或含有编码所述第四grna的核苷酸序列的核酸分子。
277.在某些实施方案中,所述系统或试剂盒还包含:如前述中所定义的核酸载体。
278.在某些实施方案中,所述系统或试剂盒还包含:
279.(15)第四标签引物或含有编码所述第四标签引物的核苷酸序列的核酸分子d4,其中,所述第四标签引物含有第四标签序列和第四靶结合序列,所述第四标签序列位于所述第四靶结合序列的上游或5’端;并且,在允许核酸杂交或退火的条件下,所述第四靶结合序列能够杂交或退火到所述断裂的靶核酸片段b1或b2的一条核酸链的3’端,形成双链结构,
且,所述第四标签序列不与所述靶核酸片段b1或b2结合,处于游离的单链状态。
280.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第四靶结合序列能够杂交或退火到所述断裂的靶核酸片段b1或b2的一条核酸链的3’端,并且所述3’端是因所述第四功能性复合物断裂第四双链靶核酸而形成的。
281.在某些实施方案中,所述第四靶结合序列结合的核酸链与所述第四引导序列结合的核酸链是不同的。在某些实施方案中,所述第四靶结合序列结合的核酸链是所述第四引导序列结合的核酸链的相对链。
282.在某些实施方案中,所述第四靶结合序列的长度为至少5nt,例如5-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
283.在某些实施方案中,所述第四靶结合序列与所述第一、第二或第三靶结合序列不同。在某些实施方案中,所述第四靶结合序列结合的核酸链与所述第三靶结合序列结合的核酸链是不同的。在某些实施方案中,所述第四靶结合序列结合的核酸链是所述第三靶结合序列结合的核酸链的相对链。
284.在某些实施方案中,在所述第四靶结合序列杂交或退火到所述断裂的靶核酸片段b1或b2的一条核酸链的3’端后,第四dna聚合酶能够以第四标签引物为模板,延伸所述核酸链的3’端。在某些实施方案中,所述延伸形成第四悬突。
285.在某些实施方案中,所述第四标签序列的长度为至少4nt,例如4-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
286.在某些实施方案中,所述第四标签序列与所述第一、第二或第三标签序列相同或不同。在某些实施方案中,所述第四标签序列与所述第一、第二或第三标签序列不同。
287.在某些实施方案中,所述第四dna聚合酶与所述第一、第二或第三dna聚合酶相同或者不同。在某些实施方案中,所述第一、第二、第三和第四dna聚合酶是相同的dna聚合酶。
288.在某些实施方案中,所述第四标签引物为单链脱氧核糖核酸或者单链核糖核酸。
289.在某些实施方案中,所述第四标签引物为单链核糖核酸,并且所述第四dna聚合酶为依赖于rna的dna聚合酶。或者,所述第四标签引物为单链脱氧核糖核酸,并且所述第四dna聚合酶为依赖于dna的dna聚合酶。
290.在某些实施方案中,所述第四引导序列与所述第三靶结合序列结合相同的核酸链,并且,所述第三靶结合序列的结合位置位于所述第四引导序列的结合位置的上游或5’端。
291.在某些实施方案中,所述第三引导序列与所述第四靶结合序列结合相同的核酸链,并且,所述第四靶结合序列的结合位置位于所述第三引导序列的结合位置的上游或5’端。
292.在某些实施方案中,所述第三悬突和第四悬突包含于不同的靶核酸片段上,且在某些实施方案中,彼此位于相对的核酸链上。
293.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第四标签序列的互补序列或所述第四悬突能够与含有第一悬突或者第二悬突的核酸链杂交或退火。在某些实施方案中,所述第四标签序列的互补序列或所述第四悬突能够与所述第一悬突或者第二悬突或其上游核苷酸序列杂交或退火。
294.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第三标签序列的互补
序列或所述第三悬突能够与所述第一悬突或其上游核苷酸序列杂交或退火,并且,所述第四标签序列的互补序列或所述第四悬突能够与所述第二悬突或其上游核苷酸序列杂交或退火;或者,在允许核酸杂交或退火的条件下,所述第三标签序列的互补序列或所述第三悬突能够与所述第二悬突或其上游核苷酸序列杂交或退火,并且,所述第四标签序列的互补序列或所述第四悬突能够与所述第一悬突或其上游核苷酸序列杂交或退火。
295.在某些实施方案中,所述核酸分子d4能够在细胞中转录出所述第四标签引物。
296.在某些实施方案中,所述核酸分子d4包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子d4为含有编码所述第四标签引物的核苷酸序列的表达载体(例如,真核表达载体)。
297.在某些实施方案中,所述第四dna聚合酶与所述第一、第二或第三dna聚合酶不同;并且,所述系统或试剂盒还包含:
298.(16)所述第四dna聚合酶或含有编码所述第四dna聚合酶的核苷酸序列的核酸分子b4。
299.在某些实施方案中,所述第四dna聚合酶选自但不限于依赖于dna的dna聚合酶和依赖于rna的dna聚合酶。
300.在某些实施方案中,所述第四dna聚合酶为依赖于rna的dna聚合酶。
301.在某些实施方案中,所述第四dna聚合酶为逆转录酶,例如上文列举的逆转录酶,例如莫洛尼氏鼠白血病病毒的逆转录酶。
302.在某些实施方案中,所述第四dna聚合酶具有seq id no:4所示的氨基酸序列。
303.在某些实施方案中,所述核酸分子b4能够在细胞中表达所述第四dna聚合酶;
304.在某些实施方案中,所述核酸分子b4包含于表达载体(例如,真核表达载体)中,或者,所述核酸分子b4为含有编码所述第四dna聚合酶的核苷酸序列的表达载体(例如,真核表达载体)。
305.在某些实施方案中,所述第四标签引物与所述第四grna相连接。
306.在某些实施方案中,所述第四标签引物通过接头或者不通过接头与所述第四grna共价相连接。
307.在某些实施方案中,所述第四标签引物任选地通过接头连接至所述第四grna的3’端。
308.在某些实施方案中,所述接头为核酸接头(例如核糖核酸接头或脱氧核糖核酸接头)。
309.在某些实施方案中,所述第四标签引物为单链核糖核酸,并且,其通过核糖核酸接头或者不通过核糖核酸接头与所述第四grna的3’端相连接,形成第四pegrna。
310.在某些实施方案中,所述核酸分子c4和核酸分子d4包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c4和核酸分子d4在细胞中能够转录出含有所述第四grna和所述第四标签引物的第四pegrna。
311.在某些实施方案中,所述系统或试剂盒包含:含有所述第四grna和所述第四标签引物的第四pegrna,或者,含有编码所述第四pegrna的核苷酸序列的核酸分子。
312.在某些实施方案中,所述第四cas蛋白与所述第四dna聚合酶分离的或者相连接的。
313.在某些实施方案中,所述第四cas蛋白通过接头或者不通过接头与所述第四dna聚合酶共价相连接。
314.在某些实施方案中,所述接头为肽接头,例如柔性肽接头;例如,所述接头具有seq id no:51所示的氨基酸序列。
315.在某些实施方案中,所述第四cas蛋白通过肽接头或者不通过肽接头与所述第四dna聚合酶融合,形成第四融合蛋白。
316.在某些实施方案中,所述第四cas蛋白任选地通过接头连接或融合至所述第四dna聚合酶的n端;或者,所述第四cas蛋白任选地通过接头连接或融合至所述第四dna聚合酶的c端。
317.在某些实施方案中,所述第四融合蛋白具有seq id no:52所示的氨基酸序列。
318.在某些实施方案中,所述第四融合蛋白或所述第四cas蛋白可以通过内含肽拆分系统拆分为两个部分。易于理解,所述内含肽拆分系统可以在第四融合蛋白或所述第四cas蛋白的任意氨基酸位置拆分。例如,在某些实施方案中,所述内含肽拆分系统在所述的第四cas蛋白的内部进行拆分。因此,在某些实施方案中,所述第四cas蛋白被拆分为n端段和c端段。例如,所述第四cas蛋白的n端段和c端段可以分别与内含肽的n端段和c端段(或者分别与内含肽的c端段和n端段)融合,并且二者在细胞内能够重构成具有活性的第四cas蛋白。在某些实施方案中,所述第四cas蛋白的n端段和c端段在分离的状态下各自不具有活性,但在细胞内能够重构成具有活性的第四cas蛋白。相应地,在某些实施方案中,所述核酸分子a1可以被拆分为两个部分,其分别包含编码所述第四cas蛋白的n端段和c端段的核苷酸序列。此外,易于理解,在所述第四融合蛋白中,所述第四dna聚合酶可以融合至所述第四cas蛋白的n端段或c端段。在某些实施方案中,所述第四dna聚合酶融合至所述第四cas蛋白的c端段。
319.在某些实施方案中,所述核酸分子a4和核酸分子b4包含于相同或不同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子a4和核酸分子b4在细胞中能够表达分离的所述第四cas蛋白和所述第四dna聚合酶,或者能够表达含有所述第四cas蛋白和所述第四dna聚合酶的第四融合蛋白。
320.在某些实施方案中,所述系统或试剂盒包含,含有所述第四cas蛋白和所述第四dna聚合酶的第四融合蛋白,或者,含有编码所述第四融合蛋白的核苷酸序列的核酸分子。或者,分离的所述第四cas蛋白和第四dna聚合酶,或者,能够表达分离的所述第四cas蛋白和第四dna聚合酶的核酸分子。
321.在某些实施方案中,所述第一、第二、第三和第四cas蛋白是相同的cas蛋白,所述第一、第二、第三和第四dna聚合酶是相同的dna聚合酶;并且,所述系统或试剂盒包含:
322.(m1-1)含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白,或者,含有编码所述第一融合蛋白的核苷酸序列的核酸分子;或,(m1-2)分离的所述第一cas蛋白和第一dna聚合酶,或者,能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子;
323.(m2)含有所述第一grna和第一标签引物的第一pegrna,或者,含有编码所述第一pegrna的核苷酸序列的核酸分子;
324.(m3)含有所述第二grna和第二标签引物的第二pegrna,或者,含有编码所述第二pegrna的核苷酸序列的核酸分子;
325.(m4)含有所述第三grna和第三标签引物的第三pegrna,或者,含有编码所述第三pegrna的核苷酸序列的核酸分子;
326.(m5)含有所述第四grna和第四标签引物的第四pegrna,或者,含有编码所述第四pegrna的核苷酸序列的核酸分子。
327.在某些实施方案中,所述系统或试剂盒还包含:如前述中所定义的核酸载体。
328.在某些实施方案中,所述第四双链靶核酸与所述第三双链靶核酸是相同的,并且,所述第三和第四功能性复合物在不同的位置断裂所述相同的双链靶核酸,形成断裂的核苷酸片段a1、a2和a3。其中,在所述相同的双链靶核酸中,核苷酸片段a1通过核苷酸片段a2与核苷酸片段a3相连。
329.在某些实施方案中,所述第三和第四功能性复合物分别导致核苷酸片段a1和a2的分离以及核苷酸片段a2和a3的分离。
330.在某些实施方案中,所述核苷酸片段a1具有以第三标签引物为模板延伸形成的第三悬突;并且,所述核苷酸片段a3具有以第四标签引物为模板延伸形成的第四悬突。
331.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第一标签序列或其互补序列或所述第一悬突能够与断裂的核苷酸片段a1杂交或退火。在某些实施方案中,所述第一标签序列或其互补序列或所述第一悬突能够在第三功能性复合物断裂第三双链靶核酸所形成的末端处与断裂的核苷酸片段a1杂交或退火。在某些实施方案中,所述第一标签序列的互补序列或所述第一悬突能够杂交或退火到断裂的核苷酸片段a1的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第三功能性复合物断裂所述第三双链靶核酸而形成的。在某些实施方案中,所述第一悬突能够杂交或退火到断裂的核苷酸片段a1的第三悬突或其上游核苷酸序列。
332.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第三标签序列的互补序列或所述第三悬突能够与所述第一悬突或其上游核苷酸序列杂交或退火。
333.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第二标签序列或其互补序列或所述第二悬突能够与断裂的核苷酸片段a3杂交或退火。在某些实施方案中,所述第二标签序列或其互补序列或所述第二悬突能够在第四功能性复合物断裂第三双链靶核酸所形成的末端处与断裂的核苷酸片段a3杂交或退火。在某些实施方案中,所述第二标签序列的互补序列或所述第二悬突能够杂交或退火到断裂的核苷酸片段a3的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第四功能性复合物断裂所述第三双链靶核酸而形成的。在某些实施方案中,所述第二悬突能够杂交或退火到断裂的核苷酸片段a3的第四悬突或其上游核苷酸序列。
334.在某些实施方案中,在允许核酸杂交或退火的条件下,所述第四标签序列的互补序列或所述第四悬突能够与所述第二悬突或其上游核苷酸序列杂交或退火。
335.在某些实施方案中,所述试剂盒还包含额外的组分。
336.在某些实施方案中,所述额外的组分包括选自下列的一项或多项:
337.(1)一个或多个(例如,2个,3个,4个,5个,10个,15个,20个,或更多个)额外的grna或含有编码所述额外的grna的核苷酸序列的核酸分子,其中,所述额外的grna能够与cas蛋白结合,并形成功能性复合物。在某些实施方案中,所述功能性复合物能够将双链靶核酸的两条链断裂,形成断裂的靶核酸片段。
338.(2)一个或多个(例如,2个,3个,4个,5个,10个,15个,20个,或更多个)额外的cas蛋白或含有编码所述额外的cas蛋白的核苷酸序列的核酸分子。在某些实施方案中,所述cas蛋白能够切割或断裂双链靶核酸。
339.(3)一个或多个(例如,2个,3个,4个,5个,10个,15个,20个,或更多个)额外的标签引物或含有编码所述额外的标签引物的核苷酸序列的核酸分子,其中,所述额外的标签引物含有标签序列和靶结合序列,所述标签序列位于所述靶结合序列的上游或5’端。在某些实施方案中,在允许核酸杂交或退火的条件下,所述靶结合序列能够杂交或退火到所述断裂的靶核酸片段的一条核酸链的3’端,形成双链结构,且,所述标签序列不与所述靶核酸片段结合,处于游离的单链状态。
340.(4)一个或多个(例如,2个,3个,4个,5个,10个,15个,20个,或更多个)额外的dna聚合酶或含有编码所述额外的dna聚合酶的核苷酸序列的核酸分子。在某些实施方案中,所述额外的dna聚合酶选自依赖于dna的dna聚合酶和依赖于rna的dna聚合酶。在某些实施方案中,所述额外的dna聚合酶为依赖于rna的dna聚合酶,例如逆转录酶。
341.在第二方面,本技术提供了一种融合蛋白,其包含cas蛋白与依赖于模板的dna聚合酶,其中,所述cas蛋白能够断裂双链靶核酸。
342.在某些实施方案中,所述cas蛋白能够断裂双链靶核酸,并产生粘末端或平末端。
343.在某些实施方案中,所述cas蛋白选自但不限于cas9蛋白、cas12a蛋白、cas12b蛋白、cas12c蛋白、cas12d蛋白、cas12e蛋白、cas12f蛋白、cas12g蛋白、cas12h蛋白、cas12i蛋白、cas14蛋白、cas13a蛋白、cas1蛋白、cas1b蛋白、cas2蛋白、cas3蛋白、cas4蛋白、cas5蛋白、cas6蛋白、cas7蛋白、cas8蛋白、cas10蛋白、csy1蛋白、csy2蛋白、csy3蛋白、cse1蛋白、cse2蛋白、csc1蛋白、csc2蛋白、csa5蛋白、csn2蛋白、csm2蛋白、csm3蛋白、csm4蛋白、csm5蛋白、csm6蛋白、cmr1蛋白、cmr3蛋白、cmr4蛋白、cmr5蛋白、cmr6蛋白、csb1蛋白、csb2蛋白、csb3蛋白、csx17蛋白、csx14蛋白、csx10蛋白、csx16蛋白、csax蛋白、csx3蛋白、csx1蛋白、csx15蛋白、csf1蛋白、csf2蛋白、csf3蛋白、csf4蛋白及其同源物或其修饰形式。
344.在某些实施方案中,所述cas蛋白为cas9蛋白,例如酿脓链球菌(s.pyogenes)的cas9蛋白(spcas9)。
345.在某些实施方案中,所述cas蛋白具有seq id no:1所示的氨基酸序列。
346.在某些实施方案中,所述dna聚合酶选自但不限于依赖于dna的dna聚合酶和依赖于rna的dna聚合酶。
347.在某些实施方案中,所述dna聚合酶为依赖于rna的dna聚合酶。
348.在某些实施方案中,所述dna聚合酶为逆转录酶,例如上文列举的逆转录酶,例如莫洛尼氏鼠白血病病毒的逆转录酶。
349.在某些实施方案中,所述dna聚合酶具有seq id no:4所示的氨基酸序列。
350.在某些实施方案中,所述cas蛋白通过接头或者不通过接头与所述dna聚合酶共价相连接。
351.在某些实施方案中,所述接头为肽接头,例如柔性肽接头;例如,所述接头具有seq id no:51所示的氨基酸序列。
352.在某些实施方案中,所述cas蛋白任选地通过接头连接或融合至所述dna聚合酶的n端;或者,所述cas蛋白任选地通过接头连接或融合至所述dna聚合酶的c端。
id no:51所示的氨基酸序列。
373.在某些实施方案中,所述第一cas蛋白通过肽接头或者不通过肽接头与所述第一dna聚合酶融合,形成融第一合蛋白。
374.在某些实施方案中,所述第一cas蛋白任选地通过接头连接或融合至所述第一dna聚合酶的n端;或者,所述第一cas蛋白任选地通过接头连接或融合至所述第一dna聚合酶的c端。
375.在某些实施方案中,所述第一融合蛋白具有seq id no:52所示的氨基酸序列。
376.在某些实施方案中,所述复合物还包含第一grna。
377.在某些实施方案中,所述第一grna能够与所述第一cas蛋白结合,并形成第一功能性单元;所述第一功能性单元能够结合双链靶核酸,并将其两条链断裂,形成断裂的靶核酸片段。
378.在某些实施方案中,所述第一grna含有第一引导序列,并且,在允许核酸杂交或退火的条件下,所述第一引导序列能够杂交或退火至双链靶核酸的一条核酸链。
379.在某些实施方案中,所述第一引导序列的长度为至少5nt,例如5-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
380.在某些实施方案中,所述第一grna还含有第一支架序列,其能够被所述第一cas蛋白识别并结合,从而形成第一功能性单元。
381.在某些实施方案中,所述第一支架序列的长度为至少20nt,例如20-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
382.在某些实施方案中,所述第一引导序列位于所述第一支架序列的上游或5’端。
383.在某些实施方案中,所述复合物或第一功能性单元在所述第一引导序列与双链靶核酸结合后,能够将双链靶核酸的两条链断裂,形成断裂的靶核酸片段。
384.在某些实施方案中,所述复合物还包含双链靶核酸,
385.在某些实施方案中,所述双链靶核酸含有所述第一cas蛋白识别的第一pam序列以及能够与所述第一引导序列杂交或退火的第一引导结合序列,由此,所述第一功能性单元通过所述第一引导结合序列和所述第一pam序列,结合所述双链靶核酸。
386.在某些实施方案中,所述复合物还包含与所述双链靶核酸杂交或退火的第一标签引物;其中,所述第一标签引物含有第一靶结合序列,其能够与所述双链靶核酸杂交或退火。
387.在某些实施方案中,所述标签引物含有第一标签序列和第一靶结合序列,所述第一标签序列位于所述第一靶结合序列的上游或5’端;并且,在允许核酸杂交或退火的条件下,所述第一靶结合序列能够杂交或退火至所述双链靶核酸。在某些实施方案中,所述第一靶结合序列能够杂交或退火至所述双链靶核酸被所述第一功能性单元断裂的位置处;在某些实施方案中,所述第一靶结合序列能够杂交或退火至所述断裂的靶核酸片段的一条核酸链的3’端,形成双链结构。在某些实施方案中,所述3’端是因所述第一功能性单元断裂所述双链靶核酸而形成的;在某些实施方案中,所述第一标签序列不与所述靶核酸片段结合,处于游离的单链状态。
388.在某些实施方案中,所述第一靶结合序列的长度为至少5nt,例如5-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
389.在某些实施方案中,所述第一标签序列的长度为至少4nt,例如4-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
390.在某些实施方案中,所述第一标签引物通过所述第一靶结合序列结合至所述断裂的靶核酸片段;在某些实施方案中,所述第一dna聚合酶与所述断裂的靶核酸片段和所述第一标签引物结合。
391.在某些实施方案中,所述第一标签引物为单链脱氧核糖核酸或者单链核糖核酸。
392.在某些实施方案中,所述第一标签引物为单链核糖核酸,并且所述第一dna聚合酶为依赖于rna的dna聚合酶;或者,所述第一标签引物为单链脱氧核糖核酸,并且所述第一dna聚合酶为依赖于dna的dna聚合酶。
393.在某些实施方案中,所述断裂的靶核酸片段被所述第一dna聚合酶以所述第一标签引物为模板延伸,形成第一悬突。
394.在某些实施方案中,所述第一grna结合的核酸链与所述第一标签引物结合的核酸链是不同的。在某些实施方案中,所述第一grna结合的核酸链是所述第一标签引物结合的核酸链的相对链。
395.在某些实施方案中,所述第一标签引物与所述第一grna相连接。
396.在某些实施方案中,所述第一标签引物通过接头或者不通过接头与所述第一grna共价相连接。
397.在某些实施方案中,所述第一标签引物任选地通过接头连接至所述第一grna的3’端。
398.在某些实施方案中,所述接头为核酸接头(例如核糖核酸接头或脱氧核糖核酸接头)。
399.在某些实施方案中,所述第一标签引物为单链核糖核酸,并且,其通过核糖核酸接头或者不通过核糖核酸接头与所述第一grna的3’端相连接,形成第一pegrna。
400.在某些实施方案中,所述复合物还包含第二cas蛋白和第二grna,其中,所述第二cas蛋白具有断裂双链靶核酸的能力,所述第二grna能够与所述第二cas蛋白结合,并形成第二功能性单元;所述第二功能性单元能够结合双链靶核酸,并将其两条链断裂,形成断裂的靶核酸片段。
401.在某些实施方案中,所述第二cas蛋白与所述第一cas蛋白相同或者不同。在某些实施方案中,所述第二cas蛋白与所述第一cas蛋白相同。
402.在某些实施方案中,所述第二cas蛋白能够断裂双链靶核酸,并产生粘末端或平末端。
403.在某些实施方案中,所述第二cas蛋白选自但不限于cas9蛋白、cas12a蛋白、cas12b蛋白、cas12c蛋白、cas12d蛋白、cas12e蛋白、cas12f蛋白、cas12g蛋白、cas12h蛋白、cas12i蛋白、cas14蛋白、cas13a蛋白、cas1蛋白、cas1b蛋白、cas2蛋白、cas3蛋白、cas4蛋白、cas5蛋白、cas6蛋白、cas7蛋白、cas8蛋白、cas10蛋白、csy1蛋白、csy2蛋白、csy3蛋白、cse1蛋白、cse2蛋白、csc1蛋白、csc2蛋白、csa5蛋白、csn2蛋白、csm2蛋白、csm3蛋白、csm4蛋白、csm5蛋白、csm6蛋白、cmr1蛋白、cmr3蛋白、cmr4蛋白、cmr5蛋白、cmr6蛋白、csb1蛋白、csb2蛋白、csb3蛋白、csx17蛋白、csx14蛋白、csx10蛋白、csx16蛋白、csax蛋白、csx3蛋白、csx1蛋白、csx15蛋白、csf1蛋白、csf2蛋白、csf3蛋白、csf4蛋白及其同源物或其修饰形式。
404.在某些实施方案中,所述第二cas蛋白为cas9蛋白,例如酿脓链球菌(s.pyogenes)的cas9蛋白(spcas9)。
405.在某些实施方案中,所述第二cas蛋白具有seq id no:1所示的氨基酸序列。
406.在某些实施方案中,所述第二grna含有第二引导序列,并且,在允许核酸杂交或退火的条件下,所述第二引导序列能够杂交或退火至双链靶核酸的一条核酸链。
407.在某些实施方案中,所述第二引导序列与所述第一引导序列不同;在某些实施方案中,所述第一引导序列结合的核酸链与所述第二引导序列结合的核酸链是不同的。在某些实施方案中,所述第一引导序列结合的核酸链是所述第二引导序列结合的核酸链的相对链。
408.在某些实施方案中,所述第二引导序列的长度为至少5nt,例如5-10nt,10-15nt,15-20nt,20-25nt,25-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
409.在某些实施方案中,所述第二grna还含有第二支架序列,其能够被所述第二cas蛋白识别并结合,从而形成第二功能性单元。
410.在某些实施方案中,所述第二支架序列与所述第一支架序列相同或者不同。在某些实施方案中,所述第二支架序列与所述第一支架序列相同。
411.在某些实施方案中,所述第二支架序列的长度为至少20nt,例如20-30nt,30-40nt,40-50nt,50-100nt,100-200nt,或者更长。
412.在某些实施方案中,所述第二引导序列位于所述第二支架序列的上游或5’端。
413.在某些实施方案中,所述双链靶核酸含有所述第二cas蛋白识别的第二pam序列以及能够与所述第二引导序列杂交或退火的第二引导结合序列,由此,所述第二功能性单元通过所述第二引导结合序列和所述第二pam序列,结合所述双链靶核酸。
414.在某些实施方案中,所述复合物还包含依赖于模板的第二dna聚合酶,所述第二dna聚合酶通过共价或者非共价的方式与第二cas蛋白复合。
415.在某些实施方案中,所述第二dna聚合酶选自但不限于依赖于dna的dna聚合酶和依赖于rna的dna聚合酶。
416.在某些实施方案中,所述第二dna聚合酶为依赖于rna的dna聚合酶。
417.在某些实施方案中,所述第二dna聚合酶为逆转录酶,例如上文列举的逆转录酶,例如莫洛尼氏鼠白血病病毒的逆转录酶。
418.在某些实施方案中,所述第二dna聚合酶具有seq id no:4所示的氨基酸序列。
419.在某些实施方案中,所述第二dna聚合酶与所述第一dna聚合酶相同或者不同。在某些实施方案中,所述第二dna聚合酶与所述第一dna聚合酶相同。
420.在某些实施方案中,所述第二cas蛋白通过接头或者不通过接头与所述第二dna聚合酶共价相连接。
421.在某些实施方案中,所述接头为肽接头,例如柔性肽接头;例如,所述接头具有seq id no:51所示的氨基酸序列。
422.在某些实施方案中,所述第二cas蛋白通过肽接头或者不通过肽接头与所述第二dna聚合酶融合,形成融第二合蛋白。
423.在某些实施方案中,所述第二cas蛋白任选地通过接头连接或融合至所述第二dna聚合酶的n端;或者,所述第二cas蛋白任选地通过接头连接或融合至所述第二dna聚合酶的
端。
439.在某些实施方案中,所述接头为核酸接头(例如核糖核酸接头或脱氧核糖核酸接头)。
440.在某些实施方案中,所述第二标签引物为单链核糖核酸,并且,其通过核糖核酸接头或者不通过核糖核酸接头与所述第二grna的3’端相连接,形成第二pegrna。
441.在某些实施方案中,所述第一和第二功能性单元以预定的位置关系结合双链靶核酸。
442.在某些实施方案中,所述第二引导序列与所述第一靶结合序列结合相同的核酸链;和/或,所述第一引导序列与所述第二靶结合序列结合相同的核酸链。
443.在某些实施方案中,所述第二引导序列的结合位置位于所述第一靶结合序列的结合位置的上游或5’端;和/或,所述第一引导序列的结合位置位于所述第二靶结合序列的结合位置的上游或5’端。
444.在某些实施方案中,所述第二引导序列的结合位置位于所述第一靶结合序列的结合位置的下游或3’端;和/或,所述第一引导序列的结合位置位于所述第二靶结合序列的结合位置的下游或3’端。
445.在某些实施方案中,所述双链靶核酸选自但不限于基因组dna和核酸载体dna。
446.在第七方面,本技术提供了一种方法,其用于将双链靶核酸断裂并在其3’端添加悬突,其中,所述方法包括,使用如前所述的系统或试剂盒。
447.在某些实施方案中,所述方法包括以下步骤:
448.i.提供双链靶核酸;和
449.提供所述第一cas蛋白、第一grna、第一dna聚合酶和第一标签引物;
450.ii将所述双链靶核酸与所述第一cas蛋白、第一grna、第一dna聚合酶和第一标签引物接触。
451.在某些实施方案中,在步骤ii中:
452.所述第一cas蛋白和第一grna相结合形成第一功能性复合物,并且,所述第一功能性复合物结合并断裂所述双链靶核酸,形成断裂的靶核酸片段;并且,
453.所述第一标签引物通过所述第一靶结合序列杂交或退火至所述断裂的靶核酸片段的一条核酸链的3’端;并且,
454.所述第一dna聚合酶以退火至所述断裂的靶核酸片段的第一标签引物为模板,延伸所述断裂的靶核酸片段,形成第一悬突。
455.在某些实施方案中,所述方法在细胞内进行。
456.在某些实施方案中,在步骤i中,将所述第一cas蛋白或核酸分子a1、所述第一dna聚合酶或核酸分子b1、所述第一grna或核酸分子c1以及所述第一标签引物或核酸分子d1递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶和第一标签引物。
457.在某些实施方案中,在步骤i中,将所述核酸分子a1、所述核酸分子b1、所述第一grna或核酸分子c1和所述第一标签引物或核酸分子d1递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶和第一标签引物。
458.在某些实施方案中,在步骤i中,将所述核酸分子a1、b1、c1和d1递送入细胞中,以
在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶和第一标签引物。
459.在某些实施方案中,所述核酸分子a1和核酸分子b1包含于相同或不同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子a1和核酸分子b1在细胞中能够表达分离的所述第一cas蛋白和所述第一dna聚合酶,或者能够表达含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白。在某些实施方案中,在步骤i中,将能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子或者含有编码所述第一融合蛋白的核苷酸序列的核酸分子递送入细胞中,并在细胞中进行表达,以在细胞内提供所述第一cas蛋白和所述第一dna聚合酶。
460.在某些实施方案中,所述核酸分子c1和核酸分子d1包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c1和核酸分子d1在细胞中能够转录出含有所述第一grna和所述第一标签引物的第一pegrna。在某些实施方案中,在步骤i中,将所述第一pegrna递送入细胞中以在细胞内提供所述第一grna和所述第一标签引物,或者,将含有编码所述第一pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第一pegrna,以在细胞内提供所述第一grna和所述第一标签引物。
461.在某些实施方案中,在步骤i中,将能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子或含有编码所述第一融合蛋白的核苷酸序列的核酸分子,以及含有编码所述第一pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中进行转录和表达,从而在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶和第一标签引物。
462.在某些实施方案中,在步骤i中,将所述双链靶核酸或含有所述双链靶核酸的核酸分子t递送入细胞中,以在细胞内提供所述双链靶核酸。
463.在某些实施方案中,所述第一cas蛋白、第一grna、第一dna聚合酶或第一标签引物如前述中所定义。
464.在某些实施方案中,所述双链靶核酸或核酸分子t含有第一cas蛋白识别的第一pam序列。在某些实施方案中,在步骤ii中,所述第一功能性复合物通过所述第一pam序列和所述第一grna与所述双链靶核酸或核酸分子t结合,并将其断裂。
465.在第八方面,本技术提供了一种方法,其用于将双链靶核酸断裂为靶核酸片段,并在所述靶核酸片段的两个3’端分别添加悬突,其中,所述方法包括,使用如前所述的系统或试剂盒;其中,所述第一双链靶核酸与所述第二双链靶核酸是相同的。
466.在某些实施方案中,所述方法包括以下步骤:
467.i.提供双链靶核酸;和
468.提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、所述第二cas蛋白、第二grna、第二dna聚合酶和第二标签引物;
469.ii将所述双链靶核酸与所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶和第二标签引物接触。
470.在某些实施方案中,在步骤ii中:
471.所述第一cas蛋白和第一grna相结合形成第一功能性复合物,且所述第二cas蛋白和第二grna相结合形成第二功能性复合物;并且,所述第一和第二功能性复合物结合并断裂所述双链靶核酸,形成靶核酸片段f1;并且,
472.所述第一标签引物通过所述第一靶结合序列杂交或退火至所述靶核酸片段f1的
一条核酸链的3’端;且,所述第二标签引物通过所述第二靶结合序列杂交或退火至所述靶核酸片段f1的另一条核酸链的3’端;并且,
473.所述第一dna聚合酶和第二dna聚合酶分别以退火至所述靶核酸片段f1的第一标签引物和第二标签引物为模板,延伸所述靶核酸片段f1,形成具有第一悬突和第二悬突的靶核酸片段f2。
474.在某些实施方案中,所述方法在细胞内进行。
475.在某些实施方案中,在步骤i中,将所述第一cas蛋白或核酸分子a1、所述第一dna聚合酶或核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二cas蛋白或核酸分子a2、所述第二dna聚合酶或核酸分子b2、所述第二grna或核酸分子c2以及所述第二标签引物或核酸分子d2递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶和第二标签引物。
476.在某些实施方案中,在步骤i中,将所述核酸分子a1、所述核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述核酸分子a2、所述核酸分子b2、所述第二grna或核酸分子c2以及所述第二标签引物或核酸分子d2递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶和第二标签引物。
477.在某些实施方案中,在步骤i中,将所述核酸分子a1、b1、c1、d1、a2、b2、c2以及d2递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶和第二标签引物。
478.在某些实施方案中,所述核酸分子a1和核酸分子b1包含于相同或不同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子a1和核酸分子b1在细胞中能够表达分离的所述第一cas蛋白和所述第一dna聚合酶,或者能够表达含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白。在某些实施方案中,在步骤i中,将能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子或者含有编码所述第一融合蛋白的核苷酸序列的核酸分子递送入细胞中,并在细胞中进行表达,以在细胞内提供所述第一cas蛋白和所述第一dna聚合酶。
479.在某些实施方案中,所述核酸分子a2和核酸分子b2包含于相同或不同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子a2和核酸分子b2在细胞中能够表达分离的所述第二cas蛋白和所述第二dna聚合酶,或者能够表达含有所述第二cas蛋白和所述第二dna聚合酶的第二融合蛋白。在某些实施方案中,在步骤i中,将能够表达分离的所述第二cas蛋白和第二dna聚合酶的核酸分子或者含有编码所述第二融合蛋白的核苷酸序列的核酸分子递送入细胞中,并在细胞中进行表达,以在细胞内提供所述第二cas蛋白和所述第二dna聚合酶。
480.在某些实施方案中,所述核酸分子c1和核酸分子d1包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c1和核酸分子d1在细胞中能够转录出含有所述第一grna和所述第一标签引物的第一pegrna。在某些实施方案中,在步骤i中,将所述第一pegrna递送入细胞中以在细胞内提供所述第一grna和所述第一标签引物,或者,将含有编码所述第一pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述
第一pegrna,以在细胞内提供所述第一grna和所述第一标签引物。
481.在某些实施方案中,所述核酸分子c2和核酸分子d2包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c2和核酸分子d2在细胞中能够转录出含有所述第二grna和所述第二标签引物的第二pegrna。在某些实施方案中,在步骤i中,将所述第二pegrna递送入细胞中以在细胞内提供所述第二grna和所述第二标签引物,或者,将含有编码所述第二pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第二pegrna,以在细胞内提供所述第二grna和所述第二标签引物。
482.在某些实施方案中,在步骤i中,将所述双链靶核酸或含有所述双链靶核酸的核酸分子t递送入细胞中,以在细胞内提供所述双链靶核酸。
483.在某些实施方案中,所述第一cas蛋白、第一grna、第一dna聚合酶或第一标签引物如前述中所定义。
484.在某些实施方案中,所述第二cas蛋白、第二grna、第二dna聚合酶或第二标签引物如前述中所定义。
485.在某些实施方案中,所述双链靶核酸或核酸分子t含有第一cas蛋白识别的第一pam序列以及第二cas蛋白识别的第二pam序列。在某些实施方案中,在步骤ii中,所述第一功能性复合物通过所述第一pam序列和所述第一grna与所述双链靶核酸或核酸分子t结合,并将其断裂;并且,所述第二功能性复合物通过所述第二pam序列和所述第二grna与所述双链靶核酸或核酸分子t结合,并将其断裂。
486.在某些实施方案中,所述第二cas蛋白与所述第一cas蛋白相同,并且所述第二dna聚合酶与所述第一dna聚合酶相同;其中,所述第一cas蛋白与所述第一和第二grna分别形成第一和第二功能性复合物,并且,所述第一dna聚合酶分别以退火至所述靶核酸片段f1的第一标签引物和第二标签引物为模板,延伸所述靶核酸片段f1,形成具有第一悬突和第二悬突的靶核酸片段f2。
487.在某些实施方案中,在步骤i中,将所述第一cas蛋白或核酸分子a1、所述第一dna聚合酶或核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二grna或核酸分子c2以及所述第二标签引物或核酸分子d2递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna和第二标签引物。
488.在某些实施方案中,在步骤i中,所述核酸分子a1、所述核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二grna或核酸分子c2以及所述第二标签引物或核酸分子d2递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna和第二标签引物。
489.在某些实施方案中,在步骤i中,所述核酸分子a1、b1、c1、d1、c2以及d2递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna和第二标签引物。
490.在某些实施方案中,所述核酸分子a1和核酸分子b1包含于相同或不同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子a1和核酸分子b1在细胞中能够表达分离的所述第一cas蛋白和所述第一dna聚合酶,或者能够表达含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白。在某些实施方案中,在步骤i中,将能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子或者含有编码所述第一融合蛋白的核苷酸
序列的核酸分子递送入细胞中,并在细胞中进行表达,以在细胞内提供所述第一cas蛋白和所述第一dna聚合酶。
491.在某些实施方案中,所述核酸分子c1和核酸分子d1包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c1和核酸分子d1在细胞中能够转录出含有所述第一grna和所述第一标签引物的第一pegrna。在某些实施方案中,在步骤i中,将所述第一pegrna递送入细胞中以在细胞内提供所述第一grna和所述第一标签引物,或者,将含有编码所述第一pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第一pegrna,以在细胞内提供所述第一grna和所述第一标签引物。
492.在某些实施方案中,所述核酸分子c2和核酸分子d2包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c2和核酸分子d2在细胞中能够转录出含有所述第二grna和所述第二标签引物的第二pegrna。在某些实施方案中,在步骤i中,将所述第二pegrna递送入细胞中以在细胞内提供所述第二grna和所述第二标签引物,或者,将含有编码所述第二pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第二pegrna,以在细胞内提供所述第二grna和所述第二标签引物。
493.在某些实施方案中,在步骤i中,将能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子或含有编码所述第一融合蛋白的核苷酸序列的核酸分子、含有编码所述第一pegrna的核苷酸序列的核酸分子以及含有编码所述第二pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中进行转录和表达,从而在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna和第二标签引物。
494.在第九方面,本技术提供了一种方法,其用于将靶核酸片段插入感兴趣的核酸分子;其中,所述方法包括,使用如前所述的系统或试剂盒;其中,所述第一双链靶核酸与所述第二双链靶核酸是相同的,用于提供所述靶核酸片段;并且,所述第三双链靶核酸为感兴趣的核酸分子。
495.在某些实施方案中,所述方法包括:
496.a.通过如前述中所述的方法,将所述第一双链靶核酸断裂为靶核酸片段f1,并在所述靶核酸片段f1的两个3’端分别添加悬突,形成具有第一悬突和第二悬突的靶核酸片段f2;
497.b.用所述第三功能性复合物将所述感兴趣的核酸分子断裂,形成断裂的核苷酸片段a1和a2;以及,
498.c.用所述靶核酸片段f2连接所述核苷酸片段a1和a2,从而将所述靶核酸片段插入所述感兴趣的核酸分子。
499.在某些实施方案中,所述方法包括以下步骤:
500.i.提供双链靶核酸和感兴趣的核酸分子;和
501.提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、所述第二cas蛋白、第二grna、第二dna聚合酶、第二标签引物、第三cas蛋白和第三grna;
502.ii将所述双链靶核酸与所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶和第二标签引物接触,并且,将所述感兴趣的核酸分子与所述第三cas蛋白和第三grna接触。
503.在某些实施方案中,在步骤ii中:
504.所述第一cas蛋白和第一grna相结合形成第一功能性复合物,所述第二cas蛋白和第二grna相结合形成第二功能性复合物,且所述第三cas蛋白和第三grna相结合形成第三功能性复合物;并且,
505.所述第一和第二功能性复合物结合并断裂所述双链靶核酸,形成靶核酸片段f1,且,所述第三功能性复合物结合并断裂所述感兴趣的核酸分子,形成断裂的核苷酸片段a1和a2;并且,
506.所述第一标签引物通过所述第一靶结合序列杂交或退火至所述靶核酸片段f1的一条核酸链的3’端;且,所述第二标签引物通过所述第二靶结合序列杂交或退火至所述靶核酸片段f1的另一条核酸链的3’端;并且,
507.所述第一dna聚合酶和第二dna聚合酶分别以退火至所述靶核酸片段f1的第一标签引物和第二标签引物为模板,延伸所述靶核酸片段f1,形成具有第一悬突和第二悬突的靶核酸片段f2;其中,所述第一悬突和第二悬突分别能够与断裂的核苷酸片段a1和a2杂交或退火;并且,
508.所述靶核酸片段f2通过第一悬突和第二悬突分别与核苷酸片段a1和a2杂交或退火,进而被插入或连接至核苷酸片段a1和a2之间,从而,将所述靶核酸片段插入所述感兴趣的核酸分子中。
509.在某些实施方案中,所述第一悬突能够杂交或退火到所述核苷酸片段a1的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第三功能性复合物断裂所述感兴趣的核酸分子而形成的。
510.在某些实施方案中,所述第一标签序列的互补序列或所述第一悬突能够杂交或退火到断裂的核苷酸片段a1的一条核酸链的3’部分,且所述核苷酸片段a1的3’部分与所述第三双链靶核酸所形成的断裂末端之间具有第一间隔区域。
511.在某些实施方案中,所述第一间隔区域的长度为1nt-200nt,例如1-10nt,10-20nt,20-30nt,30-40nt,40-50nt,50-100nt或100-200nt。
512.在某些实施方案中,所述第二悬突能够杂交或退火到所述核苷酸片段a2的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第三功能性复合物断裂所述感兴趣的核酸分子而形成的。
513.在某些实施方案中,所述第二标签序列的互补序列或所述第二悬突能够杂交或退火到断裂的核苷酸片段a2的一条核酸链的3’部分,且所述核苷酸片段a2的3’部分与所述第三双链靶核酸所形成的断裂末端之间具有第二间隔区域。
514.在某些实施方案中,所述第二间隔区域的长度为1nt-200nt,例如1-10nt,10-20nt,20-30nt,30-40nt,40-50nt,50-100nt或100-200nt。
515.在某些实施方案中,所述方法在细胞内进行。
516.在某些实施方案中,在步骤i中,将所述第一cas蛋白或核酸分子a1、所述第一dna聚合酶或核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二cas蛋白或核酸分子a2、所述第二dna聚合酶或核酸分子b2、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2、所述第三cas蛋白或核酸分子a3以及所述第三grna或核酸分子c3递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶、第二标签引物、第三cas蛋白和第
三grna。
517.在某些实施方案中,在步骤i中,将所述核酸分子a1、所述核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述核酸分子a2、所述核酸分子b2、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2、所述核酸分子a3以及所述第三grna或核酸分子c3递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶、第二标签引物、第三cas蛋白和第三grna。
518.在某些实施方案中,在步骤i中,将所述核酸分子a1、b1、c1、d1、a2、b2、c2、d2、a3和c3递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶、第二标签引物、第三cas蛋白和第三grna。
519.在某些实施方案中,在步骤i中,将所述双链靶核酸或含有所述双链靶核酸的核酸分子t递送入细胞中,以在细胞内提供所述双链靶核酸。
520.在某些实施方案中,所述双链靶核酸或核酸分子t含有第一cas蛋白识别的第一pam序列以及第二cas蛋白识别的第二pam序列。在某些实施方案中,在步骤ii中,所述第一功能性复合物通过所述第一pam序列和所述第一grna与所述双链靶核酸或核酸分子t结合,并将其断裂;并且,所述第二功能性复合物通过所述第二pam序列和所述第二grna与所述双链靶核酸或核酸分子t结合,并将其断裂。
521.在某些实施方案中,所述感兴趣的核酸分子含有第三cas蛋白识别的第三pam序列;在某些实施方案中,在步骤ii中,所述第三功能性复合物通过所述第三pam序列和所述第三grna与所述感兴趣的核酸分子结合,并将其断裂。
522.在某些实施方案中,所述感兴趣的核酸分子是所述细胞的基因组dna。
523.在某些实施方案中,所述第一cas蛋白、第一grna、第一dna聚合酶或第一标签引物如前述中所定义。
524.在某些实施方案中,所述第二cas蛋白、第二grna、第二dna聚合酶或第二标签引物如前述中所定义。
525.在某些实施方案中,所述第三cas蛋白和第三grna如前述中所定义。
526.在某些实施方案中,所述第一、第二和第三cas蛋白是相同的cas蛋白,并且所述第二dna聚合酶与所述第一dna聚合酶相同;其中,所述第一cas蛋白与所述第一、第二和第三grna分别形成第一、第二和第三功能性复合物,并且,所述第一dna聚合酶分别以退火至所述靶核酸片段f1的第一标签引物和第二标签引物为模板,延伸所述靶核酸片段f1,形成具有第一悬突和第二悬突的靶核酸片段f2。
527.在某些实施方案中,在步骤i中,将所述第一cas蛋白或核酸分子a1、所述第一dna聚合酶或核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2和所述第三grna或核酸分子c3递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna、第二标签引物和第三grna。
528.在某些实施方案中,在步骤i中,将所述核酸分子a1、所述核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2以及所述第三grna或核酸分子c3递送入细胞中,以在细胞内提供
所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna、第二标签引物和第三grna。
529.在某些实施方案中,在步骤i中,将所述核酸分子a1、b1、c1、d1、c2、d2以及c3递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna、第二标签引物和第三grna。
530.在某些实施方案中,所述核酸分子a1和核酸分子b1包含于相同或不同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子a1和核酸分子b1在细胞中能够表达分离的所述第一cas蛋白和所述第一dna聚合酶,或者能够表达含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白。在某些实施方案中,在步骤i中,将能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子或者含有编码所述第一融合蛋白的核苷酸序列的核酸分子递送入细胞中,并在细胞中进行表达,以在细胞内提供所述第一cas蛋白和所述第一dna聚合酶。
531.在某些实施方案中,所述核酸分子c1和核酸分子d1包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c1和核酸分子d1在细胞中能够转录出含有所述第一grna和所述第一标签引物的第一pegrna。在某些实施方案中,在步骤i中,将所述第一pegrna递送入细胞中以在细胞内提供所述第一grna和所述第一标签引物,或者,将含有编码所述第一pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第一pegrna,以在细胞内提供所述第一grna和所述第一标签引物。
532.在某些实施方案中,所述核酸分子c2和核酸分子d2包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c2和核酸分子d2在细胞中能够转录出含有所述第二grna和所述第二标签引物的第二pegrna。在某些实施方案中,在步骤i中,将所述第二pegrna递送入细胞中以在细胞内提供所述第二grna和所述第二标签引物,或者,将含有编码所述第二pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第二pegrna,以在细胞内提供所述第二grna和所述第二标签引物;
533.在某些实施方案中,在步骤i中,将能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子或含有编码所述第一融合蛋白的核苷酸序列的核酸分子、含有编码所述第一pegrna的核苷酸序列的核酸分子、含有编码所述第二pegrna的核苷酸序列的核酸分子以及含有编码所述第三grna的核苷酸序列的核酸分子递送入细胞中,并在细胞中进行转录和表达,从而在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna、第二标签引物和第三grna。
534.第十方面,本技术提供了一种方法,其用于将靶核酸片段置换感兴趣的核酸分子中的核苷酸片段;其中,所述方法包括,使用如前所述的系统或试剂盒;其中,所述第一双链靶核酸与所述第二双链靶核酸是相同的,用于提供所述靶核酸片段;并且,所述第三双链靶核酸与所述第四双链靶核酸是相同的,为感兴趣的核酸分子。
535.在某些实施方案中,所述方法包括:
536.a.通过如前所述的方法,将所述第一双链靶核酸断裂为靶核酸片段f1,并在所述靶核酸片段f1的两个3’端分别添加悬突,形成具有第一悬突和第二悬突的靶核酸片段f2;
537.b.用所述第三和第四功能性复合物断裂所述感兴趣的核酸分子,形成断裂的核苷酸片段a1、a2和a3;其中,在断裂之前,在所述感兴趣的核酸分子中,核苷酸片段a1、a2和a3
依次排列(即,核苷酸片段a1通过核苷酸片段a2与核苷酸片段a3相连);以及,
538.c.用所述靶核酸片段f2连接所述核苷酸片段a1和a3,从而将感兴趣的核酸分子中的核苷酸片段a2替换为所述靶核酸片段。
539.在某些实施方案中,所述方法包括以下步骤:
540.i.提供双链靶核酸和感兴趣的核酸分子;和
541.提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、所述第二cas蛋白、第二grna、第二dna聚合酶、第二标签引物、第三cas蛋白、第三grna、第四cas蛋白和第四grna;
542.ii将所述双链靶核酸与所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶和第二标签引物接触,并且,将所述感兴趣的核酸分子与所述第三cas蛋白、第三grna、第四cas蛋白和第四grna接触。
543.在某些实施方案中,在步骤ii中:
544.所述第一cas蛋白和第一grna相结合形成第一功能性复合物,所述第二cas蛋白和第二grna相结合形成第二功能性复合物,所述第三cas蛋白和第三grna相结合形成第三功能性复合物,且所述第四cas蛋白和第四grna相结合形成第四功能性复合物;并且,
545.所述第一和第二功能性复合物结合并断裂所述双链靶核酸,形成靶核酸片段f1,且,所述第三和第四功能性复合物结合并断裂所述感兴趣的核酸分子,形成断裂的核苷酸片段a1、a2和a3;并且,
546.所述第一标签引物通过所述第一靶结合序列杂交或退火至所述靶核酸片段f1的一条核酸链的3’端;且,所述第二标签引物通过所述第二靶结合序列杂交或退火至所述靶核酸片段f1的另一条核酸链的3’端;并且,
547.所述第一dna聚合酶和第二dna聚合酶分别以退火至所述靶核酸片段f1的第一标签引物和第二标签引物为模板,延伸所述靶核酸片段f1,形成具有第一悬突和第二悬突的靶核酸片段f2;其中,所述第一悬突和第二悬突分别能够与断裂的核苷酸片段a1和a3杂交或退火;并且,
548.所述靶核酸片段f2通过第一悬突和第二悬突分别与核苷酸片段a1和a3杂交或退火,进而连接在核苷酸片段a1和a3之间,从而,将感兴趣的核酸分子中的核苷酸片段a2替换为所述靶核酸片段;
549.在某些实施方案中,所述第一悬突能够杂交或退火到所述核苷酸片段a1的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第三功能性复合物断裂所述感兴趣的核酸分子而形成的;
550.在某些实施方案中,所述第二悬突能够杂交或退火到所述核苷酸片段a3的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第四功能性复合物断裂所述感兴趣的核酸分子而形成的。
551.在某些实施方案中,所述方法在细胞内进行。
552.在某些实施方案中,在步骤i中,将所述第一cas蛋白或核酸分子a1、所述第一dna聚合酶或核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二cas蛋白或核酸分子a2、所述第二dna聚合酶或核酸分子b2、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2、所述第三cas蛋白或核酸分子a3、所述第三grna或核
酸分子c3、所述第四cas蛋白或核酸分子a4、所述第四grna或核酸分子c4递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶、第二标签引物、第三cas蛋白、第三grna、第四cas蛋白和第四grna。
553.在某些实施方案中,在步骤i中,所述核酸分子a1、所述核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述核酸分子a2、所述核酸分子b2、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2、所述核酸分子a3、所述第三grna或核酸分子c3、所述核酸分子a4以及所述第四grna或核酸分子c4递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶、第二标签引物、第三cas蛋白、第三grna、第四cas蛋白和第四grna。
554.在某些实施方案中,在步骤i中,所述核酸分子a1、b1、c1、d1、a2、b2、c2、d2、a3、c3、a4和c4递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二cas蛋白、第二grna、第二dna聚合酶、第二标签引物、第三cas蛋白、第三grna、第四cas蛋白和第四grna。
555.在某些实施方案中,在步骤i中,将所述双链靶核酸或含有所述双链靶核酸的核酸分子t递送入细胞中,以在细胞内提供所述双链靶核酸。
556.在某些实施方案中,所述双链靶核酸或核酸分子t含有第一cas蛋白识别的第一pam序列以及第二cas蛋白识别的第二pam序列。在某些实施方案中,在步骤ii中,所述第一功能性复合物通过所述第一pam序列和所述第一grna与所述双链靶核酸或核酸分子t结合,并将其断裂;并且,所述第二功能性复合物通过所述第二pam序列和所述第二grna与所述双链靶核酸或核酸分子t结合,并将其断裂。
557.在某些实施方案中,所述感兴趣的核酸分子含有第三cas蛋白识别的第三pam序列以及第四cas蛋白识别的第四pam序列。在某些实施方案中,在步骤ii中,所述第三功能性复合物通过所述第三pam序列和所述第三grna与所述感兴趣的核酸分子结合,并将其断裂;并且,所述第四功能性复合物通过所述第四pam序列和所述第四grna与所述感兴趣的核酸分子结合,并将其断裂。
558.在某些实施方案中,所述感兴趣的核酸分子是所述细胞的基因组dna。
559.在某些实施方案中,所述第一cas蛋白、第一grna、第一dna聚合酶或第一标签引物如前述中所定义。
560.在某些实施方案中,所述第二cas蛋白、第二grna、第二dna聚合酶或第二标签引物如前述中所定义。
561.在某些实施方案中,所述第三cas蛋白和第三grna如前述中所定义。
562.在某些实施方案中,所述第四cas蛋白和第四grna如前述中所定义。
563.在某些实施方案中,所述第一、第二、第三和第四cas蛋白是相同的cas蛋白,并且所述第二dna聚合酶与所述第一dna聚合酶相同;其中,所述第一cas蛋白与所述第一、第二、第三和第四grna分别形成第一、第二、第三和第四功能性复合物,并且,所述第一dna聚合酶分别以退火至所述靶核酸片段f1的第一标签引物和第二标签引物为模板,延伸所述靶核酸片段f1,形成具有第一悬突和第二悬突的靶核酸片段f2。
564.在某些实施方案中,在步骤i中,将所述第一cas蛋白或核酸分子a1、所述第一dna
聚合酶或核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2、所述第三grna或核酸分子c3和所述第四grna或核酸分子c4递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna、第二标签引物、第三grna和第四grna。
565.在某些实施方案中,在步骤i中,将所述核酸分子a1、所述核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2、所述第三grna或核酸分子c3和所述第四grna或核酸分子c4递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna、第二标签引物、第三grna和第四grna。
566.在某些实施方案中,在步骤i中,将所述核酸分子a1、b1、c1、d1、c2、d2、c3以及c4递送入细胞中,以在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna、第二标签引物、第三grna和第四grna。
567.在某些实施方案中,所述核酸分子a1和核酸分子b1包含于相同或不同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子a1和核酸分子b1在细胞中能够表达分离的所述第一cas蛋白和所述第一dna聚合酶,或者能够表达含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白;在某些实施方案中,在步骤i中,将能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子或者含有编码所述第一融合蛋白的核苷酸序列的核酸分子递送入细胞中,并在细胞中进行表达,以在细胞内提供所述第一cas蛋白和所述第一dna聚合酶。
568.在某些实施方案中,所述核酸分子c1和核酸分子d1包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c1和核酸分子d1在细胞中能够转录出含有所述第一grna和所述第一标签引物的第一pegrna。在某些实施方案中,在步骤i中,将所述第一pegrna递送入细胞中以在细胞内提供所述第一grna和所述第一标签引物,或者,将含有编码所述第一pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第一pegrna,以在细胞内提供所述第一grna和所述第一标签引物。
569.在某些实施方案中,所述核酸分子c2和核酸分子d2包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c2和核酸分子d2在细胞中能够转录出含有所述第二grna和所述第二标签引物的第二pegrna。在某些实施方案中,在步骤i中,将所述第二pegrna递送入细胞中以在细胞内提供所述第二grna和所述第二标签引物,或者,将含有编码所述第二pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第二pegrna,以在细胞内提供所述第二grna和所述第二标签引物。
570.在某些实施方案中,在步骤i中,将能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子或含有编码所述第一融合蛋白的核苷酸序列的核酸分子、含有编码所述第一pegrna的核苷酸序列的核酸分子、含有编码所述第二pegrna的核苷酸序列的核酸分子、含有编码所述第三grna的核苷酸序列的核酸分子以及含有编码所述第四grna的核苷酸序列的核酸分子递送入细胞中,并在细胞中进行转录和表达,从而在细胞内提供所述第一cas蛋白、第一grna、第一dna聚合酶、第一标签引物、第二grna、第二标签引物、第三grna和第四grna。
571.在某些实施方案中,所述方法包括以下步骤:
572.i.提供双链靶核酸和感兴趣的核酸分子;和
573.提供所述第一、第二、第三和第四cas蛋白,所述第一、第二、第三和第四grna,所述第一、第二、第三和第四dna聚合酶,以及所述第一、第二、第三和第四标签引物;
574.ii将所述双链靶核酸与所述第一和第二cas蛋白、第一和第二grna、第一和第二dna聚合酶、第一和第二标签引物接触,并且,将所述感兴趣的核酸分子与所述第三和第四cas蛋白、第三和第四grna、第三和第四dna聚合酶,以及第三和第四标签引物接触。
575.在某些实施方案中,在步骤ii中:
576.所述第一cas蛋白和第一grna相结合形成第一功能性复合物,所述第二cas蛋白和第二grna相结合形成第二功能性复合物,所述第三cas蛋白和第三grna相结合形成第三功能性复合物,且所述第四cas蛋白和第四grna相结合形成第四功能性复合物;并且,
577.所述第一和第二功能性复合物结合并断裂所述双链靶核酸,形成靶核酸片段f1,且,所述第三和第四功能性复合物结合并断裂所述感兴趣的核酸分子,形成断裂的核苷酸片段a1、a2和a3;并且,
578.所述第一标签引物通过所述第一靶结合序列杂交或退火至所述靶核酸片段f1的一条核酸链的3’端;且,所述第二标签引物通过所述第二靶结合序列杂交或退火至所述靶核酸片段f1的另一条核酸链的3’端;并且,
579.所述第一dna聚合酶和第二dna聚合酶分别以退火至所述靶核酸片段f1的第一标签引物和第二标签引物为模板,延伸所述靶核酸片段f1,形成具有第一悬突和第二悬突的靶核酸片段f2;其中,所述第一悬突和第二悬突分别能够与断裂的核苷酸片段a1和a3杂交或退火;并且,
580.所述第三标签引物通过所述第三靶结合序列杂交或退火至所述核苷酸片段a1的一条核酸链的3’端,其中,所述3’端是因所述第三功能性复合物断裂感兴趣的核酸分子而形成的;且,所述第四标签引物通过所述第四靶结合序列杂交或退火至所述核苷酸片段a3的一条核酸链的3’端,其中,所述3’端是因所述第四功能性复合物断裂感兴趣的核酸分子而形成的;并且,
581.所述第三dna聚合酶以退火至所述核苷酸片段a1的第三标签引物为模板,延伸所述核苷酸片段a1,形成具有第三悬突的核苷酸片段a1;且,所述第四dna聚合酶以退火至所述核苷酸片段a3的第四标签引物为模板,延伸所述核苷酸片段a3,形成具有第四悬突的核苷酸片段a3;其中,所述第三悬突和第四悬突分别能够与所述靶核酸片段f2杂交或退火;并且,
582.通过所述第一、第二、第三和第四悬突,所述靶核酸片段f2分别与核苷酸片段a1和a3杂交或退火,进而连接在核苷酸片段a1和a3之间,从而,将感兴趣的核酸分子中的核苷酸片段a2替换为所述靶核酸片段。
583.在某些实施方案中,所述第一悬突能够杂交或退火到所述核苷酸片段a1的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第三功能性复合物断裂所述感兴趣的核酸分子而形成的。在某些实施方案中,所述第一悬突能够杂交或退火到核苷酸片段a1的第三悬突或其上游核苷酸序列。
584.在某些实施方案中,所述第二悬突能够杂交或退火到所述核苷酸片段a3的一条核酸链的3’端或3’部分,并且所述3’端或3’部分是因所述第四功能性复合物断裂所述感兴趣
的核酸分子而形成的。在某些实施方案中,所述第二悬突能够杂交或退火到核苷酸片段a3的第四悬突或其上游核苷酸序列。
585.在某些实施方案中,所述第三悬突能够与所述第一悬突或其上游核苷酸序列杂交或退火。
586.在某些实施方案中,所述第四悬突能够与所述第二悬突或其上游核苷酸序列杂交或退火。
587.在某些实施方案中,所述方法在细胞内进行。
588.在某些实施方案中,在步骤i中,将所述第一cas蛋白或核酸分子a1、所述第一dna聚合酶或核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二cas蛋白或核酸分子a2、所述第二dna聚合酶或核酸分子b2、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2、所述第三cas蛋白或核酸分子a3、所述第三dna聚合酶或核酸分子b3、所述第三grna或核酸分子c3、所述第三标签引物或核酸分子d3、所述第四cas蛋白或核酸分子a4、所述第四dna聚合酶或核酸分子b4、所述第四grna或核酸分子c4以及所述第四标签引物或核酸分子d4递送入细胞中,以在细胞内提供所述第一、第二、第三和第四cas蛋白,所述第一、第二、第三和第四grna,所述第一、第二、第三和第四dna聚合酶,以及所述第一、第二、第三和第四标签引物。
589.在某些实施方案中,在步骤i中,将所述核酸分子a1、所述核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述核酸分子a2、所述核酸分子b2、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2、所述核酸分子a3、所述核酸分子b3、所述第三grna或核酸分子c3、所述第三标签引物或核酸分子d3、所述核酸分子a4、所述核酸分子b4、所述第四grna或核酸分子c4以及所述第四标签引物或核酸分子d4递送入细胞中,以在细胞内提供所述第一、第二、第三和第四cas蛋白,所述第一、第二、第三和第四grna,所述第一、第二、第三和第四dna聚合酶,以及所述第一、第二、第三和第四标签引物。
590.在某些实施方案中,在步骤i中,将所述核酸分子a1、b1、c1、d1、a2、b2、c2、d2、a3、b3、c3、d3、a4、b4、c4、d4递送入细胞中,以在细胞内提供第一、第二、第三和第四cas蛋白,所述第一、第二、第三和第四grna,所述第一、第二、第三和第四dna聚合酶,以及所述第一、第二、第三和第四标签引物。
591.在某些实施方案中,在步骤i中,将所述双链靶核酸或含有所述双链靶核酸的核酸分子t递送入细胞中,以在细胞内提供所述双链靶核酸。
592.在某些实施方案中,所述双链靶核酸或核酸分子t含有第一cas蛋白识别的第一pam序列以及第二cas蛋白识别的第二pam序列;在某些实施方案中,在步骤ii中,所述第一功能性复合物通过所述第一pam序列和所述第一grna与所述双链靶核酸或核酸分子t结合,并将其断裂;并且,所述第二功能性复合物通过所述第二pam序列和所述第二grna与所述双链靶核酸或核酸分子t结合,并将其断裂。
593.在某些实施方案中,所述感兴趣的核酸分子含有第三cas蛋白识别的第三pam序列以及第四cas蛋白识别的第四pam序列。在某些实施方案中,在步骤ii中,所述第三功能性复合物通过所述第三pam序列和所述第三grna与所述感兴趣的核酸分子结合,并将其断裂。并且,所述第四功能性复合物通过所述第四pam序列和所述第四grna与所述感兴趣的核酸分子结合,并将其断裂。
594.在某些实施方案中,所述感兴趣的核酸分子是所述细胞的基因组dna。
595.在某些实施方案中,所述第一cas蛋白、第一grna、第一dna聚合酶或第一标签引物如前述中所定义。
596.在某些实施方案中,所述第二cas蛋白、第二grna、第二dna聚合酶或第二标签引物如前述中所定义。
597.在某些实施方案中,所述第三cas蛋白、第三grna、第三dna聚合酶或第三标签引物如前述中所定义。
598.在某些实施方案中,第四cas蛋白、第四grna、第四dna聚合酶或第四标签引物如前述中所定义。
599.在某些实施方案中,所述第一、第二、第三和第四cas蛋白是相同的cas蛋白,并且所述第一、第二、第三和第四dna聚合酶是相同的dna聚合酶;其中,所述第一cas蛋白与所述第一、第二、第三和第四grna分别形成第一、第二、第三和第四功能性复合物;并且,所述第一dna聚合酶分别以退火至所述靶核酸片段f1的第一标签引物和第二标签引物为模板,延伸所述靶核酸片段f1,形成具有第一悬突和第二悬突的靶核酸片段f2;并且,所述第一dna聚合酶分别以第三标签引物和第四标签引物为模板,延伸所述核苷酸片段a1和a3,形成第三和第四悬突。
600.在某些实施方案中,在步骤i中,将所述第一cas蛋白或核酸分子a1、所述第一dna聚合酶或核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2、所述第三grna或核酸分子c3、所述第三标签引物或核酸分子d3、所述第四grna或核酸分子c4、以及所述第四标签引物或核酸分子d4递送入细胞中,以在细胞内提供所述第一cas蛋白,第一dna聚合酶,第一、第二、第三和第四grna,以及第一、第二、第三和第四标签引物。
601.在某些实施方案中,在步骤i中,将所述核酸分子a1、所述核酸分子b1、所述第一grna或核酸分子c1、所述第一标签引物或核酸分子d1、所述第二grna或核酸分子c2、所述第二标签引物或核酸分子d2、所述第三grna或核酸分子c3、所述第三标签引物或核酸分子d3、所述第四grna或核酸分子c4、以及所述第四标签引物或核酸分子d4递送入细胞中,以在细胞内提供所述第一cas蛋白,第一dna聚合酶,第一、第二、第三和第四grna,以及第一、第二、第三和第四标签引物。
602.在某些实施方案中,在步骤i中,将所述核酸分子a1、b1、c1、d1、c2、d2、c3、d3、c4和d4递送入细胞中,以在细胞内提供所述第一cas蛋白,第一dna聚合酶,第一、第二、第三和第四grna,以及第一、第二、第三和第四标签引物。
603.在某些实施方案中,所述核酸分子a1和核酸分子b1包含于相同或不同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子a1和核酸分子b1在细胞中能够表达分离的所述第一cas蛋白和所述第一dna聚合酶,或者能够表达含有所述第一cas蛋白和所述第一dna聚合酶的第一融合蛋白。在某些实施方案中,在步骤i中,将能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子或者含有编码所述第一融合蛋白的核苷酸序列的核酸分子递送入细胞中,并在细胞中进行表达,以在细胞内提供所述第一cas蛋白和所述第一dna聚合酶。
604.在某些实施方案中,所述核酸分子c1和核酸分子d1包含于相同的表达载体(例如,
真核表达载体)中。在某些实施方案中,所述核酸分子c1和核酸分子d1在细胞中能够转录出含有所述第一grna和所述第一标签引物的第一pegrna。在某些实施方案中,在步骤i中,将所述第一pegrna递送入细胞中以在细胞内提供所述第一grna和所述第一标签引物,或者,将含有编码所述第一pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第一pegrna,以在细胞内提供所述第一grna和所述第一标签引物。
605.在某些实施方案中,所述核酸分子c2和核酸分子d2包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c2和核酸分子d2在细胞中能够转录出含有所述第二grna和所述第二标签引物的第二pegrna。在某些实施方案中,在步骤i中,将所述第二pegrna递送入细胞中以在细胞内提供所述第二grna和所述第二标签引物,或者,将含有编码所述第二pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第二pegrna,以在细胞内提供所述第二grna和所述第二标签引物。
606.在某些实施方案中,所述核酸分子c3和核酸分子d3包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c3和核酸分子d3在细胞中能够转录出含有所述第三grna和所述第三标签引物的第三pegrna。在某些实施方案中,在步骤i中,将所述第三pegrna递送入细胞中以在细胞内提供所述第三grna和所述第三标签引物,或者,将含有编码所述第三pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第三pegrna,以在细胞内提供所述第三grna和所述第三标签引物。
607.在某些实施方案中,所述核酸分子c4和核酸分子d4包含于相同的表达载体(例如,真核表达载体)中。在某些实施方案中,所述核酸分子c4和核酸分子d4在细胞中能够转录出含有所述第四grna和所述第四标签引物的第四pegrna。在某些实施方案中,在步骤i中,将所述第四pegrna递送入细胞中以在细胞内提供所述第四grna和所述第四标签引物,或者,将含有编码所述第四pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中转录所述第四pegrna,以在细胞内提供所述第四grna和所述第四标签引物。
608.在某些实施方案中,在步骤i中,将能够表达分离的所述第一cas蛋白和第一dna聚合酶的核酸分子或含有编码所述第一融合蛋白的核苷酸序列的核酸分子、含有编码所述第一pegrna的核苷酸序列的核酸分子、含有编码所述第二pegrna的核苷酸序列的核酸分子、含有编码所述第三pegrna的核苷酸序列的核酸分子以及含有编码所述第四pegrna的核苷酸序列的核酸分子递送入细胞中,并在细胞中表达第一融合蛋白和转录第一、第二、第三和第四pegrna,从而在细胞内提供所述第一cas蛋白,第一dna聚合酶,第一、第二、第三和第四grna,以及第一、第二、第三和第四标签引物。
609.发明的有益效果
610.与现有技术相比,本技术提供的核酸编辑系统、试剂盒和方法能够断裂双链核酸,并在其末端(3’末端)延伸/添加一段或两段任意碱基序列的悬突。在此基础上,本技术的系统、试剂盒和方法能够实现高效、精确的外源核酸(特别是大片段外源核酸)的插入和置换。
611.下面将结合附图和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
612.图1显示了本发明方法介导外源基因插入基因组的原理的示意图。其中,黑色双实线代表基因组序列或供体载体的骨架序列;蓝色双实线代表待插入的外源基因;灰色虚线圈中的橙色和绿色单条实线代表延伸的第一悬突和第二悬突,灰色虚线圈中的橙色和绿色双实线代表基因组断裂处末端分别与第一悬突和第二悬突互补的第一同源序列和第二同源序列;黑色实心三角指示基因组特异位点spacerx,其能够被cas9-mlv-rt/genex-grna(由cas9蛋白、逆转录酶(mlv-rt)和genex-grna形成的复合物)识别并切割;黑色空心三角指示供体载体上外源基因上游的sapcera位点,其能够被cas9-mlv-rt/spacera-pegrna(由cas9蛋白、逆转录酶(mlv-rt)和spacera-pegrna形成的复合物)识别并切割;灰色空心三角指示供体载体上外源基因下游的sapcerk位点,其能够被cas9-mlv-rt/spacerk-pegrna(由cas9蛋白、逆转录酶(mlv-rt)和spacerk-pegrna形成的复合物)识别并切割;并且,spacera和sapcerk彼此位于相对的核酸链上。
613.sapcera位点被cas9-mlv-rt/spacera-pegrna识别并切割,其中,spacera-pegrna含有第一靶结合序列和第一标签序列(其与第一同源序列的一条链互补),第一靶结合序列杂交至切割后的靶核酸片段的一条核酸链的3’端,形成双链结构,并且,第一标签序列不与所述靶核酸片段结合,处于游离的单链状态。因此,逆转录酶(mlv-rt)能够以第一标签引物为模板,延伸所述核酸链的3’端,形成了第一悬突(即橙色单条实线,其长度可以为例如35nt)。同理,spacerk位点被cas9-mlv-rt/spacerk-pegrna识别并切割,其中,spacerk-pegrna含有第二靶结合序列和第二标签序列(其与第二同源序列的一条链互补),第二靶结合序列杂交至切割后的靶核酸片段的一条核酸链的3’端,形成双链结构,并且,第二标签序列不与所述靶核酸片段结合,处于游离的单链状态。因此,逆转录酶(mlv-rt)能够以第二标签引物为模板,延伸所述核酸链的3’端,形成了第二悬突(即绿色单条实线,其长度可以为例如35nt)。通过双重切割,外源基因片段被从载体中切割出来,且在两端被添加了第一悬突和第二悬突。
614.此外,spacerx位点被cas9-mlv-rt/genex-grna识别并切割,形成断裂的基因组;并且,断裂位点处的两个末端分别含有第一同源序列(与第一悬突互补)和第二同源序列(与第二悬突互补)。由此,带有第一悬突和第二悬突的外源基因片段可通过链间退火整合到基因组的断裂位点,实现外源基因的定点插入。
615.图2显示了本发明方法介导外源基因替换基因组的特定核苷酸片段的原理的示意图。其中,黑色双实线表示基因组序列或供体载体的骨架序列;黑色双虚线代表拟被替换的基因组片段;蓝色双实线代表待替换的外源插入基因;灰色虚线圈中相同颜色的实线代表能够彼此互补的同源序列,橙色单条实线代表延伸的第一悬突,绿色单条实线代表延伸的第二悬突,红色单条实线代表延伸的第三悬突,紫色单条实线代表延伸的第四悬突;黑色实心三角指示基因组上拟替换片段上游的切割位点rc-pegrna,其可以被cas9-mlv-rt/rc-pegrna(由cas9蛋白、逆转录酶(mlv-rt)和rc-pegrna形成的复合物)识别、切割和延伸;灰色实心三角指示基因组上拟替换片段下游的切割位点rt-pegrna,其可以被cas9-mlv-rt/rt-pegrna(由cas9蛋白、逆转录酶(mlv-rt)和rt-pegrna形成的复合物)识别、切割和延伸;黑色空心三角代表供体载体上外源插入片段上游的切割位点rc-pega,其可以被cas9-mlv-rt/rc-pega识别、切割和延伸;灰色空心三角代表供体载体上外源插入片段下游的切割位
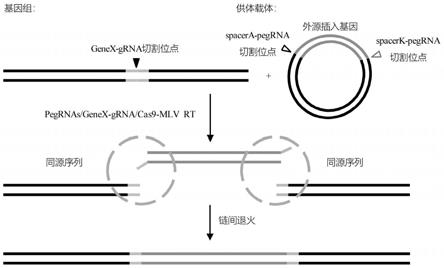
点rt-pegk,其可以被cas9-mlv-rt/rt-pegk识别、切割和延伸;rc-pega和rt-pegk位点彼此位于相对的核酸链上;且rc-pegrna和rt-pegrna位点彼此位于相对的核酸链上。
616.位点rc-pega被cas9-mlv-rt/rc-pegrna识别和切割,其中,rc-pegrna含有第一靶结合序列和第一标签序列(其与第一同源序列的一条链互补),第一靶结合序列杂交至切割后的靶核酸片段的一条核酸链的3’端,形成双链结构,并且,第一标签序列不与所述靶核酸片段结合,处于游离的单链状态。因此,逆转录酶(mlv-rt)能够以第一标签引物为模板,延伸所述核酸链的3’端,形成第一悬突(即橙色单条实线),并且,第一悬突能够与rc-pegrna位点上游的核苷酸序列(橙色双实线)互补。
617.同理,位点rt-pegk被cas9-mlv-rt/rt-pegk识别和切割,其中,rt-pegk含有第二靶结合序列和第二标签序列(其与第二同源序列的一条链互补),第二靶结合序列杂交至切割后的靶核酸片段的一条核酸链的3’端,形成双链结构,并且,第二标签序列不与所述靶核酸片段结合,处于游离的单链状态。因此,逆转录酶(mlv-rt)能够以第二标签引物为模板,延伸所述核酸链的3’端,形成第二悬突(即绿色单条实线),并且,第二悬突能够与rt-pegrna位点下游的核苷酸序列(绿色双实线)互补。
618.通过双重切割,外源基因片段被从载体中切割出来,且在两端被添加了第一悬突和第二悬突。
619.位点rc-pegrna被cas9-mlv-rt/rc-pegrna识别并切割,其中,rc-pegrna含有第三靶结合序列和第三标签序列(其与第三同源序列的一条链互补),第三靶结合序列杂交至切割后的靶核酸片段的一条核酸链的3’端,形成双链结构,并且,第三标签序列不与所述靶核酸片段结合,处于游离的单链状态。因此,逆转录酶(mlv-rt)能够以第三标签引物为模板,延伸所述核酸链的3’端,形成了第三悬突(即红色单条实线),并且,第三悬突能够与rc-pega位点下游的核苷酸序列(红色双实线)互补。
620.位点rt-pegrna被cas9-mlv-rt/rt-pegrna识别并切割,其中,rt-pegrna含有第四靶结合序列和第四标签序列(其与第四同源序列的一条链互补),第四靶结合序列杂交至切割后的靶核酸片段的一条核酸链的3’端,形成双链结构,并且,第四标签序列不与所述靶核酸片段结合,处于游离的单链状态。因此,逆转录酶(mlv-rt)能够以第四标签引物为模板,延伸所述核酸链的3’端,形成了第四悬突(即紫色单条实线),并且,第四悬突能够与rt-pegk位点上游的核苷酸序列(紫色双实线)互补。
621.通过双重切割,拟被替换的片段被从基因组中切除,且断裂的基因组两端被添加了第三悬突和第四悬突。
622.由此,带有第一、第二悬突的外源基因片段可通过链间退火插入到带有第三、第四悬突的断裂的基因组中,从而实现基因组上特定核苷酸片段的替换。
623.图3显示了在人细胞基因组的gapdh基因中定点敲入外源基因(ires-egfp)的流程示意图。
624.图4显示了使用本发明方法在人细胞基因组的gapdh基因中定点敲入外源基因(ires-egfp)的结果示意图。图4a显示了通过流式细胞荧光分选技术(facs)分析不同方法产生的egfp阳性细胞的比率。图4b为通过pcr对报告基因ires-egfp(5’端和3’端)与基因组dna连接处的核苷酸序列进行pcr鉴定的结果。图4c为对报告基因ires-egfp(5’端和3’端)与基因组dna连接处的核苷酸序列进行sanger法测序的结果。
625.图5显示了在人细胞基因组的actb基因中定点敲入外源基因(ires-egfp)的流程示意图。
626.图6显示了使用本发明方法在人细胞基因组的actb基因中定点敲入外源基因(ires-egfp)的结果示意图。图6a显示了通过流式细胞荧光分选技术(facs)分析不同方法产生的egfp阳性细胞的比率。图6b为对报告基因ires-egfp(5’端和3’端)与基因组dna连接处的核苷酸序列进行pcr鉴定的结果。图6c为对报告基因ires-egfp(5’端和3’端)与基因组dna连接处的核苷酸序列进行sanger法测序的结果。
627.图7显示了用含有外源基因(t2a-egfp)的靶核酸片段定点置换人细胞基因组的gapdh基因中的核苷酸片段的流程示意图。
628.图8显示了使用本发明方法,用含有外源基因(t2a-egfp)的靶核酸片段定点置换人细胞基因组的gapdh基因中的核苷酸片段的效率。
629.图9显示了使用hdr方法和本发明方法(epti)在293t细胞的actb基因的终止密码子前定点敲入外源基因(t2a-egfp),从而使t2a-egfp与actb基因融合表达的结果示意图。
630.图9a显示了hdr和epti介导外源基因(t2a-egfp)在actb基因的终止密码子前定点敲入的示意图。
631.图9b显示了epti介导外源基因(t2a-egfp)在actb基因的终止密码子前定点敲入的序列示意图;
632.其中,第一排序列表示人actb基因序列;蓝色序列表示actb基因的蛋白编码序列(该蓝色序列也为同源序列);黑色三角表示基因组被靶向的切割位点(sgactb2);其中,tag为终止密码子,基因组靶向的切割位点在终止密码子的“t”碱基与“a”碱基之间。
633.第二排序列表示供体载体的序列,其中,黑色三角表示供体载体上外源基因的上游被靶向的切割位点。根据如上所描述的,当该位点被cas9-mlv-rt和pegrna的复合物识别并切割,pegrna会延伸所述外源基因上游核酸链的3’端,形成一段悬突序列。
634.第三排序列表示外源基因上游的悬突序列与actb基因同源序列链间退火后的序列;由于链间退火,actb基因同源序列与断裂位点之间的间隔序列(例如,碱基“t”)形成了游离的碱基;
635.其中,蓝色序列为actb基因的同源序列;位于灰色框内的蓝色序列为外源基因上游形成的悬突序列;位于灰色框内的红色序列为供体载体的序列;
636.第四排序列表示完成了外源基因(t2a-egfp)在actb基因的终止密码子前定点敲入的序列,其中,游离的“t”碱基被切除,实现了开放阅读框的连续和蛋白的融合表达。
637.图9c显示hdr和epti介导外源基因(t2a-egfp)在actb基因的终止密码子前定点敲入的效率比较。
638.图9d为对报告基因egfp(5’端和3’端)与基因组dna连接处的核苷酸序列进行pcr鉴定的结果。
639.序列信息
640.本发明涉及的部分序列的信息提供于下面的表1中。
641.表1:序列的描述
642.643.644.645.646.647.648.649.具体实施方式
650.现参照下列意在举例说明本发明(而非限定本发明)的实施例来描述本发明。
651.除非特别指明,否则基本上按照本领域内熟知的以及在各种参考文献中描述的常规方法进行实施例中描述的实验和方法。例如,本发明中所使用的免疫学、生物化学、化学、分子生物学、微生物学、细胞生物学、基因组学和重组dna等常规技术,可参见萨姆布鲁克(sambrook)、弗里奇(fritsch)和马尼亚蒂斯(maniatis),《分子克隆:实验室手册》(molecular cloning:a laboratory manual),第2次编辑(1989);《当代分子生物学实验手册》(current protocols in molecular biology)(f.m.奥苏贝尔(f.m.ausubel)等人编辑,(1987));《酶学方法》(methods in enzymology)系列(学术出版公司):《pcr 2:实用方
法》(pcr 2:a practical approach)(m.j.麦克弗森(m.j.macpherson)、b.d.黑姆斯(b.d.hames)和g.r.泰勒(g.r.taylor)编辑(1995)),以及《动物细胞培养》(animal cell culture)(r.i.弗雷谢尼(r.i.freshney)编辑(1987))。
652.另外,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。本领域技术人员知晓,实施例以举例方式描述本发明,且不意欲限制本发明所要求保护的范围。本文中提及的全部公开案和其他参考资料以其全文通过引用合并入本文。
653.实施例1.使用epti系统将外源基因定点插入人gapdh基因
654.为了验证epti系统将外源基因定点插入基因组的效果,本实施例设计了如下实验:使用epti系统将报告基因ires-egfp定点敲入人基因组gapdh的3’utr区,并且以hiti系统作为对照。epti系统定点插入外源基因的原理如图1所示,在人细胞基因组的gapdh基因中定点敲入外源基因(ires-egfp)的具体流程如图3所示。
655.gapdh基因位于12号染色体,编码甘油醛-3-磷酸脱氢酶,是重要的管家基因,在293t细胞中的表达丰度高。报告基因被敲入gapdh的3’utr区后能够随gapdh基因一起转录,并且,其中的ires序列可以招募核糖体,从而使egfp得以表达。egfp的荧光信号可方便地通过荧光显微镜直接观察和定量,并且表达egfp的细胞可通过流式细胞术进行捕捉和定量。
656.本实施例使用的pcag-cas9-mcherry质粒(其能够表达cas9蛋白(seq id no:1)和mcherry蛋白(seq id no:2))和puc19-u6-grna(其能够转录缺少引导序列的grna(seq id no:3))均获自中国科学院动物研究所李伟课题组。
657.从addgene公司的pcmv-pe2(#132775)质粒上扩增得到编码mlv-tr(seq id no:4)的核苷酸片段,且从pcag-cas9-mcherry质粒上扩增出编码cas9的部分核苷酸片段和编码mcherry的核苷酸片段。通过in-fusion克隆技术将上述扩增的核苷酸片段连接到asci/bsrgi双酶切的pcag-cas9-mcherry质粒上,得到pcag-cas9-mlv rt-mcherry质粒,其能够表达cas9蛋白,mlv-tr蛋白和mcherry蛋白。
658.将引物gapdh-grna-f(seq id no:5)和gapdh-grna-r(seq id no:6)退火并用t4连接酶连接到用bsai酶切的puc19-u6-grna质粒上,得到puc19-u6-gapdh-grna质粒,其能够转录出gapdh-grna(seq id no:7),引导cas9蛋白靶向人gapdh位点的3’urt区。
659.将引物spacera-grna-f(seq id no:17)和spacera-grna-r(seq id no:18)退火并通过t4连接酶连接到用bsai酶切的puc19-u6-grna质粒载体上,得到puc19-u6-spacera-grna质粒,其能够转录出spacera-grna(seq id no:19),引导cas9蛋白靶向spacer a序列(seq id no:49)。
660.将引物spacerk-grna-f(seq id no:20)和spacerk-grna-r(seq id no:21)退火并通过t4连接酶连接到用bsai酶切的puc19-u6-grna质粒载体上,得到puc19-u6-spacerk-grna质粒,其能够转录出spacerk-grna(seq id no:22),引导cas9蛋白靶向spacer k序列(seq id no:50)。
661.将引物gapdh-pega-f(seq id no:23)和gapdh-pega-r(seq id no:24)进行重叠延伸pcr,得到的片段回收后通过in-fusion克隆技术连接到hindiii酶切的puc19-u6-spacera-grna质粒载体上,得到puc19-u6-gapdh-pega质粒,其能够转录出gapdh-pega(seq id no:25),引导cas9蛋白靶向spacera序列(seq id no:49)。
662.将引物gapdh-pegk-f(seq id no:26)和gapdh-pegk-r(seq id no:27)进行重叠延伸pcr,得到的片段回收后通过in-fusion克隆技术连接到hindiii酶切的puc19-u6-spacerk-grna质粒载体上,得到puc19-u6-gapdh-pegk质粒,其能够转录出gapdh-pegk(seq id no:28),引导cas9蛋白靶向spacerk序列(seq id no:50)。
663.报告基因ires-egfp(seq id no:47)由捷瑞公司合成,并通过t4连接酶连接到ecorv酶切的pgh载体(捷瑞公司提供)上,作为供体载体。报告基因的两侧分别具有spacera-grna/gapdh-pega和spacerk-grna/gapdh-pegk的识别和切割位点spacera和spacerk(序列分别为seq id no:49和seq id no:50)。
664.在epti系统的实施中,用invitrogen公司的lipofectamine 3000脂质体转染试剂将pcag-cas9-mlv rt-mcherry、gapdh-grna、gapdh-pega、gapdh-pegk连同供体载体转染到293t细胞中。在epti系统的阴性对照组中,将pcag-cas9-mlv rt-mcherry、gapdh-pega、gapdh-pegk连同供体载体转染到293t细胞中。293t细胞系来自atcc细胞库。转染24小时后在流式细胞仪分选mcherry阳性的细胞,分选得到的细胞继续培养5天后,用流式细胞仪分析egfp阳性细胞的比率。在hiti系统的实施中,用invitrogen公司的lipofectamine 3000脂质体转染试剂将pcag-cas9-mcherry、gapdh-grna、spacera-grna、spacerk-grna连同供体载体转染到293t细胞中。在hiti系统的阴性对照组中,将pcag-cas9-mcherry、spacera-grna、spacerk-grna连同供体载体转染到293t细胞中。转染24小时后在流式细胞仪分选mcherry阳性的细胞,分选得到的细胞继续培养5天后,用流式细胞仪分析egfp阳性细胞的比率。比较两个不同系统的egfp阳性细胞的比例,可以反应两个系统在gapdh基因的定点敲入的效率的差异。外源基因整合效率结果如图4a所示。结果显示,hiti系统中egfp阳性细胞的比率在5%以下,而epti系统中,egfp阳性细胞的比率超过60%。并且在去除gapdh-grna组分的阴性对照组中,hiti系统和epti系统均检测不到egfp阳性细胞,表明egfp阳性细胞可以反映供体载体上的外源基因ires-egfp在人gapdh靶位点的特异性整合。
665.提取egfp阳性细胞的基因组dna,然后分别用引物gapdh-p1(seq id no:68)/gapdh-p2(seq id no:69)、gapdh-p3(seq id no:70)/gapdh-p4(seq id no:71)对报告基因ires-egfp(5’端和3’端)与基因组dna连接处的核苷酸序列进行pcr鉴定和sanger法测序分析。
666.pcr鉴定结果如图4b所示。结果显示,所使用的引物对gapdh-p1/gapdh-p2和gapdh-p3/gapdh-p4能够以egfp阳性细胞的基因组dna为模板,扩增产生具有预期大小的两个扩增片段。sanger测序分析结果如图4c所示。结果显示,本技术的epti方法能够高效、定点、准确地介导外源基因连接到基因组dna的断裂末端。综上可知,本发明描述的epti系统可以大幅提高外源基因的定点整合效率。
667.实施例2.使用epti系统将外源基因定点插入人actb基因
668.为了验证epti系统将外源基因定点插入基因组的效果,本实施例设计了如下实验:使用epti系统将报告基因ires-egfp(seq id no:47)定点敲入人基因组actb的3’utr区,并且以hiti系统作为对照。人细胞基因组的actb基因中定点敲入外源基因(ires-egfp)的具体流程如图5所示。报告基因的合成与切割步骤同实施例1。
669.将引物actb-grna-f(seq id no:8)和actb-grna-r(seq id no:9)退火并用t4连接酶连接到用bsai酶切的puc19-u6-grna质粒上,得到puc19-u6-actb-grna质粒,其能够转
录出actb-grna(seq id no:10),引导cas9蛋白靶向人actb位点的3’urt区。
670.将引物actb-pega-f(seq id no:29)和actb-pega-r(seq id no:30)进行重叠延伸pcr,得到的片段回收后通过in-fusion克隆技术连接到hindiii酶切的puc19-u6-spacera-grna质粒载体上,得到puc19-u6-actb-pega质粒,其能够转录出actb-pega(seq id no:31),引导cas9蛋白靶向spacer a序列(seq id no:49)。
671.将引物actb-pegk-f(seq id no:32)和actb-pegk-r(seq id no:33)进行重叠延伸pcr,得到的片段回收后通过in-fusion克隆技术连接到hindiii酶切的puc19-u6-spacerk-grna质粒载体上,得到puc19-u6-actb-pegk质粒,其能够转录出actb-pegk(seq id no:34),引导cas9蛋白靶向spacer k序列(seq id no:50)。
672.在epti系统的实施中,用invitrogen公司的lipofectamine 3000脂质体转染试剂将pcag-cas9-mlv rt-mcherry、actb-grna、actb-pega、actb-pegk连同供体载体转染到293t细胞中。在epti系统的阴性对照组中,将pcag-cas9-mlv rt-mcherry、actb-pega、actb-pegk连同供体载体转染到293t细胞中。转染24小时后在流式细胞仪分选mcherry阳性的细胞,分选得到的细胞继续培养5天后,用流式细胞仪分析egfp阳性细胞的比率。在hiti系统的实施中,用invitrogen公司的lipofectamine 3000脂质体转染试剂将pcag-cas9-mcherry、actb-grna、spacera-grna、spacerk-grna连同供体载体转染到293t细胞中。在hiti系统的阴性对照组中,将pcag-cas9-mcherry、spacera-grna、spacerk-grna连同供体载体转染到293t细胞中。转染24小时后在流式细胞仪分选mcherry阳性的细胞,分选得到的细胞继续培养5天后,用流式细胞仪分析egfp阳性细胞的比率。比较两个不同系统的egfp阳性细胞的比例,可以反应两个系统在actb基因的定点敲入的效率的差异。不同方法的外源基因整合效率比较结果如图6a所示。结果显示,hiti系统中egfp阳性细胞的比率在8%以下,而epti系统中,egfp阳性细胞的比率超过50%。并且在去除actb-grna组分的阴性对照组中,hiti系统和epti系统均检测不到egfp阳性细胞,表明egfp阳性细胞可以反映供体载体上的外源基因ires-egfp在人actb靶位点的特异性整合。
673.提取egfp阳性细胞的基因组dna,然后分别用引物actb-p1(seq id no:72)/actb-p2(seq id no:73)、actb-p3(seq id no:74)/actb-p4(seq id no:75)对报告基因ires-egfp(5’端和3’端)与基因组dna连接处的核苷酸序列进行pcr鉴定和sanger法测序分析。
674.pcr鉴定结果如图6b所示。结果显示,所使用的引物对actb-p1/actb-p2、actb-p3/actb-p4能够以egfp阳性细胞的基因组dna为模板,扩增产生具有预期大小的两个扩增片段。sanger法测序分析结果如图6c所示。结果显示,本技术的epti方法能够高效、定点、准确地介导外源基因连接到基因组dna的断裂末端。综上可知,本发明描述的epti系统可以大幅提高外源基因的定点整合效率。
675.实施例3.使用epti系统用外源基因定点置换人gapdh基因中的核苷酸片段
676.为了验证epti系统将外源基因定点置换入基因组的效果,本实施例设计了如下实验:使用epti系统将含有报告基因t2a-egfp的dna片段(seq id no:48)定点置换人基因组gapdh基因的一段dna序列,并且以hiti系统作为对照。epti方法介导外源基因替换基因组的特定核苷酸片段的原理的示意图如图2所示,含有外源基因(t2a-egfp)的靶核酸片段定点置换人细胞基因组的gapdh基因中的核苷酸片段的具体流程如图7所示。报告基因的合成与切割步骤与实施例1中描述的类似。
677.将引物gapdhrc-grna-f(seq id no:11)和gapdhrc-grna-f(seq id no:12)退火并用t4连接酶连接到用bsai酶切的puc19-u6-grna质粒上,得到puc19-u6-gapdhrc-grna质粒,其能够转录出gapdhrc-grna(seq id no:13),引导cas9蛋白靶向人gapdh基因的4号和5号外显子之间的内含子区。
678.将引物gapdhrt-grna-f(seq id no:14)和gapdhrt-grna-r(seq id no:15)退火并用t4连接酶连接到用bsai酶切的puc19-u6-grna质粒上,得到puc19-u6-gapdhrt-grna质粒,其能够转录出gapdhrt-grna(seq id no:16),引导cas9蛋白靶向人gapdh基因的下游区域。
679.将引物gapdhrc-pegrna-f(seq id no:35)和gapdhrc-pegrna-f(seq id no:36)进行重叠延伸pcr,得到的片段回收后通过in-fusion克隆技术连接到hindiii酶切的puc19-u6-gapdhrc-grna质粒载体上,得到puc19-u6-gapdhrc-pegrna质粒,其能够转录出gapdhrc-pegrna(seq id no:37),引导cas9蛋白靶向人gapdh基因的4号和5号外显子之间的内含子区。
680.将引物gapdhrt-pegrna-f(seq id no:38)和gapdhrt-pegrna-f(seq id no:39)进行重叠延伸pcr,得到的片段回收后通过in-fusion克隆技术连接到hindiii酶切的puc19-u6-gapdhrt-grna质粒载体上,得到puc19-u6-gapdhrt-pegrna质粒,其能够转录出gapdhrt-pegrna(seq id no:40),引导cas9蛋白靶向人gapdh基因的下游区域。
681.将引物gapdhrc-pega-f(seq id no:41)和gapdhrc-pega-r(seq id no:42)进行重叠延伸pcr,得到的片段回收后通过in-fusion克隆技术连接到hindiii酶切的puc19-u6-spacera-grna质粒载体上,得到puc19-u6-gapdhrc-pega质粒,其能够转录出gapdhrc-pega(seq id no:43),引导cas9蛋白靶向spacera序列(seq id no:49)。
682.将引物gapdhrt-pegk-f(seq id no:44)和gapdhrt-pegk-r(seq id no:45)进行重叠延伸pcr,得到的片段回收后通过in-fusion克隆技术连接到hindiii酶切的puc19-u6-spacerk-grna质粒载体上,得到puc19-u6-gapdhrt-pegk质粒,其能够转录出gapdhrt-pegk(seq id no:46),引导cas9蛋白靶向spacerk序列(seq id no:50)。
683.含报告基因t2a-egfp的外源基因片段(seq id no:48)由捷瑞公司合成,并通过t4连接酶连接到ecorv酶切的pgh载体(捷瑞公司提供)上,作为供体载体。报告基因的两侧分别具有spacera-grna/gapdh-pega和spacerk-grna/gapdh-pegk的识别和切割位点spacera和spacerk(序列分别为seq id no:49和seq id no:50)。
684.在epti系统的实施中,用invitrogen公司的lipofectamine 3000脂质体转染试剂将pcag-cas9-mlv rt-mcherry、gapdhrc-pegrna、gapdhrt-pegrna、gapdhrc-pega、gapdhrt-pegk、连同供体载体转染到293t细胞中。在epti系统的阴性对照组中,将pcag-cas9-mlv rt-mcherry、gapdhrc-pega、gapdhrt-pegk连同供体载体转染到293t细胞中。转染24小时后在流式细胞仪分选mcherry阳性的细胞,分选得到的细胞继续培养5天后,用流式细胞仪分析egfp阳性细胞的比率。在hiti系统的实施中,用invitrogen公司的lipofectamine 3000脂质体转染试剂将pcag-cas9-mcherry、gapdhrc-grna、gapdhrt-grna、spacera-grna、spacerk-grna连同供体载体转染到293t细胞中。在hiti系统的阴性对照组中,将pcag-cas9-mcherry、spacera-grna、spacerk-grna连同供体载体转染到293t细胞中。转染24小时后在流式细胞仪分选mcherry阳性的细胞,分选得到的细胞继续培养5天
后,用流式细胞仪分析egfp阳性细胞的比率。比较两个不同系统的egfp阳性细胞的比例,可以反应两个系统在gapdh基因的定点置换的效率的差异。
685.实验结果如图8所示,hiti系统中egfp阳性细胞的比率在3%左右,而epti系统中,egfp阳性细胞的比率高于30%。并且在去除靶向gapdh基因的sgrna/pegrna组分的阴性对照组中,hiti系统和epti系统均检测不到egfp阳性细胞,表明egfp阳性细胞可以反映供体载体上整合了t2a-egfp的外源基因片段在人gapdh靶位点与基因组片段发生了定点置换。综上可知,本发明描述的epti系统可以大幅提高外源基因在人gapdh基因位点定点置换的效率。
686.实施例4.使用epti系统将外源基因定点插入actb基因的终止密码子前,以表达actb-t2a-egfp融合蛋白
687.为了进一步验证epti系统将外源基因精确定点插入基因组的效果,本实施例设计了如下实验:使用epti系统将报告基因t2a-egfp(seq id no:82)定点敲入293t细胞actb基因的终止密码子之前,并且以hdr系统作为对照。在293t细胞基因组的actb基因中定点敲入外源基因(t2a-egfp)的流程如图9a和9b所示。
688.如图9b所示,actb基因被靶向的切割位点并不在最后一个编码密码子和终止密码子之间,而是在终止密码子的碱基“t”和碱基“a”之间。为了使外源基因片段(t2a-egfp)能够正好插入到actb基因的最后一个编码密码子之后,与actb基因融合表达,在基因组的编辑过程中需要将终止密码子的碱基“t”去除。为此目的,设计pegrna中的标签序列,使得所产生的外源基因片段上的悬突(第一悬突)与actb基因被靶向切割的位点上游互补;也即,使得第一悬突所靶向结合的基因组序列与actb基因被靶向切割的位点之间存在间隔序列(在本实施例中,间隔序列即为需要去除的碱基“t”)。借助于该设计,第一悬突在与其靶向结合的基因组序列链间退火后,间隔序列将呈游离状态,并会被切除;由此,外源基因片段(t2a-egfp)能够精确地连接到actb基因最后一个编码密码子之后。
689.本实施例使用的pcag-cas9-mcherry质粒、pcag-cas9-mlv rt-mcherry与实施例1相同。
690.将引物sgactb2-f(seq id no:53)和sgactb2-r(seq id no:54)退火并用t4连接酶连接到用bsai酶切的puc19-u6-grna质粒上,得到puc19-u6-sgactb2质粒,其能够转录出sgactb2(seq id no:55),引导cas9蛋白靶向切割293t细胞actb基因的特异位点(即,在actb基因终止密码子的碱基“t”和碱基“a”之间进行切割)。
691.将引物actb2-sgl-f(seq id no:56)和actb2-sgl-r(seq id no:57)退火并通过t4连接酶连接到用bsai酶切的puc19-u6-grna质粒载体上,得到puc19-u6-actb2-sgl质粒,其能够转录出actb2-sgl(seq id no:58)。
692.将引物actb2-sgr-f(seq id no:59)和actb2-sgr-r(seq id no:60)退火并通过t4连接酶连接到用bsai酶切的puc19-u6-grna质粒载体上,得到puc19-u6-actb2-sgr质粒,其能够转录出actb2-sgr(seq id no:61)。
693.将引物actb2-pegl-f(seq id no:62)和actb2-pegl-r(seq id no:63)进行重叠延伸pcr,得到的片段回收后通过in-fusion克隆技术连接到hindiii酶切的puc19-u6-actb2-sgl质粒载体上,得到puc19-u6-actb2-pegl质粒,其能够转录出actb2-pegl(seq id no:64),引导cas9蛋白靶向spacer l序列(seq id no:80)。
694.将引物actb2-pegr-f(seq id no:65)和actb2-pegr-r(seq id no:66)进行重叠延伸pcr,得到的片段回收后通过in-fusion克隆技术连接到hindiii酶切的puc19-u6-actb-pegr质粒载体上,得到puc19-u6-actb-pegr质粒,其能够转录出actb2-pegr(seq id no:67),引导cas9蛋白靶向spacerr序列(seq id no:81)。
695.报告基因t2a-egfp(seq id no:82)由捷瑞公司合成,并通过t4连接酶连接到ecorv酶切的pgh载体(捷瑞公司提供)上,作为供体载体。对于epti系统的供体载体,报告基因t2a-egfp的两侧分别具有spacer l序列(seq id no:80),与t2a-egfp基因反向;和spacer r序列(seq id no:81),与t2a-egfp基因同向。对于hdr系统的供体载体,报告基因t2a-egfp的两侧分别具有左侧同源臂actb2 lha(seq id no:83)和右侧同源臂actb2 rha(seq id no:84)。
696.在使用epti系统的实验中,用invitrogen公司的lipofectamine 3000脂质体转染试剂将pcag-cas9-mlv rt-mcherry、u6-sgactb2、u6-actb2-pegl、u6-actb2-pegr连同供体载体转染到293t细胞中。在epti系统的阴性对照组中,将pcag-cas9-mlv rt-mcherry、u6-actb2-pegl、u6-actb2-pegr连同供体载体转染到293t细胞中。在使用hdr系统的实验中,用invitrogen公司的lipofectamine 3000脂质体转染试剂将pcag-cas9-mcherry、u6-sgactb2连同hdr供体载体转染到293t细胞中。在hdr系统的阴性对照组中,将pcag-cas9-mcherry连同hdr供体载体转染到293t细胞中。293t细胞系来自atcc细胞库。转染24小时后在流式细胞仪分选mcherry阳性的细胞,即为成功转染的细胞。分选得到的细胞继续培养5天后,用流式细胞仪分析egfp阳性细胞的比率。比较两个不同系统的egfp阳性细胞的比例,可以反应不同系统在actb基因上定点敲入的效率的差异。使用不同方法插入外源基因的效率的比较结果如图9c所示。结果显示,在使用epti系统的情况下,egfp阳性细胞的比率在30%左右,明显高于使用hdr系统的方法。
697.将培养5天后的egfp阳性细胞进行基因组dna提取,然后分别用引物actb2-p1(seq id no:76)/actb2-p2(seq id no:77)、actb2-p3(seq id no:78)/actb2-p4(seq id no:79)对报告基因egfp(5’端和3’端)与基因组dna连接处的核苷酸序列进行pcr鉴定。
698.pcr鉴定结果如图9d所示。结果显示,所使用的引物对actb2-p1/actb2-p2、actb2-p3/actb2-p4能够以egfp阳性细胞的基因组dna为模板,扩增产生具有预期大小的两个扩增片段。这些结果表明,本发明的epti系统可以将外源基因(t2a-egfp)定点、准确地插入293t细胞actb基因的特定位置处。此外,这些结果还标明,在悬突所靶向结合的基因组序列与基因组被靶向切割的位点之间存在间隔的情况下,本发明的epti系统仍然可以大幅提高外源基因在靶基因组中的定点整合效率。
699.尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公布的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部分为由所附权利要求及其任何等同物给出。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1