一种非变性II型胶原蛋白的制备方法与流程
一种非变性ii型胶原蛋白的制备方法
技术领域
1.本发明公开的是一种从动物软骨中提取胶原蛋白的方法,涉及食品生物技术领域,尤其涉及一种非变性ii型胶原蛋白的制备方法。
背景技术:
2.胶原蛋白是一种广泛分布于哺乳动物体内的结构性蛋白,是构成皮肤、骨骼和关节等组织的重要组成部分,同时也是多细胞动物细胞外基质的主要成分之一。目前已知的胶原蛋白种类已有二十余种,根据组织分类可分为间隙胶原蛋白、基膜胶原蛋白和软骨胶原蛋白三大类,其中ii型胶原蛋白主要分布于关节软骨中,少量存在于玻璃体、胚胎角膜等部位。
3.ii型胶原蛋白是由三股缠绕的多肽链组成,由于其具备稳定的三螺旋结构,因此,在体内主要起到支撑器官、保护机体的作用。近年来的研究表明,ii型胶原蛋白因其可作为关节的结构和功能性营养素,具有低免疫原性和生物相容性好等特点
1.,受到消费者的广泛关注。
4.目前市售的ii型胶原蛋白产品,多为完全酶解的胶原蛋白产品。由于提取工艺和制剂工艺的局限,在酶、高温等因素作用下,ii型胶原蛋白丧失原有的三螺旋结构,胶原蛋白被分解为20,000道尔顿以下的多肽和氨基酸,失去原有对类风湿关节炎和关节炎的预防及辅助治疗功能
2.。
5.目前,国内外已公开多种非变性ii型胶原蛋白的制备工艺,例如cn106916870a公开的一种含非变性ii型胶原蛋白的软骨提取物的制备方法,通过脱脂、消毒、匀浆、酶解、过滤、干燥等步骤;其中,在所述酶解步骤中:将在匀浆步骤中获得的浆状物的ph调节为2.5~8.5,加入软骨重量的0.001%~2%的酶,加入软骨重量的1/20~1/500的木瓜和/或菠萝低温榨汁后过滤获得的清液,酶解12~48h。李洁,朱大开和龚辉(李洁, 朱大开, 龚辉. 非变性ⅱ型胶原蛋白生产方法.),采用胃蛋白酶先对软骨除杂24h,再进行酶解提取24h得到可溶性非变性ii型胶原蛋白。us7083820公开的一种生物活性产品的生产方法,鸡胸骨通过清洗、消毒、切碎、混合(无机盐)、干燥等步骤,其中上述所述步骤是在110℉以下操作,得到不改变生物活性产品原始结构的ii型胶原蛋白。
6.但已公开的技术方法及制备的非变性ii型胶原蛋白依然存在问题:一产品在溶液中悬浮性能差,易分层;二是产品制备提取经过蛋白酶或酶提取原料进行长时间的充分水解,非变性ii胶原蛋白含量较低,且提取时间长,不利于工业生产推广。
技术实现要素:
7.本发明提供了一种非变性ii型胶原蛋白的制备方法,旨在解决上述问题中的一个或多个问题。
8.具体技术方案如下:本发明提供了一种非变性ii型胶原蛋白的制备方法,它的特征是依次包括以下步
骤:(1)选材:所选原料为新鲜鸡胸软骨,手工剔除脂肪和肌肉后,切取距离鸡胸软骨尖端3厘米以内部分备用;(2)清洗:使用温度不高于37℃的清水清洗步骤(1)中切取备用的软骨;(3)粉碎:将步骤(2)中经清洗的软骨沥干后,使用粉碎机将软骨粉碎为2 mm以下的软骨颗粒;(4)酶解:向步骤(3)所得软骨颗粒中加水,加水量为软骨颗粒质量的0.5~3倍(m/v),使用酸液或碱液调节料液ph值在2.0~4.0之间,加入软骨颗粒重量1.0~5.0%的胃蛋白酶,酶解温度不超过37℃,搅拌并酶解0.5~2.0 h;酶解结束后,使用碱液调节ph值至8.5~9.5,静置15~60 min;(5)过滤:使用20 ~ 60目筛过滤步骤(4)中的酶解液,收集筛上物;(6)干燥:将筛上物进行真空干燥或冷冻干燥,干燥后获得干燥品;(7)粉碎:将干燥品进行粉碎,经60~200目筛网过筛,取筛下物,得非变性ii型胶原蛋白粉末。
9.本发明的上述方案中,首先通过对原料进行选择,选取鸡胸软骨,并选择距离骨尖端3厘米以内,结合对工艺的改进,尤其是酶解步骤的改进,可以获得蛋白含量大于15%的非变性ii型胶原蛋白。而且提取过程快速、简便:总提取时间不超过4 h。
10.更加优选,原料选用鸡胸软骨尖端1.5厘米以内。
11.作为优选,所述胃蛋白酶通过负载载体加入,所述负载载体为食品级二氧化硅。本方案中,胃蛋白酶通过负载载体的形式加入,能够有效控制酶解程度,结合胃蛋白酶的浓度以及酶解时间,得到的非变性ii胶原蛋白含量高。
12.作为优选,所述胃蛋白酶与所述负载载体的添加比例为0.3~0.6:15。
13.作为优选,步骤(4)中在软骨颗粒中加水后,先进行打浆,再使用酸液或碱液调节料液ph值在2.0~4.0之间。
14.作为优选,打浆温度控制在25℃以下。
15.作为优选,步骤(2)中清洗次数为1~3次,每次10 ~15min。
16.作为优选,酶解温度为30℃~32℃。
17.通过本发明的提取方法获得非变性ii型胶原蛋白。
18.与现有技术相比,本发明的优点在于:(1)提取过程快速、简便:总提取时间不超过4 h,与现有技术24 h以上的长时间提取相比,制备时间明显缩短;(2)非变性ii型胶原蛋白含量高,产品性能好:通过本发明所述方法制备的非变性ii型胶原蛋白,非变性ii型胶原蛋白含量大于15%,在水溶液中吸水倍数为10~12倍,体积膨胀率为5~7倍;(3)在水溶液中悬浮性能好,不易分层,除可应用于硬胶囊、片剂外,还适合软胶囊、固体饮料、凝胶糖果等剂型。
附图说明
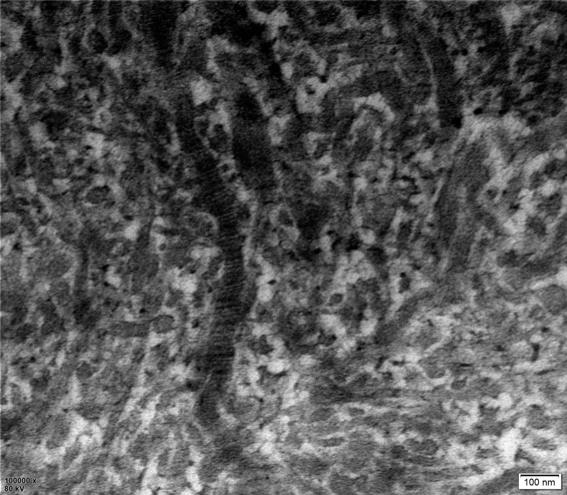
19.图1为本发明从动物软骨中提取的非变性ii型胶原蛋白,在透射电镜下的天然胶
原蛋白特征性、规律性横纹组织图片。
具体实施方式
20.下面结合实施例进一步说明本发明的实质性内容,但并不以此限定本发明保护范围。尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
21.实施例1(1)选材:选择新鲜鸡胸骨,手工剔去脂肪和肌肉后,切取距离尖端1 cm以内部位的软骨1.0kg;(2)清洗:使用不高于37℃的清水清洗1~3次,每次10 min;沥干;(3)粉碎:将步骤(2)中经清洗的软骨沥干后,使用粉碎机将软骨粉碎为2 mm以下的软骨颗粒;(4)酶解:将步骤(3)所得软骨颗粒投入反应罐,加入1 l清水,温度控制在35℃,使用酸液或碱液调节料液ph值在3.0~4.0之间,加入20 g胃蛋白酶,搅拌并酶解2.0 h;酶解结束后,使用碱液调节ph值至9.0,静置30 min;(5)过滤:使用40目筛过滤步骤(4)中的酶解液,收集筛上物;(6)干燥:将筛上物进行冷冻干燥,干燥后获得干燥品s1,共计91.6 g。;(7)粉碎:将干燥品进行粉碎,经100目标准筛过筛,取筛下物。
22.采用《卫生部药品标准生化药品》89年版第一册氨基己糖法检测糖胺聚糖,糖胺聚糖含量为22.3%(以硫酸软骨素计,系数按2.82计);采用gb 5009.5的方法检测,总蛋白质含量为79.1%(蛋白质折算系数按5.79计);采用gb/t 9695.23的方法检测,羟脯氨酸含量6.8%;采用elisa试剂盒检测非变性ii型胶原蛋白含量为21.88%。
23.吸水倍数检测:称取上述筛下物20 g至带刻度的量入式量筒中,加入纯化水至样品全部湿润呈胶状,产品体积由42 ml迅速膨胀至260 ml,体积膨胀6.2倍,使用定量滤纸过滤除去自由水,湿润后产品质量为276.1 g,吸水256.1 g,为产品自身重的12.8倍。
24.悬浮能力测试:取上述筛下物20 g,用纯化水配制成5%(w/v)液体,静置2 h,未分层。
25.实施例2(1)选材:选择新鲜鸡胸骨,手工剔去脂肪和肌肉后,切取距离尖端2~3 cm以内部位的软骨1.0 kg;(2)清洗:使用不高于37℃的清水清洗1~3次,每次10 min;沥干;(3)粉碎:将步骤(2)中经清洗的软骨沥干后,使用粉碎机将软骨粉碎为2 mm以下的软骨颗粒;(4)酶解:将步骤(3)所得软骨颗粒投入反应罐,加入1 l清水,温度控制在35 ℃,使用酸液或碱液调节料液ph值在3.0~4.0之间,加入30 g胃蛋白酶,搅拌并酶解2.0 h;酶解结束后,使用碱液调节ph值至9.0,静置30 min;(5)过滤:使用40目筛过滤步骤(4)中的酶解液,收集筛上物;(6)干燥:将筛上物进行冷冻干燥,干燥后获得干燥品s2,共计81.5 g;(7)粉碎:将干燥品进行粉碎,经100目标准筛过筛,取筛下物。
26.采用《卫生部药品标准生化药品》89年版第一册氨基己糖法检测糖胺聚糖,糖胺聚糖含量为28.9%(以硫酸软骨素计,系数按2.82计);采用gb 5009.5的方法检测,总蛋白质含量为70.3%(蛋白质折算系数按5.79计);采用gb/t 9695.23的方法检测,羟脯氨酸含量5.2 %;采用elisa试剂盒检测非变性ii型胶原蛋白含量为16.77%。
27.吸水倍数检测:称取上述筛下物20 g至带刻度的量入式量筒中,加入纯化水至样品全部湿润呈胶状,产品体积由39 ml迅速膨胀至200 ml,体积膨胀5.1倍,使用定量滤纸过滤除去自由水,湿润后产品质量为252.2 g,吸水232.2 g,为产品自身重的11.6倍。
28.悬浮能力测试:取上述筛下物20 g,用纯化水配制成5%(w/v)液体,静置2 h,未分层。
29.实施例3(1)选材:选择新鲜鸡胸骨,手工剔去脂肪和肌肉后,切取距离尖端3 cm以内部位的软骨1.0 kg;(2)清洗:使用不高于37℃的清水清洗1~3次,每次10 min;沥干;(3)粉碎:将步骤(2)中经清洗的软骨沥干后,使用粉碎机将软骨粉碎为2 mm以下的软骨颗粒;(4)酶解:将步骤(3)所得软骨颗粒投入反应罐,加入1 l清水,温度控制在35 ℃,使用酸液或碱液调节料液ph值在3.0~4.0之间,加入50 g胃蛋白酶,搅拌并酶解2.0 h;酶解结束后,使用碱液调节ph值至9.0,静置30 min;(5)过滤:使用40目筛过滤步骤(4)中的酶解液,收集筛上物;(6)干燥:将筛上物进行冷冻干燥,干燥后获得干燥品s3,共计90.1 g;(7)粉碎:将干燥品进行粉碎,经100目标准筛过筛,取筛下物。
30.采用《卫生部药品标准生化药品》89年版第一册氨基己糖法检测糖胺聚糖,糖胺聚糖含量为25.2%(以硫酸软骨素计,系数按2.82计);采用gb 5009.5的方法检测,总蛋白质含量为74.5%(蛋白质折算系数按5.79计);采用gb/t 9695.23的方法检测,羟脯氨酸含量5.9 %;采用elisa试剂盒检测非变性ii型胶原蛋白含量为18.81%。
31.吸水倍数检测:称取上述产品20 g至带刻度的量入式量筒中,加入纯化水至样品全部湿润呈胶状,产品体积由40 ml迅速膨胀至212 ml,体积膨胀5.3倍,使用定量滤纸过滤除去自由水,湿润后产品质量为266.1 g,吸水246.1 g,为产品自身重的12.3倍。
32.悬浮能力测试:取上述产品20 g,用纯化水配制成5%(w/v)液体,静置2 h,未分层。
33.实施例4(1)选材:选择新鲜鸡胸骨,手工剔去脂肪和肌肉后,切取距离尖端3 cm以内部位的软骨1.0 kg;(2)清洗:使用不高于37℃的清水清洗1~3次,每次10 min;沥干;(3)粉碎:将步骤(2)中经清洗的软骨沥干后,使用粉碎机将软骨粉碎为2 mm以下的软骨颗粒;(4)酶解:将步骤(3)所得软骨颗粒加入1 l清水,25℃以下打浆,浆液投入反应罐,温度控制在35 ℃,使用酸液或碱液调节料液ph值在3.0~4.0之间,加入负载胃蛋白酶的食品级二氧化硅,胃蛋白酶10 g,食品级二氧化硅500g,搅拌并酶解2.0 h;酶解结束后,使用碱液调节ph值至9.0,静置30 min;
(5)过滤:使用40目筛过滤步骤(4)中的酶解液,收集筛上物;(6)干燥:将筛上物进行冷冻干燥,干燥后获得干燥品s3,共计86.2g;(7)粉碎:将干燥品进行粉碎,经100目标准筛过筛,取筛下物。
34.采用《卫生部药品标准生化药品》89年版第一册氨基己糖法检测糖胺聚糖,糖胺聚糖含量为24.8%(以硫酸软骨素计,系数按2.82计);采用gb 5009.5的方法检测,总蛋白质含量为75.1%(蛋白质折算系数按5.79计);采用gb/t 9695.23的方法检测,羟脯氨酸含量5.9 %;采用elisa试剂盒检测非变性ii型胶原蛋白含量为23.2%。
35.吸水倍数检测:称取上述产品20 g至带刻度的量入式量筒中,加入纯化水至样品全部湿润呈胶状,产品体积由40 ml迅速膨胀至256 ml,体积膨胀6.4倍,使用定量滤纸过滤除去自由水,湿润后产品质量为278.2 g,吸水258.2 g,为产品自身重的12.9倍。
36.悬浮能力测试:取上述产品20 g,用纯化水配制成5%(w/v)液体,静置2 h,未分层。
37.实施例5(1)选材:选择新鲜鸡胸骨,手工剔去脂肪和肌肉后,切取距离尖端3 cm以内部位的软骨1.0 kg;(2)清洗:使用不高于37℃的清水清洗1~3次,每次10 min;沥干;(3)粉碎:将步骤(2)中经清洗的软骨沥干后,使用粉碎机将软骨粉碎为2 mm以下的软骨颗粒;(4)酶解:将步骤(3)所得软骨颗粒加入1 l清水,25℃以下打浆,浆液投入反应罐,温度控制在35 ℃,使用酸液或碱液调节料液ph值在3.0~4.0之间,加入负载胃蛋白酶的食品级二氧化硅,胃蛋白酶20 g,食品级二氧化硅500g,搅拌并酶解2.0 h;酶解结束后,使用碱液调节ph值至9.0,静置30 min;(5)过滤:使用40目筛过滤步骤(4)中的酶解液,收集筛上物;(6)干燥:将筛上物进行冷冻干燥,干燥后获得干燥品s3,共计86.2g;(7)粉碎:将干燥品进行粉碎,经100目标准筛过筛,取筛下物。
38.采用《卫生部药品标准生化药品》89年版第一册氨基己糖法检测糖胺聚糖,糖胺聚糖含量为25.0%(以硫酸软骨素计,系数按2.82计);采用gb 5009.5的方法检测,总蛋白质含量为75.1%(蛋白质折算系数按5.79计);采用gb/t 9695.23的方法检测,羟脯氨酸含量5.8 %;采用elisa试剂盒检测非变性ii型胶原蛋白含量为23.5%。
39.吸水倍数检测:称取上述产品20 g至带刻度的量入式量筒中,加入纯化水至样品全部湿润呈胶状,产品体积由40 ml迅速膨胀至260ml,体积膨胀6.5倍,使用定量滤纸过滤除去自由水,湿润后产品质量为282g,吸水262 g,为产品自身重的13.1倍。
40.悬浮能力测试:取上述产品20 g,用纯化水配制成5%(w/v)液体,静置2 h,未分层。
41.比较例1(1)选材:选择新鲜鸡胸骨,手工剔去脂肪和肌肉后,切取距离尖端3 cm以外部位的软骨1.0 kg;(2)清洗:使用不高于37℃的清水清洗1~3次,每次10 min;沥干;(3)粉碎:将步骤(2)中经清洗的软骨沥干后,使用粉碎机将软骨粉碎为2 mm以下的软骨颗粒;(4)酶解:将步骤(3)所得软骨颗粒投入反应罐,加入1 l清水,温度控制在35 ℃,
使用酸液或碱液调节料液ph值在3.0~4.0之间,加入20 g胃蛋白酶,搅拌并酶解2.0 h;酶解结束后,使用碱液调节ph值至9.0,静置30 min;(5)过滤:使用40目筛过滤步骤(4)中的酶解液,收集筛上物;(6)干燥:将筛上物进行冷冻干燥,干燥后获得干燥品d1,共计90.1 g;(7)粉碎:将干燥品进行粉碎,经100目标准筛过筛,取筛下物。
42.采用《卫生部药品标准生化药品》89年版第一册氨基己糖法检测糖胺聚糖,糖胺聚糖含量为33.1%(以硫酸软骨素计,系数按2.82计);采用gb 5009.5的方法检测,总蛋白质含量为64.2%(蛋白质折算系数按5.79计);采用gb/t 9695.23的方法检测,羟脯氨酸含量4.1 %;采用elisa试剂盒检测非变性ii型胶原蛋白含量为6.71%。
43.吸水倍数检测:称取上述产品20 g至带刻度的量入式量筒中,加入纯化水至样品全部湿润呈胶状,产品体积由38 ml迅速膨胀至156 ml,体积膨胀4.1倍,使用定量滤纸过滤除去自由水,湿润后产品质量为208.1 g,吸水188.1 g,为产品自身重的9.4倍。
44.悬浮能力测试:取上述产品20 g,用纯化水配制成5%(w/v)液体,静置0.5 h,悬浮液开始分层,静置1.25 h,悬浮液呈1:1分层。
45.比较例2(1)选材:选择1.0 kg新鲜鸡胸骨,手工剔去脂肪和肌肉;(2)清洗:使用不高于37℃的清水清洗1~3次,每次10 min;沥干;(3)粉碎:将步骤(2)中经清洗的软骨沥干后,使用粉碎机将软骨粉碎为2 mm以下的软骨颗粒;(4)酶解:将步骤(3)所得软骨颗粒投入反应罐,加入1 l清水,温度控制在35 ℃,使用酸液或碱液调节料液ph值在3.0~4.0之间,加入20 g胃蛋白酶,搅拌并酶解2.0 h;酶解结束后,使用碱液调节ph值至9.0,静置30 min;(5)过滤:使用40目筛过滤步骤(4)中的酶解液,收集筛上物;(6)干燥:将筛上物进行冷冻干燥,干燥后获得干燥品d2,共计93.6 g;(7)粉碎:将干燥品进行粉碎,经100目标准筛过筛,取筛下物。
46.采用《卫生部药品标准生化药品》89年版第一册氨基己糖法检测糖胺聚糖,糖胺聚糖含量为30.4%(以硫酸软骨素计,系数按2.82计);采用gb 5009.5的方法检测,总蛋白质含量为66.2%(蛋白质折算系数按5.79计);采用gb/t 9695.23的方法检测,羟脯氨酸含量4.7 %;采用elisa试剂盒检测非变性ii型胶原蛋白含量为6.9%。
47.吸水倍数检测:称取上述产品20 g至带刻度的量入式量筒中,加入纯化水至样品全部湿润呈胶状,产品体积由38 ml迅速膨胀至170 ml,体积膨胀4.5倍,使用定量滤纸过滤除去自由水,湿润后产品质量为212.0 g,吸水192.0 g,为产品自身重的9.6倍。
48.悬浮能力测试:取上述产品20 g,用纯化水配制成5%(w/v)液体,静置47 min,悬浮液开始分层,静置65 min,悬浮液呈1:1分层。
49.针对不同取材部位,通过实施例4的方法制备非变性ii型胶原蛋白,其对应的产品性能如表1。
50.以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制。凡是根据发明技术实质对以上实施例所作的任何简单修改、变更以及等效变化,均仍属于本发明技术方案的保护范围内。
51.参考文献[1] 刘斌. 巴氏毕赤酵母基因工程菌高密度发酵表达重组人源胶原蛋白[d]. 南京理工大学, 2012.[2] trentham d e . autoimmunity to type ii collagen an experimental model of arthritis.[j]. journal of experimental medicine, 1977, 146(3):857
‑
868.。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1