一种纯化抗体的方法与流程
1.本公开涉及纯化抗体的方法的领域,具体地,是使用亲和层析、复合模式层析对抗体聚集体及非预期糖基化杂质进行去除的方法。
背景技术:
2.随着生物医药的不断发展,抗体药物显示出越来越重要的地位。对含有目标抗体培养物进行分离纯化是其生产过程中必不可少的步骤,如何通过优化抗体的纯化条件,进一步增加去除杂质的效率,提高抗体的纯度和收率是目前工业化生产中重要的问题。
3.双、多特异性抗体能够同时结合不同的抗原或者同一抗原的不同表位,具有良好的应用前景。双、多特异性抗体结构灵活多样,但存在稳定性欠佳、易产生聚集体及降解碎片,且此类杂质通常难以去除的问题。
4.随着细胞培养阶段抗体表达量不断提高,表达产物异质性更加明显,抗体纯化工艺面临更加严峻的挑战。糖基化是一种重要的翻译后修饰,与抗体序列、表达系统、培养基成分、培养工艺等因素均存在相关性。糖基化修饰会影响抗体的构象、稳定性、药代动力学、活性及免疫原性。非预期的糖基化杂质增加了抗体的异质性,且可能对产品的稳定性、安全性及有效性产生不利影响,因此需通过合适的纯化工艺进行去除。
5.抗体纯化工艺包含多个步骤,目前常用的是亲和层析、阳离子交换层析和阴离子交换层析等色谱分离方法。聚集体及非预期的糖基化杂质,通常与目标抗体分子理化性质极为接近,使用单一模式层析难以去除。因此针对不同的抗体,优化出合适的纯化工艺,尽可能降低聚集体及非预期糖基化杂质的含量,是目前需要迫切解决的技术问题。
技术实现要素:
6.本公开提供的抗体纯化方法能够有效去除抗体聚集体和糖基化杂质。
7.本公开提供了一种纯化抗体的方法,包括:利用a)亲和层析和b)复合模式层析,可选地,进一步包括将含有氨基酸的缓冲液与亲和层析填料和复合模式层析填料接触的步骤。一些实施方案中,含有氨基酸的缓冲液仅与亲和层析填料接触,或含有氨基酸的缓冲液仅与复合模式层析填料接触,或含有氨基酸的缓冲液与亲和层析填料和复合模式层析填料均接触。
8.一些实施方案中,氨基酸是碱性氨基酸。一些具体实施方案中,所述碱性氨基酸选自精氨酸、组氨酸、赖氨酸中的一种或多种,例如,所述氨基酸可以是精氨酸。
9.一些实施方案中,本公开的步骤a)亲和层析缓冲液中氨基酸的浓度为10
‑
100mm,步骤b)复合模式层析缓冲液中氨基酸的浓度为10
‑
50mm。
10.一些实施方案中,本公开的步骤a)亲和层析缓冲液中氨基酸的浓度为约100mm,步骤b)复合模式层析缓冲液中氨基酸的浓度为约20mm。
11.一些实施方案中,本公开的抗体存在糖基化位点。例如,所述糖基化位点是抗原结合片段上“asn
‑
x1
‑
x2”的特征序列,其中x1可为任意氨基酸,x2为丝氨酸、苏氨酸、半胱氨酸
中的任意一种。
12.一些实施方案中,本公开的方法能够去除抗体聚集体和糖基化杂质。
13.一些实施方案中,本公开提供纯化抗体的方法,包括以下步骤:a)亲和层析1)上样:将包含双特异性抗体的细胞培养澄清液加载到预处理好的亲和层析填料上;2)平衡:用平衡缓冲液清洗亲和层析填料;3)洗脱:用洗脱缓冲液洗脱,收集洗脱液。
14.b)复合模式层析1)上样:将调节后的亲和层析中间产物加载到预处理好的复合模式层析填料上;2)平衡:用平衡缓冲液清洗复合模式层析填料;3)洗脱:用洗脱缓冲液梯度洗脱,收集洗脱液。
15.其中,步骤a)中的洗脱缓冲液、步骤b)中的平衡缓冲液和洗脱缓冲液均含有氨基酸。一些实施方案中,氨基酸是碱性氨基酸。一些具体实施方案中,所述碱性氨基酸选自精氨酸、组氨酸、赖氨酸中的一种或多种,例如,所述氨基酸可以是精氨酸。
16.一些实施方案中,本公开的步骤a)洗脱缓冲液中氨基酸浓度为10
‑
100mm;步骤b)平衡缓冲液、洗脱缓冲液中氨基酸浓度为10
‑
50mm。
17.一些实施方案中,本公开的步骤a)洗脱缓冲液中氨基酸浓度为约100mm;步骤b)平衡缓冲液、洗脱缓冲液中氨基酸浓度为约20mm。
18.一些实施方案中,本公开的步骤a)亲和层析填料是protein a作为配基的填料,protein a配基交联到包括但不限于琼脂糖、聚丙烯酸树脂、聚苯乙烯二乙烯苯基树脂、聚甲基丙烯酸树脂、聚苯乙烯树脂、玻璃的基质上。
19.一些实施方案中,本公开的步骤a)亲和层析填料是mabselect prisma,即protein a配基交联到琼脂糖上。
20.一些实施方案中,本公开的步骤a)平衡缓冲液中的缓冲物质选自磷酸盐、磷酸、mes、柠檬酸或柠檬酸盐。
21.一些实施方案中,本公开的步骤a)平衡缓冲液中缓冲物质是磷酸盐,浓度为10
‑
50mm,例如,约10mm、约20mm、约30mm、约40mm、约50mm。
22.一些实施方案中,本公开的步骤a)平衡缓冲液中缓冲物质是磷酸盐,浓度为约20mm。
23.一些实施方案中,本公开的步骤a)平衡缓冲液的ph值为7.1
‑
7.5,例如约7.1、约7.2、约7.3、约7.4、约7.5。
24.一些实施方案中,本公开的步骤a)平衡缓冲液的ph值为7.4
±
0.1。
25.一些实施方案中,本公开的步骤a)洗脱缓冲液中缓冲物质选自醋酸盐、柠檬酸盐、柠檬酸、醋酸。
26.一些实施方案中,本公开的步骤a)洗脱缓冲液中缓冲物质为醋酸盐,浓度为10
‑
50mm,例如,约10mm、约20mm、约30mm、约40mm、约50mm。
27.一些实施方案中,本公开的步骤a)洗脱缓冲液中缓冲物质为醋酸盐,浓度为约50mm。
28.一些实施方案中,本公开的步骤a)洗脱缓冲液
‑
b中还包括氨基酸,其浓度为约100mm。
29.一些实施方案中,本公开的步骤a)洗脱缓冲液的ph为3.4
‑
3.6(例如,3.5
±
0.1)。
30.一些实施方案中,本公开的步骤b)复合模式层析填料选自capto mmc、capto mmc impres、羟基磷灰石,所述复合模式层析填料是capto mmc impres。
31.一些实施方案中,本公开的步骤b)上样前,使用1m tris调节亲和中间产物ph至5.5
‑
6.5;去离子水稀释电导率<6ms。
32.一些实施方案中,本公开的步骤b)上样前,使用1m tris调节亲和中间产物ph至约6.0;去离子水稀释电导率<6ms。
33.一些实施方案中,本公开的步骤b)平衡缓冲液中的缓冲物质选自磷酸盐、柠檬酸盐、醋酸盐、磷酸、柠檬酸、醋酸。
34.一些实施方案中,本公开的步骤b)的洗脱缓冲液包含洗脱缓冲液a和洗脱缓冲液b,步骤b)平衡缓冲液、洗脱缓冲液a和洗脱缓冲液b中的缓冲物质是磷酸盐和柠檬酸,所述浓度均为10
‑
50mm,例如,约10mm、约20mm、约30mm、约40mm、约50mm。
35.一些实施方案中,本公开的步骤b)平衡缓冲液、洗脱缓冲液
‑
a和洗脱缓冲液
‑
b中缓冲物质是柠檬酸,浓度为约10mm,以及含有磷酸盐,浓度为约20mm。
36.一些实施方案中,本公开的步骤b)平衡缓冲液、洗脱缓冲液
‑
a和洗脱缓冲液
‑
b的ph值为5.5
‑
6.5,例如约5.5、约5.6、约5.7、约5.8.、约5.9、约6.0、约6.1、约6.2、约6.3、约6.4、约6.5。
37.一些实施方案中,本公开的步骤b)平衡缓冲液、洗脱缓冲液
‑
a和洗脱缓冲液
‑
b的ph值为6.0。
38.一些实施方案中,本公开的步骤b)平衡缓冲液、洗脱缓冲液
‑
a和洗脱缓冲液
‑
b中还包括氨基酸,其浓度为10
‑
50mm。
39.一些实施方案中,本公开的步骤b)平衡缓冲液、洗脱缓冲液
‑
a和洗脱缓冲液
‑
b中还包括氨基酸,其浓度为约20mm。
40.一些实施方案中,本公开的步骤b)洗脱缓冲液
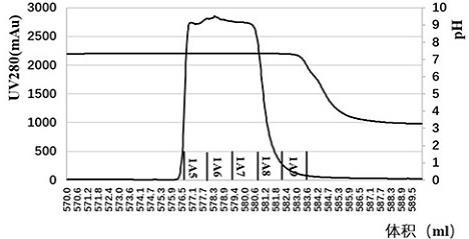
‑
b进一步还包括氯化钠,浓度为400
‑
600mm,例如,约400mm、约450mm、约500mm、约550mm、约600mm。
41.一些实施方案中,本公开的步骤b)洗脱缓冲液
‑
b进一步还包括氯化钠,浓度为约400mm。
42.一些实施方案中,本公开的方法步骤a)和b)平衡缓冲液和洗脱缓冲液中的缓冲物质均含有磷酸盐、磷酸、mes、醋酸盐、醋酸、柠檬酸或柠檬酸盐中的一种或多种。
43.一些实施方案中,本公开的步骤a)平衡缓冲液含有10
‑
50mm磷酸盐,ph值为7.1
‑
7.5;步骤a)洗脱缓冲液含有10
‑
50mm醋酸盐,ph为3.4
‑
3.6;和步骤b)平衡缓冲液和洗脱缓冲液均含有10
‑
50mm磷酸盐和柠檬酸,ph值为5.5
‑
6.5,所述步骤b)洗脱缓冲液包括洗脱缓冲液a和b,其中洗脱缓冲液b进一步还含有400
‑
600mm氯化钠。
44.一些实施方案中,本公开的步骤a)平衡缓冲液含有约20mm磷酸盐,ph值为约7.4;步骤a)洗脱缓冲液含有约50mm醋酸盐,ph为约3.5;和步骤b)平衡缓冲液和洗脱缓冲液均含有约20mm磷酸盐和约10mm柠檬酸,ph值为约6.0,所述洗脱缓冲液包括洗脱缓冲液a和b,其中洗脱缓冲液b进一步还含有约400mm氯化钠。
45.一些实施方案中,本公开的抗体选自单克隆抗体、人抗体、人源化抗体、嵌合抗体、cdr移植抗体、fab、fab’、f(ab’)2、fv、二硫键连接的fv、scfv、单结构域抗体、双抗体、多特异性抗体、双重特异性抗体和双特异性抗体。
46.一些实施方案中,本公开的抗体结合选自pd
‑
1、pd
‑
2、pd
‑
l1、pd
‑
l2、lag
‑
3、cd20、vegfr、ctla
‑
4、tim
‑
3免疫检查点分子中的任意一种或多种。
47.一些实施方案中,本公开的抗体特异性结合pd
‑
1和lag
‑
3。
48.一些实施方案中,本公开的抗体重链氨基酸序列为如seq id no:1所示的序列,轻链氨基酸序列为如seq id no:2所示的序列。
49.一些实施方案中,本公开的抗体特异性结合b7h3,其包含如nydin(seq id no:3)所示的hcdr1,如wifpgdgstqynetfkg(seq id no:4)所示hcdr2,如qttgtwfay(seq id no:5)所示的hcdr3;和,如rasqsiskylh(seq id no:6)所示的lcdr1,如yanqsir(seq id no:7)所示的lcdr2,如qnghsfplt(seq id no:8)所示的lcdr3。此处全文引入us20170362322a1的该抗体全长序列。
50.本公开包括以下实施方案:1、一种纯化抗体的方法,包括利用a)亲和层析和b)复合模式层析,以及使用含有氨基酸的缓冲液与亲和层析填料和复合模式层析填料接触的步骤。
51.2、如第1项所述的方法,其中所述氨基酸为碱性氨基酸。
52.3、如第2项所述的方法,其中所述碱性氨基酸选自精氨酸、组氨酸、赖氨酸中的一种或多种。
53.4、如第3项所述的方法,其中所述碱性氨基酸是精氨酸。
54.5、如前述任一项所述的方法,其中所述步骤a)亲和层析缓冲液中氨基酸的浓度为10
‑
100mm,步骤b)复合模式层析缓冲液中氨基酸的浓度为10
‑
50mm。
55.6、如第5项所述的方法,其中所述步骤a)亲和层析缓冲液中氨基酸的浓度为约100mm,步骤b)复合模式层析缓冲液中氨基酸的浓度为约20mm。
56.7、如第6项所述的方法,其中所述抗体存在糖基化位点。
57.8、如第7项所述的方法,所述糖基化位点是抗原结合片段上“asn
‑
x1
‑
x2”的特征序列,其中x1可为任意氨基酸,x2为丝氨酸、苏氨酸、半胱氨酸中的任意一种。
58.9、如前述任一项所述的方法,其中所述方法能够去除抗体聚集体和糖基化杂质。
59.10、一种纯化抗体的方法,包括以下步骤:a)亲和层析1)上样:将包含抗体的细胞培养澄清液加载到预处理好的亲和层析填料上;2)平衡:用平衡缓冲液清洗亲和层析填料;3)洗脱:用洗脱缓冲液洗脱,收集洗脱液;b)复合模式层析1)上样:将调节后的亲和层析洗脱产物加载到预处理好的复合模式层析填料上;2)平衡:用平衡缓冲液清洗复合模式层析填料;3)洗脱:用洗脱缓冲液梯度洗脱,收集洗脱液;其中,步骤a)中的洗脱缓冲液、步骤b)中的平衡缓冲液和洗脱缓冲液均含有氨基酸。
60.11、如第10项所述的方法,其中所述氨基酸为碱性氨基酸。
61.12、如第11项所述的方法,其中所述碱性氨基酸选自精氨酸、组氨酸、赖氨酸中的一种或多种。
62.13、如第12项所述的方法,其中所述碱性氨基酸为精氨酸。
63.14、如第10
‑
13项中任一项所述的方法,其中步骤a)的洗脱缓冲液中氨基酸浓度为10
‑
100mm;步骤b)的平衡缓冲液、洗脱缓冲液中氨基酸浓度为10
‑
50mm。
64.15、如第14项所述的方法,其中所述步骤a)的洗脱缓冲液中氨基酸浓度为约100mm;步骤b)的平衡缓冲液、洗脱缓冲液中氨基酸浓度为约20mm。
65.16、如前述任一项所述的方法,其中所述步骤a)的亲和层析填料是protein a作为配基的填料,和\或步骤b)的复合模式层析填料选自capto mmc、capto mmc impres或羟基磷灰石。
66.17、如第16项所述的方法,其中所述步骤a)亲和层析填料是mabselect prisma,步骤b)复合模式层析填料是capto mmc impres。
67.18、如第17项所述的方法,其中所述方法步骤a)和步骤b)的平衡缓冲液和洗脱缓冲液中的缓冲物质均含有磷酸盐、磷酸、mes、醋酸盐、醋酸、柠檬酸或柠檬酸盐中的一种或多种。
68.19、如第18项所述的方法,其中:步骤a)的平衡缓冲液含有10
‑
50mm磷酸盐,ph值为7.1
‑
7.5;步骤a)的洗脱缓冲液含有10
‑
50mm醋酸盐,ph为3.4
‑
3.6;和步骤b)的洗脱缓冲液包含洗脱缓冲液a和洗脱缓冲液b,步骤b)的平衡缓冲液和步骤b)的洗脱缓冲液a、洗脱缓冲液b均含有10
‑
50mm磷酸盐和柠檬酸,ph值为5.5
‑
6.5,所述步骤b)的洗脱缓冲液b进一步含有400
‑
600mm氯化钠。
69.20、如第19项所述的方法,其中:步骤a)的平衡缓冲液含有约20mm磷酸盐,ph值为约7.4;步骤a)的洗脱缓冲液含有约50mm醋酸盐,ph值为约3.5;和步骤b)的平衡缓冲液和步骤b)的洗脱缓冲液a、洗脱缓冲液b均含有约20mm磷酸盐和约10mm柠檬酸,ph值为6.0,所述洗脱缓冲液b进一步含有约400mm氯化钠。
70.21、如第20项所述的方法,其中所述步骤b)在上样前,使用1m tris调节亲和层析洗脱产物ph至约6.0,并用去离子水稀释至电导率<6ms。
71.22、如第1
‑
21任一项所述的方法,所述抗体存在糖基化位点,所述糖基化位点是抗原结合片段上“asn
‑
x1
‑
x2”的特征序列,其中x1可为任意氨基酸,x2为丝氨酸、苏氨酸、半胱氨酸中的任意一种。
72.23、如前述任一项所述的方法,其中所述抗体选自单克隆抗体、人抗体、人源化抗体、嵌合抗体、fab、fab’、f(ab’)2、fv、二硫键连接的fv、scfv、单域抗体、双特异性抗体和多特异性抗体。
73.24、如第23项所述的方法,所述抗体为双特异性抗体。
74.25、如前述任一项所述的方法,其中所述抗体结合选自pd
‑
1、pd
‑
2、pd
‑
l1、pd
‑
l2、lag
‑
3、cd20、vegfr、ctla
‑
4、b7h3和tim
‑
3免疫检查点分子中的任意一种或多种。
75.26、如第25项所述的方法,其中所述抗体结合pd
‑
1和lag
‑
3。
76.27、如第26项所述的方法,其中所述抗体重链为如seq id no:1所示的氨基酸序列,轻链氨基酸序列为如seq id no:2所示的氨基酸序列。
77.28、一种纯化抗体的方法,包括以下步骤:a)亲和层析1)上样:将包含seq id no:1和2所示的双特异性抗体的细胞培养澄清液加载到预处理好的mabselect prisma亲和层析柱上,上样载量≤30g/l;2)平衡:用平衡缓冲液冲洗3
‑
5个柱体积,其中平衡缓冲液含有约20mm磷酸盐,ph7.4
±
0.1;3)洗脱:用洗脱缓冲液洗脱目的蛋白,收集洗脱液,其中洗脱缓冲液含有约50mm醋酸盐,约0.1m精氨酸,ph3.5
±
0.1;b)复合模式层析上样前,使用约1m tris调节亲和层析洗脱产物ph至6.0
±
0.1,并用去离子水稀释样品至电导率<6ms,所述去离子水选自纯水、高纯水、超纯水;1)上样:将调节后的亲和层析洗脱产物加载到预处理好的capto mmc impres复合模式层析柱上,上样载量≤30g/l;2)平衡:用平衡缓冲液冲洗3
‑
5个柱体积,其中平衡缓冲液含有约20mm磷酸盐、约20mm精氨酸、约10mm柠檬酸,ph约为6.0;3)洗脱:用洗脱缓冲液a和洗脱缓冲液b(约20mm磷酸盐,约20mm精氨酸,约10mm柠檬酸,约400mm 氯化钠,约ph6.0)梯度洗脱,收集洗脱液;其中,洗脱缓冲液a含有约20mm磷酸盐、约20mm精氨酸、约10mm柠檬酸,ph约为6.0;洗脱缓冲液b含有约20mm磷酸盐、约20mm精氨酸、约10mm柠檬酸、约400mm 氯化钠,ph约为6.0。
78.29、一种纯化抗体的方法,包括以下步骤:a)亲和层析1)上样:将包含抗体的细胞培养澄清液加载到预处理好的亲和层析填料上;2)平衡:用平衡缓冲液清洗亲和层析填料;3)洗脱:用洗脱缓冲液洗脱,收集洗脱液;b)复合模式层析1)上样:将调节后的亲和层析洗脱产物加载到预处理好的复合模式层析填料上;2)平衡:用平衡缓冲液清洗复合模式层析填料;3)洗脱:用洗脱缓冲液梯度洗脱,收集洗脱液;其中,步骤a)中的洗脱缓冲液、步骤b)中的平衡缓冲液和洗脱缓冲液均含有精氨酸,所述步骤a)的洗脱缓冲液中精氨酸浓度为约100mm;步骤b)的平衡缓冲液、洗脱缓冲液中精氨酸浓度为约20mm,所述抗体存在糖基化位点,所述糖基化位点是抗原结合片段上“asn
‑
x1
‑
x2”的特征序列,其中x1为任意氨基酸,x2为丝氨酸、苏氨酸、半胱氨酸中的任意一种。
79.30、如第29项所述的方法,所述抗体重链氨基酸序列为如seq id no:1所示的氨基酸序列,轻链氨基酸序列为如seq id no:2所示的氨基酸序列。
80.31、如第29项所述的方法,其中:步骤a)的平衡缓冲液含有约20mm磷酸盐,ph值为7.4
±
0.1;
guide for the preparation and use of buffers in biological systems,gueffroy,d.,ed.calbiochem corporation(1975)中记载了取决于例如期望的缓冲液ph而可采用的多种缓冲液。
88.术语“平衡缓冲液”在本发明中是指用于在将包含感兴趣抗体和一种或多种污染物的组合物加载到离子交换材料上之前平衡离子交换材料的缓冲液。
89.术语“洗脱缓冲液”是指包含诸如柠檬酸钠或醋酸钠等主要物质(a primary species)的缓冲液,其用于从色谱柱上洗脱下目标产物,如抗体、蛋白质等。
90.术语“电导率”是指水溶液在两个电极之间传导电流的能力。在溶液中,电流通过离子运输来流动,随着水溶液中存在的离子的量越来越多,溶液会具有更高的电导率。电导率的度量的基本单位是西门子(或欧姆)、欧姆(ms/cm),而且可以使用电导率计来测量,诸如各种型号的orion电导率计。因为电解电导率是溶液中的离子携带电流的能力,所以溶液的电导率可以通过改变其中的离子浓度来改变。例如可以改变溶液中缓冲剂的浓度和/或盐(例如氧化纳、乙酸钠、或氧化钾)的浓度来实现期望的电导率。
91.术语“uv
280”是指样品在280纳米波长处的吸光度值。蛋白质分子中通常含有酪氨酸、色氨酸、苯丙氨酸等氨基酸,在280纳米波长处有最大吸收峰,且吸光度值与蛋白浓度成正比。
92.术语“抗体”以最广义使用,明确覆盖单克隆抗体(包括全长单克隆抗体)、多克隆抗体、单特异性抗体、双或多特异性抗体、抗体片段(例如fab、修饰的fab、fab’、修饰的fab’、f(ab’)2、fv、fab
‑
fv、fab
‑
dsfv、单结构域抗体(例如vh或vl或vhh)、scfv、二价或三价或四价抗体、bis
‑
scfv、diabody、tribody、triabody、tetrabody和上述任意一种的表位结合片段),以及鼠源、嵌合、人源化、全人抗体,以及含有上述抗体的蛋白、多肽或任意分子,只要它们展现出期望的抗原结合特异性。
93.术语“约”是指数值在由本领域一般技术人员所测定的具体值的可接受误差范围内,所述数值部分取决于怎样测量或测定(即测量体系的限度)。例如,“约”可意味着在1内或超过1的标准差。或者,“约”或“基本上包含”可意味着至多20%的范围,例如1%至15%之间、在1%至10%之间、在1%至5%之间、在0.5%至5%之间、在0.5%至1%之间变化,本公开中,数字或数值范围之前有术语“约”的每种情况也包括给定数的实施方案。此外,特别对于生物学系统或过程而言,该术语可意味着至多一个数量级或数值的至多5倍。除非另外说明,否则当具体值在本技术和权利要求中出现时,“约”或“基本上包含”的含义应该假定为在该具体值的可接受误差范围内。
94.术语“梯度洗脱”是指在同一个分析周期中随着时间的变化按一定程序梯度性地改变洗脱液的比例(浓度配比、成 分、离子强度、溶液极性等)或ph,以期将层析柱上不同的组分洗脱出来的方法。从而可以使一个复杂样品中性质(极性)差异较大的组分能按各自适宜的容量因子k达到良好的分离目的。梯度洗脱一般分为二元梯度、四元梯度,本公开就是采用二元梯度洗脱,即利用两种洗脱液(洗脱缓冲液a和洗脱缓冲液b)梯度洗脱抗体产物。
附图说明
95.图1为亲和mabselect prisma层析洗脱图谱。
96.图2为亲和mabselect prisma层析洗脱组分sec
‑
hplc纯度结果图。
97.图3为亲和mabselect prisma层析洗脱组分质谱检测结果图。
98.图4a和4b为精纯步骤层析梯度洗脱图谱,其中图4a为capto mmc impres,图4b为nanogel sp hp。
99.图5a、5b和5c为复合模式capto mmc impres层析梯度洗脱峰质谱检测结果图,图5a、图5b、图5c分别为峰1、峰2、峰3的图。
100.图6a和6b为阳离子交换层析nanogel sp hp层析梯度洗脱峰质谱检测结果图,图6a、图6b分别为峰4、峰5的图。
具体实施方式
101.以下结合实施例用于进一步描述本公开,但这些实施例并非限制着本公开的范围。
102.实施例1、细胞培养澄清液经亲和层析捕获并初步提纯和复合模式层析亲和层析步骤如下:步骤一、将亲和层析填料mabselect prisma装填入柱。
103.步骤二、用消毒液(0.5m氢氧化钠)冲洗3个柱体积。
104.步骤三、用预平衡缓冲液(20mm磷酸盐,1m氯化钠,ph7.4
±
0.1)冲洗3个柱体积。
105.步骤四、用平衡液(20mm 磷酸盐,ph7.4
±
0.1)冲洗3
‑
5个柱体积,至流出液ph及电导率与平衡液一致。
106.步骤五、上样,确保载量≤30g/l。
107.步骤六、用平衡液(20mm 磷酸盐,ph7.4
±
0.1)冲洗3
‑
5个柱体积,至uv
280
稳定且流出液ph及电导率与平衡液一致。
108.步骤七、用洗脱液(50mm醋酸盐,0.1m精氨酸,ph3.5
±
0.1)洗脱目的蛋白,分段收集。
109.步骤八、收集亲和层析洗脱样品,检测sec
‑
hplc纯度。
110.使用一个具体序列的双特异性抗体对上述方法进行验证。该双抗的重、轻链全长序列如seq id no:1和seq id no:2所示。
111.结果如表1所示,检测sec
‑
hplc纯度后,可知单体得到了较好的分离;另取亲和层析洗脱样品进行质谱检测,结果如图3所示,洗脱样品含有非预期糖基化杂质。
112.表1 亲和mabselect prisma 层析收集组分sec
‑
hplc纯度取亲和层析洗脱样品,使用1mol/l tris调节ph至6.0
±
0.1,使用超纯水将合并所得样品稀释至电导率<6 ms/cm。
113.复合模式层析步骤如下:步骤一、将复合模式层析填料capto mmc impres装填入柱。
114.步骤二、用消毒液(0.5m氢氧化钠)冲洗3个柱体积。
115.步骤三、用预平衡缓冲液(20mm磷酸盐,1m氯化钠,ph7.4
±
0.1)冲洗3个柱体积。
116.步骤四、用平衡液(20mm磷酸盐,20mm精氨酸,10mm柠檬酸,ph6.0)冲洗3
‑
5个柱体积,至流出液ph及电导率与平衡液一致。
117.步骤五、上样,确保载量≤30g/l。
118.步骤六、用平衡液(20mm磷酸盐,20mm精氨酸,10mm柠檬酸,ph6.0)冲洗3
‑
5个柱体积,至uv
280
稳定且流出液ph及电导率与平衡液一致。
119.步骤七、系统a泵放置洗脱缓冲液a(20mm磷酸盐,20mm精氨酸,10mm柠檬酸,ph6.0),系统b泵放置洗脱缓冲液b(20mm磷酸盐,20mm精氨酸,10mm柠檬酸,400mm 氯化钠,ph6.0),0
‑
100%b/15cv梯度洗脱目的蛋白,梯度洗脱结束后100% b维持3cv,收集洗脱样品。
120.步骤八、复合模式层析梯度洗脱,取洗脱峰进行质谱检测。
121.使用实施例1中seq id no:1和2的双抗的亲和层析洗脱样品进行上述复合模式层析方法的验证。图谱如图4a所示,取洗脱峰1、峰2、峰3进行质谱检测,结果如图5a、5b和5c所示,可知峰1、峰2均含有非预期糖基化杂质,但峰3未检测到杂质存在。可知,通过精纯,目标产物得到了较好的分离。目标产物回收率49.1%,sec纯度>99%(分管收集,均大于99%)。
122.实施例2、阳离子交换层析取亲和层析洗脱样品,使用1mol/l tris调节ph至5.0
±
0.1,使用超纯水将合并所得样品稀释至电导率<6 ms/cm。
123.阳离子交换层析步骤如下:步骤一、将阳离子交换层析填料nanogel sp hp装填入柱。
124.步骤二、用消毒液(0.5m氢氧化钠)冲洗3个柱体积。
125.步骤三、用预平衡缓冲液(50mm醋酸盐,1m氯化钠,ph5.0
±
0.1)冲洗3个柱体积。
126.步骤四、用平衡液(50mm醋酸盐,ph5.0
±
0.1)冲洗3
‑
5个柱体积,至流出液ph及电导率与平衡液一致。
127.步骤五、上样,确保载量≤30g/l。
128.步骤六、用平衡液(50mm醋酸盐,ph5.0
±
0.1)冲洗3
‑
5个柱体积,至uv
280
稳定且流出液ph及电导率与平衡液一致。
129.步骤七、系统a泵放置洗脱缓冲液
‑
a(50mm醋酸盐,ph5.0
±
0.1),系统b泵放置洗脱缓冲液
‑
b(50mm醋酸盐,400mm氯化钠,ph5.0
±
0.1),0
‑
100%b/15 cv梯度洗脱目的蛋白,100% b维持3cv,收集洗脱样品。
130.步骤八、阳离子交换层析梯度洗脱,取洗脱峰进行质谱检测。
131.使用实施例1中seq id no:1和2的双抗a的亲和层析洗脱样品进行上述阳离子交换层析方法的验证。图谱如图4b所示,结果如图6a和6b所示,可知峰4、峰5均含有非预期糖基化杂质。可知,阳离子交换层析无法对非预期糖基化杂质进行有效去除,无法得到目标产物,回收率为0。
132.同时,我们也使用所述方法对重轻链为seq id no:9和seq id no:10的抗体b进行了验证。
133.本公开的序列:>双抗a重链全长氨基酸序列:evqlvesggglvqpggslrlscaastytfknkcmgwfrqapgkeregvsvvdrfggtiyadsvkgrftisrdnskntlylqmnslraedtavyycaagsytsanscqpdalwgqgtlvtvssggggsggggsggggsggggsqvqlvqsgaevkkpgasvkvsckasgytftdyymnwvrqapgqrlewmgvinpyngdtaynqkfkgrvtitrdtsastaymelsslrsedtavyycarddgyydyyfdvwgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgkseq id no:1>双抗a轻链全长氨基酸序列:diqmtqspsslsasvgdrvtitcrasqdigsrlnwyqqkpgkapkrliyatstldsgvpsrfsgsrsgtdftltisslqpedfatyyclqlasspptfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
seq id no:2>hcdr1nydin
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
seq id no:3>hcdr2wifpgdgstqynetfkg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
seq id no:4>hcdr3qttgtwfay
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
seq id no:5>lcdr1rasqsiskylh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
seq id no:6>lcdr2yanqsir
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
seq id no:7>lcdr3qnghsfplt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
seq id no:8>抗体b重链全长氨基酸序列:qvqlqqsgaevkkpgasvkvsckasgytftnydinwvrqapgqglewigwifpgdgstqynetfkgratlttdtststaymelsslrsedtavyfcarqttgtwfaywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynst
yrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkseq id no:9>抗体b轻链全长氨基酸序列:divltqspatlslspgeratlscrasqsiskylhwyqqkpgqaprllikyanqsirgiparfsgsgsgsdftltisslepedfavyycqnghsfpltfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
seq id no:10实施例3、双抗a的生物学功能验证双抗a为靶向pd
‑
1和lag
‑
3的双特异性抗体。
134.1、亲和力鉴定使用biacore t200 (ge healthcare)仪器测定双抗a与人pd
‑
1蛋白或人lag
‑
3蛋白的解离常数。将proteina(雅心rspa05) 共价偶联到cm5 s series芯片上,待检测抗体通过亲和捕获至芯片表面,然后于芯片表面流过不同浓度的人pd
‑
1蛋白(sino biological cat. 10377
‑
h08h)或人lag
‑
3蛋白,实时检测反应信号从而获得结合解离曲线,通过拟合获得结合力常数。实验使用溶液为hbs
‑
ep溶液 (10 mm hepes,150 mm nacl,3mm edta,0.005% p20, ph 7.4)。每个实验循环结束时,用10mm glycein,ph=1.5(ge,br
‑
1003
‑
54)溶液将芯片洗净再生。经检测,双抗a与人pd
‑
1蛋白的亲和力k
d
值为约1.5e
‑
07 m,与人lag
‑
3蛋白的亲和力k
d
值为约1.3e
‑
07 m。
135.2、双抗a阻断细胞上的pd
‑
1与pd
‑
l1结合,阻断lag
‑
3与mhcii高表达的a735结合将人pd
‑
1全长基因pcr克隆到哺乳动物细胞表达载体ptarget上,取线性化质粒电转染 cho
‑
s细胞(电转仪自带的预设cho细胞参数),经1mg/ml g418 筛选2周,再进行2次有限稀释,通过流式细胞分析仪检测细胞表面的pd
‑
1基因,选出单克隆细胞株高表达人pd
‑
1。命名为cho
‑
pd
‑
1。
136.收集稳定高表达pd
‑
1的细胞系cho
‑
pd
‑
1,每孔5
×
105细胞。梯度稀释双抗a为33.33 ug/ml、11.11 ug/ml、3.7 ug/ml、1.23 ug/ml、0.41 ug/ml、0.13ug/ml,每孔加入50ul,与cho
‑
pd
‑
1冰上避光孵育1个小时。检测时,重悬细胞,每管加入pd
‑
l1
‑
migg2a蛋白 1μg/ml冰上孵育1小时,pbs再次清洗。清洗后每管加入pe 抗小鼠igg2a (1:300) 冰上孵育1小时,用pbs漂洗一次后,以每管100ul pbs重悬,在bd c6 plus流式细胞分析仪上进行荧光检测。使用graphpad prism9软件进行对抗体各剂量处理所得的平均荧光强度进行曲线拟合并作图,以定量分析双抗a阻断细胞上的pd
‑
1与pd
‑
l1结合。结果显示,双抗a能阻断pd
‑
l1蛋白与cho
‑
pd
‑
1细胞结合,呈现抗体剂量依赖性。双抗a阻断pd
‑
l1蛋白与细胞表面抗原pd
‑
1的ic
50
约为1.8 ug/ml。
137.收集稳定高表达lag
‑
3的细胞系 cho
‑
lag
‑
3,用pbs调整细胞密度为6
×
106/ml,每孔加入50ul。梯度稀释双抗a为111.1 nm、37.04 nm、12.3 nm、4.12 nm、1.37 nm、0.46 nm ,每孔加入50ul。与cho
‑
lag
‑
3细胞冰上孵育1个小时。检测时,重悬细胞,用pbs漂洗一次后,每管加入fitc anti
‑
human igg(1:100) 冰上避光孵育1个小时。再用pbs漂洗一次后,以每管100ul pbs重悬,在bd c6 plus流式细胞分析仪上进行荧光检测。使用graphpad prism9软件进行对抗体各剂量处理所得的平均荧光强度进行曲线拟合并作图,以定量分析双抗a
与cho
‑
lag
‑
3细胞的结合。结果显示,双抗a与cho
‑
lag
‑
3细胞的结合强度呈抗体剂量依赖性所应用的阴性对照为nc。双抗阻断lag
‑
3蛋白与细胞表面mhcii结合的ic
50
约为110nm。
138.3、双抗a在人源化动物模型中抑制肿瘤生长将nog小鼠(雌性,6
‑
8周龄,购自北京维通利华实验动物技术有限公司)适应性饲养一周。实验当天编号称重,收集处于对数生长期的人黑色素瘤细胞系a375,按照每只动物接种6
×
106/个细胞(100ul)的剂量接种于小鼠右肋部皮下。同一天复苏人pbmc,置于37℃ 5% co2的培养箱培养1小时后,用pbs漂洗并调整细胞密度为1
×
107/ml,按照每只动物接种5
×
106/个细胞(500ul)的剂量进行尾静脉注射。接种后5
‑
7天,待肿瘤生长至50
‑
90mm3后,去除体重、肿瘤过大或过小的,按照下表34
‑
36所示随机分组,并腹腔注射相应抗体,一周两次,共给药6次。每周测量2次小鼠体重以及肿瘤体积。肿瘤体积计算公式为tv=l
长
×ꢀ
l
短2
/2。各组肿瘤体积用平均值
±
标准差表示,使用two
‑
way anova进行统计分析,并计算肿瘤抑制率(%tgi),计算公式为%tgi=[1
‑
(t
‑
t0)/(c
‑
c0)]
ꢀ×
100%。实验终点时取血,裂解红细胞(bd 555899),与靶向人和鼠的cd45的单克隆抗体(ebioscience
™ꢀ
11
‑
0451
‑
82, 12
‑
9459
‑
42)混合孵育40分钟后,用bd c6 plus流式细胞分析仪检测小鼠血液中人cd45阳性细胞占所有淋巴细胞的百分比,作为该小鼠模型中人pbmc的重建水平。结果如表2所示。
[0139]
表2 pd
‑
1/lag
‑
3双抗给药方案和小鼠模型抑瘤效果(注:在two
‑
way anova统计分析中,与pbs组相比,第31天肿瘤大小有显著性差异,p<0.0001时,标记为****。)
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1