一种霍氏肠杆菌及其在生产香兰素中的应用
1.本发明涉及生物技术领域,具体涉及到一种霍氏肠杆菌及其在生产香兰素中的应用。
背景技术:
2.香兰素是世界第三大食用香料,随着人们健康意识的提高,天然香兰素的用量逐年递增。现代生产香兰素的方法主要包括:化学合成法、植物提取法以及微生物发酵法。其中,化学合成以乙醛酸法为主流方法,但其具有产物复杂、过程污染较大、产品纯度不高等特点。植物提取法则是使用浸提萃取的方法从香荚兰植物中直接提取香兰素,但同时香荚兰存在的种植区域有限,产量受气候影响大,种植及加工处理繁琐,操作复杂等缺点,以至于产量一直无法满足市场需求。而微生物转化生产则是使用微生物发酵的方式,通过微生物的生物代谢作用,直接从代谢产物中提取香兰素。目前利用阿魏酸生产香兰素的菌株有:黑曲霉、朱红密孔菌和沙链霉菌。近年来利用微生物发酵转化生产香兰素越来越受到广泛的关注。
3.在诸多微生物转化法中,黑曲霉与朱红密孔菌两部联合法发酵有效转化率为 34.01%,转化率偏低。沙链霉菌株的产量较高。但这些菌株转化率均偏低,所需要的最佳发酵ph为中性,且均有不耐高浓度阿魏酸的弊端。所以,其发酵所需条件较为固定,对于一些特殊的发酵条件下并不适用。同时,香兰素为酚酸类物质且其合成途径中的前体物质为香草酸,含有的羧酸官能团的香草酸和阿魏酸以及香兰素均对菌株具有一定的毒性,影响菌株的功能,从而降低香兰素的产量和利用效率。
技术实现要素:
4.针对上述的不足,本发明的目的是提供一种霍氏肠杆菌及其在生产香兰素中的应用,可有效解决现代微生物以反式
‑
阿魏酸为底物发酵生产香兰素时存在的发酵周期长、条件普适性差、菌株转化率低和不耐高浓度阿魏酸等缺陷。
5.为达上述目的,本发明采取如下的技术方案:
6.本发明提供一种霍氏肠杆菌(enterobacter hormaechei),该菌株能够以反式
‑
阿魏酸为底物发酵高效生产香兰素,命名为dq,保藏于中国普通微生物菌种保藏管理中心(cgmcc),保藏中心地址为北京市朝阳区北辰西路1号院3号,保藏日期为2021年07月26日,保藏编号为cgmcc no.22958。
7.本发明还提供上述霍氏肠杆菌(dq)在生产香兰素中的应用。
8.进一步地,该霍氏肠杆菌(dq)在生产香兰素中的应用,以反式阿魏酸为底物,通过微生物转化法生产香兰素;应用时的具体参数为:ph为9~11,接种量为1.5~3wt%,发酵温度为30~35℃。
9.进一步地,该霍氏肠杆菌(dq)在生产香兰素中的应用,应用时的具体参数为:ph为 10.8,接种量为2wt%,发酵温度为33℃。
10.一种提高香兰素生产效率的制剂,该制剂的有效成分为上述的霍氏肠杆菌(dq)。
11.综上所述,本发明具有以下优点:
12.1、本发明中霍氏肠杆菌(dq)可有效利用反式阿魏酸生产香兰素,可以大幅提高香兰素的产量及其利用效率,并且该菌株有优异的阿魏酸与香兰素的耐受性,进而提高生产和经济效益,也满足特殊环境下的生产,有效解决了现代微生物以反式
‑
阿魏酸为底物发酵生产香兰素时存在的发酵周期长、条件普适性差和菌株转化率低等缺陷。
附图说明
13.图1为本发明中绘制的标准曲线图;
14.图2为本发明中dq薄层层析色谱图;
15.图3
‑
10为本发明中dq
‑
4、dq、hs
‑
2和6
‑
6的群体形态图和个体形态图;
16.图11为本发明中dq
‑
4、dq、hs
‑
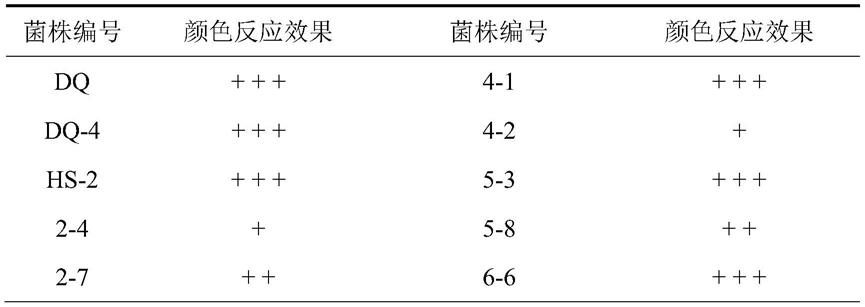
2和6
‑
6的pcr产物电泳图谱;
17.图12
‑
15为本发明中6
‑
6、hs
‑
2、dq、dq
‑
4的基于16s rdna序列的系统发育树;
18.图16为本发明中6
‑
6、hs
‑
2、dq、dq
‑
4的生长曲线图;
19.图17为本发明中6
‑
6、hs
‑
2、dq、dq
‑
4的底物耐受性结果图;
20.图18为本发明中霍氏肠杆菌(dq)的生长曲线图;
21.图19为本发明中霍氏肠杆菌(dq)的发酵曲线图;
22.图20为本发明中底物浓度对霍氏肠杆菌(dq)产香兰素的影响结果图;
23.图21为本发明中初始ph对霍氏肠杆菌(dq)产香兰素的影响结果图;
24.图22为本发明中接种量对霍氏肠杆菌(dq)产香兰素的影响结果图;
25.图23为本发明中发酵温度对霍氏肠杆菌(dq)产香兰素的影响结果图;
26.图24
‑
29为本发明中各因素交互作用对霍氏肠杆菌(dq)产香兰素的影响结果图。
具体实施方式
27.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明,即所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
28.因此,以下对提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
29.实施例1、菌种的分离、筛选与鉴定
30.1、样品处理
31.称取酒糟、大曲各10g置于250ml烧杯中,加入无菌水90ml,摇匀、浸渍30min后过滤,得到酒糟滤液和大曲滤液,编号酒糟样液(jz
‑
1~6)、大曲样液(dh
‑
1~6)备用;量取10ml黄水于90ml无菌水中,得黄水样液,编号黄水样液(hs
‑
1~6)备用。
32.2、菌株的分离纯化
33.用移液管分别取上述三种样液5ml接种于灭菌冷却后的lb液体培养基(50ml)的锥形瓶中摇床培养48h,培养转速为160r/min、培养温度为37℃;重复操作此步骤,置于同样条件下进行再次富集培养;经过富集之后采用10倍系列梯度稀释法稀释至10^
‑
8,分别稀释倍
数为10^
‑
6、10^
‑
7、10^
‑
8的菌悬液0.2ml涂布于lb固体培养基,在37℃条件下恒温培养24h,挑取生长较好的、菌落形态不一的单菌落,采用接种环分别在ph=7环境下以反式
ꢀ‑
阿魏酸为唯一碳源的培养基中进行平板划线,纯化2~3次;纯化完成后将菌种接种于斜面培养基中于37℃恒温培养24h,随后保存于4℃冰箱中备用。
34.3、种子液制备
35.用灼烧后的接种环,挑取一环在lb培养基上活化后的单菌落接种到装有50ml的lb 液体培养基上,160r/min、37℃条件下培养直至吸光度od值在0.4~0.6范围内,以同时配置不含菌的lb液体培养基作为空白对照,得种子培养液。
36.4、产香兰素菌株初筛结果:
37.通过富集培养后,在分离培养基上经划线分离共获得32个单菌落。对所有单菌落进行摇床发酵培养;经过fecl3显色反应,得到11株疑似产香兰素的菌株,显色结果如表1
‑
1所示。其中编号为2
‑
4、3
‑
7、4
‑
2的菌株显色效果较弱、几乎无蓝紫色;编号为2
‑
7和5
‑
8的菌株显色效果弱,不明显;编号为dq、dq
‑
4、hs
‑
2、4
‑
1、5
‑
3和6
‑
6菌株的显色效果很明显。
38.表1
‑
1 fecl3反应显色效果
[0039][0040][0041]
备注:“+”代表显色效果较弱,“++”代表显色效果弱,“+++”代表显色效果很明显
[0042]
5、产香兰素菌株复筛结果:
[0043]
以香兰素含量(mg/l)为标准曲线图的横坐标x,以od 440nm
值为标准曲线图的纵坐标 y,绘制的标准曲线如图1所示。所得标准曲线回归方程为y=0.002x
‑
0.0119,相关系数r2=0.9985,可说明波长为440nm下的od值和香兰素含量(mg/l)之间呈线性关系。
[0044]
利用tba光度法对初筛中疑似产香兰素的菌株进行复筛,测定440nm波长下的od值,根据标准曲线计算出发酵液中的香兰素含量,结果如表1
‑
2所示。可得筛选出的产香兰素菌种的产量在100.0mg/l与1600.0mg/l之间,其中产量在100mg/l至300mg/l之间的有5 株,产量在300.0mg/l至600.0mg/l的有6株,编号分别dq、dq
‑
4、hs
‑
2、4
‑
1、5
‑
8、6
‑
6,其中疑似产香兰素能力最强的为dq菌株,香兰素产量为1482.62
±
92.78mg/l,其次为hs
‑
2、 6
‑
6和dq
‑
4,香兰素产量分别为864.28
±
71.17mg/l、589.28
±
80.98mg/l和550.95
±
70.00mg/l。
[0045]
表1
‑
2筛选菌株复筛结果
[0046][0047]
6、薄层层析色谱图
[0048]
将待测菌液和香兰素标液至于活化好的薄板上,进行点样、层析,层析后取出在90℃下烘干30min,紫外照射灯下观察荧光条带。以菌株dq为例,薄层色谱图其如图2(其中,a —dq发酵液;b—香兰素标样)所示。经过测量和计算,香兰素的r
f
值为0.82;观察到在发酵液的条带上,有一个r
f
值与香兰素的r
f
值相同的荧光斑点,说明该发酵液的发酵产物中有香兰素生成。
[0049]
7、形态分析
[0050]
通过观察平板上菌株的群体形态和进行革兰氏染色(10
×
100倍油镜)观察菌株的个体形态,对dq
‑
4、dq、hs
‑
2、6
‑
6菌株进行菌株的形态学鉴定,dq的群体形态图和个体形态图 (10
×
100倍油镜)如图3和图4所示,dq
‑
4的群体形态图和个体形态图(10
×
100倍油镜) 如图5和图6所示,hs
‑
2的群体形态图和个体形态图(10
×
100倍油镜)如图7和图8所示, 6
‑
6的群体形态图和个体形态图(10
×
100倍油镜)如图9和图10所示,各自形态分析如表 1
‑
3所示:
[0051]
表1
‑
3株高产香兰素菌的形态分析
进行pcr扩增后,将得到的产物经1%琼脂糖电泳检测,测得各高产菌株的pcr产物为大小约1500bp的片段,如图11(其中,1为dq;2为dq
‑
4;3为6
‑
6;4为hs
‑
2)所示,与目标菌特征一致。
[0061]
10、高产菌株基因序列构建的系统发育树
[0062]
将dq、dq
‑
4、6
‑
6、hs
‑
2所得pcr产物送第三方检测公司测序,所得测序结果在ncbi 的genbank数据库中进行blast同源比对,经对比dq
‑
4与编号为nr 114077.1的菌株 cronobacter sakazakii的同源性达到99.58%;dq与编号为mh 542252的菌株enterobacterhormaechei的同源性达到99.51%;6
‑
6与编号为kx 959963的菌株leclercia adecarboxylata 的同源性达到99.65%;hs
‑
2与编号为mn 396719的菌株serratia marcescens的同源性达到 99.44%。
[0063]
借助构建系统发育mega7.0软件,使用邻接法构建直观明晰的系统发育树。菌株6
‑
6、 hs
‑
2、dq、dq
‑
4的建树结果依次如图12
‑
15所示。各菌株聚于亲缘关系最为接近的一支,按照分子生物学鉴定的结果,再参考和结合菌株形态学特征,可以初步判断dq
‑
4为 cronobacter属的cronobacter sakazakii(阪崎肠杆菌)、dq为enterobacter属的enterobacterhormaechei(霍氏肠杆菌)、6
‑
6为leclercia属的leclercia adecarboxylata(非脱羧勒克菌)、 hs
‑
2为serratia属的serratia marcescens(粘质沙雷氏菌)。
[0064]
11、高产香兰素菌株的生长曲线测定
[0065]
在660nm的波长下测定4株分离菌株(dq、hs
‑
2、6
‑
6、dq
‑
4)在2h、4h、6h、8h、 10h、12h、14h、16h的菌体数量,以发酵时间(h)为横坐标,以od
660
值为纵坐标,得到菌株的生长曲线如图16所示。由图16明显观察到hs
‑
2的对数生长期为2h~6h,在6h~10h 处于缓慢生长,10h后处于稳定期;6
‑
6的对数生长期较长为0h~10h,10h过后处于稳定; dq的适应期相对较长,6h~8h为对数生长期,8h后增长缓慢;dq
‑
4菌株的对数生长期为 4h~8h,8h~10h处于缓慢生长,10h后处于稳定期。
[0066]
12、高产香兰素菌株底物耐受性的测定
[0067]
将dq、hs
‑
2、6
‑
6、dq
‑
4分别接入含2g/l、4g/l、6g/l、8g/l、10g/l、12g/l、14g/l、 16g/l的反式
‑
阿魏酸发酵培养基中,培养至相对应的生长对数期后,利用tba光度法测定各发酵液中香兰素的含量以及计算各菌株的转化率,如图17、表1
‑
5所示。结果表明:dq 在160r/min、37℃、ph=7条件下恒温震荡培养8h后至对数生长期,可以得出在底物添加量为12g/l的浓度下,发酵液中香兰素含量含为4142.10mg/l、香兰素转化率达到最高,为 76%;hs
‑
2在160r/min、37℃、ph=7条件下恒温震荡培养6h至对数生长期,可以得出在底物添加量为12g/l的浓度下,发酵液中香兰素含量含为2705.40mg/l、香兰素转化率为53%; dq
‑
4在160r/min、37℃、ph=7条件下恒温震荡培养6h至对数生长期,同样在不同浓度的底物添加量下,发酵液中香兰素含量最高只有为327.97mg/l,转化率较低;6
‑
6在160r/min、 37℃、ph=7条件下恒温震荡培养8h至对数生长期,可以得出在在底物添加量为8g/l的浓度下,发酵液中香兰素含量最高为572.40mg/l,转化率在底物浓度为2g/l时最高为42%。
[0068]
表1
‑
5 4株菌株不同底物浓度香兰素转化能力比较
[0069][0070]
实施例2、目的菌株特征
[0071]
1、霍氏肠杆菌菌株生长特性
[0072]
由图18可知,发酵培养至0
‑
4h时,曲线几乎没有任何趋势,说明霍氏肠杆菌处于停滞期;发酵液培养了4h之后,生长曲线突然陡增,说明霍氏肠杆菌进入生长对数期;发酵培养12h之后,曲线再次趋于平稳,这时霍氏肠杆菌进入了稳定期。
[0073]
2、霍氏肠杆菌菌株发酵
[0074]
由图19可知,霍氏肠杆菌发酵培养至48h,发酵曲线出现最高的峰值,说明霍氏肠杆菌最佳的发酵时间为48h。
[0075]
3、霍氏肠杆菌菌株形态特性
[0076]
菌落较大、微灰白色圆形微凸起状,2~3mm左右大小,表面光滑不透明,边缘整齐;经染色呈紫红色,为革兰氏阴性菌。
[0077]
实施例3、菌株发酵单因素实验探究
[0078]
1、底物浓度对霍氏肠杆菌产香兰素的影响结果:
[0079]
固定蛋白胨和氯化钠的含量不变,改变底物(反式
‑
阿魏酸)的含量,探究不同底物浓度对霍氏肠杆菌产香兰素的影响。结果如图20所示,底物浓度在2g/l~12g/l时,霍氏肠杆菌产香兰素的含量不断上升。底物浓度在12g/l时,霍氏肠杆菌产香兰素含量最高,达5591.3 mg/l。到达12g/l之后,再增加底物浓度,霍氏肠杆菌产香兰素含量就开始不断下降。因此选择12g/l的底物浓度作为霍氏肠杆菌的最大耐受量,并在此基础上进行初始ph、接种量和发酵温度的单因素试验。
[0080]
表3
‑
1不同底物浓度对霍氏肠杆菌发酵产香兰素的影响
[0081]
[0082]
2、初始ph对霍氏肠杆菌产香兰素的影响结果:
[0083]
在最佳底物浓度确定的基础上,探究不同初始ph对霍氏肠杆菌产香兰素的影响。结果如图21所示,ph在2
‑
10之间时,在ph上升的情况下,香兰素含量不断升高,在碱性条件下更有利于霍氏肠杆菌将反式
‑
阿魏酸转化为香兰素;在ph为10时,其香兰素含量达到最大值,即4887.3mg/l;当ph超过10以后,香兰素的含量呈下降趋势,可能是此碱性环境已超出菌种生长繁殖的环境,从而导致香兰素产量降低。所以初始ph选用8、10和12为考察水平比较合适。
[0084]
表3
‑
2不同初始ph对霍氏肠杆菌发酵产香兰素的影响
[0085][0086]
3、接种量对霍氏肠杆菌产香兰素的影响结果:
[0087]
在最佳底物浓度确定的基础上,探究不同接种量对霍氏肠杆菌产香兰素的影响。结果如图22所示,随着接种量(1wt%~2wt%)的增加,香兰素含量也不断上升,从2200.2mg/l 上升到了3314.8mg/l;而在接种量由2wt%到12wt%时,香兰素含量呈现下降趋势,从3314.8 mg/l下降到1653.8mg/l,说明接种量在2wt%时为最佳,可能是因为本实验的装液量为50 ml,营养物有限,所以过多的接种量反而导致香兰素含量降低。最终,选择接种量为1wt%、 2wt%和3wt%为考察水平比较合适。
[0088]
表3
‑
3不同接种量对霍氏肠杆菌发酵产香兰素的影响
[0089][0090]
4、发酵温度对霍氏肠杆菌产香兰素的影响结果:
[0091]
在最佳底物浓度确定的基础上,探究不同发酵温度对霍氏肠杆菌产香兰素的影响。结果如图23可知,在发酵温度范围在29℃~33℃之间时,香兰素含量呈现出上升的趋势,即从 1470.7mg/l至3145.0mg/l。当发酵温度在33℃以上时,香兰素含量总体呈下降趋势,说明温度过高会破坏菌体正常的代谢环境,并由此可以看出发酵温度在33℃左右,香兰素含量达最高,可以选择发酵温度29℃~37℃为考察温度大小较为适合。
[0092]
表3
‑
4不同发酵温度对霍氏肠杆菌发酵产香兰素的影响
[0093]
[0094]
5、box
‑
behenken的试验设计方案与结果
[0095]
响应面比较直观的看到各因素对霍氏肠杆菌产香兰素的影响,并通过回归方程计算出不同因素的理论值,更具现实运用。通过响应面法对ph、接种量、发酵温度3个因素分析得到以下试验方案及结果见表3
‑
5。
[0096]
表3
‑
5响应面试验设计及结果
[0097][0098][0099]
design
‑
expert 8.0.5软件对表3
‑
5的数据进行分析,得到结果如表3
‑
6所示。由表3
‑
6可知: ph对香兰素含量的影响极为显著,接种量对香兰素含量的影响比较显著,发酵温度对香兰素含量的影响相对显著。以香兰素含量为响应值,经回归拟合后,得到回归方程:
[0100]
香兰素含量
[0101]
=6577.20+483.38a+105.75b+168.88c+43.00ab+27.25ac
‑
39.50bc
‑
573.98a2‑
1180.73b2‑
686.47 c2[0102]
表3
‑
6方差分析
[0103][0104][0105]
根据表3
‑
6中方差分析结果,香兰素含量的回归方程描述与响应面值之间的关系模型显著(p<0.0002)且失拟项检验不显著(p>0.7669),表明该试验模型充分拟合试验数据,,即可以利用此回归方程确定产香兰素的最佳发酵条件。
[0106]
6、双因素交互作用的响应面分析
[0107]
响应面图形是响应值对各试验因子所构成的三维空间的曲面图,从响应面分析图上可形象地看出最佳参数及各参数之间的相互作用。根据香兰素含量的回归方程得出不同因子的响应面分析图,结果见图24
‑
29。由图24
‑
29可较直观地看出各因素交互作用对香兰素含量的影响,若曲线越陡峭,则表明该因素对香兰素含量的影响越大。从图24
‑
29可以看出ph对香兰素含量的影响最大,发酵温度次之,与表3
‑
6方差分析结果相吻合。
[0108]
7、验证实验
[0109]
通过软件分析,确定了发酵产香兰素的最佳发酵条件为ph=10.85、接种量2.05wt%及发酵温度33.52℃,此条件下由公式算出的理论值为6.69381g/l。由于需要结合生产条件的实际情况进行考虑,通过响应面优化分析得到的各因子,把最优的理论值调整成:ph=10.8、接种量2wt%及发酵温度33℃。根据所得的分析数据进行三组验证实验,验证实验的条件为 ph=10.8、接种量2wt%及发酵温度33℃,得到香兰素含量为6.6924g/l,测
定结果稳定,偏差处于合理范围,证明该结果合理可靠。同时,反应体系中香兰素产量越高,菌株对香兰素的耐受性越高。本发明中于最佳条件下得到的香兰素含量高达6.6924g/l,说明本发明中霍氏肠杆菌(dq)对香兰素具有优异的耐受性。
[0110]
以上内容仅仅是对本发明结构所作的举例和说明,所属本领域的技术人员不经创造性劳动即对所描述的具体实施例做的修改或补充或采用类似的方式替代仍属本专利的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1