与菠菜抽薹主效QTL紧密连锁的SNP分子标记及其应用
与菠菜抽薹主效qtl紧密连锁的snp分子标记及其应用
技术领域
1.本发明涉及分子遗传学技术领域,具体涉及与菠菜抽薹主效qtl紧密连锁的snp分子标记及其应用。
背景技术:
2.菠菜(spinacia oleracea l.,2n=2x=12))属苋科藜亚属植物,原产伊朗,是主要以绿叶为产品器官的一、二年生草本植物。因其适应性广、耐储藏、供应期长、栽培方式多样,营养比较全面,在世界各地普遍种植。
3.菠菜的耐寒性和适应性很强,生长期较短,一年内可多茬栽培,而菠菜抽薹对光周期的敏感性,使得春夏种植菠菜容易发生早抽薹,降低了总体产量,导致了商品性的下降,不利于菠菜的周年生产。抽薹性状属于数量性状遗传,其表现易受环境条件的限制影响。chan-navarrete等(2016)首次在菠菜作物中报道了包含六个连锁群(p01-p06),283个snp标记的遗传连锁图谱,其中p01包含2个qtls和p02包含1个qtl位点与菠菜抽薹紧密连锁,为研究抽薹性状提供了可能(chan-navarrete,r.,dolstra,o.,van kaauwen,m.,van bueren,e.t.l.,&van der linden,c.g.(2016).genetic map construction and qtl analysis of nitrogen use efficiency in spinach(spinacia oleracea l.).euphytica,208(3),621-636.)。在通过简化基因组测序技术对美国288份菠菜种质材料进行测序分析中,chitwood等(2016)筛选到与菠菜抽薹紧密相关的三个snp位点,即:ayzv02001321_398,ayzv02041012_1060和ayzv02118171_95,分别位于2号和4号染色体上(chitwood,j.,shi,a.,mou,b.,evans,m.,clark,j.,motes,d.,...&hensley,d.(2016).population structure and association analysis of bolting,plant height,and leaf erectness in spinach.hortscience,51(5),481-486.)。xu等(2017)组装了菠菜高代自交系sp75材料的基因组,在2号染色体44.7-50.5mb区间内获得了一些与抽薹相关的标记和数量性状位点(qtls)并筛选出2个与菠菜抽薹紧密连锁的主效qtl,其中1个qtl包含的基因spo00403与拟南芥控制开花基因agamous-like高度同源(xu,c.,jiao,c.,sun,h.,cai,x.,wang,x.,ge,c.,...&wang,q.(2017).draft genome of spinach and transcriptome diversity of 120spinacia accessions.nat commun 8,15275.)。bhattarai等(2020)利用全基因组关联分析(gwas)技术,在2、3和5号染色体上发现了与抽薹和开花相关的snp位点(bhattarai,g.,shi,a.,correll,j.c.,&poudel,b.(2020,august).identification of genomic regions associated with bolting and flowering time in spinach.in 2020ashs annual conference.ashs.)。
4.目前,对菠菜抽薹性状研究仍然较少,仍有必要开发出更多的与菠菜抽薹性状相关的分子标记,从而利于菠菜耐抽薹品种的开发。
技术实现要素:
5.本发明的目的是提供一种与菠菜抽薹主效qtl紧密连锁的snp分子标记以及该分
子标记的检测引物和应用。
6.具体地,本发明提供以下技术方案:
7.第一方面,本发明提供一种与菠菜抽薹主效qtl紧密连锁的snp分子标记,其为分子标记kmbl29,其多态性位点位于菠菜1号染色体的第47693313位,多态性为a/g。
8.该标记的位置信息是根据xu等(xu,c.,jiao,c.,sun,h.,cai,x.,wang,x.,ge,c.,...&wang,q.(2017).draft genome of spinach and transcriptome diversity of 120spinacia accessions.nat commun 8,15275.http://spinachbase.org/)发表的菠菜全基因组序列而确定的。
9.本发明所述的snp分子标记含有如seq id no.1所示序列第36位多态性为a/g的核苷酸序列。
10.具体地,所述的snp分子标记的核苷酸序列如seq id no.1所示,多态性位点位于如seq id no.1所示序列的第36位,多态性为a/g。
11.seq id no.1:
[0012]5’‑
attataaatatgtttaatctttatatacaaagtttgaggttatatgatcattatcctgagctgattatattgaattactc-3’。
[0013]
本发明所述的snp分子标记可由序列如seq id no.2和seq id no.4所示的引物扩增得到,或者由序列如seq id no.3和seq id no.4所示的引物扩增得到。
[0014]
所述snp分子标记的基因型为aa,对应于菠菜耐抽薹;所述snp分子标记的基因型为ag或gg,对应于菠菜易抽薹。
[0015]
第二方面,本发明提供用于检测上述snp分子标记的特异性引物组,其包含具有如seq id no.2-3所示序列的正向引物以及具有如seq id no.4所示序列的反向引物;
[0016]
seq id no.2:
[0017]5’‑
attataaatatgtttaatctttatatacaaagttta-3’[0018]
seq id no.3:
[0019]5’‑
attataaatatgtttaatctttatatacaaagtttg-3’[0020]
seq id no.4:
[0021]5’‑
gagtaattcaatataatcagctcaggataatgat-3’。
[0022]
本发明提供的引物组包含2条正向引物以及1条反向引物,3条引物配合使用,能够利用kasp(kompetitive allele specific pcr)技术检测所述snp标记的基因型。
[0023]
为便于采用kasp技术进行检测,所述正向引物的5’端还连接有荧光标签序列。
[0024]
对于连接的荧光标签序列,本发明没有特殊限制,只要保证2条正向引物连接的荧光标签序列所对应的荧光标记不同即可。
[0025]
作为本发明的一种实施方式,seq id no.2所示引物的5’端连接fam荧光标签(通用标签a)序列:5
’‑
gaaggtgaccaagttcatgct-3’(seq id no.7)组成seq id no.5,seq id no.3所示引物的5’端连接hex荧光标签(通用标签b)序列:5
’‑
gaaggtcggagtcaacggatt-3’(seq id no.8)组成seq id no.6。
[0026]
本发明还提供含有上述特异性引物组的试剂盒。
[0027]
除包含上述特异性引物组外,所述试剂盒还可包含选自如下试剂中的一种或多种:dntp、mg
2+
、dna聚合酶、ddh2o、pcr反应缓冲液;上述试剂可单独包装,也可以预混液的形
式混合包装。
[0028]
第三方面,本发明提供上述snp分子标记或特异性引物组或所述的试剂盒的如下任一种应用:
[0029]
(1)在鉴定菠菜抽薹特性中的应用;
[0030]
(2)在耐抽薹菠菜的分子标记辅助育种中的应用;
[0031]
(3)在菠菜抽薹性状的种质资源改良中的应用。
[0032]
本发明中,所述应用包括:以待测菠菜植株的dna为模板,采用具有如seq id no.2-4所示序列的引物进行pcr扩增,根据pcr扩增产物判断待测菠菜植株的抽薹特性。
[0033]
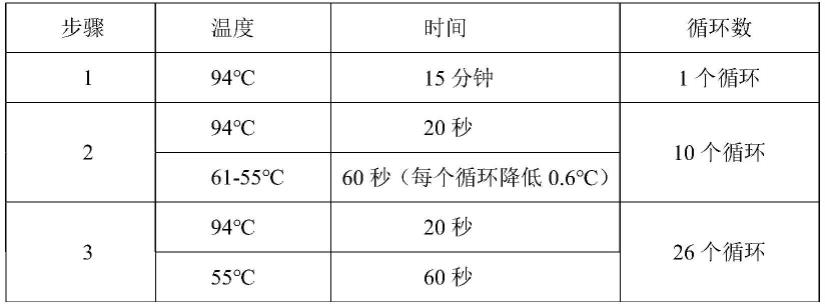
优选地,所述pcr扩增的反应程序如下:(1)94℃、15分钟;1个循环;(2)94℃、20秒,61-55℃、60秒、每个循环降低0.6℃;10个循环;(3)94℃、20秒,55℃、60秒;26个循环;上述反应程序结束后进行荧光检测分析,若分型结果不理想,则再进行如下反应程序:(4)94℃、20秒,57℃、60秒;3-9个循环,结束后再次进行荧光检测分析;
[0034]
优选地,所述pcr扩增的反应体系中,具有seq id no.2、seq id no.3、seq id no.4所示序列的引物的摩尔比为1:1:2。
[0035]
pcr反应体系如下表1:
[0036]
表1
[0037]
组分96孔板(μl)384孔板(μl)模板dna4.862.43kasp master mix52.5kasp primer mix0.140.07总体积105
[0038]
具体地,本发明提供的kasp基因分型通量大且操作简单,只需将特异的kasp primer mix和通用的kasp master mix加入到含有dna样本的pcr微孔反应板中,进行pcr扩增。最终结果采用荧光检测仪进行分析即可。
[0039]
所述kasp primer mix含有3条特异引物:分别带有通用标签a和b的正向引物(seq id no.5和seq id no.6),以及一条反向引物(seq id no.4)。
[0040]
作为一个具体实施方式,以上所述的应用包括以下步骤:
[0041]
(1)提取待检测的菠菜dna;
[0042]
(2)稀释步骤(1)中的dna到20ng/μl,并向其中加入特异的kasp primer mix和通用的kasp master mix,进行pcr扩增;
[0043]
(3)pcr产物在低于40℃下进行荧光检测分析。
[0044]
上述特异的kasp primer mix含seq id no.4-6;
[0045]
上述通用的kasp master mix包含如下组份:通用的tret cassette荧光引物,rox内参染料,kleartaq dna聚合酶,dntp和mgcl2。其中荧光报告基团a为fam,荧光报告基团b为hex。
[0046]
本发明中,若读取到的荧光信号仅为具有seq id no.2所示序列的引物对应的荧光信号,则判断待测菠菜植株耐抽薹;若读取到的荧光信号仅为具有seq id no.3所示序列的引物对应的荧光信号或者读取到的荧光信号为具有seq id no.2和seq id no.3所示序列的引物对应的荧光信号,则判断待测菠菜植株易抽薹。
[0047]
本发明的有益效果在于:本发明提供了一种与菠菜抽薹主效qtl紧密连锁的snp分子标记kmbl29。利用本发明提供的三条引物可以在苗期对菠菜抽薹特性进行检测,其分析通量高,准确率高。本发明提供的共显性snp标记可大大加快菠菜优质耐抽薹品种的选育。
附图说明
[0048]
图1为本发明实施例1中抽薹相关主效qtl的定位结果;其中,右侧是分子标记的名称,左侧为遗传图距的大小,单位是cm。
[0049]
图2为本发明实施例2中分子标记kmbl29检测bc1群体的结果。
[0050]
图3为实施例3中95株bc1群体的抽薹时间与表型统计图。纵坐标的单位为:天。
具体实施方式
[0051]
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件。所有菠菜品种均有中国农业科学院蔬菜花卉研究所菠菜课题提供。菠菜自交系12s3和12s4公开在qian,w.,fan,g.,liu,d.,zhang,h.,wang,x.,wu,j.,&xu,z.(2017).construction of a high-density genetic map and the x/y sex-determining gene mapping in spinach based on large-scale markers developed by specific-locus amplified fragment sequencing(slaf-seq).bmc genomics,18(1),1-10。
[0052]
实施例1与菠菜耐抽薹相关性状主效qtl紧密连锁的分子标记的开发
[0053]
1、菠菜遗传图谱的构建
[0054]
利用菠菜自交系12s3作为母本和轮回亲本,12s4作为父本,杂交得到147株bc1群体。12s3为耐抽薹亲本,12s4为易抽薹亲本。对父母本进行slaf-seq获得4048个snp(qian,w.,fan,g.,liu,d.,zhang,h.,wang,x.,wu,j.,&xu,z.(2017).construction of a high-density genetic map and the x/y sex-determining gene mapping in spinach based on large-scale markers developed by specific-locus amplified fragment sequencing(slaf-seq).bmc genomics,18(1),1-10.),从中均匀地选取300个snp并将其设计为kasp引物,其中180个kasp引物可以成功在bc1群体中正确分型。将该分型结果导入joinmap 4.0中,结果共有179个标记紧密连锁,从而构建了一张含有179个标记的连锁图。该遗传图包含6条连锁群(linkage group,lg),总长度为583.84cm,平均长度为3.26cm。
[0055]
2、菠菜抽薹性状的调查
[0056]
所有bc1群体种植于中国农业科学院蔬菜花卉研究所实验基地,以薹抽出5cm为抽薹日期,用抽薹日期与播种日期的差值作为抽薹时间。抽薹时间在bc1群体上呈正态分布。
[0057]
3、qtl定位以及分子标记的开发
[0058]
根据bc1群体构建的遗传图和bc1群体的抽薹时间表型数据,用mapqtl 6.0软件的区间作图(im)和多qtl模型(mqm)进行qtl检测,lod阈值采用1000次重复排列测验来确定。用p《0.05水平下的lod阈值来确定显著的qtl。最终抽薹时间的主效qtl位于lg3(1号染色体)(图1),kmbl29标记与该qtl紧密连锁(表2),将其设计为kasp引物。该引物包含正向引物1(seq id no.2)、正向引物2(seq id no.3)和反向引物(seq id no.4)。两条正向引物末端为等位变异碱基a/g,反向引物的序列选择要保证扩增片段在60-120bp。正向引物的5’端连接有荧光标签序列,其中正向引物1的5’端连接有fam荧光标签序列5
’‑
gaaggtgaccaagttcatgct-3’组成seq id no.5,正向引物2的5’端连接有hex荧光标签序列5
’‑
gaaggtcggagtcaacggatt-3’组成seq id no.6。
[0059]
上述引物序列均由生工生物工程(上海)股份有限公司合成获得。
[0060]
表2菠菜耐抽薹相关性状qtl定位结果
[0061]
性状qtl紧密连锁标记位置(cm)lod值变异解释率(%)加性效应抽薹时间qbt1-1kmbl294769331310.296441.9909-4.4059
[0062]
实施例2分子标记kmbl29的在分离群体中的验证
[0063]
本实施例对实施例1开发的分子标记kmbl29的有效性进行验证,具体方法如下:
[0064]
1、材料表型测定及基因组dna提取
[0065]
利用菠菜自交系12s3作为母本和轮回亲本,12s4作为父本,获得bc1群体。本发明从bc1群体中随机选取95株,调查其抽薹时间。同时,采用ctab法提取全基因组dna。
[0066]
2、稀释dna
[0067]
将步骤1提取的dna稀释至浓度为20ng/μl。
[0068]
3、kasp primer mix制备
[0069]
各取正向引物(seq id no.5和seq id no.6)12μl(100μm),反向引物(seq id no.4)30μl(100μm),用无菌超纯水补充至100μl。
[0070]
4、pcr扩增
[0071]
pcr扩增反应体系如下表3:
[0072]
表3
[0073]
组分96孔板(μl)384孔板(μl)模板dna4.862.43kasp master mix52.5kasp primer mix0.140.07总体积105
[0074]
同时设置反应体系中不添加模版dna的空白对照(ntc),每个板设置1个空白对照。
[0075]
其中,kasp master mix是英国lgc公司产品。产品目录号为kbs-1016-002。
[0076]
pcr反应条件如下表4:
[0077]
表4
[0078][0079]
待荧光检测分型后,若分型结果不理想,可再进行如下表5所示的pcr反应程序。
[0080]
表5
[0081][0082]
第二次pcr反应结束后再次进行荧光检测分析。
[0083]
5、pcr扩增产物的荧光扫描
[0084]
利用applied biosystems公司生产的quantstudio 6flex机器对pcr扩增产物进行扫描,基于两荧光(fam荧光和hex荧光)的激发波长和发射波长不同,从而实现对扩增产物的分型。聚合在y轴的样本的基因型为两种等位基因,即为ag;聚合在中间的基因型为连接hex荧光标签序列的等位基因型,即为aa;左下角显示的黑色样本为ntc(图2)。
[0085]
所选95株bc1群体共有53株基因型为ag,对应抽薹时间为47-55天,对比两亲本抽薹时间平均中值56天为早抽薹表型;42株基因型为aa,对应抽薹时间为58-65天,对比两亲本抽薹时间平均中值56天为晚抽薹表型(图3)。
[0086]
因为该bc1群体为回交群体,所以并未出现非轮回亲本的基因型gg。
[0087]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1