一种影响绒山羊绒细性状的SNP分子标记及其应用
一种影响绒山羊绒细性状的snp分子标记及其应用
技术领域
1.本发明涉及动物遗传育种领域,特别涉及一种影响绒山羊绒细性状的snp分子标记及其应用。
背景技术:
2.绒山羊是经过长期自然选择和人工选育而形成的一种绒肉兼用型的山羊品种,具有耐干旱抗严寒的优点,主要分布在北纬25
°
~55
°
,东经40
°
~125
°
,我国著名的绒山羊品种主要包括内蒙古绒山羊、辽宁绒山羊、陕北白绒山羊、柴达木绒山羊、新疆山羊、西藏山羊等,产绒山羊品种多达世界绒山羊品种的五分之三,是我国具有自主供种能力的畜种。
3.羊绒即无髓毛,从次级毛囊中长出,毛囊直径较小且其大小能直接影响羊绒的细度。绒山羊的羊绒秋冬生长春夏脱落,羊绒生长的厚度和细度均受气候影响较大。阿尔巴斯型绒山羊羊绒生长开始较早,且公羊羊绒比母羊羊绒生长时间还要早大约一个月,最早7月份开始,在10至11月羊绒生长速度达到最快,为生长旺盛期。羊绒是绒山羊生产的主要畜产品,是我国唯一具有出口定价权的重要出口畜产品,被称为“软黄金”,其最主要的经济性状是绒毛品质和产量性状,国际上以克和微米议价,可见其经济重要性,绒毛性状包括产绒量、绒毛长度、羊绒细度。绒山羊养殖是我国畜牧业的支柱型产业,山羊绒及其织品出口量大,占世界市场贸易总量的50%左右,且羊绒及其织品质量也在国际享有盛誉。
4.然而,近年来由于偏向对绒山羊产羔率、羊绒产绒量等生产性能的改良,对羊绒细度性状不够重视,导致绒山羊所产羊绒品质变差。
5.由近几年内蒙古地区绒山羊绒细检测结果可知,羊绒纤维在逐年变粗。而通过对超细短山羊绒可纺性对比试验显示,细羊绒更利于纺织高质量纱线。所以绒细性状对优质纱线的纺织生产有重要的影响作用,细羊绒更有利于优质纺织品的生产。所以羊绒变粗会影响纱线品质,降低纺织品品质,进而降低养殖绒山羊的经济效益,且不利于绒山羊优良产绒性状的保持,会减缓绒山羊的育种改良。
技术实现要素:
6.本发明的目的是提供一种影响绒山羊绒细性状的snp分子标记及该snp分子标记在选育和鉴定绒山羊绒细性状上的应用,同时用于绒山羊绒细性状遗传改良和品系选育,进而提高绒山羊的细绒性状频率及所产羊绒的品质。
7.根据本发明的一个方面,提供了一种影响绒山羊绒细性状的snp分子标记,其中,该snp分子标记为山羊三代基因组ars1版本8号染色体上第28342240bp处的g
→
a突变;该snp分子标记位于ccdc171基因上;该snp分子标记的核苷酸序列如seq id no:1所示,该核苷酸序列中m表示碱基突变位点,m表示碱基g或a。
8.在某些实施方式中,该绒山羊为内蒙古绒山羊。
9.根据本发明的第二个方面,提供了一种snp分子标记在绒山羊绒细性状品种选育上的应用,该snp分子标记为山羊三代基因组ars1版本8号染色体上第28342240bp处的g
→
a
突变;该snp分子标记位于ccdc171基因上;该snp分子标记的核苷酸序列如seq id no:1所示,该核苷酸序列中m表示碱基突变位点,m选自碱基g或a。
10.在某些实施方式中,该绒山羊为内蒙古绒山羊。
11.根据本发明的第三个方面,提供了一种snp分子标记在绒山羊绒细性状品种鉴定上的应用,该snp分子标记为山羊三代基因组ars1版本8号染色体上第28342240bp处的g
→
a突变;该snp分子标记位于ccdc171基因上;该snp分子标记的核苷酸序列如seq id no:1所示,该核苷酸序列中m表示碱基突变位点,m表示碱基g或a。
12.在某些实施方式中,该绒山羊为内蒙古绒山羊。
13.根据本发明的第四个方面,提供了一种选育细绒性状绒山羊品系的方法,该方法包括如下步骤:
14.1)检测绒山羊第8号染色体上第28342240bp处的g
→
a突变;
15.2)选留aa基因型的个体,进行培育,进而获得细绒性状的绒山羊品系。
16.在某些实施方式中,该绒山羊为内蒙古绒山羊。
17.根据本发明的第五个方面,提供了一种绒山羊绒细性状遗传改良的方法,其中,所述的方法包括通过选育出的细绒性状绒山羊品系作为种绒山羊,经过繁育,逐代提高该位点的优势等位基因的频率,从而改良后代绒山羊的绒细性状。
18.在某些实施方式中,该绒山羊为内蒙古绒山羊。
19.本发明的有益效果:
20.1、本发明通过筛选确定了影响绒山羊绒细性状的snp分子标记,其与绒山羊绒细类型显著相关,通过该分子标记,可以建立对绒细性状进行快速改良的分子标记辅助选择技术,极大地改善绒山羊选育进程,提高羊绒的质量和产量,迎合市场需求,提高羊绒的国际竞争力。
21.2、本发明的分子标记可以用于绒山羊绒细性状品种选育,通过该应用可以极大的提高绒山羊的绒细性状,培育的绒山羊产绒品质更高,获得更大的经济价值。
22.3、本发明的分子标记可以用于绒山羊绒细性状品种鉴定,通过对幼羊进行鉴定,筛选出具有绒细优势基因型aa的个体,进行培育,从而获得更高的产绒量,创造更大的经济价值。
23.4、本发明公开的选育细绒性状绒山羊品系的方法,可以快速高效地获得高质量绒细性状的绒山羊品系以及获得更高经济价值的绒山羊品系,具有不可估量的经济价值。
24.5、本发明公开绒山羊绒细性状遗传改良的方法,可以高效的改良绒山羊的绒细性状,提高育种效率,节约育种成本,提高经济价值。
附图说明
25.图1为绒细表型数据统计图;
26.图2为绒细性状全基因组关联分析曼哈顿图;
27.图3为绒细性状全基因组关联分析q
‑
q图;
28.图4为ccdc171、stum基因dna琼脂糖凝胶电泳检测结果图:其中1号孔为dl500 dna marker,2~11号孔样对应基因ccdc171,12~15号孔样对应基因stum;
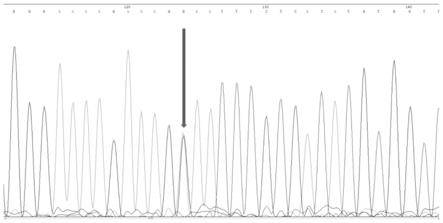
29.图5为ccdc171基因的sanger测序结果图。
具体实施方式
30.1实验材料
31.1.1器材与试剂
32.试剂:石油醚,75%酒精,10%sds,蛋白酶k,ste,饱和tris酚,dna提取液25:24:1酚:氯仿:异戊醇,冰异丙醇,无酶水,琼脂糖,tae,核酸染料,dl500 dna maker等。
33.器材:耳缺钳,手术剪,移液枪,封口膜,ofda纤维细度测试仪,恒温培养摇床,离心机,nanodrop 2000c超微量分光光度计,abi veriti型梯度pcr仪,电子天平,dyy
‑
6c型双稳定时电泳仪电源,电泳槽,bio
‑
rad伯乐chemidoc xrs+imager等。
34.1.2样品采集
35.选取内蒙古亿维白绒山羊有限责任公司1920只内蒙古绒山羊,利用手术剪在绒山羊个体腹中线肩胛处后方采集绒毛样本装入塑封袋,用耳缺钳采集群体中个体的耳样组织,将组织置于装有75%酒精的冻存管中带回内蒙古农业大学
‑
80℃低温保存。(1)消化过夜:从冻存管中取出黄豆粒大小的耳样组织置于1.5ml的离心管中,剪碎并依次加入500ul的ste、50ul的10%sds、10ul的蛋白酶k,封口膜封口后置于56℃恒温培养摇床消化约7小时。(2)消化后向离心管中加入500ul的饱和tris酚试剂,混匀后4℃、12000r离心5min,取上清重复加入500ul的饱和tris酚试剂,混匀后同样参数离心5min。取上清加入500ul的25:24:1酚:氯仿:异戊醇,冰异丙醇,混匀后4℃、12000r离心5min。(3)再取上清加入1000ul的冰异丙醇,并轻微振荡直至产生白色絮状沉淀,4℃、12000r离心5min。(4)弃去冰异丙醇后加入1000ul的75%乙醇洗涤dna沉淀,4℃、12000r离心10min。(5)弃去75%乙醇后通风干燥,再加入100ul无酶水稀释溶解dna沉淀,溶解完全后进行分装。(6)利用nanodrop 2000c超微量分光光度计和0.8%琼脂糖凝胶电泳对样品进行dna质检。
36.2数据预处理
37.2.1绒细表型数据处理
38.(1)从绒山羊个体腹中线肩胛处后方,采集1920只绒山羊羊绒样本,利用ofda纤维细度测试仪对羊绒样本的绒细进行检测,并记录整理数据(如表1)。
39.(2)根据绒样的细度检测数据利用统计软件绘图分析,检验得出绒细表型数据符合正态分布(如图1所示),可以进行gwas分析。
40.表1内蒙古绒山羊测序样本绒细表型数据统计表
[0041][0042]
2.2样本数据质控
[0043]
利用内蒙古绒山羊ggp_goat_70k芯片(后文均用70k snp芯片表示)(详见内蒙古农业大学博士学位论文“山羊snp芯片设计与内蒙古绒山羊重要经济性状的全基因组关联分析和基因组选择研究”)对1920个内蒙古绒山羊个体进行了基因分型,利用plink软件对snp位点进行质控,去除最小等位基因频率小于1%、显著哈迪温伯格不平衡的snp,获得50383个snps用于后续分析。
[0044]
2.3统计分析
[0045]
利用gemma软件中的混合线性模型对羊绒细度性状进行了全基因组关联分析,测
试snps与绒细性状之间的相关性。研究采用的统计分析模型为y=xα+zβ+wμ+e,其中y为表型性状,x为固定效应矩阵,α为固定效应估计参数,z为单核苷酸多态性矩阵,β为单核苷酸多态性效应,w为随机效应矩阵,μ为预测的随机个体,e为随机误差,分布为e~n(0,δe2)。采用bonferroni校正方法确定gwas的显著性阈值。全基因组关联显著性阈值为p<0.05(p<9.92
×
10
‑7=0.05/50 383)。
[0046]
3绒细性状全基因组关联分析
[0047]
利用gemma软件gwas分析可在p<10
‑6范围内得到1个性状相关snp位点。sahana等人的研究表明p<10
‑4范围内的位点也与性状显著相关,所以本研究取p<10
‑4时进行分析。利用r v.3.2.0绘制q
‑
q图(q
‑
q
‑
plot)和曼哈顿图(manhattan
‑
plot)。曼哈顿图(如图2所示)的y轴取p value的
‑
log10,x轴表示染色体号,图中实线表示基因组水平5%阈值线,显著的单核苷酸多态性在曼哈顿图中位于阈值线上方。q
‑
q图(如图3所示)λ接近1。根据gwas分析p value<1.06e
‑
04时,分析曼哈顿图可在绒山羊染色体chr4、chr5、chr8、chr11、chr14、chr16上鉴定出共10个与绒细性状相关的snp(p value<1.06e
‑
04),经注释与acss3、cdc42bpa、itpkb、stum、slc13a1、ccdc171等8个基因相关(如表2)。而q
‑
q图(如图3所示)结果表明p value观测值与期望值较符合,前半段散点分布在y=x附近,可反映所采用混合线性模型获得的p值符合期望值且统计模型合理,右上角存在点显著位于对角线上方,表明位点的p value观测值超过期望值,即这些位点与绒细性状显著相关。选取注释到的基因ccdc171和stum的位点进行位点验证,可以通过后续的验证试验对基因位点进行位点验证和对该snp的序列进行确认。
[0048]
表2绒细性状gwas候选基因列表
[0049][0050][0051]
4候选基因验证
[0052]
4.1引物制备及预处理
[0053]
根据70k snp芯片筛选后gwas分析出的snp位点,,利用genbank数据库进行引物设计,设计好后使用biast检查确认引物的特异性,得引物序列如表3。将设计好的引物序列交上海生工生物工程股份有限公司制备引物。
[0054]
预处理步骤如下:1.引物贮存液配制:(1)开盖前4℃、4000r离心1min,防止粉末状引物损失。(2)缓慢开盖后加入适量无酶水,盖上盖,先涡旋再用掌上离心机震荡混匀。(3)置于
‑
20℃冰箱冷藏储存。2.引物工作液配制:离心管标号后每个管加入90ul无酶水,以及10ul贮存液,取10ul分装到小离心管再标号。
[0055]
表3引物序列信息
[0056][0057]
4.2 pcr反应
[0058]
使用abi veriti型梯度pcr仪,对含有目标基因的dna样本进行pcr扩增反应,扩增产物用于后期检测。
[0059]
(1)预实验:通过预实验确定最适的上下游引物及其最佳退火温度,使用热启动法进行pcr扩增反应。
[0060]
反应体系:
[0061]
表4预实验pcr反应体系
[0062][0063]
反应条件:
[0064]
表5热启动法pcr反应条件
[0065][0066]
(tm:根据引物的推荐温度进行梯度设置)
[0067]
验证试验中首先通过前期的预实验,可以确定出两种引物所对应的pcr反应退火温度,分别是ccdc171为59℃、stum为60℃。
[0068]
(2)正式实验:利用预实验确定的引物和退火温度,使用冷启动法进行pcr扩增反应。
[0069]
反应体系:
[0070]
表6正式实验pcr反应体系
[0071][0072]
反应条件:
[0073]
表7冷启动法pcr反应条件
[0074][0075]
4.3电泳实验
[0076]
(1)制胶:量取60ml的1
×
tae溶液,再用电子天平称量0.9g琼脂糖,均添加到锥形瓶中,利用微波炉进行加热,边加热边摇匀至透明清亮无气泡。冷却后加3ul的核酸染料,并倒胶。
[0077]
(2)电泳:电泳仪参数调到110v、200ma,时间定为25min,将制好的胶放入到电泳槽中,倒入电泳液至没过胶板,将6ul的dl500 maker及6ul的样品分别加入到胶板的各小孔中,进行电泳。
[0078]
(3)拍照:利用bio
‑
rad伯乐chemidoc xrs+imager及其配套的软件系统对电泳跑胶结束后的胶板进行拍照获取样品dna的条带图像,并根据maker的条带对样品条带位置进行大致比对,初步判断对应引物进行pcr后所筛选出的位点是否正确。
[0079]
利用电泳实验对pcr后的样品进行检验,结果显示进行位点验证的2个绒细性状相关位点ccdc171、stum均有明亮且不拖尾条带(如图4),可初步判断所用引物能筛选出的绒细性状的相关snp位点,引物设计无误。
[0080]
4.4扩增产物sanger测序
[0081]
将pcr扩增后的样本进行sanger测序,并根据结果统计样本基因分型情况,判断进行验证的ccdc171和stum基因是否显著与内蒙古绒山羊的绒细性状相关。
[0082]
对基因进行sanger测序,其中ccdc171基因的测序峰图如下(如图5),对sanger测序结果进行基因分型统计(表8)。根据统计结果进行卡方检验,可知进行验证的ccdc171基因分型明显(p=0.00072),而stum基因分型不明显(p=0.76453)。说明ccdc171基因与内蒙古绒山羊的绒细性状显著相关;而stum基因与该性状相关不显著。
[0083]
候选基因位点的sanger测序和分型统计结果显示基因ccdc171(28342240,g
→
a),其核苷酸序列为gataaaggggaaaagaaagmaatttctcatatgtggttgta(m表示碱基g或a)(如seq id no:1所示)所示,该snp标记与绒细类型显著相关,是绒细性状的主要调控位点之一,且基因型aa与细绒型相关。
[0084]
表8验证基因的基因分型统计表
[0085][0086]
5 ccdc171(28342240,g
→
a)基因snp分子标记在绒山羊绒细性状品种鉴定上的应用及方法
[0087]
对待鉴定的绒山羊,采取组织dna,进行pcr扩增,pcr引物为f:gcacaccctttacgtgaactt(seq id no:2);r:tgtggcaaagattggtcctct(seq id no:3),然后将pcr扩增后的样本进行sanger测序,并根据结果进行基因分型,基因型为aa型的个体为细绒型绒山羊。
[0088]
6 ccdc171(28342240,g
→
a)基因snp分子标记在绒山羊绒细性状品种选育上的应用及方法
[0089]
对刚出生幼羊,采取组织dna,进行pcr扩增,pcr引物为f:gcacaccctttacgtgaactt(seq id no:2);r:tgtggcaaagattggtcctct(seq id no:3),然后将pcr扩增后的样本进行sanger测序,并根据结果进行基因分型,选留aa基因型个体,将选出来的aa基因型个体培育,即可获得细绒性状的绒山羊品系。
[0090]
7 ccdc171(28342240,g
→
a)基因snp分子标记在绒山羊绒细性状遗传改良上的应用及方法
[0091]
对刚出生幼羊,采取组织dna,进行pcr扩增,pcr引物为f:gcacaccctttacgtgaactt(seq id no:2);r:tgtggcaaagattggtcctct(seq id no:3),然后将pcr扩增后的样本进行sanger测序,并根据结果进行基因分型,选留aa基因型个体,将选出来的aa基因型个体培育,即可获得细绒性状的绒山羊品系。选取获得的细绒性状的绒山羊品系中的父本和母本进行扩繁,培育后代群体,逐代提高该位点的优势等位基因的频率,从而改良后代绒山羊的绒细性状,进而可加快绒山羊绒细性状遗传改良进程,提高绒山羊的产绒品质和产量。
[0092]
以上所述的仅是本发明的一些实施方式。对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些都属于发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1