一种pcMINI载体及其构建方法与应用与流程
一种pcmini载体及其构建方法与应用
技术领域
1.本发明属于分子生物学技术领域,具体涉及一种pcmini载体及其构建方法与应用。
背景技术:
2.真核生物中,无论是蛋白质还是除mrna之外的其他rna分子(如microrna、cirrna、lncrna等)都有对应的编码基因,这些编码基因通常被非编码的间隔序列(内含子)分隔为若干个外显子,上述编码基因也被称为断裂基因。在转录过程中,断裂基因首先被转录为含有外显子和内含子的mrna前体(precursor messenger rna,pre
‑
mrna),随后mrna前体经rna剪接(rna splicing),将内含子剪切去除,并将外显子rna部分有序连接,最终产生成熟的mrna。rna剪接是真核细胞基因表达的重要生物学机制,正确的rna剪接依赖于剪接体(spliceosome)及rna结合蛋白与mrna前体顺式作用元件的正确结合。调控rna剪接的顺式作用元件包括:1)内含子5’端的剪接供体(donor)位点gt和内含子3’端的剪接受体(acceptor)位点ag;2)近邻内含子的外显子序列,即外显子5’端的第1个碱基和3’端的最后3个碱基;这两类元件共同构成了外显子内含子接头序列,除了接头序列,基因外显子和内含子区域内部存在的剪接调控元件如增强子和沉默子亦会调控基因的剪接。
3.明确遗传病的致病基因是实现精准医疗的前提,随着高通量测序技术的完善和测序成本的降低,越来越多的基因突变得以被发现。在这些新发现的突变中,一部分位于基因编码区的无义突变、错义突变、移码突变等突变因直接影响编码蛋白的结构和功能,其致病性和临床意义能很快明确;但是,还有大量突变因其功能不明而被列为未知意义变异(variants of uncertain significant,vus),明确这些未知意义变异与遗传病的相关性是基因诊断要解决的重要问题。目前研究表明,有大量的人类遗传病与mrna异常剪接有直接关系:外显子内含子接头序列的突变可以导致邻近的内含子滞留或外显子缺失;基因内部突变产生新的接头序列可以导致rna剪接异常;剪接调控元件序列突变会影响rna剪接效率,从而影响基因表达水平。因此,如何能快速、高效地在体外对mrna异常剪接进行验证一直是研究的热点和难点,现有技术中报道的在体外对mrna异常剪接进行验证的载体系统存在着效率不高、准确性差等问题。
技术实现要素:
4.针对以上现有技术中的不足,本发明提供了一种pcmini载体及其构建方法与应用。通过克隆带有可能与mrna剪接相关的基因突变(包括外显子内含子接头序列附近以及深度内含子中的点突变、插入及缺失等变异)的目标基因组片段,构建重组表达载体,转染真核细胞株后进行rt
‑
pcr,再利用琼脂糖凝胶电泳和sanger测序技术验证该突变对mrna剪接的影响(外显子缺失、内含子滞留),本发明构建的载体能快速、高效并准确的验证一些突变对mrna剪接异常的影响。
5.本发明的一个目的在于提供一种pcmini载体。
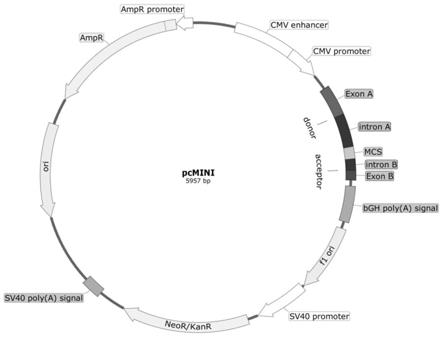
6.一种pcmini载体,所述pcmini载体是由载体pcdna3.1+改造而成,所述pcmini载体包含cmv增强子、pcmv启动子、多克隆位点(mcs)、外显子
‑
内含子基因片段和bgh_pa_terminator终止子,所述多克隆位点(mcs)用于插入外显子
‑
内含子结合处存在突变的基因片段。
7.进一步地,所述多克隆位点(mcs)位于所述外显子
‑
内含子基因片段之间,并且按“外显子a
‑
内含子a
‑
mcs
‑
内含子b
‑
外显子b”顺序排列,所述内含子a带有mrna剪切供体(donor)gt,所述内含子b带有mrna剪切受体(acceptor)ag。
8.进一步地,所述外显子a的核苷酸序列如seq id no:1所示;所述内含子a的核苷酸序列如seq id no:2所示;所述内含子b的核苷酸序列如seq id no:3所示;所述外显子b的核苷酸序列如seq id no:4所示。
9.本发明的另外一个目的在于提供一种pcmini载体的构建方法。
10.上述任一项所述的pcmini载体的构建方法,包括如下步骤:
11.s1、以人基因组dna为模板,设计扩增引物,经pcr扩增获得“外显子a+内含子a”dna片段,然后经hindiii/kpni双酶切插入载体pcdna3.1+多克隆位点区域,获得重组中间载体pcdna3.1
‑
a;
12.s2、以人基因组dna为模板,设计扩增引物,经pcr扩增获得“内含子b+外显子b”dna片段,然后经xhoi/xbai双酶切后插入步骤s1中得到的pcdna3.1
‑
a载体多克隆位点区域,获得pcmini重组载体;
13.s3、将步骤s2中得到的pcmini重组载体转化至大肠杆菌dh5α感受态细菌,培养后提取重组质粒,即为pcmini载体。
14.进一步地,步骤s1中,pcr扩增“外显子a+内含子a”dna片段的引物为pcmini
‑
hindiii
‑
f和pcmini
‑
kpni
‑
r,其序列分别如seq id no:5和seq id no:6所示。
15.进一步地,步骤s2中,pcr扩增“内含子b+外显子b”dna片段的引物为pcmini
‑
xhoi
‑
f和pcmini
‑
xbai
‑
r,其序列分别如seq id no:7和seq id no:8所示。
16.进一步地,步骤s3中具体方法如下:将得到的pcmini重组载体通过热激法转化至大肠杆菌dh5α感受态细菌,并通过氨苄青霉素抗性筛选获得阳性重组质粒。
17.更进一步地,所述抗性筛选的具体方法如下:挑取单菌落接种于含氨苄青霉素的lb液体培养基中,在37℃、200rpm的条件下培养过夜,使用商品化质粒小提试剂盒提取重组pcmini载体质粒dna。
18.本发明的最后一个目的在于提供一种pcmini载体的应用。
19.上述任一项所述的pcmini载体在体外验证真核生物mrna异常剪切中的应用。
20.进一步地,所述应用方法包括如下步骤:
21.s101、分别将含有突变位点的野生型dna片段和突变型dna片段插入pcmini载体的多克隆位点区域,构建表达野生型和突变型基因的重组表达载体;
22.s102、将步骤s101中构建的野生型和突变型基因的重组表达载体转染真核细胞,转染24小时后收集细胞;
23.s103、提取步骤s102中收集的细胞总rna,然后逆转录合成cdna;
24.s104、以步骤s103中合成的cdna为模板,使用引物扩增目标基因的转录产物;所述引物为pcmini
‑
f和pcmini
‑
r,其序列分别如seq id no:9和seq id no:10所示;
25.s105、琼脂糖凝胶电泳检测野生型和突变型基因片段的转录产物,并观察上述基因片段的差异;
26.s106、将步骤s105中得到的野生型和突变型基因的转录产物进行sanger测序,比对测序结果,分析此突变的影响。
27.与现有技术,本发明具有如下优点:
28.1)本发明的pcmini载体系统只需通过更换插入的dna片段即可实现对不同基因突变的检测,使用范围广,操作简便;
29.2)本发明构建的pcmini载体所需插入的dna片段更小,载体构建更为高效快速;
30.3)本发明的pcmini载体的内含子元件包含了高效的剪接受体和剪接供体位点,能确保插入dna片段有效进行rna剪接;
31.4)本发明提供了一套完整可行的基于pcmini载体的真核生物mrna异常剪切验证方法。
附图说明
32.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
33.图1为本发明构建的pcmini载体图谱;
34.图2为本发明构建的pcmini
‑
tsc1载体图谱;
35.图3为minigene检测载体pcmini
‑
tsc1
‑
wt(图a)和pcmini
‑
tsc1
‑
mut(图b)测序结果图;
36.图4为tsc1基因转录产物检测结果图;其中,图a为琼脂糖电泳检测rt
‑
pcr扩增产物结果;图b为2个转录本的结构示意图;图c和图d分别为野生型和突变型基因片段的2个转录本的测序结果。
具体实施方式
37.下面将结合具体实施例对本发明的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
38.其他常规试剂和设备,如无特别说明,均可市售获得;若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
39.以下实施例以人tsc1基因c.1550_1551del突变导致的mrna剪接异常检测为例,阐述本发明的技术方案和应用方式。
40.实施例1pcmini载体的构建
41.1.1重组中间载体pcdna3.1
‑
a的构建
42.以人基因组dna为模板,使用引物pcmini
‑
hindiii
‑
f和pcmini
‑
kpni
‑
r扩增“外显子a+内含子a”dna片段;所述引物的序列如下所示:
43.pcmini
‑
hindiii
‑
f:acttaagcttatgagtgggctttggggtggccggtt(seq id no:5)
44.pcmini
‑
kpni
‑
r:gctcggtacctacccatgagccatgtg(seq id no:6)
45.将上述pcr片段纯化回收后,使用hindiii/kpni双酶切扩增片段,同时使用hindiii/kpni双酶切pcdna3.1+质粒;使用t4 dna连接酶连接片段和载体,使用热激法将连接产物转化至大肠杆菌dh5α感受态细胞,对经氨苄青霉素抗性筛选的阳性克隆进行菌落pcr检测和测序检测双重验证后,获得重组中间载体pcdna3.1
‑
a。
46.1.2pcmini载体的构建
47.以人基因组dna为模板,使用引物pcmini
‑
xhoi
‑
f和pcmini
‑
xbai
‑
r扩增“内含子b+外显子b”dna片段;所述引物的序列如下所示:
48.pcmini
‑
xhoi
‑
f:gccgctcgaggaaaactgccct(seq id no:7)
49.pcmini
‑
xbai
‑
r:gccctctagactggtcattccggctc(seq id no:8)
50.将pcr片段纯化回收后,使用xhoi/xbai双酶切扩增片段,同时使用xhoi/xbai双酶切步骤1.1中获得的pcdna3.1
‑
a重组质粒;使用t4 dna连接酶连接片段和载体,使用热激法将连接产物转化至大肠杆菌dh5α感受态细胞,挑选经氨苄青霉素抗性筛选的阳性克隆进行菌落pcr检测和pcr测序,获得pcmini表达载体,pcmini载体图谱如图1所示。
51.本实施例中,外显子a、b和内含子a、b均来自人asl基因组序列,其中,内含子a和内含子b分别带有高效的mrna剪切供体(donor)gt和mrna剪切受体(acceptor)ag,是经过大量的筛选得到的,能确保插入的基因正确进行mrna剪切。
52.实施例2人tsc1基因c.1550_1551del突变导致的mrna剪接异常的检测
53.2.1pcmini
‑
tsc1载体的构建
54.tsc1基因的c.1550_1551del突变位于tsc1基因的第15号外显子上,将含有部分14号内含子(316bp)、15号外显子(559bp)和部分15号内含子(304bp)的基因片段连入pcmini载体构建表达质粒,所述表达质粒的图谱如图2所示。
55.对于tsc1野生型表达载体,以人基因组dna为模板,使用引物tsc1
‑
37525
‑
f/tsc1
‑
39957
‑
r和引物tsc1
‑
37892
‑
f/tsc1
‑
39618
‑
r进行巢式pcr扩增;所述引物的序列如下所示:
56.tsc1
‑
37525
‑
f:gtattctgacttgactatatc(seq id no:11)
57.tsc1
‑
39957
‑
r:ctgtgttgttagcttaacacag(seq id no:12)
58.tsc1
‑
37892
‑
f:gtaatgtatgtgggattgctatg(seq id no:13)
59.tsc1
‑
39618
‑
r:tccccaagcacctgtaaagtag(seq id no:14)
60.再以扩增产物为模板,使用引物pcmini
‑
tsc1
‑
kpn1
‑
f和pcmini
‑
tsc1
‑
bamh1
‑
r进行pcr扩增,所述引物的序列如下所示:
61.pcmini
‑
tsc1
‑
kpn1
‑
f:ggtaggtacccacctcagcctcctgagtagctg(seq id no:15)
62.pcmini
‑
tsc1
‑
bamh1
‑
r:tagtggatcccttgcagagggcacatatgaaag(seq id no:16)
63.扩增片段回收纯化后,经kpni/bamhi双酶切后插入pcmini载体,筛选阳性克隆即得pcmini
‑
tsc1
‑
wt质粒。
64.对于tsc1突变型表达载体,以人pcmini
‑
tsc1
‑
wt质粒为模板,分别使用pcmini
‑
tsc1
‑
kpn1
‑
f(seq id no:15)/tsc1
‑
mut
‑
r和tsc1
‑
mut
‑
f/pcmini
‑
tsc1
‑
bamh1
‑
r(seq id no:16)引物进行pcr扩增,所述引物的序列如下所示:
65.tsc1
‑
mut
‑
f:ctcccaggttctcagcaagacccactcggcag(seq id no:17)
66.tsc1
‑
mut
‑
r:ctgccgagtgggtcttgctgagaacctgggag(seq id no:18)
67.以上述2个pcr产物为模板,使用引物pcmini
‑
tsc1
‑
kpn1
‑
f(seq id no:15)和pcmini
‑
tsc1
‑
bamh1
‑
r(seq id no:16)进行重叠pcr,扩增片段即为携带有tsc1 c.1550_1551del突变的片段;该片段经kpni/bamhi双酶切后插入pcmini载体,筛选阳性克隆即得pcmini
‑
tsc1
‑
mut质粒。
68.sanger测序结果(图3)显示,pcmini
‑
tsc1
‑
wt和pcmini
‑
tsc1
‑
mut质粒插入片段序列与预期一致,pcmini
‑
tsc1
‑
mut质粒中成功导入了c.1550_1551del突变。
69.2.2tsc1基因c.1550_1551del突变对转录的影响
70.将步骤2.1中得到的pcmini
‑
tsc1
‑
wt和pcmini
‑
tsc1
‑
mut质粒分别转染至人宫颈癌细胞系hela细胞系,转染48小时后收集细胞,常规提取总rna并逆转录合成cdna,使用pcmini
‑
f/pcmini
‑
r引物进行rt
‑
pcr检测,所述引物的序列如下:
71.pcmini
‑
f:gcttactggcttatcgaaatt(seq id no:9)
72.pcmini
‑
r:ggcaaacaacagatggctggc(seq id no:10)
73.经琼脂糖凝胶电泳检测检测野生型和突变型基因片段的转录产物,并观察上述基因片段的差异;继续将上述野生型和突变型基因的转录产物进行sanger测序,比对测序结果,分析此突变的影响,结果见图4。
74.图4结果表明,pcmini
‑
tsc1
‑
wt和pcmini
‑
mut均产生了2个转录本,说明tsc1基因本身存在可变剪切,并且c.1550_1551del突变则使转录本b的转录水平增加了;sanger测序结果表明:转录本a完整表达了exona+tsc1 exon15+exonb序列,而转录本b中tsc1exon15有417bp缺失,因此,本发明构建的pcmini载体能快速、高效并准确的在体外验证一些突变对真核生物mrna剪接异常的影响。
75.以上实施例,仅为本发明的具体实施方式,用以说明本发明的技术方案,而非对其限制,本发明的保护范围并不局限于此,尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,其依然可以对前述实施例所记载的技术方案进行修改或可轻易想到变化,或者对其中部分技术特征进行等同替换;而这些修改、变化或者替换,并不使相应技术方案的本质脱离本发明实施例技术方案的精神和范围,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1