一种融合多肽TAT-pY682及其在制备阿尔茨海默病药物中的应用
一种融合多肽tat
‑
py682及其在制备阿尔茨海默病药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及一种融合多肽tat
‑
py682及其在制备阿尔茨海默病药物中的应用。
背景技术:
2.阿尔茨海默病(alzheimer’s disease,ad)是老年人中最常见的神经系统退行性疾病,约占老年痴呆症的三分之二,临床上主要表现为进行性记忆减退、认知功能下降以及精神行为异常等。ad的特征性病理变化主要包括β淀粉样蛋白(amyloidβpeptide,aβ)斑块形成、神经原纤维缠结和神经元丢失等等,其中aβ由β淀粉样前体蛋白(β
‑
amyloid precursor protein,app)水解而成,app依次经过β分泌酶和γ分泌酶的切割后生成aβ。在机体正常代谢条件下,aβ的产生和降解处于动态平衡中,当app蛋白出现代谢异常时,aβ的生成增加和(或)降解减少均会造成aβ的大量沉积。随着世界人口老龄化程度的不断加剧,在老年人群中阿尔茨海默病已成为继心脑血管疾病和恶性肿瘤之后的第4位致死原因,给社会和家庭带来了沉重的负担。然而,ad的病因和发病机制却仍不明确,更缺乏有效的治疗手段,目前多个临床试验均以失败告终,ad已成为医学科学研究工作者所面临的一大具有挑战性的世界难题。
3.vav2是vav蛋白家族的成员之一,是rho家族小gtp酶的鸟苷酸交换因子(guanine nucleotide exchange factor,gef),在细胞内参与多种重要的信号转导通路,参与细胞迁移、粘附、极化等重要生理功能。研究表明,vav2所参与的信号通路中,vav2的sh2结构域发挥了关键作用。vav2通过其sh2结构域与不同的蛋白,包括各种质膜受体的胞内区域或者是胞质内的接头蛋白相互作用,从而被招募到细胞质膜并被激活。在生长因子信号通路中,vav2
‑
sh2直接结合激活的egf受体、pdgf受体的胞内域的酪氨酸磷酸化位点;在ephs信号通路中vav2
‑
sh2也是直接结合ephs的胞内域的酪氨酸磷酸化位点;在tcr信号通路中,vav2
‑
sh2与磷酸化的slp76结合;在bcr信号通路中,vav2与辅助受体cdl9的胞内区的酪氨酸磷酸化位点结合等等。app蛋白是位于细胞膜上的单次跨膜蛋白,研究表明app胞内段不仅可被水解为致病性aβ,还参与了细胞内多种重要的信号转导通路,具有重要的生理功能。
4.经检索,目前尚未见到vav2蛋白与app蛋白之间的研究。在本次发明中,我们首次发现了vav2对app蛋白表达的正向调节作用,vav2蛋白通过其sh2结构域与app蛋白胞内域的磷酸化y682位点直接结合,显著增加了app蛋白的表达,进而增加c99、c83及aβ40的生成,加重β淀粉样蛋白斑块的形成。
技术实现要素:
5.本发明旨在提供一种融合多肽及其在制备阿尔茨海默病药物中的应用,其作为针对于vav2调控app蛋白表达的竞争性抑制剂,该融合多肽可以使细胞中app蛋白水平下降,进而降低细胞内c99、c83以及aβ40的生成。
6.为了达到上述目的,本发明采用以下技术方案:
7.本发明的第一个目的是提供一种融合多肽tat
‑
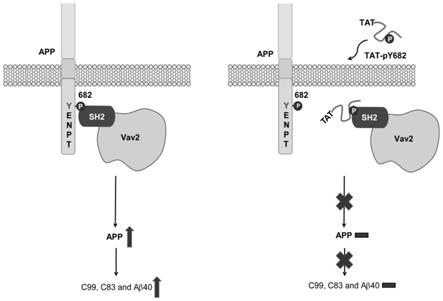
py682,所述融合多肽tat
‑
py682含有多肽ⅰ和多肽ⅱ,所述多肽ⅰ为hiv
‑
tat蛋白转导域,其作用是跨膜传递;所述多肽ⅱ为app蛋白中含有氨基酸位点py682的肽段,其作用是进入细胞内部后,选择性与vav2结合,与app蛋白竞争vav2,从而降低vav2对app蛋白表达的正向调节作用,进而抑制β淀粉样斑块的形成。多肽ⅰ的n
‑
末端与多肽ⅱ的c
‑
末端的氨基酸缩合形成肽键。
8.优选的,所述多肽ⅰ序列信息如seq id no.1所示;多肽ⅱ序列信息如seq id no.2所示。
9.ygrkkrrqrrr(seq id no.1);
10.qngpy682enpt(seq id no.2)
11.优选的,所述融合多肽tat
‑
py682的氨基酸序列如seq id no.3所示。
12.ygrkkrrqrrrqngpy682enpt(seq id no.3)
13.本发明的第二个目的是提供一种上述所述的融合多肽tat
‑
py682在制备抑制β淀粉样蛋白斑块形成的药物中的应用。
14.本发明的又一个目的是提供一种上述所述的融合多肽tat
‑
py682在制备阿尔茨海默病药物中的应用。
15.优选的,所述阿尔茨海默病包括散发性阿尔茨海默病或家族性阿尔茨海默病。
16.本发明的又一个目的是提供一种用于治疗阿尔茨海默病的药物组合物,所述药物组合物包含上述所述的融合多肽tat
‑
py682。
17.优选的,所述药物组合物还包括药用辅料;所述药物组合物的剂型为注射剂、胶囊剂、片剂、气雾剂。
18.本发明的又一个目的是提供一种筛选抑制β淀粉样蛋白斑块形成药物的方法,所述药物作为vav2与app蛋白结合的阻断剂或竞争性抑制剂。
19.本发明的又一个目的是提供一种筛选治疗阿尔茨海默病药物的方法,所述药物作为vav2与app蛋白结合的阻断剂或竞争性抑制剂。
20.优选的,vav2蛋白通过其sh2结构域与app蛋白胞内域的磷酸化y682位点直接结合。
21.优选的,vav2对app蛋白的调节作用消失,则说明vav2对app蛋白两者之间的作用依赖于app蛋白上的磷酸化y682位点。
22.本发明整体的设计思路如下:
23.首先,本发明通过免疫共沉淀实验和免疫荧光共聚焦实验验证了vav2和app蛋白之间的相互作用。其次,为了探讨vav2对app蛋白的调节作用,本发明在20e2细胞(app稳转细胞系)中分别高表达vav2表达质粒pcmv5
‑
vav2
‑
wt、pcmv5
‑
vav2
‑
r680a(sh2结构域突变质粒)、pcmv5
‑
vav2
‑
e205a(gef酶活性突变质粒)及pcmv5
‑
vav2
‑
r680ae205a(双突变质粒),wb实验发现野生型vav2可显著增加细胞内app蛋白的含量,进而增加细胞内c99、c83以及aβ40的生成,并且这种调节作用主要依赖于vav2
‑
sh2与app胞内域磷酸化y682位点的特异性结合。
24.针对上述结果,本发明提供了一种融合多肽,是由多肽ⅰ和多肽ⅱ构成的融合多肽,其中,多肽ⅰ为hiv
‑
tat蛋白转导域,其序列为ygrkkrrqrrr,作用为跨膜传递,多肽ⅱ为
一段app上的特异性磷酸化氨基酸序列(qngpy682enpt),其作用为进入细胞内后,特异性与vav2蛋白结合,与app蛋白竞争vav2,从而降低vav2对app的正向调节作用,减少细胞内c99、c83以及aβ40的生成。多肽ⅰ的n
‑
末端与多肽ⅱ的c
‑
末端的氨基酸缩合形成肽键。所述融合多肽,制备时,常规方法人工合成,或使用重组表达系统的合成方法合成即可,均为现有技术中的成熟技术。
25.本发明的融合多肽作用原理为:在hiv
‑
tat的作用下,磷酸化融合多肽被带入细胞内部,然后融合多肽与app蛋白竞争vav2,降低vav2对app蛋白表达的正向调节作用,进而减少细胞内c99、c83以及aβ40的生成,抑制细胞内淀粉样斑块形成。本发明的融合多肽作为针对于vav2调控app蛋白表达的竞争性抑制剂,在细胞内抑制vav2对app的作用实验表明该融合多肽可以使细胞中app蛋白水平下降,进而降低细胞内c99、c83以及aβ40的生成,抑制β淀粉样蛋白斑块形成。本发明为阿尔茨海默病药物的设计提供了新的作用靶点,为延缓阿尔茨海默病的进展提供了新的思路。
26.与现有技术相比,本发明具有以下有益效果:
27.1)本发明首次发现了vav2对app蛋白的调节作用,vav2蛋白通过其sh2结构域与app蛋白胞内域的磷酸化y682位点直接结合,显著增加了app蛋白的表达,进而增加c99、c83及aβ40的生成,加重了β淀粉样蛋白斑块的形成;
28.2)本发明提供了一种融合多肽tat
‑
py682,其作为针对于vav2调控app蛋白表达的竞争性抑制剂,可以特异性结合vav2蛋白,使细胞中app蛋白水平下降,进而降低细胞内c99、c83以及aβ40的生成;
29.3)本发明提供了一种能竞争性抑制vav2对app蛋白表达的正向调节作用的融合多肽,以及该融合多肽在制备阿尔兹海默病药物中的应用,为阿尔茨海默病药物的设计提供了新的作用靶点,为延缓ad的进展提供了新的思路。
附图说明
30.图1为免疫共沉淀coip实验图;其中,图1(a):针对于app蛋白的anti
‑
c20抗体可有效沉淀vav2蛋白;图1(b):针对于vav2蛋白的anti
‑
myc抗体可反向有效沉淀app蛋白;
31.图2为共聚焦免疫荧光实验图;其中,图2(a)为vav2蛋白和app蛋白的共聚焦免疫荧光图;图2(b)为图2(a)的荧光共定位图;
32.图3为高表达野生型vav2质粒及其突变质粒后的western blot和elisa实验图;其中,图3(a)为高表达野生型vav2及其突变质粒的western blot实验结果图;图3(b)为图3(a)中app蛋白的量化图;图3(c)为图3(a)中c99蛋白的量化图;图3(d)为图3(a)中c83蛋白的量化图;图3(e)为高表达野生型vav2质粒及其突变质粒后的elisa实验结果图;图3(f)为pcmv5
‑
vav2
‑
wt与papp
‑
wt或papp
‑
y682a共转染hek293细胞后的western blot实验结果图;
33.图4为加入融合多肽tat
‑
py682后的western blot和elisa图;其中,图4(a)为加入融合多肽tat
‑
py682后的western blot实验结果图;图4(b)为图4(a)中app蛋白的量化图;图4(c)为图4(a)中c99蛋白的量化图;图4(d)为图4(a)中c83蛋白的量化图;图4(e)为加入融合多肽tat
‑
py682后的酶联免疫吸附实验(elisa)实验结果图;
34.图5为融合多肽tat
‑
py682的作用机制示意图。
具体实施方式
35.以下通过实施例形式的具体实施方式,对本发明的上述内容作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下实施例。
36.所述pcmv5
‑
vav2
‑
wt质粒、pcmv5
‑
vav2
‑
r680a质粒、pcmv5
‑
vav2
‑
e205a质粒及pcmv5
‑
vav2
‑
r680ae205a质粒(双突变质粒)由中国科学院合肥物质科学研究院王俊峰教授提供;所述papp
‑
wt质粒、papp
‑
y682a质粒购自维真生物;所述pei转染试剂购自维真生物,货号fh880806;所述蛋白酶抑制剂和磷酸酶抑制剂均购自sigma公司,货号分别为s8830和4906845001;所述5
×
sds样品变性缓冲液和2
×
sds样品变性缓冲液购自碧云天公司,货号分别为p0015l和p0015b;所述anti
‑
myc抗体和anti
‑
c20抗体由本实验室自制;所述蛋白a/g琼脂糖珠购自santa cruze,货号sc2003;所述anti
‑
app
‑
n抗体购自sigma公司,货号sab4200536;所述蛋白定量检测试剂盒购自thermofisher scientific公司,货号23225;所述hek293细胞购自atcc,所述20e2细胞是本实验室在hek293细胞基础上构建的app稳转细胞系。
37.实施例1vav2蛋白和app蛋白之间存在物理相互作用
38.为了研究vav2蛋白和app蛋白的相互作用,在20e2细胞中高表达pcmv5
‑
vav2
‑
wt质粒,进行免疫共沉淀实验和免疫荧光共聚焦实验;所述pcmv5
‑
vav2
‑
wt为野生型vav2表达质粒。
39.1.1免疫共沉淀实验过程如下:
40.1)应用pei转染试剂(或其他品牌转染试剂均可)将构建好的pcmv5
‑
vav2
‑
wt质粒转染入10cm皿的20e2细胞中,转染时细胞密度约为75%,转染后4小时更换培养基,所述培养基为含有10%胎牛血清的dmem培养基,其中,胎牛血清购自thermofisher公司,货号10099141。
41.2)转染后48小时,用预冷的磷酸盐缓冲盐溶液(pbs溶液)清洗细胞并离心收集细胞,向细胞沉淀中加入np40裂解液1000μl(已加入足量的蛋白酶抑制剂和磷酸酶抑制剂),30%强度超声充分破碎细胞,4℃条件下12000rpm离心15分钟
42.3)取适量裂解液上清加入一抗和蛋白a/g琼脂糖珠,一抗分别为anti
‑
myc抗体和anti
‑
c20抗体,4度孵育过夜;次日依次用np40裂解液和pbs缓冲液洗涤珠子,按1:1的比例加入2
×
sds上样变性缓冲液,95℃加热5分钟后冷却离心,将样品上样于8%glycine sds
‑
page凝胶电泳,进行wb检测,应用anti
‑
c20一抗结合对应种属的荧光二抗,观察app蛋白及vav2蛋白是否有相互作用。
43.免疫共沉淀实验结果如图1所示,其中,图1(a):针对于app蛋白的anti
‑
c20抗体可有效沉淀vav2蛋白;图1(b):针对于vav2蛋白的anti
‑
myc抗体可反向有效沉淀app蛋白。图1(a)证实了针对于app蛋白的anti
‑
c20抗体可有效沉淀vav2蛋白,图1(b)证实了针对于vav2蛋白的anti
‑
myc抗体可反向沉淀app蛋白,由此可知,在细胞中vav2蛋白和app蛋白之间存在相互作用。
44.1.2免疫荧光共聚焦实验过程如下:
45.1)应用pei转染试剂(或其他品牌转染试剂均可)将构建好的pcmv5
‑
vav2
‑
wt质粒转染入24孔的20e2细胞中,转染时细胞密度约为75%,转染后4小时更换培养基,所述培养基为含有10%胎牛血清的dmem培养基,其中,胎牛血清购自thermofisher公司,货号
10099141。
46.2)转染后48小时,用预冷的磷酸盐缓冲盐溶液(pbs溶液)清洗细胞并用4%多聚甲醛固定细胞15分钟,pbs溶液清洗细胞3次后用0.5%triton
‑
x
‑
100室温孵育20min。
47.3)pbs溶液清洗细胞3次后,山羊血清封闭液室温封闭30min,加入一抗,一抗分别为anti
‑
app
‑
n抗体和anti
‑
myc抗体,室温孵育2小时,而后加入与一抗属性对应的荧光二抗,共聚焦荧光显微镜下观察vav2蛋白和app蛋白。
48.共聚焦免疫荧光实验结果如图2所示,其中,图2(a)为vav2蛋白和app蛋白的共聚焦免疫荧光图;图2(b)为图2(a)的荧光共定位图;由此可知,vav2蛋白和app蛋白之间存在物理相互作用。
49.实施例2vav2对app蛋白的调节作用
50.为了研究vav2对app蛋白的调节作用,在20e2细胞(app稳转细胞系)中分别高表达pcmv5
‑
vav2
‑
wt质粒、pcmv5
‑
vav2
‑
r680a、pcmv5
‑
vav2
‑
e205a质粒及pcmv5
‑
vav2
‑
r680ae205a质粒,进行wb实验和酶联免疫吸附实验(elisa);所述pcmv5
‑
vav2
‑
r680a为sh2结构域突变质粒;所述pcmv5
‑
vav2
‑
e205a为gef酶活性突变质粒;所述pcmv5
‑
vav2
‑
r680ae205a,为sh2结构域和gef酶活性的双突变质粒。
51.2.1wb实验过程如下:
52.1)应用pei转染试剂(或其他品牌转染试剂均可)将构建好的pcmv5
‑
vav2
‑
wt质粒、pcmv5
‑
vav2
‑
r680a质粒、pcmv5
‑
vav2
‑
e205a质粒及pcmv5
‑
vav2
‑
r680ae205a质粒(双突变质粒),分别转染入6孔板的20e2细胞中,转染时细胞密度约为75%,转染后4小时更换培养基,所述培养基为含有10%胎牛血清的dmem培养基,其中,胎牛血清购自thermofisher公司,货号10099141。
53.2)转染后48小时,收取培养基上清,同时用预冷的磷酸盐缓冲盐溶液(pbs溶液)清洗细胞并离心收集细胞,向细胞沉淀中加入ripa裂解液150ul(已加入足量的蛋白酶抑制剂和磷酸酶抑制剂),30%强度超声充分破碎细胞,4℃条件下12000rpm离心15分钟后,取上清进行bca法蛋白定量,bca法蛋白定量过程详见蛋白定量检测试剂盒(thermofisher scientific公司,货号23225)。
54.所述ripa裂解液配方为:50mm tris(ph7.4),150mm nacl,1%triton x
‑
100,1%sodium deoxycholate,0.1%sds。
55.3)根据定量结果将每个样品总蛋白取出50μg,按4:1的比例加入5
×
sds上样变性缓冲液,95℃加热5分钟后冷却离心,将样品上样于8%glycine sds
‑
page凝胶电泳,进行wb检测,应用anti
‑
c20一抗结合对应种属的荧光二抗,观察app蛋白、c99蛋白和c83蛋白表达的差异。
56.实验结果如图3所示,其中,图3(a)为高表达野生型vav2及其突变质粒的western blot实验结果图;图3(b)为图3(a)中app蛋白的量化图;图3(c)为图3(a)中c99蛋白的量化图;图3(d)为图3(a)中c83蛋白的量化图;图3(f)为pcmv5
‑
vav2
‑
wt与papp
‑
wt或papp
‑
y682a共转染hek293细胞后的western blot实验结果图。
57.图3(a)western blot实验中分别高表达pcmv5
‑
vav2
‑
wt质粒、pcmv5
‑
vav2
‑
r680a质粒、pcmv5
‑
vav2
‑
e205a质粒及pcmv5
‑
vav2
‑
r680ae205a质粒(双突变质粒)至20e2细胞中,anti
‑
c20抗体免疫杂交检测app蛋白、c99蛋白和c83蛋白图,证实了vav2可显著增加细胞内
app蛋白的表达,进而增加c99和c83生成。图3(b/c/d)为图(a)电泳图中app蛋白、c99蛋白和c83蛋白的量化结果图,结果显示突变app蛋白的y682位点为a后,vav2对app蛋白的调节作用消失,说明vav2对app蛋白表达的正向调节作用依赖于app蛋白上的磷酸化y682位点。图3(f)为pcmv5
‑
vav2
‑
wt与papp
‑
wt或papp
‑
y682a共转染hek293细胞,anto
‑
c20抗体免疫杂交检测app蛋白图,柱形图为电泳图量化结果图。由图3(a/b/c/d/f)可知,高表达野生型vav2后,细胞内app蛋白、c99和c83的表达均增加,其原因可能是vav2蛋白通过其sh2结构域与app蛋白胞内域的磷酸化y682位点直接结合,显著增加了app蛋白的表达,进而增加c99和c83的生成,加重细胞内β淀粉样蛋白斑块的形成。
58.2.2酶联免疫吸附实验(elisa)过程如下:
59.1)应用pei转染试剂(或其他品牌转染试剂均可)将构建好的pcmv5
‑
vav2
‑
wt质粒、pcmv5
‑
vav2
‑
r680a质粒、pcmv5
‑
vav2
‑
e205a质粒及pcmv5
‑
vav2
‑
r680ae205a质粒(双突变质粒),分别转染入6孔板的20e2细胞中,转染时细胞密度约为75%,转染后4小时更换培养基,所述培养基为含有10%胎牛血清的dmem培养基,其中,胎牛血清购自thermofisher公司,货号10099141。
60.2)转染后48小时,收取细胞培养基上清,采用aβ1
‑
40elisa试剂盒处理培养基上清,具体过程详见aβ1
‑
40elisa试剂盒(cloud
‑
clone corp公司,货号cea864 hu)。
61.实验结果如图3(e)所示,其中,图3(e)为分别高表达pcmv5
‑
vav2
‑
wt质粒、pcmv5
‑
vav2
‑
r680a质粒、pcmv5
‑
vav2
‑
e205a质粒及pcmv5
‑
vav2
‑
r680ae205a质粒(双突变质粒)至20e2细胞中,elisa实验检测细胞培养基上清中的aβ40含量图;elisa结果显示,高表达野生型vav2后,培养基上清中的aβ40明显增加,而sh2结构域突变质粒(vav2
‑
r680a)及双突变质粒并不能使培养基上清中的aβ40增加,证实了vav2显著增加了aβ40的生成和分泌(p<0.05),进而加重β淀粉样蛋白斑块的形成,并且这种调节作用依赖于vav2的sh2结构域。
62.综上可见,野生型vav2可显著增加细胞内app蛋白的含量,进而增加细胞内c99、c83以及aβ40的生成,并且这种调节作用主要依赖于vav2
‑
sh2与app胞内域磷酸化y682位点的特异性结合。
63.由wb实验和酶联免疫吸附实验(elisa)可知,vav2对app蛋白的调节作用主要体现在vav2在20e2细胞中增加app蛋白的表达,进而增加c99、c83和aβ40的生成,并且关键作用位点是vav2
‑
sh2结构域和app
‑
y682磷酸化位点。
64.实施例3制备及纯化融合多肽tat
‑
py682
65.1)合成顺序:从序列c端到n端,步骤如下:
66.a.称取n当量树脂放入反应器,加入二氯甲烷(dcm)溶胀半小时,然后抽掉dcm,加入序列中第一个氨基酸2n当量,加2n当量的二异丙基乙胺(diea),适量的二甲基甲酰胺(dmf),dcm(适量是指以可使树脂充分鼓动起来为宜),diea、dmf、dcm,氮气鼓泡反应60min。然后加入约5n当量甲醇,反应半小时,抽掉反应液,用dmf、甲醇洗净;
67.b.往反应器中加入2n当量序列中第二个氨基酸,2n当量1
‑
羟基,苯并,三氯唑四甲基六氟磷酸盐(hbtu)及diea,氮气鼓泡反应半小时,洗掉液体,茚三酮检测,然后用吡啶和乙酸酐封端;最后洗净,加入适量的脱帽液去除fmoc(9
‑
芴甲氧羰基)保护基,洗净,茚三酮检测;
68.c.依步骤b的方式依次加入序列中不同的氨基酸并进行各种修饰,得到融合多肽
tat
‑
py682的氨基酸序列如seq id no.3所示。
69.d.将树脂用氮气吹干后从反应柱中取下,倒入烧瓶中,然后往烧瓶中加一定量的切割液,震荡,滤掉树脂;所述切割液的配方为:95%tfa,2%乙二硫醇,2%三异丙基硅烷,1%水;所述切割液与树脂的比例为1:10;
70.e.得到滤液,然后向滤液中加入大量乙醚,析出粗产物,然后离心,清洗即可得到序列的粗产物;
71.2)多肽纯化:开发新工艺用高效液相色谱将粗品提纯至要求纯度;
72.3)多肽冻干:纯化好的液体放入冻干机中进行浓缩,冻干成白色粉末。
73.实施例4融合多肽tat
‑
py682在细胞内抑制vav2对app的作用
74.融合多肽tat
‑
py682在细胞内抑制vav2对app的作用,包括如下步骤:
75.1)采用pei转染试剂将构建好的pcmv5
‑
vav2
‑
wt质粒及其空白对照分别转染入20e2细胞中,转染时细胞密度约为75%,转染后4小时更换培养基;所述培养基为含有10%胎牛血清的dmem培养基,其中,胎牛血清购自thermofisher公司,货号10099141。
76.2)转染后4小时,加入含有100μm融合多肽tat
‑
py682的培养基或其空白溶剂,所述培养基购自中科迈晨,货号cm15019;作用48小时后收取培养基上清液进行elisa实验,同时收取细胞沉淀进行wb实验。
77.实验结果如图4所示,其中,图4(a)为加入融合多肽tat
‑
py682后的western blot实验结果图;图4(b)为图4(a)中app蛋白的量化图;图4(c)为图4(a)中c99蛋白的量化图;图4(d)为图4(a)中c83蛋白的量化图。图4(a)中western blot实验转染pcmv5
‑
vav2
‑
wt质粒至20e2细胞中,而后加入融合多肽tat
‑
py682或空白溶剂,anti
‑
c20抗体免疫杂交检测app蛋白、c99蛋白和c83蛋白,证实了融合多肽tat
‑
py682显著抑制了vav2对app蛋白表达的正向调节作用,减少了细胞内app蛋白的表达,进而减少了c99和c83蛋白的表达。
78.图4(b/c/d)为图(a)电泳图中app蛋白、c99蛋白和c83蛋白的量化结果,图4(e)为转染pcmv5
‑
vav2
‑
wt质粒至20e2细胞中,而后加入融合多肽tat
‑
py682或空白溶剂,elisa实验检测细胞培养基上清中的aβ40含量图。由图4(a/b/c/d)可知tat
‑
py682显著抑制了vav2对app蛋白表达的正向调节作用,减少了细胞内app蛋白的表达,进而减少了c99和c83蛋白的表达。
79.图4(e)为加入融合多肽tat
‑
py682后的酶联免疫吸附实验(elisa)实验结果图,elisa实验结果显示高表达野生型vav2后,培养基上清中的aβ40明显增加,而融合多肽tat
‑
py682显著抑制了vav2对aβ40的调节作用,使培养基上清中的aβ40含量明显降低(p<0.05),进而减轻了β淀粉样蛋白斑块的形成。
80.图5为融合多肽tat
‑
py682的作用机制示意图。
81.由此可知,该融合多肽tat
‑
py682可以竞争性抑制vav2对app蛋白表达的作用,进而减少细胞内c99、c83的含量及上清中aβ40的含量。
82.上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1