一种纯化蛛丝蛋白包涵体的方法与流程
1.本发明涉及生物技术领域,尤其涉及一种纯化蛛丝蛋白包涵体的方法。
背景技术:
2.自然界的蜘蛛丝是一种极具吸引力的物质,体轻质坚,能生物降解,具有广泛的用途。但天然蜘蛛丝产量很低,且蜘蛛有同类相食的特性,无法像家蚕一样高密度养殖,严重限制了蛛丝的应用。
3.随着生物技术的发展,研究人员开始探索通过基因工程技术重组表达蛛丝蛋白制备仿生蜘蛛丝。在此领域中,大肠杆菌作为表达系统相对研究较成熟。但因大肠杆菌缺乏内质网和伴侣蛋白等真核生物中用于蛋白质折叠的关键元件,从而导致一些真核来源的蛋白或者对细胞有毒性的蛋白时经常聚集形成包涵体蛋白。
4.传统溶解包涵体蛋白的方法一般需要用强变性剂,如8m尿素或6m盐酸胍,但是变性的蛋白需要通过缓慢去除变性剂使目标蛋白从变性的伸展状态恢复到正确的高级结构。由于含有高浓度的变性剂在复性过程中需要多次重复更换缓冲液,因此需要大体积的缓冲液且耗时长,不利用工业生产。因此,亟需开发一种快速简单的纯化蛛丝蛋白包涵体的方法。
5.鉴于此,特提出本发明。
技术实现要素:
6.为了解决传统溶解包涵体的方法需要大体积的缓冲液且耗时长的问题,本发明提供了一种纯化蛛丝蛋白包涵体的方法,该方法通过分级离心去除杂蛋白的方法可以简单快速实现蛛丝蛋白包涵体的纯化,可应用于工业生产。
7.具体地,本发明提供以下技术方案:
8.本发明提供一种纯化蛛丝蛋白包涵体的方法,包括:
9.步骤(1),将湿菌体破壁后,分离得到含有蛛丝蛋白包涵体的沉淀i;
10.步骤(2),将所述沉淀i与含有尿素的缓冲液混合,并分离得到含有蛛丝蛋白包涵体的沉淀ii;
11.其中,所述含有尿素的缓冲液中,尿素的体积摩尔浓度为1~3m。
12.本发明意外发现,湿菌体破壁后,其沉淀用含有1~3m尿素的缓冲液处理,有利于杂蛋白的去除,进而有望实现蛛丝蛋白包涵体的纯化。
13.为了进一步提高蛛丝蛋白包涵体的纯化效果,本发明对纯化方法进行了优化,具体如下:
14.作为优选,所述方法还包括:
15.步骤(3),将所述沉淀ii再次与含有尿素的缓冲液混合,并分离得到包含蛛丝蛋白包涵体的上清液,从所述上清液中继续分离得到纯化后的蛛丝蛋白包涵体。
16.作为优选,步骤(3)中,在800~1200r/min下离心,以分离得包含蛛丝蛋白包涵体
的上清液;
17.优选离心的时间为1~3min。
18.作为优选,步骤(3)中,在8000~12000r/min下离心,以从所述上清液中继续分离得到纯化后的蛛丝蛋白包涵体;
19.优选离心的时间为18min以上可达到分离效果。
20.出于能耗方面考虑,离心时间可优选为18~30min。
21.本发明还发现,向含有尿素的缓冲液处理后得到的沉淀ii中,加入相同的缓冲液,先在800~1200r/min下离心1~3min,可以最大程度上去除沉淀ii中的细胞壁;分离得到的上清液再在8000~12000r/min下离心18~30min,可实现进一步纯化。
22.进一步地,先在1000r/min下离心3min,沉淀ii中的细胞壁去除率最大;分离得到的上清液再在10000r/min下离心20min,可实现深度纯化。
23.作为优选,步骤(1)中,在5000~7000r/min下离心,以分离得到含有蛛丝蛋白包涵体的沉淀i;
24.优选离心的时间为14min以上可达到分离效果。
25.出于能耗方面考虑,离心时间可优选为14
‑
30min。
26.作为优选,步骤(2)中,在8000~12000r/min下离心,以分离得到含有蛛丝蛋白包涵体的沉淀ii;
27.优选离心的时间为14min以上可达到分离效果。
28.出于能耗方面考虑,离心时间可优选为14~30min。
29.本发明步骤(1)和(2)中,分别采用上述条件进行离心,相关蛋白能够更多地吸附在固形物上进而有利于后续步骤的纯化。
30.作为优选,所述方法还包括:将所述沉淀ii再次重复步骤(2)1~3次。
31.进一步地,将所述沉淀ii再次重复步骤(2)1次。
32.作为优选,步骤(1)中,所述破壁具体为:使用含有蛋白酶抑制剂的缓冲液对湿菌体进行破壁;
33.所述蛋白酶抑制剂选自pmsf、tlck、tpck、亮肽素、aebsf、焦磷酸钠、β磷酸甘油中的一种或几种;
34.进一步地,所述蛋白酶抑制剂为pmsf;
35.更进一步地,所述含有蛋白酶抑制剂的缓冲液中,蛋白酶抑制剂的体积摩尔浓度为0.5~2m。
36.作为优选,所述含有蛋白酶抑制剂的缓冲液可选为tris缓冲液和pbs缓冲液。
37.在一个具体的实施例中采用的tris体系的缓冲液,包含tris
‑
hcl和nacl;
38.其中,所述tris
‑
hcl的ph值为8.0,其体积摩尔浓度为18~22mm;所述nacl的体积摩尔浓度为0.4~0.6m。
39.作为优选,所述含有尿素的缓冲液还包含tris
‑
hcl和nacl;
40.其中,所述tris
‑
hcl的ph值为8.0,其体积摩尔浓度为18~22mm;所述nacl的体积摩尔浓度为0.4~0.6m。
41.本发明中,以上述含有蛋白酶抑制剂的缓冲液处理湿菌体,有利于杂蛋白的初步去除;再以上述含有尿素的缓冲液处理沉淀,有利于杂蛋白的深度去除。
42.如此,本发明通过分级沉淀的方法得到了纯化后的蛛丝蛋白包涵体。
43.作为优选,步骤(1)中,含有蛋白酶抑制剂的缓冲液的添加量为湿菌体质量的4~6倍。
44.作为优选,步骤(2)中,含有尿素的缓冲液的添加量为湿菌体质量的4~6倍。
45.作为本发明的较佳技术方案,所述方法包括如下步骤:
46.(1)使用含有蛋白酶抑制剂的缓冲液对湿菌体进行破壁后,在5000~7000r/min下离心14min以上,分离得到含有蛛丝蛋白包涵体的沉淀i;
47.其中,所述蛋白酶抑制剂的体积摩尔浓度为0.5~2m;所述缓冲液的ph值为8.0,其体积摩尔浓度为18~22mm;
48.(2)将所述沉淀i与含有尿素的缓冲液混合,在8000~12000r/min下离心14min以上,分离得到的沉淀重复步骤(2)1~3次,得含有蛛丝蛋白包涵体的沉淀ii;
49.其中,所述尿素的体积摩尔浓度为1~3m;所述缓冲液的ph值为8.0,其体积摩尔浓度为18~22mm;;
50.(3)将所述沉淀ii再次与含有尿素的缓冲液混合,先在800~1200r/min下离心1~3min,分离得到的上清液再在8000~12000r/min下离心18min以上,所得沉淀即为纯化后的蛛丝蛋白包涵体。
51.相比于现有技术,本发明的有益效果在于:
52.本发明直接采用离心的方法纯化蛛丝蛋白包涵体,操作简单,简化了蛋白纯化和复性步骤,可得到较纯的蛛丝蛋白包涵体;同时,节约了时间,降低了成本,可应用于工业生产。
附图说明
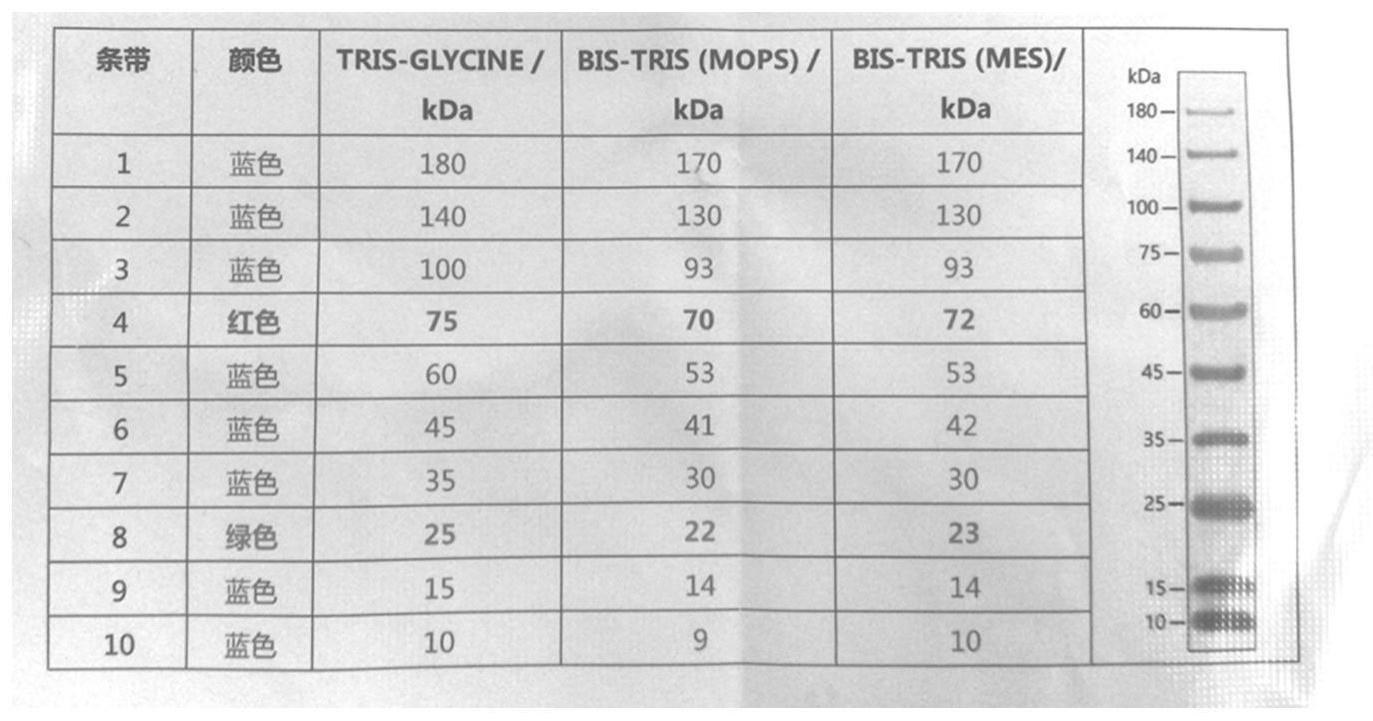
53.图1为marker的示意图;
54.图2为实施例1中,步骤(3)中两次离心后的沉淀和上清液的电泳分析结果;
55.图3为在不同尿素浓度下,蛛丝蛋白包涵体的电泳分析结果;
56.图4为在不同离心条件下,蛛丝蛋白包涵体的电泳分析结果;
57.图5为在不同离心条件下,蛛丝蛋白包涵体的电泳分析结果;
58.图6为不同重复次数以及不同尿素浓度下,蛛丝蛋白包涵体的电泳分析结果;
59.图7为按照cn110272476a中实施例的方法纯化蛛丝蛋白包涵体的电泳分析结果。
具体实施方式
60.以下实施例用于说明本发明,但不用来限制本发明的范围。
61.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
62.实施例1
63.本实施例提供一种纯化蛛丝蛋白包涵体的方法,包括如下步骤:
64.(1)称取30g湿菌体,向湿菌体中加入150g含有蛋白酶抑制剂的缓冲液[20mm tris
‑
hcl(ph8.0)+0.5m nacl+1mm pmsf],剪切均质破壁后,在6000r/min下离心15min后弃
去上清液(杂蛋白),得沉淀i;
[0065]
(2)向所述沉淀i中加入150g含有尿素的缓冲液[20mm tris
‑
hcl(ph8.0)+0.5m nacl+2m尿素],剪切后,在10000下离心15min,弃去上清液,分离得到的沉淀重复步骤(2)1次,得沉淀ii(即为初步纯化后的蛛丝蛋白包涵体);
[0066]
(3)向所述沉淀ii中加入含有尿素的缓冲液[20mm tris
‑
hcl(ph8.0)+0.5m nacl+2m尿素],剪切后,先在1000r/min下离心1~3min去除细胞壁,分离得到的上清液再在10000r/min下离心18~22min以深度纯化,所得沉淀即为纯化后的蛛丝蛋白包涵体。
[0067]
分别取本实施例步骤(3)中,第一次离心和第二次离心后的沉淀和上清液进行电泳分析;结果如图1和图2所示;其中,图1为marker示意图,由图1可知,蛛丝蛋白在45kd处。
[0068]
实施例2
[0069]
本实施例提供一种纯化蛛丝蛋白包涵体的方法,包括如下步骤:
[0070]
(1)称取30g湿菌体,向湿菌体中加入150g含有蛋白酶抑制剂的缓冲液[20mm pbs+0.5m nacl+1mm pmsf],剪切均质破壁后,在6000r/min下离心15min后弃去上清液(杂蛋白),得沉淀i;
[0071]
(2)向所述沉淀i中加入150g含有尿素的缓冲液[20mm pbs+0.5m nacl+2m尿素],剪切后,在10000下离心15min,弃去上清液,分离得到的沉淀重复步骤(2)1次,得沉淀ii(即为初步纯化后的蛛丝蛋白包涵体);
[0072]
(3)向所述沉淀ii中加入含有尿素的缓冲液[20mm pbs+0.5mnacl+2m尿素],剪切后,先在1000r/min下离心1~3min去除细胞壁,分离得到的上清液再在10000r/min下离心18~22min以深度纯化,所得沉淀即为纯化后的蛛丝蛋白包涵体。
[0073]
对比例1
[0074]
为验证含有尿素的缓冲液有利于杂蛋白的去除、进而可实现蛛丝蛋白包涵体的纯化,本对比例提供一种纯化蛛丝蛋白包涵体的方法,与实施例1的区别仅在于:步骤(2)中,含有尿素的缓冲液中,尿素的体积摩尔浓度分别为4m、6m、8m。
[0075]
从实施例1和对比例1的步骤(2)中,分别取上清液进行电泳分析。
[0076]
图3为不同尿素浓度的缓冲液所得上清液的电泳分析结果,由图3可知,含有2m尿素的缓冲液能够除去杂蛋白并且几乎不会溶解目标蛋白,而含有4m、6m、8m尿素的缓冲液均会溶解目标蛋白造成蛋白损失。
[0077]
对比例2
[0078]
为验证步骤(3)中第一次离心有利于细胞壁的去除、进而可实现蛛丝蛋白包涵体的纯化,本对比例提供一种纯化蛛丝蛋白包涵体的方法,与实施例1的区别仅在于:步骤(3)中,第一次离心的条件分别为:在500r/min下离心30min、在500r/min下离心45min、在500r/min下离心60min、在1000r/min下离心5min、在2000r/min下离心5min、在3000r/min下离心5min、在5000r/min下离心5min、在7000r/min下离心5min。
[0079]
从实施例1和对比例2的步骤(3)中,第一次离心后分别取上清液和沉淀进行电泳分析。
[0080]
图4和图5为在不同离心条件下,蛛丝蛋白包涵体的电泳分析结果;由图4和图5可知,在1000r/min下离心1~3min目标蛋白变化不大。
[0081]
对比例3
[0082]
为验证步骤(2)中重复次数、以及步骤(3)中含有尿素的缓冲液浓度有利于杂蛋白的去除、进而可实现蛛丝蛋白包涵体的纯化,本对比例提供一种纯化蛛丝蛋白包涵体的方法,与实施例1的区别仅在于:
[0083]
步骤(2)中,分离得到的沉淀重复步骤(2)3次;每一次重复步骤后所得上清液的电泳分析如图6所示;
[0084]
步骤(3)中,向所述沉淀ii中加入含有尿素的缓冲液[20mm tris
‑
hcl(ph8.0)+0.5m nacl+8m尿素];所得上清液和沉淀的电泳分析如图6所示。
[0085]
如图6所示,分离得到的沉淀重复步骤(2)1次时,效果理想;而向所述沉淀ii中加入含有尿素的缓冲液[20mm tris
‑
hcl(ph8.0)+0.5m nacl+8m尿素],虽然也能够溶解目标蛋白,但是溶解率只有50%左右,还有很大一部分目标蛋白留在沉淀中,损失很大。
[0086]
对比例4
[0087]
本对比例按照cn110272476a中实施例进行,具体操作如下:
[0088]
(1)称取30g湿菌体,向湿菌体中加入150g含有蛋白酶抑制剂的缓冲液[20mm tris
‑
hcl(ph8.0)+0.5m nacl+1mm pmsf],剪切均质破壁后,在6000r/min下离心15min后弃去上清液(杂蛋白),得沉淀i;
[0089]
(2)向所述沉淀i中加入150g含有尿素的缓冲液[20mm tris
‑
hcl(ph8.0)+0.5m nacl+4m尿素],剪切后,将所述悬浮液加热至90℃,使重组蛛丝蛋白包涵体蛋白溶解。12000r/min下离心20min,上清进行电泳分析;电泳分析见图7。
[0090]
由图7可知,在高温下蛛丝蛋白并未溶解于上清液中,大部分蛋白还是在沉淀中。
[0091]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1