一种用于猫Chapparvovirus实时荧光定量PCR检测的引物及试剂盒
一种用于猫chapparvovirus实时荧光定量pcr检测的引物及试剂盒
技术领域
1.本发明涉及分子生物学技术领域,特别是涉及一种用于猫chapparvovirus实时荧光定量pcr检测的引物及试剂盒。
背景技术:
2.细小病毒科病毒为二十面体结构,无囊膜的单链dna病毒,其基因组大小约为4
‑
6kb。国际病毒分类委员会将细小病毒科划分为三个亚科,即densovirinae,hamapa rvovirinae和parvovirinae。fcpv属于hamaparvovirinae亚科中的chaphamaparvovirus属。chaphamaparvovirus属的病毒成员已被发现可以感染多种脊椎动物,包括大鼠、小鼠、蝙蝠、犬、猪、鸡、火鸡等。目前已有fcpv与猫腹泻相关的报道。
3.目前,对于新发病毒进行分子流行病学检测采用的方法有pcr方法和实时荧光定量pcr方法。荧光定量pcr方法是在普通pcr的基础上,在扩增反应体系中加入一对特异性引物的同时再加入一个特异性的荧光探针,使得基于sybr greenⅰ的实时荧光定量pcr技术具有特异性高、灵敏性强、重复性好等优点,并且具有直观的反应结果,被广泛用于病毒检测。然而,目前还没有将sybr green用于检测fcpv的报道。
技术实现要素:
4.本发明的目的是提供一种用于猫chapparvovirus实时荧光定量pcr检测的引物及试剂盒,以解决上述现有技术存在的问题,本发明建立的sybr green i实时荧光定量pcr技术能够在短时间内实现对目的片段的高效扩增,整个反应简单快速,检出率高,重复性好,适合样本量较大的情况下使用,推广力强,本发明的建立可填补相关领域的空白。
5.为实现上述目的,本发明提供了如下方案:
6.本发明提供一种用于猫chapparvovirus实时荧光定量pcr检测的引物,所述引物包括上游引物和下游引物,所述上游引物具有如seq id no.1所示的序列,所述下游引物具有如seq id no.2所示的序列。
7.本发明还提供一种上述的用于猫chapparvovirus实时荧光定量pcr检测的引物的应用,所述应用为将所述引物用于猫chapparvovirus实时荧光定量pcr检测。
8.本发明还提供一种用于猫chapparvovirus的实时荧光定量pcr试剂盒,包括上述的用于猫chapparvovirus实时荧光定量pcr检测的引物。
9.进一步地,所述实时荧光定量pcr试剂盒还包括dna荧光染料。
10.进一步地,所述dna荧光染料为sybr greenⅰ。
11.在本发明中,建立了基于sybr greenⅰ的实时荧光定量pcr来检测fcpv,随后也将用于评估临床样品。
12.本发明建立的sybr green i实时荧光定量pcr技术能够在短时间内实现对目的片段的高效扩增,整个反应简单快速,检出率高,重复性好,适合样本量较大的情况下使用,推
广力强,本发明的建立可填补相关领域的空白。
13.荧光定量pcr是在pcr反应过程中连续监测荧光型号的强弱来实时测定特异性产物的量,并据此推断监测病料的初始含毒量,不仅具有常规pcr技术的扩增高效率的特点,还具有高度特异性、光谱技术的高敏感性和精确性等特点,同时避免了后续电泳等步骤,减少了污染和人为操作带来的误差。并且通过试验证明了,本发明方法具有高度的灵敏性和特异性和良好的重复性。
14.本发明公开了以下技术效果:
15.(1)灵敏度高,实时荧光定量pcr检测技术,采用本发明提供的引物对样本进行检测,其灵敏度可达到101拷贝数/μl,比常规pcr方法敏感100倍。
16.(2)特异性好,本发明实验中同时检测了猫星状病毒、猫博卡病毒1型、猫细小病毒、猫冠状病毒、猫杯状病毒和猫疱疹病毒,该方法不与猫的其他常见病毒性疾病发生反应,适用性好。
17.(3)操作简便,检测用时短。
附图说明
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
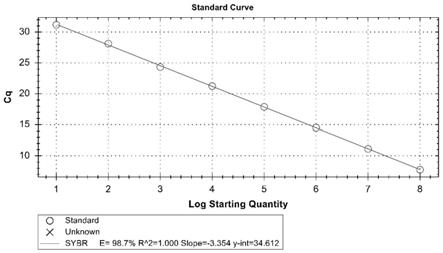
19.图1为fcpv的实时荧光定量pcr方法的标准曲线;
20.图2为fcpv的实时荧光定量pcr方法的特异性实验结果;
21.图3为fcpv的实时荧光定量pcr方法的灵敏性实验结果。
具体实施方式
22.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
23.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
24.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
25.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
26.实施例1fcpv的实时荧光定量pcr检测方法的有效性实验
27.1、针对fcpv的vp1基因(carnivore chapparvovirus 1isolate vri 849,compl ete genome序列号genbank:mn794869.1)设计特异性引物:
28.上游引物(seq id no.1):5
’‑
gcgtataccgtatggggtca
‑3’
。
29.下游引物(seq id no.2):5
’‑
agtccctgggaatctccatc
‑3’
。
30.上下游引物由通用公司合成。
31.2、毒株
32.实验所用fcpv由本实验室鉴定并保存。且该毒株也可以通过从ncbi中获取上述序列,然后通过本领域常用的普通生物方法合成获得。
33.3、病毒核酸的提取
34.将采取的样本按照天根基因组试剂盒(天根生物技术有限公司)说明书提取病毒基因组,之后均放置
‑
20℃保存备用。
35.4.构建重组质粒
36.4.1连接
37.使用ta克隆程序将纯化后的dna片段连接到pmd
‑
19t载体中。连接条件为16℃连接3h。连接体系如下:胶回收产物4μl、pmd
‑
19t 1μl、solution i 5μl。
38.4.2转化
39.将连接产物转化入dh5α感受态细胞中,具体操作步骤如下:
40.(1)提前取出dh5α感受态细胞,置于冰上,使其充分融化;
41.(2)向50μl dh5α感受态细胞中加入连接产物5μl;
42.(3)4℃孵育30min,之后42℃水浴90s,之后迅速转移冰上冰浴150s;
43.(4)加入600μl已预热至37℃的无抗性lb培养基,37℃摇床200rpm培养1
‑
2h;
44.(5)6000rpm离心3min,弃取500μl上清液,保留的100ul液体充分重悬细菌沉淀;
45.(6)将重悬后的液体无菌涂布于氨抗性固体培养基中,37℃过夜培养。
46.4.3质粒提取及测序
47.挑取过夜培养之后在固体培养基中的单克隆菌落,置于5ml氨苄抗性的lb培养基中,37℃摇床200rpm培养12h。同时进行菌液pcr进行验证,对鉴定为正确的菌液,进行质粒提取。提取质粒详细步骤如下:
48.(1)柱平衡步骤:向吸附柱加入500μl的平衡液bl,12000rpm离心1min,弃废液;
49.(2)将菌液加入离心管中,12000rpm离心1min,完全去除上清;
50.(3)向沉淀中加入250μl溶液p1,涡旋振荡,使沉淀完全重悬;
51.(4)向上一步的悬液中加入250μl溶液p2,上下翻转6
‑
8次;
52.(5)向上一步的悬液中加入350μl溶液p3,上下翻转6
‑
8次,12000rpm离心10min;
53.(6)吸出上清至过滤柱cs中,12000rpm离心2min;
54.(7)将离心出的液体加入完成柱平衡步骤的吸附柱中,12000rpm离心45s,弃废液;
55.(8)向吸附柱中加入500μl的pd,12000rpm离心45s,弃废液;
56.(9)向吸附柱中加入600μl的pw,12000rpm离心45s,弃废液:
57.(10)重复步骤(9);
58.(11)将吸附柱不加液体,12000rpm离心2min,完全去除吸附柱中的液体;
59.(12)将吸附柱转移至新的1.5ml离心管中,向吸附柱中间部位滴加50μl洗脱液tb,室温静置2min,12000rpm离心2min;
60.(13)将得到的重组质粒放入
‑
20℃中保存备用,同时抽取部分质粒送至生工生物(上海)有限公司进行测序验证。
61.实施例2实时荧光定量pcr反应及标准曲线绘制
62.利用核酸浓度测定仪测定重组质粒的浓度,经计算重组质粒拷贝数为1.07
×
10
11
copies/μl。重组质粒的10倍系列稀释液用作模板,在cfx96
tm
实时pcr检测系统(bio
‑
rad,hercules,ca,usa)上进行sybr greenⅰ测定。该系统由10μl superreal premix plus(中国天根)、0.6μl正向引物、0.6μl反向引物、1μl模板和7.8μl ddh2o组成。sybr green i的条件为95℃ 15min,然后95℃ 10s和60℃ 30s,40个循环。将重组质粒十倍梯度稀释至101并建立标准曲线,横坐标代表质粒拷贝数的对数,纵坐标为ct值。在此基础上得到相应的回归方程:y=
‑
3.354x+34.612,r2为1.000,扩增效率为98.7%。标准曲线见图1。且在扩增过程中无引物二聚体和非特异性扩增产物出现,所建立的荧光定量pcr方法的引物特异性好。
63.实施例3特异性、灵敏性及重复性试验
64.1、特异性实验
65.采用建立的实施荧光定量pcr方法,对fcpv阳性标准品、猫星状病毒、猫博卡病毒1型、猫疱疹病毒、猫瘟病毒、猫冠状病毒、猫杯状病毒的核酸进行扩增,并建立阴性对照,结果如图2所示,阴性是一条无变化的直线,除fcpv外均无特异性扩增曲线,表明该方法具有良好的特异性。
66.2、灵敏性实验
67.将十倍稀释后的重组质粒的108到101作为模板进行荧光定量pcr扩增,结果见图3,本方法检测到的最低拷贝数为1.07
×
10
11
copies/μl。
68.3、重复性实验
69.以108,106,104,102共4个拷贝数的重组质粒为模板进行实时荧光定量pcr的重复性实验,结果见表1。在重复性实验中变异系数均小于1%,表明该方法具有很好的重复性。
70.表1实时荧光定量pcr重复性实验
[0071][0072]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1