一种脂溶性抗生素生物发酵调控的方法与流程
1.本发明涉及微生物药物技术领域,具体涉及一种脂溶性抗生素生物发酵调控的方法。
背景技术:
2.脂溶性抗生素如西罗莫司(sirolimus)、他克莫司(tacrolimus)、多拉菌素(doramectin)、多杀菌素(spinosyn)和柱晶白霉素(kitasamycin)等其结构上均属聚酮类物质,这类抗生素通常累积在微生物细胞内,只有少量存在于发酵液中。当微生物生物合成这些代谢产物达到一定浓度后就会产生反馈抑制,目标产物合成速度逐渐减慢或停止。为了解除抗生素的反馈抑制,可以采用多种方法。首选的方法是对产生菌进行菌种选育,得到具备抗生素耐受的高产菌株,该方法需投入大量的人力物力,还需要一些运气。其次,可以采用向发酵液中加入树脂,对产物进行吸附,从而解除反馈抑制,但树脂会对微生物菌丝产生损伤,还可能吸附营养成分影响代谢。
3.因此,提供一种脂溶性抗生素发酵方法,能解除产物反馈抑制,不会对微生物菌丝产生损伤,能促进目标产物大量合成,成为了本领域技术人员亟待解决的问题。
技术实现要素:
4.本发明的目的在于,提供一种脂溶性抗生素生物发酵调控的方法,其工艺简单,操作简便,易于控制,能明显提高目标产物产量。
5.为实现上述目的,本发明采用的技术方案如下:
6.本发明提供的一种脂溶性抗生素生物发酵调控的方法,包括以下步骤:在脂溶性抗生素发酵过程中,向发酵液中加入脂溶性培养基,所述脂溶性培养基包括高碳醇或油脂。
7.申请人意外地发现,在菌株适应的情况下,向发酵液中加入高碳醇或油脂等不溶于水可以溶解脂溶性抗生素的培养基,其既可以作为缓慢利用碳源,用于促进菌株的生长,还能溶解脂溶性目标产物,解除产物反馈抑制,促进目标产物大量合成。此外,由于目标产物溶解到脂溶性培养基中,简化了后续分离纯化过程,节省了生产成本。
8.本发明的部分实施方案中,所述高碳醇为c8-c20的脂肪醇。
9.本发明的部分实施方案中,所述油脂为脂肪酸或其酯化物。
10.本发明的部分实施方案中,所述脂溶性抗生素包含西罗莫司(sirolimus)、他克莫司(tacrolimus)、阿维菌素(avermectin)、多杀菌素(spinosyn)和柱晶白霉素(kitasamycin)。
11.本发明的部分实施方案中,脂溶性培养基的用量为发酵液质量的4.0%~15.0%。
12.本发明的部分实施方案中,脂溶性培养基分批加入发酵液中。
13.本发明的部分实施方案中,脂溶性培养基每批加入的量为发酵液质量的0.5~2%。
14.本发明的技术方案中,先通过基础培养基使得菌丝快速生长,在发酵中期或中后
期开始加入脂溶性培养基。
15.本发明的一个实施例中,在阿维菌素产生菌发酵前期80小时内,通过基础培养基使得菌丝快速生长,80小时
‑‑
315小时,每隔24小时补入发酵液质量1.0wt.%十二醇(月桂醇)。
16.本发明的一个实施例中,在西罗莫司产生菌发酵前期0-60小时,通过基础培养基使得菌丝快速生长;80小时-220小时,每隔24小时补入1.5%油酸甲酯。
17.本发明的一个实施例中,在他克莫司产生菌发酵前期0-48小时,通过基础培养基使得菌丝快速生长;80小时-220小时,每隔24小时补入1.2%油酸甲酯。
18.本发明的一个实施例中,在多杀菌素产生菌发酵前期0-96小时,通过基础培养基使得菌丝快速生长;96小时-360小时,每隔24小时补入0.8%壬醇。
19.本发明的一个实施例中,在柱晶白霉素产生菌发酵前期0-15小时,通过基础培养基使得菌丝快速生长;15小时-116小时,每隔24小时补入1.5%棕榈油。
20.本发明的一个实施例中,在红霉素产生菌发酵前期0-20小时,通过基础培养基使得菌丝快速生长;20小时-230小时,每隔24小时补入1.8%油酸甲酯。
21.本发明的部分实施方案中,脂溶性培养基一次性全部加入发酵液中。
22.与现有技术相比,本发明具有以下有益效果:
23.本发明设计科学,构思巧妙。本发明创造性地在脂溶性抗生素发酵过程中加入脂溶性培养基,其不仅能为菌株提供缓慢利用碳源,还可以溶解脂溶性目标产物,解除产物反馈抑制。并且,本发明采用脂溶性培养基溶解了目标产物,大大简化了后续的分离纯化过程,节省了生产成本。
24.本发明工艺简单易行,易于操作,非常适合商业化生产。
具体实施方式
25.下面结合实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。本发明涵盖了权利要求书范围内的所有可能的备选方案、改进方案和等效方案。下述实施例中未注明的具体技术或条件,均为常规技术或条件,或按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。
26.实施例1
27.本实施例公开了采用本发明的方法对阿维链霉菌streptomyces avermitilis siia-1502进行培养。本实施例的发酵培养基配比如表1所示:
28.表1
29.原料名称配比(克/l)淀粉100.0黄豆饼粉20.0花生饼粉5.0硫酸铵0.25酵母粉10.0氯化钴0.02钼酸钠0.02
碳酸钙1.0硫酸锰0.02消泡剂0.8
30.按照规定配比精确称好淀粉投入发酵配料罐中(预先加入适量水),启动搅拌,加入淀粉酶(淀粉重量的0.5%)蒸汽加热,逐渐升温到85℃,保温搅拌60分钟,使淀粉充分液化。再按上述配料投入配料罐中并加水至定容体积,搅拌15分钟后测ph,ph要求6.9即可,升温,当温度达到121℃时,开始灭菌30分钟。
31.发酵体积:6000l
32.接种量:10个茄子瓶
33.搅拌转速:80-220rpm
34.空气流量:1:0.5-0.8vvm
35.培养周期:315小时
36.在阿维菌素产生菌发酵前期80小时内,通过基础培养基使得菌丝快速生长,培养温度控制在29.0℃;80小时
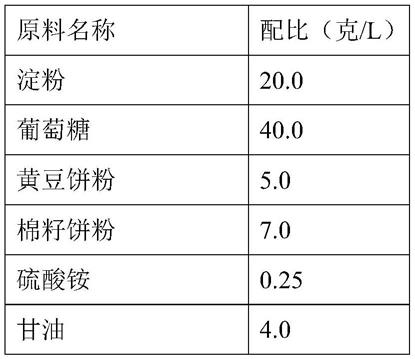
‑‑
315小时,每隔24小时补入1.0%十二醇(月桂醇)。
37.本发明中,阿维菌素的含量通过hplc高效液相检测方法进行测定,具体如下。
38.分析柱:c18柱,4.6mm
×
250mm
×
5um,柱温:30℃;采用等度洗脱,流动相为甲醇:水:乙腈(8:1:1);流速为1.2ml/min;检测波长:245nm;进样量:10μl。根据面积归一化法计算阿维菌素的含量。
39.取发酵液2毫升,加入10毫升乙醇,震摇15分钟,高速离心得上清液,hplc分析阿维菌素的含量,发酵第315小时阿维菌素的效价为9.2克/l。
40.对比例1
41.本对比例与实施例1相比,培养周期为285小时,在阿维菌素产生菌发酵过程中培养温度控制为29℃,不加入脂溶性培养基;其余条件均一致。
42.结果发现,本对比例发酵第285小时阿维菌素的效价为4.9克/l。
43.实施例2
44.本实施例公开了采用本发明的方法对游动放线菌siia-1602(actinoplanes siia-1602)进行培养。本实施例的发酵培养基配比如表2所示:
45.表2
46.[0047][0048]
按照规定配比精确称好淀粉投入发酵配料罐中(预先加入适量水),启动搅拌,蒸汽加热,逐渐升温到70℃,保温搅拌10分钟,使淀粉充分糊化。再按上述配料投入配料罐中并加水至定容体积,搅拌15分钟后测ph,ph要求6.9即可,升温,当温度达到121℃时,开始灭菌30分钟。
[0049]
发酵体积:6000l
[0050]
接种量:8%
[0051]
搅拌转速:80-220rpm
[0052]
空气流量:1:0.5-0.8vvm
[0053]
培养周期:220小时
[0054]
在西罗莫司产生菌发酵前期0-60小时,通过基础培养基使得菌丝快速生长,培养温度控制在28.0℃;80小时-220小时,每隔24小时补入1.5%油酸甲酯。
[0055]
本发明中,西罗莫司的含量通过hplc高效液相检测方法进行测定,具体如下:
[0056]
取发酵液3ml,加入丙酮7ml混匀,超声处理30分钟,12000rpm离心,取上清液进行hplc分析。色谱条件:c18(250mm
×
4.6mm,5μm)色谱柱,流动相为甲醇:乙腈:水=60:25:30(v:v:v),柱温50℃,流速1.0ml/min,检测波长277nm,进样量10μl。发酵第220小时西罗莫司的效价为2.15克/l。
[0057]
对比例2
[0058]
本对比例与实施例2相比,培养周期为192小时,在游动放线菌发酵过程中培养温度控制为28℃,不加入脂溶性培养基;其余条件均一致。
[0059]
结果发现,本对比例发酵第192小时的西罗莫司的效价为1.31克/l。
[0060]
实施例3
[0061]
本实施例公开了采用本发明的方法对千佛链霉菌新种siia-9818(streptomyces qianfoensis sp.nov.siia-9818)进行培养。本实施例的发酵培养基配比如表3所示:
[0062]
表3
[0063]
原料名称配比(克/l)淀粉30.0葡萄糖40.0酵母粉5.0蛋白胨7.0玉米蛋白5.0
氯化钠5.0异亮氨酸1.0碳酸钙4.0消泡剂0.5
[0064]
按照规定配比精确称好淀粉投入发酵配料罐中(预先加入适量水),启动搅拌,蒸汽加热,逐渐升温到70℃,保温搅拌10分钟,使淀粉充分糊化。再按上述配料投入配料罐中并加水至定容体积,搅拌15分钟后测ph,ph要求6.9即可,升温,当温度达到121℃时,开始灭菌30分钟。
[0065]
发酵体积:6000l
[0066]
接种量:8%
[0067]
搅拌转速:80-220rpm
[0068]
空气流量:1:0.8-1.0vvm
[0069]
培养周期:220小时
[0070]
在他克莫司产生菌发酵前期0-48小时,通过基础培养基使得菌丝快速生长,培养温度控制在28.5℃;80小时-220小时,每隔24小时补入1.2%油酸甲酯。
[0071]
本发明中,他克莫司的含量通过hplc高效液相检测方法进行测定,具体如下:
[0072]
取发酵液3ml,加入乙醇7ml混匀,超声处理30分钟,12000rpm离心,取上清液进行hplc分析。色谱条件:c8(250mm
×
4.6mm,5μm)色谱柱,流动相为v(异丙醇)∶v(水)=35∶65,柱温50℃,流速1.0ml/min,检测波长220nm,进样量10μl。发酵第220小时的他克莫司的效价为1.42克/l。
[0073]
对比例3
[0074]
本对比例与实施例3相比,培养周期为192小时,在他克莫司产生菌发酵过程中培养温度控制在28.5℃,不加入脂溶性培养基;其余条件均一致。
[0075]
结果发现,本对比例发酵第192小时的他克莫司的效价为0.72克/l。
[0076]
实施例4
[0077]
本实施例公开了采用本发明的方法对刺糖多孢菌siia 1802(s.spinosa siia1802)进行培养。本实施例的发酵培养基配比如表4所示:
[0078]
表4
[0079]
原料名称配比(克/l)糊精30.0黄豆饼粉12.0棉籽饼粉25.0磷酸二氢钾4.0玉米浆10.0水解酪蛋白5.0葡萄糖7.0碳酸钙1.0氯化钠1.0消泡剂1.0
[0080]
按照规定配比精确称上述配料投入配料罐中并加水至定容体积,搅拌15分钟后测ph,ph要求7.2即可,升温,当温度达到121℃时,开始灭菌35分钟。
[0081]
发酵体积:6000l
[0082]
接种量:10%
[0083]
培养温度:28.0-30.0℃
[0084]
搅拌转速:80-220rpm
[0085]
空气流量:1:0.5-0.8vvm
[0086]
培养周期:360小时
[0087]
在多杀菌素产生菌发酵前期0-96小时,通过基础培养基使得菌丝快速生长,培养温度控制在30.0℃;96小时-360小时,每隔24小时补入0.8%壬醇。
[0088]
取发酵液1.0毫升,加入10毫升乙醇,震摇15分钟,高速离心得上清液,hplc分析多杀菌素的含量。色谱柱规格为zorbax sb-c18(5μm,4.6mm
×
150mm);柱温:室温;流动相:甲醇/乙腈/2%乙酸铵溶液(体积比45/45/10);流速:1.5ml/min;上样体积:10μl;检测波长:250nm。通过检测系统自带分析软件计算多杀菌素a、d的响应峰面积,与标准品比对便可得出样品中多杀菌素的含量。
[0089]
取发酵液1.0毫升,加入10毫升乙醇,震摇15分钟,高速离心得上清液,hplc分析多杀菌素的含量,发酵第360小时的多杀菌素的效价为2.56克/l。
[0090]
对比例4
[0091]
本对比例与实施例4相比,培养周期为320小时,在多杀菌素产生菌发酵过程中培养温度控制为30℃,不加入脂溶性培养基;其余条件均一致。
[0092]
结果发现,本对比例发酵第320小时的多杀菌素的效价为1.22克/l。
[0093]
实施例5
[0094]
本实施例公开了采用本发明的方法对北里链霉菌菌nbrc 13686进行培养。本实施例的发酵培养基配比如表5所示:
[0095]
表5
[0096]
原料名称配比(克/l)淀粉10.0黄豆粉25.0硫酸锌0.1磷酸二氢钾1.0玉米油40.0复合氨基酸7.0葡萄糖15.0碳酸钙3.0氯化锰1.0消泡剂0.3
[0097]
按照规定配比精确称上述配料投入配料罐中并加水至定容体积,搅拌15分钟后测ph,ph要求7.2即可,升温,当温度达到121℃时,开始灭菌35分钟。
[0098]
发酵体积:6000l
[0099]
接种量:10%
[0100]
培养温度:28.0-30.0℃
[0101]
搅拌转速:80-220rpm
[0102]
空气流量:1:0.8-1.0vvm
[0103]
培养周期:116小时
[0104]
10-20小时补加正丙醇0.4%(菌浓大于20%时补加)。
[0105]
在柱晶白霉素产生菌发酵前期0-15小时,通过基础培养基使得菌丝快速生长,培养温度控制在28.0℃;15小时-116小时,每隔24小时补入1.5%棕榈油。
[0106]
采用hplc分析柱晶白霉素的含量。色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以0.1mol/l醋酸铵溶液(磷酸调节ph4.5)-甲醇-乙腈(40:55:5)为流动相;柱温60℃;检测波长为231nm。取对照品溶液(1)10μl注入液相色谱仪。记录的色谱图应与标准图谱一致。柱晶白霉素主组分出峰顺序依次为a9、a8、a7、a6、a5、a4、a1、a3、a13。按外标法以柱晶白霉素a5的峰面积计算,吉他霉素a5应为35%~70%,a4应为5%~25%,a1、a13均应为3%~15%;主组分a9、a8、a7、a6、a5、a4、a1、a3、a13之和不得少于85%。通过检测系统自带分析软件计算各组分的响应峰面积,与标准品比对便可得出样品中柱晶白霉素的含量。
[0107]
取发酵液1.0毫升,加入10毫升乙醇,震摇15分钟,高速离心得上清液,hplc分析柱晶白霉素的含量,发酵第116小时的效价为11.22克/l。
[0108]
对比例5
[0109]
本对比例与实施例5相比,培养周期为92小时,在柱晶白霉素产生菌发酵过程中培养温度控制为28℃,不加入脂溶性培养基;其余条件均一致。
[0110]
结果发现,本对比例发酵第92小时的柱晶白霉素的效价为7.88克/l。
[0111]
实施例6
[0112]
本实施例公开了采用本发明的方法对红霉素链霉菌siia1201(streptomyces erythreus siia 1201)进行培养。本实施例的发酵培养基配比如表6所示:
[0113]
表6
[0114]
[0115][0116]
按照规定配比精确称上述配料投入配料罐中并加水至定容体积,搅拌15分钟后测ph,ph要求6.2即可,升温,当温度达到121℃时,开始灭菌35分钟。
[0117]
发酵体积:600l
[0118]
接种量:10%
[0119]
搅拌转速:80-220rpm
[0120]
空气流量:1:0.8-1.0vvm
[0121]
培养周期:230小时
[0122]
20小时补加正丙醇0.4%,25小时补豆油,ph高于6.9开始补糖
[0123]
在红霉素产生菌发酵前期0-20小时,通过基础培养基使得菌丝快速生长,培养温度控制在34.0℃;20小时-230小时,每隔24小时补入1.8%油酸甲酯。
[0124]
采用hplc分析红霉素的含量。色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以磷酸盐溶液(取磷酸氢二钾8.7g,加水1000ml,用磷酸调节p h值至8.2)-乙腈(40:60)为流动相;流速为每分钟0.8~1.0ml;柱温35℃;波长为215nm。取对照品溶液(1)10μl注入液相色谱仪。记录的色谱图应与标准图谱一致。按红霉索c、红霉素a、杂质1、红霉素b、红霉素烯醇醚峰的顺序出峰。按外标法以峰面积计算供试品中红霉素a的含量。通过检测系统自带分析软件计算各组分的响应峰面积,与标准品比对便可得出样品中红霉素的含量。
[0125]
取发酵液1.0毫升,加入10毫升甲醇,震摇15分钟,高速离心得上清液,hplc分析红霉素的含量,发酵第230小时的效价为10.6克/l。
[0126]
对比例6
[0127]
本对比例与实施例6相比,培养周期为200小时,培养温度控制在34.0℃,不加入脂溶性培养基;其余条件均一致。
[0128]
结果发现,本对比例发酵第200小时的红霉素的效价为6.96克/l。
[0129]
根据本发明的实施例1-6中,采用了在微生物合成脂溶性抗生素阶段,向发酵液中加入高碳醇或油脂等不溶于水可以溶解脂溶性抗生素的培养基,一部分降低胞内抗生素浓
度,剩余部分还可以解除产物反馈抑制,促进目标产物大量合成,发酵单位明显提高。
[0130]
在对比例1-6中,由于脂溶性抗生素不溶于水,只有少量抗生素分泌出胞外,大量存在于胞内,产生反馈抑制,效价增长停滞,比进行补充高碳醇或油脂的实施例的发酵单位偏低30%以上。
[0131]
由于目标产物溶解到溶剂中,简化了后续分离纯化过程,节省了生产成本。本发明工艺简单易行,易于操作,非常适合商业化生产。
[0132]
本领域技术人员应该明白,本发明所述的方法和系统并不限于具体实施方式中所述的实施例,上面的具体描述只是为了解释本发明的目的,并非用于限制本发明。本领域技术人员根据本发明的技术方案得出其他的实施方式,同样属于本发明的技术创新范围,本发明的保护范围由权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1