厚朴酚衍生物及其中间体的合成方法与流程
1.本发明涉及有机合成技术领域,特别是涉及一种厚朴酚衍生物及其中间体的合成方法。
背景技术:
2.厚朴酚衍生物(ct2
‑
1、ct2
‑
2和ct2
‑
3,以及ct
‑
1、ct
‑
2和ct
‑
3(与萝卜硫素的拼接物))已经过试验验证具有一定的抗肿瘤功效,可以作为一类新型的小分子抗肿瘤潜在药物进行进一步研究。因此如何能够高效、高产率地进行厚朴酚衍生物的合成是亟待解决的问题。
3.ct2
‑
1、ct2
‑
2和ct2
‑
3的初始合成路线如下所示(参见中国专利cn111039847a,以下简称路线一):
[0004][0005]
ct
‑
1、ct
‑
2和ct
‑
3的初始合成路线藉由药物拼合原理实现,合成路线如下所示(参见中国专利cn111269161a,以下简称路线二):
[0006][0007]
可见,上述厚朴酚衍生物的合成路线中均需要制备经过单烷基化的中间体2(或带有保护基团
‑
tbs),且收率均仅在65%左右,同时由于副产物(主要为双烷基化产物)较多,极性与产物较为接近(rf(中间体2)=0.8(petroleum ether/etoac,10:1),rf(副产物)=0.85(petroleum ether/etoac,10:1))、分离难度大,使得产物的纯化步骤繁琐,反应效率低,也增加了生产的成本。
技术实现要素:
[0008]
基于此,本发明提供一种产率高,且副产物少、合成效率高的厚朴酚衍生物的中间体的合成方法,以及厚朴酚衍生物的合成方法。
[0009]
本发明的第一方面,提供一种厚朴酚衍生物的中间体的合成方法,包括如下步骤:
[0010]
将厚朴酚与3,4
‑
二氢
‑
2h
‑
吡喃、4
‑
甲基苯磺酸吡啶、第一溶剂混合,进行取代反应,制备化合物3;
[0011]
将所述化合物3与1,2
‑
二溴乙烷、第二溶剂混合,于碱性环境下进行氧烷基化反应,制备所述厚朴酚衍生物的中间体;
[0012]
所述厚朴酚的结构如下所示:
[0013][0014]
所述化合物3的结构如下所示:
[0015][0016]
所述厚朴酚衍生物的中间体的结构如下所示:
[0017][0018]
在其中一个实施例中,所述厚朴酚与所述3,4
‑
二氢
‑
2h
‑
吡喃、4
‑
甲基苯磺酸吡啶的摩尔比为1:(1.1~1.5):(0.03~0.07)。
[0019]
在其中一个实施例中,所述厚朴酚与所述1,2
‑
二溴乙烷的摩尔比为1:(1.1~1.5)。
[0020]
在其中一个实施例中,取代反应的条件包括:反应温度为室温,反应时间为30h~40h;及/或
[0021]
氧烷基化反应的条件包括:反应温度为45℃~55℃,反应时间为20h~30h。
[0022]
在其中一个实施例中,所述第一溶剂的用量为每1mol厚朴酚加入1l~20l;及/或
[0023]
所述第二溶剂的用量为每1mol厚朴酚加入3l~5l。
[0024]
在其中一个实施例中,所述第一溶剂为二氯甲烷、四氢呋喃和n,n
‑
二甲基甲酰胺(dmf)中的一种或两种的组合;及/或
[0025]
所述第二溶剂为丙酮和乙腈中的一种或两种的组合。
[0026]
本发明的第二方面,提供一种厚朴酚衍生物ct2
‑
1的合成方法,包括如下步骤:
[0027]
按照第一方面所述的合成方法合成所述厚朴酚衍生物的中间体;
[0028]
将所述厚朴酚衍生物的中间体与硫醇化合物、钠氢、第三溶剂混合,进行硫烷基化反应;硫烷基化反应结束后进行脱保护反应,制备所述厚朴酚衍生物ct2
‑
1;
[0029]
所述硫醇化合物的结构如下所示:
[0030][0031]
所述厚朴酚衍生物ct2
‑
1的结构如下所示:
[0032][0033]
在其中一个实施例中,所述厚朴酚与所述硫醇化合物、钠氢的摩尔比为1:(1.1~1.5):(1.1~1.5)。
[0034]
在其中一个实施例中,硫烷基化反应的条件包括:反应温度为
‑
5℃~5℃,反应时间为0.5h~1.5h。
[0035]
在其中一个实施例中,脱保护反应的条件包括:采用的脱保护试剂为盐酸,反应温度为室温,反应时间为0.5h~1.5h。
[0036]
本发明的第三方面,提供一种厚朴酚衍生物ct
‑
1的合成方法,包括如下步骤:
[0037]
按照第二方面所述的合成方法合成所述厚朴酚衍生物ct2
‑
1;
[0038]
将所述厚朴酚衍生物ct2
‑
1进行水解反应,制备化合物6;
[0039]
将所述化合物6与n,n'
‑
硫羰基二咪唑、三乙胺、第四溶剂混合,进行异硫氰酸酯化反应,制备所述厚朴酚衍生物ct
‑
1;
[0040]
所述化合物6的结构如下所示:
[0041][0042]
所述厚朴酚衍生物ct
‑
1的结构如下所示:
[0043][0044]
在其中一个实施例中,所述厚朴酚衍生物ct2
‑
1与所述n,n'
‑
硫羰基二咪唑、三乙胺的摩尔比为1:(1.5~2):(1.5~2)。
[0045]
在其中一个实施例中,异硫氰酸酯化反应的条件包括:反应温度为45℃~55℃,反应时间为65h~80h。
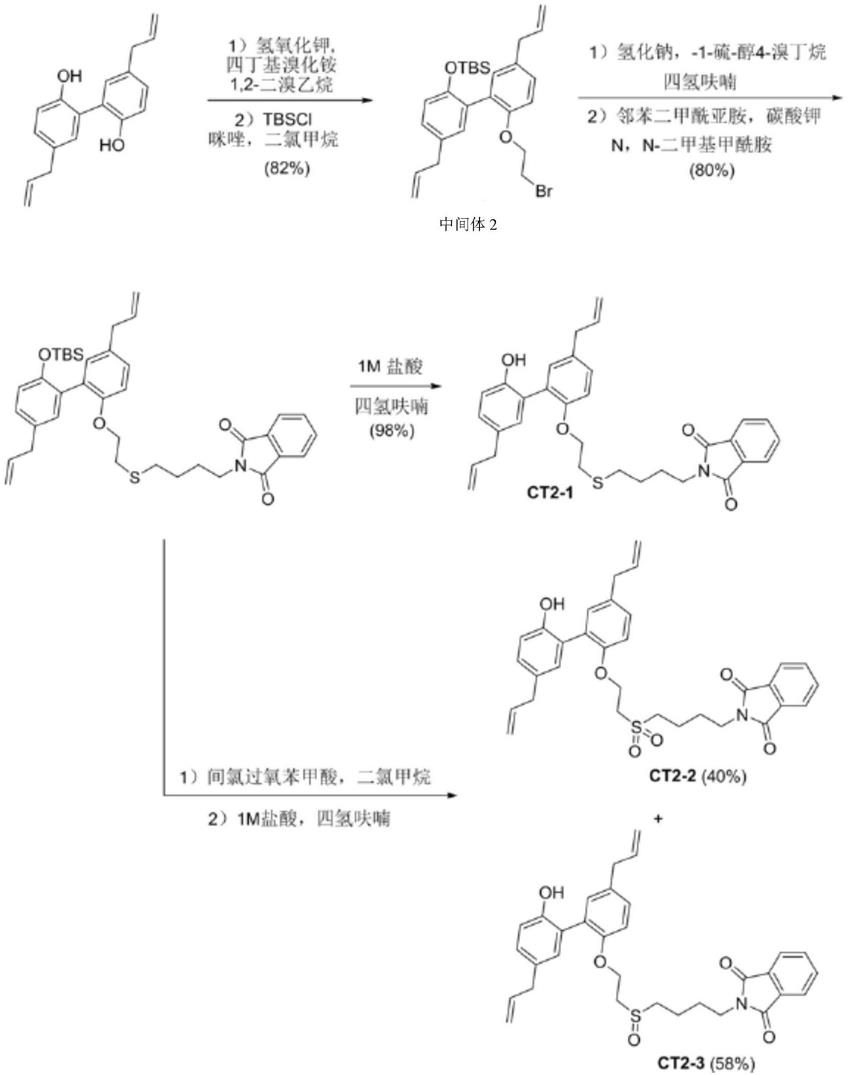
[0046]
在其中一个实施例中,水解反应的条件包括:采用的水解试剂为甲胺,反应温度为
室温,反应时间为20h~30h。
[0047]
本发明的第四方面,提供一种厚朴酚衍生物ct
‑
3的合成方法,包括如下步骤:
[0048]
按照第三方面所述的合成方法合成所述厚朴酚衍生物ct
‑
1;
[0049]
将所述厚朴酚衍生物ct
‑
1与间氯过氧苯甲酸、第五溶剂混合,进行氧化反应,制备所述厚朴酚衍生物ct
‑
3;
[0050]
所述厚朴酚衍生物ct
‑
3的结构式如下:
[0051][0052]
在其中一个实施例中,所述厚朴酚衍生物ct
‑
1与所述间氯过氧苯甲酸的摩尔比为1:(0.8~1.2)。
[0053]
在其中一个实施例中,氧化反应的条件包括:反应温度为
‑
25℃~
‑
15℃,反应时间为8min~12min。
[0054]
上述厚朴酚衍生物的中间体的合成方法,选用3,4
‑
二氢
‑
2h
‑
吡喃和4
‑
甲基苯磺酸吡啶对厚朴酚的其中一个羟基进行有效地选择性保护,如此能够避免如双烷基化副产物的出现,且反应液浓缩后无需进行额外的纯化步骤,即可直接与1,2
‑
二溴乙烷发生氧烷基化得到厚朴酚衍生物的中间体。同时,该厚朴酚衍生物的中间体中副产物少,后处理简单,使得合成效率明显提高,且合成产率高。
附图说明
[0055]
图1为本发明实施例的合成方法中化合物5(厚朴酚衍生物ct2
‑
1)的hplc谱图;
[0056]
图2为本发明实施例的合成方法中化合物5(厚朴酚衍生物ct2
‑
1)的1h nmr谱图;
[0057]
图3为本发明实施例的合成方法中化合物5(厚朴酚衍生物ct2
‑
1)的
13
c nmr谱图;
[0058]
图4为本发明实施例的合成方法中化合物5(厚朴酚衍生物ct2
‑
1)的hrms谱图;
[0059]
图5为本发明实施例的合成方法中厚朴酚衍生物ct
‑
1的hplc谱图;
[0060]
图6为本发明实施例的合成方法中厚朴酚衍生物ct
‑
1的1h nmr谱图;
[0061]
图7为本发明实施例的合成方法中厚朴酚衍生物ct
‑
1的
13
c nmr谱图;
[0062]
图8为本发明实施例的合成方法中厚朴酚衍生物ct
‑
1的hrms谱图;
[0063]
图9为本发明实施例的合成方法中厚朴酚衍生物ct
‑
3的hplc谱图;
[0064]
图10为本发明实施例的合成方法中厚朴酚衍生物ct
‑
3的1h nmr谱图;
[0065]
图11为本发明实施例的合成方法中厚朴酚衍生物ct
‑
3的
13
c nmr谱图;
[0066]
图12为本发明实施例的合成方法中厚朴酚衍生物ct
‑
3的hrms谱图;
[0067]
图13为现有的路线二生产获得的厚朴酚衍生物ct
‑
3产品的hplc谱图。
具体实施方式
[0068]
以下结合具体实施例对本发明的厚朴酚衍生物及其中间体的合成方法作进一步
详细的说明。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明公开内容理解更加透彻全面。
[0069]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
[0070]
本文所使用的术语“和/或”、“或/和”、“及/或”的可选范围包括两个或两个以上相关所列项目中任一个项目,也包括相关所列项目的任意的和所有的组合,所述任意的和所有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。
[0071]
本文中,“一种或多种”指所列项目的任一种、任两种或任两种以上。
[0072]
本发明中,“第一方面”、“第二方面”、“第三方面”、“第四方面”等仅用于描述目的,不能理解为指示或暗示相对重要性或数量,也不能理解为隐含指明所指示的技术特征的重要性或数量。而且“第一”、“第二”、“第三”、“第四”等仅起到非穷举式的列举描述目的,应当理解并不构成对数量的封闭式限定。
[0073]
本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
[0074]
本发明中,涉及到数值区间,如无特别说明,上述数值区间内视为连续,且包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值。进一步地,当范围是指整数时,包括该范围的最小值与最大值之间的每一个整数。此外,当提供多个范围描述特征或特性时,可以合并该范围。换言之,除非另有指明,否则本文中所公开之所有范围应理解为包括其中所归入的任何及所有的子范围。
[0075]
本发明中涉及的百分比含量,如无特别说明,对于固液混合和固相
‑
固相混合均指质量百分比,对于液相
‑
液相混合指体积百分比。
[0076]
本发明中涉及的百分比浓度,如无特别说明,均指终浓度。所述终浓度,指添加成分在添加该成分后的体系中的占比。
[0077]
本发明中的温度参数,如无特别限定,既允许为恒温处理,也允许在一定温度区间内进行处理。所述的恒温处理允许温度在仪器控制的精度范围内进行波动。本发明中的室温一般指4℃~30℃,较佳地指20
±
5℃。
[0078]
本发明提供一种厚朴酚衍生物的中间体的合成方法,包括如下步骤:
[0079]
s1:将厚朴酚与3,4
‑
二氢
‑
2h
‑
吡喃、4
‑
甲基苯磺酸吡啶、第一溶剂混合,进行取代反应,制备化合物3;
[0080]
s2:将化合物3与1,2
‑
二溴乙烷、第二溶剂混合,于碱性环境下进行氧烷基化反应,制备厚朴酚衍生物的中间体。
[0081]
其中,厚朴酚的结构如下所示:
[0082][0083]
化合物3的结构如下所示:
[0084][0085]
厚朴酚衍生物的中间体的结构如下所示:
[0086][0087]
进一步地,对各步骤的溶剂、反应浓度、反应条件、投料比进行合理控制,能够更好地减少副产物的生成,提高反应效率和产率。
[0088]
在其中一个具体的示例中,厚朴酚与3,4
‑
二氢
‑
2h
‑
吡喃、4
‑
甲基苯磺酸吡啶的摩尔比为1:(1.1~1.5):(0.03~0.07)。进一步地,厚朴酚与3,4
‑
二氢
‑
2h
‑
吡喃、4
‑
甲基苯磺酸吡啶的摩尔比为1:(1.2~1.4):(0.04~0.06)。
[0089]
在其中一个具体的示例中,厚朴酚与1,2
‑
二溴乙烷的摩尔比为1:(1.1~1.5)。进一步地,厚朴酚与1,2
‑
二溴乙烷的摩尔比为1:(1.2~1.4)。
[0090]
在其中一个具体的示例中,取代反应的条件包括:反应温度为室温,反应时间为30h~40h。进一步地,取代反应的条件包括:反应温度为室温,反应时间为34h~38h。
[0091]
在其中一个具体的示例中,氧烷基化反应的条件包括:反应温度为45℃~55℃,反应时间为20h~30h。进一步地,氧烷基化反应的条件包括:反应温度为48℃~52℃,反应时间为22h~26h。
[0092]
在其中一个具体的示例中,第一溶剂的用量为每1mol厚朴酚加入1l~20l。进一步地,第一溶剂的用量为每1mol厚朴酚加入4l~6l。具体地,第一溶剂的用量包括但不限于每1mol厚朴酚加入:1l、2l、3l、4l、4.5l、5l、5.5l、6l、7l、8l、9l、10l、12l、14l、16l、18l、20l。
[0093]
在其中一个具体的示例中,第二溶剂的用量为每1mol厚朴酚加入3l~5l。具体地,第二溶剂的用量包括但不限于每1mol厚朴酚加入:3l、3.5l、4l、4.5l、5l。
[0094]
在其中一个具体的示例中,第一溶剂为二氯甲烷、四氢呋喃和n,n
‑
二甲基甲酰胺(dmf)中的一种或两种的组合。
[0095]
在其中一个具体的示例中,第二溶剂为丙酮和乙腈中的一种或两种的组合。
[0096]
在其中一个具体的示例中,碱性环境通过加入碱获得;碱包括但不限于碳酸钾、碳酸钠、碳酸铯和碳酸锂中的一种或多种的组合。
[0097]
在其中一个具体的示例中,取代反应结束后,去除反应溶剂,如通过旋干处理,制备化合物3。进一步地,化合物3不经过其他如纯化等步骤,直接进行氧烷基化反应。
[0098]
本发明还提供一种厚朴酚衍生物ct2
‑
1的合成方法,包括如下步骤:
[0099]
按照如上合成方法合成厚朴酚衍生物的中间体,其过程在此不再赘述;以及
[0100]
s3:将厚朴酚衍生物的中间体与硫醇化合物、钠氢、第三溶剂混合,进行硫烷基化反应;硫烷基化反应结束后进行脱保护反应,制备所述厚朴酚衍生物ct2
‑
1。
[0101]
其中,硫醇化合物的结构如下所示:
[0102][0103]
厚朴酚衍生物ct2
‑
1的结构如下所示:
[0104][0105]
在其中一个具体的示例中,厚朴酚与硫醇化合物、钠氢的摩尔比为1:(1.1~1.5):(1.1~1.5)。进一步地,厚朴酚与硫醇化合物、钠氢的摩尔比为1:(1.2~1.4):(1.2~1.4)。
[0106]
在其中一个具体的示例中,硫烷基化反应的条件包括:反应温度为
‑
5℃~5℃,反应时间为0.5h~1.5h。进一步地,硫烷基化反应的条件包括:反应温度为0℃,反应时间为1h。
[0107]
在其中一个具体的示例中,第三溶剂为四氢呋喃、甲苯和1,4
‑
二氧六环中的一种或多种的组合。
[0108]
在其中一个具体的示例中,第三溶剂的用量为每1mol厚朴酚加入3l~5l。具体地,第三溶剂的用量包括但不限于每1mol厚朴酚加入:3l、3.5l、4l、4.5l、5l。
[0109]
在其中一个具体的示例中,脱保护反应的条件包括:采用的脱保护试剂为盐酸,反应温度为室温,反应时间为0.5h~1.5h。进一步地,盐酸以盐酸水溶液的形式加入,质量浓度为35%~40%。
[0110]
在其中一个具体的示例中,脱保护反应的溶剂为醇类溶剂,包括但不限于:乙醇和甲醇中的一种或两种的组合。
[0111]
在其中一个具体的示例中,合成所述厚朴酚衍生物的中间体的氧烷基化反应结束后,反应液浓缩后加入乙酸乙酯和水进行萃取,有机相去除溶剂,如通过旋干处理,制备所述厚朴酚衍生物的中间体。进一步地,所述厚朴酚衍生物的中间体不经过其他如纯化等步骤,直接进行硫烷基化反应。
[0112]
在其中一个具体的示例中,硫烷基化反应结束后,所得反应液直接“一锅法”进行
脱保护反应,不经过其他如纯化等步骤。
[0113]
进一步地,现有的路线二在合成厚朴酚衍生物ct
‑
1的过程中,收率较低,且需要采用剧毒的二硫化碳条件。发明人尝试直接以厚朴酚衍生物ct2
‑
1结构中的邻苯二甲酰亚胺片段向异硫氰酸酯片段转化,如此即需要保证对于邻苯二甲酰亚胺片段的有效水解。同时,为了保证合成路线的绿色环保,还需要避免使用如传统方法中通常采用的剧毒的水合肼等试剂。
[0114]
基于此,发明人摸索了许多酸性(盐酸、ptsa,tfa等)和碱性(naoh等)条件都无法有效水解厚朴酚衍生物ct2
‑
1结构中的邻苯二甲酰亚胺,最后偶然发现其在甲胺条件下可以高效地实现邻苯二甲酰亚胺水解。
[0115]
同时,发明人还结合采用低毒的n,n'
‑
硫羰基二咪唑(tcdi)条件实现了氨基向异硫氰酸酯的转化,且n,n'
‑
硫羰基二咪唑(tcdi)的低毒性替代现有的路线二中剧毒的二硫化碳条件,实现了氨基向异硫氰酸酯的绿色环保的转化,且产率高,能够保证产品的规模化制备。
[0116]
具体地,本发明还提供一种厚朴酚衍生物ct
‑
1的合成方法,包括如下步骤:
[0117]
按照如上合成方法合成厚朴酚衍生物ct2
‑
1,其过程在此不再赘述;以及
[0118]
s4:将厚朴酚衍生物ct2
‑
1进行水解反应,制备化合物6;
[0119]
s5:将化合物6与n,n'
‑
硫羰基二咪唑、三乙胺、第四溶剂混合,进行异硫氰酸酯化反应,制备厚朴酚衍生物ct
‑
1。
[0120]
其中,化合物6的结构如下所示:
[0121][0122]
厚朴酚衍生物ct
‑
1的结构如下所示:
[0123][0124]
在其中一个具体的示例中,厚朴酚衍生物ct2
‑
1与n,n'
‑
硫羰基二咪唑、三乙胺的摩尔比为1:(1.5~2):(1.5~2)。进一步地,厚朴酚衍生物ct2
‑
1与n,n'
‑
硫羰基二咪唑、三乙胺的摩尔比为1:(1.6~1.8):(1.6~1.8)。
[0125]
在其中一个具体的示例中,异硫氰酸酯化反应的条件包括:反应温度为45℃~55℃,反应时间为65h~80h。进一步地,异硫氰酸酯化反应的条件包括:反应温度为48℃~52℃,反应时间为70h~75h。
[0126]
在其中一个具体的示例中,第四溶剂为n,n
‑
二甲基甲酰胺、二氯甲烷、1,4
‑
二氧六环和四氢呋喃中的一种或多种的组合。
[0127]
在其中一个具体的示例中,第四溶剂的用量为每1mol厚朴酚衍生物ct2
‑
1加入2l~3l。具体地,第四溶剂的用量包括但不限于每1mol厚朴酚加入:2l、2.5l、3l。
[0128]
在其中一个具体的示例中,混合的步骤包括:先混合所述n,n'
‑
硫羰基二咪唑与适量所述第四溶剂,加热至45℃~55℃后再加入所述厚朴酚衍生物ct2
‑
1、三乙胺以及剩余的第四溶剂。
[0129]
在其中一个具体的示例中,水解反应采用的水解试剂为甲胺。
[0130]
在其中一个具体的示例中,水解反应的条件包括:反应温度为室温,反应时间为20h~30h。进一步地,水解反应的条件包括:反应温度为室温,反应时间为22h~26h。
[0131]
在其中一个具体的示例中,水解反应的溶剂为醇类溶剂,包括但不限于:乙醇和甲醇中的一种或两种的组合。
[0132]
在其中一个具体的示例中,水解反应结束后,去除反应溶剂,如通过旋干处理,制备化合物6。进一步地,化合物6不经过其他如纯化等步骤,直接进行异硫氰酸酯化反应。
[0133]
更进一步地,厚朴酚的各衍生物中,以厚朴酚衍生物ct
‑
3的抗肿瘤活性为最优。但是,发明人在实际生产中发现,按照现有的路线二进行厚朴酚衍生物ct
‑
3的生产时,增加至1g以上进行反应会因为副产物的增多造成产率降低,产品纯度降低(hplc纯度<80%),且副产物与厚朴酚衍生物ct
‑
3的极性相近,无法通过如柱层析等方法进行分离。而综合前述步骤s1~s5制备厚朴酚衍生物ct
‑
1,并结合以间氯过氧苯甲酸调整硫酸子的氧化态,可以高产率、高纯度,且绿色环保、规模化地实现厚朴酚衍生物ct
‑
3的制备。
[0134]
具体地,本发明提供一种厚朴酚衍生物ct
‑
3的合成方法,包括如下步骤:
[0135]
按照如上合成方法合成厚朴酚衍生物ct
‑
1,其过程在此不再赘述;以及
[0136]
s6:将厚朴酚衍生物ct
‑
1与间氯过氧苯甲酸、第五溶剂混合,进行氧化反应,制备所述厚朴酚衍生物ct
‑
3。
[0137]
其中,厚朴酚衍生物ct
‑
3的结构式如下:
[0138][0139]
在其中一个具体的示例中,厚朴酚衍生物ct
‑
1与所述间氯过氧苯甲酸的摩尔比为1:(0.8~1.2)。进一步地,厚朴酚衍生物ct
‑
1与所述间氯过氧苯甲酸的摩尔比为1:1。
[0140]
在其中一个具体的示例中,氧化反应的条件包括:反应温度为
‑
25℃~
‑
15℃,反应时间为8min~12min。进一步地,氧化反应的条件包括:反应温度为
‑
22℃~
‑
18℃,反应时间为9min~11min。
[0141]
在其中一个具体的示例中,第五溶剂为二氯甲烷、氯仿和1,2
‑
二氯乙烷中的一种或多种的组合。
[0142]
在其中一个具体的示例中,第五溶剂的用量为每1mol所述厚朴酚衍生物ct
‑
1加入8l~15l。具体地,第五溶剂的用量包括但不限于每1mol厚朴酚加入:8l、10l、11l、12l、13l、15l。
[0143]
以下为具体的实施例,如无特别说明,实施例中采用的原料均为市售产品。
[0144]
实施例中的合成路线可表示如下:
[0145][0146]
其中,化合物4为厚朴酚衍生物的中间体,化合物5为厚朴酚衍生物ct2
‑
1。
[0147]
实施例1
[0148]
化合物5(厚朴酚衍生物ct2
‑
1)的制备:
[0149]
厚朴酚(100g,0.38mol)溶于二氯甲烷2l,加入4
‑
甲基苯磺酸吡啶(4.8g,0.019mol),3,4
‑
二氢
‑
2h
‑
吡喃(42g,0.5mol),室温搅拌36小时,旋干得粗产品3直接下一步;粗产品3溶于丙酮(1.5l),加入1,2
‑
二溴乙烷(94g,0.5mol),碳酸钾(83g,0.6mol),50℃反应24h,浓缩后,加入乙酸乙酯(1l)水(500ml)萃取,硫酸钠干燥,浓缩得粗产品4,将其溶于四氢呋喃(1.5l)中,0℃加入钠氢(60%dispersion in mineral oil)(20g,0.5mol),然后加入化合物7(117.5g,0.5mol),0℃反应1小时,加入乙醇(500ml),盐酸(37wt%,200ml),室温搅拌1小时后,加入乙酸乙酯(1l)水(500ml)萃取,硫酸钠干燥,浓缩,然后用硅胶柱分离(petroleum ether/etoac,10:1)得到白色固体,化合物5,即ct2
‑
1(160g,纯度为98.77%
(hplc如图1所示),三步总收率80%);rf=0.2(petroleum ether/etoac,5:1)。
[0150]
化合物4:
[0151]1h nmr(500mhz,chloroform
‑
d)δ7.50(dt,j=2.2,1.0hz,1h),7.42(dt,j=2.1,1.0hz,1h),7.32(ddt,j=8.4,2.2,0.9hz,1h),7.26(ddt,j=8.4,2.2,1.0hz,1h),7.10(d,j=8.4hz,1h),7.03(d,j=8.4hz,1h),6.03
–
5.90(m,2h),5.31
–
5.24(m,1h),5.11
–
5.04(m,4h),4.51(dt,j=12.3,5.7hz,1h),4.43(dt,j=12.4,5.7hz,1h),3.79(dt,j=12.3,5.7hz,1h),3.77
–
3.66(m,2h),3.54
–
3.46(m,1h),3.46
–
3.37(m,1h),3.38
–
3.19(m,3h),1.94
–
1.83(m,1h),1.68
–
1.52(m,3h),1.56
–
1.40(m,1h).
[0152]
13
c nmr(125mhz,common nmr solvents)δ155.08,153.85,138.08,138.04,133.31,133.04,130.85,130.48,129.34,128.72,128.20,115.70,115.68,114.89,112.84,101.36,68.41,62.56,39.55,39.51,30.30,29.59,25.78,18.66.
[0153]
化合物5:
[0154]1h nmr(400mhz,chloroform
‑
d)δ7.82(dd,j=5.5,3.1hz,2h),7.69(dd,j=5.5,3.0hz,2h),7.16(d,j=8.1hz,2h),7.11
–
7.03(m,2h),6.95(dd,j=8.1,3.9hz,2h),6.28(s,1h),6.05
–
5.87(m,2h),5.18
–
4.97(m,4h),4.14(t,j=6.7hz,2h),3.66(t,j=7.1hz,2h),3.37(ddd,j=10.1,6.6,1.5hz,4h),2.79(t,j=6.7hz,2h),2.49(t,j=7.3hz,2h),1.75
–
1.67(m,2h),1.58
–
1.50(m,2h);谱图如图2所示;
[0155]
13
c nmr(100mhz,cdcl3)δ168.3,153.0,151.9,137.8,137.3,134.1,133.8,132.5,132.2,132.0,131.1,129.1,129.0,127.7,126.2,123.1,117.4,115.8,115.4,113.4,69.4,39.32,39.26,37.3,31.9,30.7,27.5,26.8;谱图如图3所示;
[0156]
hrms(esi):m/z calcd for c
32
h
33
nnao4s[m+na]
+
:550.2028,found:550.2019;hplc purity(98.77%);谱图如图4所示。
[0157]
ct
‑
1的制备:
[0158]
化合物5(160g,0.3mol)溶于无水乙醇(1.5l),加入甲胺(33%乙醇溶液,5l),室温搅拌24小时,旋干溶剂,得到化合物6(粗产物),rf=0.6(dcm/ea=10:1),直接下一步;n,n'
‑
硫羰基二咪唑(tcdi)(90g,0.5mol)加入dmf(300ml),50℃,缓慢加入5/无水dmf(500ml)/无水三乙胺(50.5g,0.5mol)的混合溶液,50℃搅拌72小时,加入水,ea萃取,水洗,na2so4干燥,过滤,浓缩,然后用硅胶柱分离(petroleum ether/etoac,10:1)得到ct
‑
1(121g,纯度为97.86%,hplc如图5所示,两步总收率92%);rf=0.6(petroleum ether/etoac,5:1)。
[0159]1h nmr(400mhz,chloroform
‑
d)δ7.22
–
7.09(m,4h),7.00
–
6.97(m,2h),6.05
–
5.96(m,2h),5.15
–
5.07(m,4h),4.21
–
4.18(m,2h),3.49(t,j=6.3hz,2h),3.41(t,j=6.1hz,4h),2.83(t,j=6.3hz,2h),2.48(t,j=6.9hz,2h),1.72
–
1.69(m,2h),1.63
–
1.59(m,2h);谱图如图6所示;
[0160]
13
c nmr(100mhz,cdcl3)δ153.0,151.9,137.8,137.3,134.3,132.6,132.4,131.2,129.3,129.2,127.6,126.2,117.4,115.9,115.5,113.4,69.7,44.6,39.4,39.3,31.7,30.9,29.6,28.7,26.3;谱图如图7所示;
[0161]
hrms(esi):m/z calcd for c
25
h
29
nnao2s2[m+na]
+
:462.1537,found:462.1517;hplc purity(98.27%),谱图如图8所示。
[0162]
ct
‑
3的制备:
[0163]
化合物ct
‑
1(121g,0.28mol)溶于dcm(3l),
‑
20℃采用自动进样器缓慢加入间氯过氧苯甲酸(48g,0.28mol)的dcm(200ml)溶液,
‑
20℃反应10min.加入nahco3饱和水溶液(500ml)和饱和亚硫酸钠水溶液(500ml),室温搅拌5min,dcm(1l)萃取,合并有机相,水洗,饱和食盐水洗,na2so4干燥,过滤,浓缩,然后用硅胶柱分离(petroleum ether/etoac,3:1to 1:1,then dcm/etoac,10:1)得到ct
‑
3(115g,纯度为99.167%(hplc如图9所示),收率为90%)。ct
‑
3:r
f
=0.2(petroleum ether/etoac,1:2)。
[0164]1h nmr(400mhz,chloroform
‑
d)δ7.20(dd,j=8.4,2.3hz,1h),7.14
–
7.09(m,2h),7.03
–
6.99(m,2h),6.91(d,j=8.2hz,1h),6.02
–
5.94(m,2h),5.13
–
5.06(m,4h),4.47
–
4.41(m,2h),3.49(t,j=6.2hz,2h),3.40
–
3.37(m,4h),3.13(ddd,j=13.0,8.5,4.2hz,1h),2.95(ddd,j=13.9,5.5,3.4hz,1h),2.66
–
2.60(m,1h),2.51
–
2.48(m,1h),1.78
–
1.66(m,4h);谱图如图10所示;
[0165]
13
c nmr(101mhz,cdcl3)δ153.1,151.8,137.7,137.2,134.5,132.3,132.1,131.1,129.3,129.2,1c.4,125.8,116.7,116.0,115.6,113.4,61.7,51.6,51.4,44.5,39.4,39.3,28.8,20.2;谱图如图11所示;
[0166]
hrms(esi):m/z calcd for c
25
h
29
nnao3s2[m+na]
+
:478.1487,found:478.1466;hplc purity(99.17%),谱图如图12所示。
[0167]
对比例1
[0168]
本对比例提供一种化合物5(厚朴酚衍生物ct2
‑
1)的合成方法考察,其步骤同实施例1,主要区别在于:分别采用硫酸铜、咪唑、吡啶、对甲苯磺酸中的一种等摩尔替代4
‑
甲基苯磺酸吡啶。
[0169]
结果:采用硫酸铜等摩尔替代4
‑
甲基苯磺酸吡啶,制备得到化合物5的三步总产率8%;采用咪唑、吡啶、对甲苯磺酸中的一种等摩尔替代4
‑
甲基苯磺酸吡啶,反应无法进行,即制备得到化合物5的三步总产率为0%。
[0170]
实施例2
[0171]
本实施例提供一种化合物5(厚朴酚衍生物ct2
‑
1)的合成方法考察,其步骤同实施例1,主要区别在于:分别采用dmf、甲苯、四氢呋喃、1,4
‑
二氧六环中的一种等体积替代二氯甲烷。
[0172]
结果:采用dmf等体积替代二氯甲烷制备得到化合物5的三步总产率为20%;采用甲苯等体积替代二氯甲烷制备得到化合物5的三步总产率为0%;采用四氢呋喃等体积替代二氯甲烷制备得到化合物5的三步总产率为25%;采用1,4
‑
二氧六环等体积替代二氯甲烷制备得到化合物5的三步总产率为0%。
[0173]
实施例3
[0174]
本实施例提供一种化合物5(厚朴酚衍生物ct2
‑
1)的合成方法考察,其步骤同实施例1,主要区别在于:改变二氯甲烷的用量为6l、3l、1l、0.5l、0.2l、0.1l。
[0175]
结果:改变二氯甲烷的用量为6l制备得到化合物5的三步总产率为5%;改变二氯甲烷的用量为3l制备得到化合物5的三步总产率为30%;改变二氯甲烷的用量为1l制备得到化合物5的三步总产率为25%;改变二氯甲烷的用量为0.5l制备得到化合物5的三步总产率为5%;改变二氯甲烷的用量为0.2l或0.1l制备得到化合物5的三步总产率均为0%。
[0176]
实施例4
[0177]
本实施例提供一种ct
‑
1的合成方法考察,其步骤同实施例1,主要区别在于:采用分别采用氢氧化钠、浓盐酸、6m盐酸水溶液、对甲苯磺酸、硫酸中的一种等摩尔替代甲胺。
[0178]
结果:替代后均不发生反应(产率0%)。
[0179]
对比例2
[0180]
本对比例为按照现有的路线二放大至1g进行厚朴酚衍生物ct
‑
3的生产,步骤如下:
[0181]
(1)取厚朴酚(5g)溶于200ml四氢呋喃中,向体系中加入4摩尔当量60%氢化钠和4当量摩尔1,2
‑
二溴乙烷,于60℃反应3小时,然后向体系中加入60ml水,再用200ml乙酸乙酯萃取,萃取得到的有机相用硫酸钠干燥后浓缩,最后用硅胶柱分离浓缩后的有机相,得到化合物2(4.2g),淡黄色液体,产率60%。
[0182]
(2)化合物2(4.2g)溶于110ml n,n
‑
二甲基甲酰胺,加入26mol硫化钠,于25℃反应2小时,然后加2mol/l盐酸调节ph为1,静置,过滤,收集沉淀,将沉淀溶于60mln,n
‑
二甲基甲酰胺,再加入26mol碳酸钾和26mmol的4
‑
溴
‑1‑
丁胺,于25℃反应12小时,浓缩反应液,将反应液溶于30ml四氢呋喃中,0℃加入17mol三乙胺和6mol二硫化碳,于25℃反应2小时,再加入40ml水,然后用50ml乙酸乙酯萃取,萃取得到的有机相用硫酸钠干燥后浓缩,最后用硅胶柱分离浓缩后的有机相,得到化合物ct
‑
1(1.5g),淡黄色液体,产率30%。
[0183]
(3)l化合物ct
‑
1(1.5g)于25℃(室温)溶于30ml二氯甲烷,加入4mol间氯过氧苯甲酸,25℃反应1小时,然后向反应液中加入10ml碳酸氢钠饱和水溶液,再用18ml二氯甲烷萃取,萃取得到的有机相用硫酸钠干燥后浓缩,最后用硅胶柱分离浓缩后的有机相,得到化合物ct
‑
2(0.6g),淡黄色液体,产率39%和化合物ct
‑
3(0.9g,纯度为79.687%(hplc如图13所示),淡黄色液体,产率60%。
[0184]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0185]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解,本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或者有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1