四氢喹喔啉磺酰胺衍生物及其制备方法与用途
1.本发明属于药物化学领域,具体涉及一类含有四氢喹喔啉磺酰胺结构的微管聚合抑制剂,它们的制备方法,以及含有这些化合物的药物组合物及其在治疗恶性肿瘤等药物方面的用途。
技术背景
2.癌症的发病机理复杂,与环境、基因、肥胖、感染等多种因素有关。癌症的主要特点是细胞无限制的增长,并且其致死率和复发率高、预后差。
3.微管是由α微管蛋白和β微管蛋白聚合形成的空心圆柱状结构,正常生理条件下微管处于动态平衡状态。微管作为细胞骨架的重要组成成分,与细胞内物质的运输、细胞运动、细胞形态的维持、细胞增殖等多种生物功能有关。在细胞增殖过程中微管参与纺锤体的形成,与遗传物质的分配具有密切的联系。肿瘤细胞具有快速增殖能力,其有丝分裂过程频繁且细胞周期短于正常细胞,因此肿瘤细胞中微管处于异常活化的状态。微管靶向药物(microtubule-targeting agents,mtas)通过与微管结合,促进或抑制微管聚合,破坏微管的动态平衡,干扰细胞的有丝分裂,诱导肿瘤细胞死亡。
技术实现要素:
4.发明目的:本发明公开了一类含有四氢喹喔啉磺酰胺结构的化合物,并提供了该类化合物的具体制备方法以及作为微管聚合抑制剂的制药应用。
5.技术方案:本发明公开了一类如通式(ⅰ)所示的四氢喹喔啉磺酰胺衍生物或其药学上可接受的盐:
[0006][0007]
其中:x=ch或n;
[0008]
r1代表h、f、cl、br、-or4、-coor4、-ocor4、-nhcor4、-conhr4或-oh,r1可以是单取代或双取代;r4代表h、c1-c6的烷基或c3-c8的环烷基;
[0009]
r2代表取代的c1-c6的烷基、取代的c3-c8的环烷基、取代的c2-c6的杂环烷基、取代的芳香环或取代的芳杂环,所述杂环烷基为含有1~3个o、n或s原子的三元、四元、五元或六元饱和杂环;
[0010]
r3代表h、取代的c1-c6的烷基、取代的c3-c8的环烷基、取代的c2-c6的杂环烷基或cor5;所述杂环烷基为含有1~3个o、n或s原子的三元、四元、五元或六元饱和杂环;r5代表取代的c1-c6烷基或取代的芳香环。
[0011]
其中:x=ch或n;r1优选h、f、cl、-ome、-oet、-coome、-cooet、-ocome、-ocoet、-conh2、-conhme、-nhcome、-nhcoet;r2优选优选其中r6代表h、f、ch3、t-bu、cf3、cn、oh、och3、ocf3、nh2、nhch3、n(ch3)2、nhc2h5、n(c2h5)2、nhcoch3、conh2、conhch3,r6可以是单取代、双取代或三取代;r3优选h、me、et或come。
[0012]
上述化合物的药学上可接受的盐为通式(i)化合物的酸加成盐,其中用于成盐的酸为:氯化氢、溴化氢、硫酸、碳酸、草酸、柠檬酸、琥珀酸、酒石酸、磷酸、乳酸、丙酮酸、乙酸、马来酸、甲磺酸、苯磺酸、对甲苯磺酸或阿魏酸。
[0013]
当x=ch,r1=h时,通式(i)的化合物可用下列方法制备:
[0014][0015]
当r3=h时,通式(i)的化合物可用下列方法制备:
[0016][0017]
当r3≠h时,通式(i)的化合物可用下列方法制备:
[0018][0019]
其中,x、r1、r2和r3的定义同前;
[0020]
具体步骤为:
[0021]
目标化合物i-a的制备:
[0022]
(1)以化合物ⅱ为起始原料,无水dcm为溶剂,以tea或dipea作为缚酸剂,与相应的
磺酰氯ⅲ反应生成目标化合物。
[0023]
目标化合物i-b的制备:
[0024]
(2)化合物
ⅴ
的制备
[0025]
以化合物ⅳ为起始原料,乙腈或dmf为溶剂,在碳酸钾的作用下与苄胺进行亲核取代反应生成化合物
ⅴ
;
[0026]
(3)化合物ⅵ的制备
[0027]
由化合物
ⅴ
制备化合物ⅵ,可以采用两种方法:1)以甲醇为溶剂,以pd/c作为催化剂,在氢气作用下还原硝基得到化合物ⅵ;2)以乙醇为溶剂,以fe粉和hcl(0.15m)还原硝基得到化合物ⅵ;
[0028]
(4)化合物ⅶ的制备
[0029]
化合物ⅵ与草酸二甲酯或草酸二乙酯在70~100℃环合得到化合物ⅶ;
[0030]
(5)化合物
ⅷ
的制备
[0031]
将化合物ⅶ溶于无水四氢呋喃中,采用硼烷-四氢呋喃络合物还原羰基得到化合物
ⅷ
;
[0032]
(6)化合物
ⅸ
的制备
[0033]
化合物
ⅷ
溶于无水dcm中,以tea或dipea作为缚酸剂,与相应的磺酰氯ⅲ反应生成化合物
ⅸ
;
[0034]
(7)目标化合物
ⅰ‑
b的制备
[0035]
化合物
ⅸ
溶于甲醇中,以pd/c或raney ni作为催化剂,在氢气作用下脱除苄基得到目标化合物
ⅰ‑
b。
[0036]
目标化合物i-c的制备:
[0037]
化合物x的合成与化合物
ⅷ
的合成类似。
[0038]
(8)化合物
ⅻ
的制备
[0039]
化合物x溶于dmf中,加入nah,然后加入原料xi反应得到化合物
ⅻ
;
[0040]
(9)化合物xiii的制备
[0041]
化合物
ⅻ
溶于甲醇中,以pd/c或raney ni作为催化剂,在氢气作用下脱除苄基得到化合物xiii;
[0042]
(10)目标化合物i-c的制备
[0043]
化合物xiii溶于无水dcm中,以tea或dipea作为缚酸剂,与相应的磺酰氯ⅲ反应生成目标化合物i-c。
[0044]
本发明还公开了一种药物组合物,其含有上述通式(i)化合物或其药学上可接受的盐及药学上可接受的载体。所述的化合物可以添加药学上可接受的载体制成常见的药用制剂,如片剂、胶囊、糖浆、悬浮剂、注射剂,可以加入香料、甜味剂、液体或固体填料或稀释剂等常用药用辅料。
[0045]
本发明所述的通式(i)化合物及其立体异构体、水合物、溶剂合物或结晶在制备微管聚合抑制剂药物中的应用也在本发明的保护范围内。
[0046]
进一步地,其中的微管聚合抑制剂用于制备治疗恶性肿瘤的药物,所述的恶性肿瘤包括乳腺癌、卵巢癌、肝癌、肺癌、结肠癌、前列腺癌、慢性髓细胞白血病等。
[0047]
有益效果:本发明公开了一种通式(i)所示的四氢喹喔啉磺酰胺类衍生物,药理实
验结果显示,本发明的磺酰胺类化合物(i)对肿瘤细胞具有增殖抑制活性,将肿瘤细胞阻滞在g2/m期,可用于制备治疗微管蛋白动态平衡失衡导致的恶性肿瘤;本发明还公开了所述四氢喹喔啉磺酰胺类衍生物的制备方法。
具体实施方式
[0048]
下面结合具体实施例对本技术做进一步详细说明,但本发明的保护范围并不局限于此。
[0049]
实施例1
[0050]
1-((4-甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
a-1)的合成
[0051][0052]
将ⅱ(1.00g,7.45mmol)、dmap(0.27g,2.24mmol)和tea(1.51g,14.91mmol)溶于dcm(40ml)中,0℃下滴加对甲氧基苯磺酰氯(
ⅲ‑
1)(1.46g,7.08mmol)的dcm溶液,滴加完毕,室温搅拌,1.5h后tlc监测(pe:ea=2:1)反应。反应完全后,dcm稀释,水(100ml
×
3)洗涤,饱和nacl溶液(100ml
×
3)洗涤,无水na2so4干燥。抽滤,滤液减压浓缩,柱层析(pe:ea=8:1)纯化,得深棕色固体1.59g,产率70.4%。1h nmr(300mhz,cdcl3)δ7.69(d,j=8.0hz,1h),7.53(d,j=8.6hz,2h),7.01(t,j=7.4hz,1h),6.89(d,j=8.6hz,2h),6.72(t,j=7.6hz,1h),6.50(d,j=7.9hz,1h),3.86(s,3h),3.81(t,j=4.9hz,2h),2.97(t,j=4.8hz,2h).
13
c nmr(75mhz,cdcl3)δ163.03,137.87,131.24,129.38,126.63,126.44,121.78,117.04,114.70,114.20,55.60,43.78,38.76。
[0053]
实施例2
[0054]
1-((2-甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
a-2)的合成
[0055][0056]
以ⅱ(1.00g,7.45mmol)和2-甲氧基苯磺酰氯(
ⅲ‑
2)(1.46g,7.08mmol)为原料,操作过程同目标化合物
ⅰ‑
a-1,得棕色固体1.64g,产率72.2%。1h nmr(300mhz,cdcl3)δ7.98(dd,j=7.9,1.7hz,1h),7.50(ddd,j=8.3,7.4,1.7hz,1h),7.41(dd,j=8.2,1.4hz,1h),7.08-6.99(m,1h),6.94-6.86(m,2h),6.66-6.59(m,1h),6.53(dd,j=8.0,1.5hz,1h),3.79(t,j=4.9hz,2h),3.56(s,3h),3.10(t,j=5.0hz,2h).
13
c nmr(75mhz,cdcl3)δ157.02,136.84,134.86,131.35,128.18,125.24,124.10,123.91,120.28,117.06,114.52,112.21,55.65,43.93,40.28。
[0057]
实施例3
[0058]
1-((3,4-二甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
a-3)的合成
[0059][0060]
以ⅱ(1.00g,7.45mmol)和3,4-二甲氧基苯磺酰氯(
ⅲ‑
3)(1.68g,7.08mmol)为原料,操作过程同目标化合物
ⅰ‑
a-1,得棕色固体1.70g,产率68.4%。1h nmr(300mhz,cdcl3)δ7.69(dd,j=8.2,1.5hz,1h),7.29(dd,j=8.6,2.1hz,1h),7.03-6.94(m,1h),6.84(d,j=8.5hz,1h),6.75(d,j=2.1hz,1h),6.72-6.65(m,1h),6.45(dd,j=8.0,1.4hz,1h),3.90(s,3h),3.77(t,j=5.1hz,2h),3.59(s,3h),2.88(t,j=5.2hz,2h).
13
c nmr(75mhz,cdcl3)δ152.61,148.85,138.13,131.23,126.82,126.66,121.75,120.77,116.96,114.59,110.30,109.64,56.12,55.89,43.82,38.38。
[0061]
实施例4
[0062]
1-对甲苯磺酰基-1,2,3,4-四氢喹喔啉(
ⅰ‑
a-4)的合成
[0063][0064]
以ⅱ(1.00g,7.45mmol)和4-甲基苯磺酰氯(
ⅲ‑
4)(1.35g,7.08mmol)为原料,操作过程同目标化合物
ⅰ‑
a-1,得棕色固体1.60g,产率74.4%。1h nmr(300mhz,cdcl3)δ7.63(dd,j=8.2,1.5hz,1h),7.43(d,j=8.3hz,2h),7.17(d,j=8.0hz,2h),7.00-6.92(m,1h),6.70-6.62(m,1h),6.45(dd,j=8.0,1.4hz,1h),3.83(br,1h),3.74(t,j=5.1hz,2h),2.88(t,j=5.2hz,2h),2.36(s,3h).
13
c nmr(75mhz,cdcl3)δ143.73,137.87,136.68,129.70,127.29,126.60,126.22,121.75,116.97,114.77,43.82,38.81,21.59。
[0065]
实施例5
[0066]
6-甲氧基-1-((4-甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉(i-b-1)的合成
[0067][0068]
n-苄基-5-甲氧基-2-硝基苯胺(
ⅴ‑
1)的合成
[0069]
将苄胺(2.07g,19.28mmol)溶于乙腈(40ml)中,加入3-氟-4-硝基苯甲醚(
ⅳ‑
1)
(3.00g,17.50mmol)和无水碳酸钾(4.84g,35.02mmol),85℃回流搅拌。90min后tlc(展开剂pe:ea=5:1)监测反应是否完全,原料反应完全后,停止加热,冷至室温,抽滤,滤液用水(20ml
×
3)洗涤,饱和氯化钠溶液(20ml
×
3)洗涤,无水硫酸钠干燥过夜。抽滤,滤液经减压浓缩得黄色固体3.92g,产率86.6%。产物不经进一步纯化,直接投下一步。1h nmr(300mhz,dmso)δ8.87(t,j=5.7hz,1h),8.06(d,j=9.7hz,1h),7.46-7.41(m,2h),7.40-7.34(m,2h),7.32-7.27(m,1h),6.35-6.25(m,2h),4.64(d,j=5.9hz,2h),3.74(s,3h)。
[0070]n1-苄基-5-甲氧基苯基-1,2-二胺(
ⅵ‑
1)的合成
[0071]
将
ⅴ‑
1(817mg,3.16mmol)溶于甲醇(40ml)中,搅拌下分批加入钯炭(67mg,0.63mmol),氢气三通三放,室温反应。90min后tlc(展开剂pe:ea=5:1)监测反应是否完全。原料反应完全后,硅藻土抽滤,滤液减压浓缩,柱层析(展开剂pe:ea=10:1)分离,得深灰色油状物679mg,产率93.9%。1h nmr(300mhz,cdcl3)δ7.50-7.35(m,5h),6.73(d,j=8.3hz,1h),6.36(d,j=2.7hz,1h),6.28(dd,j=8.3,2.7hz,1h),4.37(s,2h),3.79(s,3h),3.16(br,3h)。
[0072]
1-苄基-7-甲氧基-1,4-二氢喹喔啉-2,3-二酮(
ⅶ‑
1)的合成
[0073]
将
ⅵ‑
1(100mg,0.44mmol)、草酸二乙酯(517mg,4.38mmol)依次加入单颈瓶中,140℃反应4h。tlc(展开剂pe:ea=5:1)监测反应是否完全。原料反应完全后,停止加热,冷至室温,加入乙醚(20ml)搅拌1h,抽滤得棕色固体95mg,产率76.9%。产物不经进一步纯化,直接投下一步。
[0074]
1-苄基-7-甲氧基-1,2,3,4-四氢喹喔啉(
ⅷ‑
1)的合成
[0075]
将
ⅶ‑
1(1.00g,3.55mmol)加入到双颈瓶中,氮气保护,无水四氢呋喃(60ml)溶解,0℃下缓慢滴加1mol/l硼烷四氢呋喃络合物(8.80ml),滴加完毕搅拌30min。然后移至室温反应12h,tlc(展开剂pe:ea=2:1)监测反应是否完全。原料反应完全后,0℃滴加甲醇淬灭未反应的硼烷,无气泡产生后再搅拌20min,二氯甲烷萃取(20ml
×
3),合并有机层,水(20ml
×
3)洗涤,饱和氯化钠溶液(20ml
×
3)洗涤,无水硫酸钠干燥过夜。抽滤,滤液经减压浓缩,柱层析(pe:ea=8:1)分离,得白色固体350mg,产率38.8%。1h nmr(300mhz,cdcl3)δ7.28-7.14(m,6h),6.39(d,j=8.3hz,1h),6.14-6.00(m,2h),4.36(s,2h),3.57(s,3h),3.33(s,4h)。
[0076]
4-苄基-6-甲氧基-1-((4-甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅸ‑
1)的合成
[0077]
将
ⅷ‑
1(300mg,1.18mmol)溶于二氯甲烷(40ml)中,分别加入dmap(43mg,0.35mmol)、三乙胺(239mg,2.36mmol),0℃下缓慢滴加4-甲氧基苯磺酰氯(
ⅲ‑
1)(269mg,1.30mmol)的二氯甲烷溶液,滴加完毕室温反应2h,tlc(展开剂pe:ea=5:1)监测反应是否完全。待原料反应完全后,减压除去溶剂,乙酸乙酯(20ml)溶解,0.1mol/l稀盐酸洗涤(20ml
×
3),水洗涤(20ml
×
3),饱和氯化钠溶液洗涤(20ml
×
3),无水硫酸钠干燥过夜。抽滤,滤液减压浓缩得白色固体393mg,产率78.4%。1h nmr(300mhz,cdcl3)δ7.59(d,j=8.8hz,1h),7.46(d,j=8.9hz,2h),7.23-7.14(m,3h),6.87(d,j=8.9hz,2h),6.82-6.72(m,2h),6.26(dd,j=8.8,2.7hz,1h),6.04(d,j=2.6hz,1h),4.24(s,2h),3.88-3.83(m,5h),3.68(s,3h),2.98(t,j=5.4hz,2h)。
[0078]
6-甲氧基-1-((4-甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-1)的合成
[0079]
将
ⅸ‑
1(350mg,0.83mmol)、无水甲醇(40ml)和雷尼镍,依次投入到100ml圆底烧瓶中,氢气置换三次,60℃反应4h,tlc监测(pe:ea=2:1)反应。反应完毕,硅藻土抽滤,减压除去溶剂,柱层析(展开剂pe:ea=5:1)纯化,得白色固体202mg,产率72.9%。1h nmr(300mhz,cdcl3)δ7.53(d,j=8.9hz,1h),7.46(d,j=8.9hz,2h),6.85(d,j=8.9hz,2h),6.27(dd,j=8.9,2.7hz,1h),5.98(d,j=2.7hz,1h),3.82(s,3h),3.77-3.70(m,5h),2.86(t,j=5.2hz,2h).
13
c nmr(75mhz,cdcl3)δ162.91,158.47,138.87,131.13,129.37,127.82,115.09,114.10,102.99,99.13,55.52,55.22,43.75,38.37。
[0080]
实施例6
[0081]
6-甲氧基-1-((2-甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-2)的合成
[0082][0083]
4-苄基-6-甲氧基-1-((2-甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅸ‑
2)的合成
[0084]
以
ⅷ‑
1(300mg,1.18mmol)和2-甲氧基苯磺酰氯(
ⅲ‑
2)(269mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体412mg,产率82.2%。1h nmr(300mhz,cdcl3)δ7.95(dd,j=7.8,1.7hz,1h),7.58-7.48(m,1h),7.36(d,j=8.8hz,1h),7.31-7.23(m,3h),7.09-6.99(m,3h),6.89(d,j=8.3hz,1h),6.22(dd,j=8.8,2.7hz,1h),6.15(d,j=2.7hz,1h),4.37(s,2h),3.85(t,j=5.2hz,2h),3.67(s,3h),3.49(s,3h),3.12(t,j=5.2hz,2h)。
[0085]
6-甲氧基-1-((2-甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-2)的合成
[0086]
以
ⅸ‑
2(400mg,0.94mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体252mg,产率80.3%。1h nmr(300mhz,cdcl3)δ7.93(d,j=7.8hz,1h),7.55-7.45(m,1h),7.32(d,j=8.9hz,1h),7.00(d,j=7.5hz,1h),6.90(d,j=8.3hz,1h),6.21(dd,j=8.9,2.6hz,1h),6.07(d,j=2.6hz,1h),3.94(br,1h),3.75-3.66(m,5h),3.56(s,3h),3.01(t,j=5.0hz,2h).
13
c nmr(75mhz,cdcl3)δ157.62,157.04,137.99,134.89,131.33,128.03,125.66,120.25,117.28,112.28,102.65,99.36,55.74,55.33,43.73,39.83。
[0087]
实施例7
[0088]
1-((3,4-二甲氧基苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-3)的合成
[0089][0090]
4-苄基-1-((3,4-二甲氧基苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅸ‑
3)
的合成
[0091]
以
ⅷ‑
1(300mg,1.18mmol)和3,4-二甲氧基苯磺酰氯(
ⅲ‑
3)(308mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体424mg,产率56.9%。1h nmr(300mhz,cdcl3)δ7.68(d,j=8.8hz,1h),7.39-7.30(m,2h),7.26-7.23(m,2h),6.89(d,j=8.5hz,1h),6.82-6.76(m,3h),6.32(dd,j=8.8,2.7hz,1h),6.08(d,j=2.7hz,1h),4.28(s,2h),3.97(s,3h),3.90(t,j=5.4hz,2h),3.71(s,3h),3.62(s,3h),3.01(t,j=5.4hz,2h)。
[0092]
1-((3,4-二甲氧基苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-3)的合成
[0093]
以
ⅸ‑
3(400mg,0.88mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体256mg,产率80.1%。1h nmr(300mhz,cdcl3)δ7.60(d,j=8.9hz,1h),7.29(dd,j=8.4,2.4hz,1h),6.88(d,j=8.5hz,1h),6.81(d,j=2.0hz,1h),6.32(dd,j=8.9,2.7hz,1h),6.00(d,j=2.7hz,1h),3.94(s,3h),3.81-3.75(m,5h),3.67(s,3h),2.87(t,j=5.2hz,2h).
13
c nmr(75mhz,cdcl3)δ158.74,152.55,148.79,139.11,131.19,128.00,120.88,115.16,110.31,109.76,103.10,99.02,56.12,55.93,55.33,43.86,38.17。
[0094]
实施例8
[0095]
6-甲氧基-1-对甲苯磺酰基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-4)的合成
[0096][0097]
4-苄基-6-甲氧基-1-对甲苯磺酰基-1,2,3,4-四氢喹喔啉(
ⅸ‑
4)的合成
[0098]
以
ⅷ‑
1(300mg,1.18mmol)和4-甲基苯磺酰氯(
ⅲ‑
4)(248mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体406mg,产率81.8%。1h nmr(300mhz,cdcl3)δ7.64(d,j=8.8hz,1h),7.48(d,j=8.3hz,2h),7.29-7.20(m,5h),6.89-6.82(m,2h),6.32(dd,j=8.9,2.7hz,1h),6.10(d,j=2.7hz,1h),4.26(s,2h),3.90(t,j=5.4hz,2h),3.73(s,3h),2.98(t,j=5.4hz,2h),2.47(s,3h)。
[0099]
6-甲氧基-1-对甲苯磺酰基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-4)的合成
[0100]
以
ⅸ‑
4(350mg,0.86mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体202mg,产率74.3%。1h nmr(300mhz,cdcl3)δ7.50(d,j=8.9hz,1h),7.40(d,j=8.2hz,2h),7.16(d,j=8.1hz,2h),6.23(dd,j=8.9,2.8hz,1h),5.97(d,j=2.7hz,1h),3.94(br,1h),3.73-3.67(m,5h),2.80(t,j=5.1hz,2h),2.35(s,3h).
13
c nmr(75mhz,cdcl3)δ158.55,143.72,139.04,136.48,129.72,127.63,127.32,114.86,103.09,99.06,55.25,43.79,38.35,21.61。
[0101]
实施例9
[0102]
1-((2,4-二甲氧基苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-5)的合成
[0103]
4-苄基-1-((2,4-二甲氧基苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅸ‑
5)的合成
[0104]
以
ⅷ‑
1(340mg,1.34mmol)和2,4-二甲氧基苯磺酰氯(
ⅲ‑
5)(382mg,1.61mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体444mg,产率72.8%。1h nmr(300mhz,cdcl3)δ7.81(d,j=8.7hz,1h),7.39(d,j=8.7hz,1h),7.31-7.15(m,3h),7.02(d,j=6.9hz,2h),6.47(dd,j=8.8,2.3hz,1h),6.36(d,j=2.3hz,1h),6.19(dd,j=8.8,2.6hz,1h),6.13(d,j=2.7hz,1h),4.35(s,2h),3.88-3.75(m,5h),3.63(s,3h),3.40(s,3h),3.09(t,j=5.1hz,2h)。
[0105]
1-((2,4-二甲氧基苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-5)的合成
[0106]
以
ⅸ‑
5(1.00g,2.23mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体603mg,产率74.3%。1h nmr(300mhz,cdcl3)δ7.91(d,j=8.8hz,1h),7.40(d,j=8.9hz,1h),6.54(dd,j=8.8,2.3hz,1h),6.42(d,j=2.2hz,1h),6.28(dd,j=8.9,2.8hz,1h),6.11(d,j=2.8hz,1h),3.88(s,3h),3.79-3.72(m,5h),3.58(s,3h),3.10(t,j=5.0hz,2h).
13
c nmr(75mhz,cdcl3)δ164.94,158.55,157.51,137.70,133.15,125.89,120.29,117.58,104.19,102.78,99.50,99.29,55.74,55.73,55.34,43.61,39.74。
[0107]
实施例10
[0108]
1-((2,5-二甲氧基苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-6)的合成
[0109]
4-苄基-1-((2,5-二甲氧基苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅸ‑
6)的合成
[0110]
以化合物
ⅷ‑
1(300mg,1.18mmol)和2,5-二甲氧基苯磺酰氯(
ⅲ‑
6)(308mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体450mg,产率84.4%。1h nmr(300mhz,cdcl3)δ7.38(d,j=3.2hz,1h),7.29(d,j=8.8hz,1h),7.20-7.14(m,3h),7.02-6.94(m,3h),6.76(d,j=9.0hz,1h),6.14(dd,j=8.8,2.6hz,1h),6.07(d,j=2.6hz,1h),4.29(s,2h),3.76(t,j=5.3hz,2h),3.68(s,3h),3.58(s,3h),3.38(s,3h),3.06(t,j=5.2hz,2h)。
[0111]
1-((2,5-二甲氧基苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-6)的合成
[0112]
以
ⅸ‑
6(400mg,0.88mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体251mg,产率78.5%。1h nmr(300mhz,cdcl3)δ7.48(d,j=3.1hz,1h),7.33(d,j=8.9hz,1h),7.03(dd,j=9.0,3.2hz,1h),6.84(d,j=9.0hz,1h),6.23(dd,j=8.9,2.7hz,1h),6.07(d,j=2.7hz,1h),3.95(br,1h),3.78(s,3h),3.76-3.71(m,5h),3.55(s,3h),3.08(t,j=5.1hz,2h).
13
c nmr(75mhz,cdcl3)δ157.65,152.84,151.15,137.89,128.60,125.69,120.63,117.36,115.72,113.66,102.74,99.51,56.25,56.11,55.35,43.81,39.97。
[0113]
实施例11
[0114]
6-甲氧基-1-((4-(三氟甲氧基)苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-7)的合成
[0115]
4-苄基-6-甲氧基-1-((4-(三氟甲氧基)苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅸ‑
7)的合成
[0116]
以
ⅷ‑
1(300mg,1.18mmol)和4-(三氟甲氧基)苯磺酰氯(
ⅲ‑
7)(339mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体385mg,产率68.3%。1h nmr(300mhz,cdcl3)δ7.66-7.58(m,3h),7.31-7.25(m,5h),6.93-6.86(m,2h),6.34(dd,j=8.9,2.7hz,1h),6.13(d,j=2.7hz,1h),4.21(s,2h),3.92(t,j=5.5hz,2h),3.75(s,3h),2.99(t,j=5.5hz,2h)。
[0117]
6-甲氧基-1-((4-(三氟甲氧基)苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-7)的合成
[0118]
以
ⅸ‑
7(350mg,0.73mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体235mg,产率83.1%。1h nmr(300mhz,cdcl3)δ7.58(d,j=8.8hz,2h),7.50(d,j=8.9hz,1h),7.22(d,j=8.4hz,2h),6.26(dd,j=8.9,2.7hz,1h),5.99(d,j=2.7hz,1h),3.95(br,1h),3.79-3.64(m,5h),2.88(t,j=5.2hz,2h).
13
c nmr(75mhz,cdcl3)δ158.82,152.22(q,3j
c-f
=1.8hz),139.08,137.81,129.45,127.58,120.70,120.18(q,1j
c-f
=257.8hz),114.37,103.19,99.12,55.21,43.89,38.62。
[0119]
实施例12
[0120]
1-((2-氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-8)的合成
[0121][0122]
4-苄基-1-((2-氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅸ‑
8)的合成
[0123]
以
ⅷ‑
1(300mg,1.18mmol)和2-氟苯磺酰氯(
ⅲ‑
8)(186mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体357mg,产率73.5%。1h nmr(300mhz,cdcl3)δ7.82(ddd,j=7.9,6.9,1.8hz,1h),7.66-7.56(m,1h),7.47(d,j=8.8hz,1h),7.33-7.24(m,4h),7.22-7.14(m,1h),6.99(dd,j=6.7,2.8hz,2h),6.28(dd,j=8.8,2.7hz,1h),6.18(d,j=2.7hz,1h),4.40(s,2h),3.98(t,j=5.3hz,2h),3.71(s,3h),3.25(t,j=5.4hz,2h)。
[0124]
1-((2-氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-8)的合成
[0125]
以
ⅸ‑
8(300mg,0.73mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体180mg,产率76.6%。1h nmr(300mhz,cdcl3)δ7.83-7.71(m,1h),7.59-7.47(m,1h),7.33(d,j=8.9hz,1h),7.24-7.16(m,1h),7.16-7.08(m,1h),6.19(dd,j=8.9,2.7hz,1h),6.02(d,j=2.7hz,1h),3.92(br,1h),3.80(t,j=5.0hz,2h),3.69(s,3h),3.12(t,j=5.1hz,2h).
13
c nmr(75mhz,cdcl3)δ158.80(d,1j
c-f
=255.5hz),158.25,138.61,135.33(d,3j
c-f
=8.3hz),130.97,127.77(d,2j
c-f
=14.2hz),126.17,124.55(d,3j
c-f
=3.8hz),117.42(d,2j
c-f
=21.5hz),115.03,103.05,99.36,55.26,43.89,39.74。
[0126]
实施例13
[0127]
6-甲氧基-1-(萘-1-磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-9)的合成
[0128][0129]
4-苄基-6-甲氧基-1-(萘-1-磺酰基)-1,2,3,4-四氢喹喔啉(
ⅸ‑
9)的合成
[0130]
以
ⅷ‑
1(300mg,1.18mmol)和1-萘磺酰氯(
ⅲ‑
9)(295mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体443mg,产率83.1%。1h nmr(300mhz,cdcl3)δ8.18(d,j=1.8hz,1h),7.94-7.80(m,3h),7.70-7.55(m,3h),7.45(dd,j=8.6,1.9hz,1h),7.01(t,j=7.4hz,1h),6.83(t,j=7.6hz,2h),6.55(d,j=7.3hz,2h),6.31(dd,j=8.8,2.7hz,1h),6.01(d,j=2.7hz,1h),4.09(s,2h),3.91(t,j=5.4hz,2h),3.68(s,3h),2.92(t,j=5.4hz,2h)。
[0131]
6-甲氧基-1-(萘-1-磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-9)的合成
[0132]
以
ⅸ‑
9(400mg,0.90mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体218mg,产率68.5%。1h nmr(300mhz,cdcl3)δ8.24(s,1h),7.93-7.82(m,3h),7.68-7.57(m,3h),7.47(dd,j=8.7,1.7hz,1h),6.35(dd,j=9.0,2.7hz,1h),5.98(d,j=2.7hz,1h),
3.83(t,j=5.1hz,2h),3.77(s,3h),2.83(t,j=4.2hz,2h).
13
c nmr(75mhz,cdcl3)δ158.68,138.98,136.65,134.81,132.13,129.30,129.25,128.85,128.58,127.94,127.73,127.52,122.75,115.03,103.20,99.16,55.31,43.92,38.57。
[0133]
实施例14
[0134]
4-((6-甲氧基-3,4-二氢喹喔啉-1(2h)-基)磺酰基)苯胺(
ⅰ‑
b-10)的合成
[0135][0136]
4-苄基-6-甲氧基-1-((4-硝基苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅸ‑
10)的合成
[0137]
以
ⅷ‑
1(300mg,1.18mmol)和4-硝基苯磺酰氯(
ⅲ‑
10)(228mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体427mg,产率69.0%。1h nmr(300mhz,cdcl3)δ8.19(d,j=8.8hz,2h),7.66(d,j=8.8hz,2h),7.59(d,j=8.8hz,1h),7.20-7.10(m,3h),6.84-6.76(m,2h),6.31(dd,j=8.9,2.6hz,1h),6.17(d,j=2.6hz,1h),4.20(s,2h),3.92(t,j=5.4hz,2h),3.73(s,3h),2.94(t,j=5.5hz,2h)。
[0138]
4-((6-甲氧基-3,4-二氢喹喔啉-1(2h)-基)磺酰基)苯胺(
ⅰ‑
b-10)的合成
[0139]
以
ⅸ‑
10(300mg,0.73mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体166mg,产率71.3%。1h nmr(300mhz,cdcl3)δ7.50(d,j=8.9hz,1h),7.26(d,j=8.8hz,2h),6.53(d,j=8.7hz,2h),6.24(dd,j=8.9,2.7hz,1h),6.00(d,j=2.7hz,1h),4.27(br,1h),3.72(s,3h),3.66(t,j=4.9hz,2h),2.83(t,j=5.0hz,2h).
13
c nmr(75mhz,cdcl3)δ158.40,151.17,139.20,129.31,127.88,126.86,115.12,114.01,102.96,99.00,55.28,43.66,38.20。
[0140]
实施例15
[0141]
6-甲氧基-1-((4-(三氟甲基)苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-11)的合成
[0142]
4-苄基-6-甲氧基-1-((4-(三氟甲基)苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅸ‑
11)的合成
[0143]
以
ⅷ‑
1(300mg,1.18mmol)和4-三氟甲基苯磺酰氯(
ⅲ‑
11)(318mg,1.30mmol)为原
料,操作过程同化合物
ⅸ‑
1,得白色固体464mg,产率70.2%。1h nmr(300mhz,cdcl3)δ7.73-7.63(m,4h),7.59(d,j=8.9hz,1h),7.24-7.17(m,3h),6.85-6.78(m,2h),6.30(dd,j=8.9,2.6hz,1h),6.09(d,j=2.6hz,1h),4.18(s,2h),3.89(t,j=5.4hz,2h),3.70(s,3h),2.94(t,j=5.5hz,2h)。
[0144]
6-甲氧基-1-((4-(三氟甲基)苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-11)的合成
[0145]
以
ⅸ‑
11(400mg,0.87mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体214mg,产率66.7%。1h nmr(300mhz,cdcl3)δ7.70-7.65(m,4h),7.56(d,j=8.9hz,1h),6.31(dd,j=9.0,2.7hz,1h),6.00(d,j=2.7hz,1h),3.81(t,j=5.2hz,2h),3.75(s,3h),2.89(t,j=5.3hz,2h).
13
c nmr(75mhz,cdcl3)δ158.89,143.10,138.76,134.34(q,2j
c-f
=32.9hz),127.84,127.61,126.12(q,3j
c-f
=3.6hz),123.23(q,1j
c-f
=271.2hz),114.45,103.43,99.32,55.30,44.01,38.77。
[0146]
实施例16
[0147]
1-((4-(叔丁基)苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-12)的合成
[0148][0149]
4-苄基-1-((4-(叔丁基)苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅸ‑
12)的合成
[0150]
以
ⅷ‑
1(300mg,1.18mmol)和4-叔丁基苯磺酰氯(
ⅲ‑
12)(303mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体442mg,产率76.4%。1h nmr(300mhz,cdcl3)δ7.61(d,j=8.8hz,1h),7.55-7.46(m,4h),7.29-7.23(m,3h),7.00-6.94(m,2h),6.33(dd,j=8.8,2.7hz,1h),6.11(d,j=2.7hz,1h),4.16(s,2h),3.88(t,j=5.4hz,2h),3.74(s,3h),2.92(t,j=5.5hz,2h),1.37(s,9h)。
[0151]
1-((4-(叔丁基)苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-12)的合成
[0152]
以
ⅸ‑
12(400mg,0.89mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体224mg,产率69.9%。1h nmr(300mhz,cdcl3)δ7.52(d,j=8.9hz,1h),7.47(d,j=8.6hz,2h),7.39(d,j=8.6hz,2h),6.24(dd,j=8.9,2.7hz,1h),6.00(d,j=2.7hz,1h),3.95(br,1h),3.75-3.68(m,5h),2.82(t,j=5.1hz,2h),1.29(s,9h).
13
c nmr(75mhz,cdcl3)δ158.46,156.64,138.95,136.53,127.51,127.20,126.04,115.06,103.03,99.19,55.25,43.82,38.51,35.15,31.12。
[0153]
实施例17
[0154]
6-甲氧基-1-苯磺酰基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-13)的合成
[0155][0156]
4-苄基-6-甲氧基-1-苯磺酰基-1,2,3,4-四氢喹喔啉(
ⅸ‑
13)的合成
[0157]
以
ⅷ‑
1(300mg,1.18mmol)和苯磺酰氯(
ⅲ‑
13)(230mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体395mg,产率84.5%。1h nmr(300mhz,cdcl3)δ7.67-7.56(m,4h),7.51-7.43(m,2h),7.27-7.20(m,3h),6.86-6.78(m,2h),6.33(dd,j=8.9,2.7hz,1h),6.09(d,j=2.7hz,1h),4.23(s,2h),3.92(t,j=5.5hz,2h),3.73(s,3h),2.97(t,j=5.5hz,2h)。
[0158]
6-甲氧基-1-苯磺酰基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-13)的合成
[0159]
以
ⅸ‑
13(350mg,0.89mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体201mg,产率74.3%。1h nmr(300mhz,cdcl3)δ7.56-7.48(m,4h),7.42-7.34(m,2h),6.25(dd,j=8.9,2.7hz,1h),5.97(d,j=2.7hz,1h),3.90(br,1h),3.75-3.68(m,5h),2.80(t,j=4.3hz,2h).
13
c nmr(75mhz,cdcl3)δ158.62,139.39,139.00,132.88,129.08,127.62,127.29,114.77,103.12,99.08,55.27,43.82,38.41。
[0160]
实施例18
[0161]
6-甲氧基-1-((3-(三氟甲基)苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-14)的合成
[0162][0163]
4-苄基-6-甲氧基-1-((3-(三氟甲基)苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅸ‑
14)的合成
[0164]
以
ⅷ‑
1(300mg,1.18mmol)和3-三氟甲基苯磺酰氯(
ⅲ‑
14)(318mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体449mg,产率71.4%。1h nmr(300mhz,cdcl3)δ7.90(d,j=7.8hz,1h),7.81-7.59(m,2h),7.59(dd,j=7.8,1.4hz,1h),7.32-7.18(m,4h),6.96(dd,j=7.2,2.4hz,2h),6.20(dd,j=8.8,2.6hz,1h),6.14(d,j=2.6hz,1h),4.33(s,2h),3.91(t,j=5.3hz,2h),3.68(s,3h),3.15(t,j=5.3hz,2h)。
[0165]
6-甲氧基-1-((3-(三氟甲基)苯基)磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-14)的合成
[0166]
以
ⅸ‑
14(400mg,0.87mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体258mg,产率79.8%。1h nmr(300mhz,cdcl3)δ7.85-7.78(m,2h),7.70(d,j=7.9hz,1h),7.58(d,j=7.8hz,1h),7.53(d,j=8.9hz,1h),6.31(dd,j=8.9,2.7hz,1h),6.00(d,j=2.7hz,
1h),3.81(t,j=5.2hz,2h),3.75(s,3h),2.91(t,j=5.3hz,2h).
13
c nmr(75mhz,cdcl3)δ159.08,140.58,139.17,131.47(q,2j
c-f
=33.2hz),130.55,129.87,129.37(q,3j
c-f
=3.5hz),127.56,124.38(q,3j
c-f
=3.7hz),123.18(q,1j
c-f
=271.3hz),114.13,103.40,99.10,55.30,44.00,38.64。
[0167]
实施例19
[0168]
1-(乙基磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-15)的合成
[0169][0170]
4-苄基-1-(乙基磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅸ‑
15)的合成
[0171]
以
ⅷ‑
1(300mg,1.18mmol)和乙基磺酰氯(
ⅲ‑
15)(167mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体342mg,产率80.5%。1h nmr(300mhz,cdcl3)δ7.38-7.27(m,4h),7.25-7.20(m,2h),6.27(d,j=2.7hz,1h),6.23(dd,j=8.7,2.7hz,1h),4.52(s,2h),3.82(t,j=5.4hz,2h),3.69(s,3h),3.47(t,j=5.4hz,2h),2.97(q,j=7.4hz,2h),1.34(t,j=7.4hz,3h)。
[0172]
1-(乙基磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-15)的合成
[0173]
以
ⅸ‑
15(300mg,0.87mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体151mg,产率68.0%。1h nmr(300mhz,cdcl3)δ7.34(d,j=8.9hz,1h),6.23(dd,j=8.9,2.7hz,1h),6.15(d,j=2.7hz,1h),4.33(br,1h),3.80-3.70(m,5h),3.46(t,j=5.3hz,2h),3.01(q,j=7.4hz,2h),1.36(t,j=7.4hz,3h).
13
c nmr(75mhz,cdcl3)δ158.30,138.77,125.83,115.40,103.03,99.52,55.32,46.78,43.53,40.96,8.01。
[0174]
实施例20
[0175]
1-((3-溴苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-16)的合成
[0176][0177]
4-苄基-1-((3-溴苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅸ‑
16)的合成
[0178]
以
ⅷ‑
1(300mg,1.18mmol)和3-溴苯基磺酰氯(
ⅲ‑
16)(332mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体466mg,产率79.6%。1h nmr(300mhz,cdcl3)δ7.73-7.69(m,1h),7.66(d,j=8.1hz,1h),7.55(d,j=8.8hz,1h),7.43-7.37(m,1h),7.26-7.19(m,4h),6.87-6.80(m,2h),6.29(dd,j=8.8,2.7hz,1h),6.10(d,j=2.7hz,1h),4.21(s,2h),3.87(t,j=5.5hz,2h),3.70(s,3h),2.97(t,j=5.5hz,2h)。
[0179]
1-((3-溴苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-16)的合成
[0180]
以
ⅸ‑
16(400mg,0.85mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体
245mg,产率75.5%。1h nmr(300mhz,cdcl3)δ7.79-7.76(m,1h),7.71-7.66(m,1h),7.54(d,j=8.9hz,1h),7.47-7.42(m,1h),7.34-7.29(m,1h),6.32(dd,j=8.9,2.7hz,1h),6.03(d,j=2.8hz,1h),3.84-3.76(m,5h),2.95(t,j=5.2hz,2h).
13
c nmr(75mhz,cdcl3)δ158.89,141.33,138.99,135.79,130.58,130.16,127.58,125.93,122.96,114.48,103.34,99.22,55.35,43.97,38.72。
[0181]
实施例21
[0182]
1-((3,5-二氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-17)的合成
[0183][0184]
4-苄基-1-((3,5-二氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅸ‑
17)的合成
[0185]
以
ⅷ‑
1(300mg,1.18mmol)和3,5-二氟苯磺酰氯(
ⅲ‑
17)(276mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体421mg,产率75.9%。1h nmr(300mhz,cdcl3)δ7.55(d,j=8.8hz,1h),7.29-7.18(m,3h),7.13-7.02(m,2h),6.97(d,j=2.3hz,1h),6.93-6.81(m,2h),6.30(dd,j=8.9,2.7hz,1h),6.14(d,j=2.7hz,1h),4.27(s,2h),3.87(t,j=5.5hz,2h),3.71(s,3h),2.99(t,j=5.5hz,2h)。
[0186]
1-((3,5-二氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-17)的合成
[0187]
以
ⅸ‑
17(400mg,0.93mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体251mg,产率79.3%。1h nmr(300mhz,cdcl3)δ7.54(d,j=8.9hz,1h),7.16-7.11(m,2h),7.01(tt,j=8.5,2.3hz,1h),6.33(dd,j=9.0,2.7hz,1h),6.05(d,j=2.7hz,1h),3.91(br,1h),3.82(t,j=5.1hz,2h),3.79(s,3h),3.01(t,j=5.2hz,2h).
13
c nmr(75mhz,cdcl3)δ162.65(dd,1j
c-f
=253.1hz,3j
c-f
=11.5hz),158.98,142.70(t,3j
c-f
=8.2hz),138.85,127.41,114.21,110.99(d,2j
c-f
=18.3hz),110.86(d,2j
c-f
=18.3hz),108.39(t,2j
c-f
=24.9hz),103.48,99.31,55.31,44.07,38.87。
[0188]
实施例22
[0189]
6-甲氧基-1-(间甲苯磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-18)的合成
[0190][0191]
4-苄基-6-甲氧基-1-(间甲苯磺酰基)-1,2,3,4-四氢喹喔啉(
ⅸ‑
18)的合成
[0192]
以
ⅷ‑
1(300mg,1.18mmol)和3-甲基苯磺酰氯(
ⅲ‑
18)(364mg,1.30mmol)为原料,
操作过程同化合物
ⅸ‑
1,得白色固体407mg,产率83.3%。1h nmr(300mhz,cdcl3)δ7.64-7.55(m,1h),7.42-7.28(m,4h),7.24-7.16(m,3h),6.85-6.74(m,2h),6.33-6.25(m,1h),6.09-6.03(m,1h),4.20(s,2h),3.86(t,j=5.6hz,2h),3.69(s,3h),2.95(t,j=5.2hz,2h),2.32(s,3h)。
[0193]
6-甲氧基-1-(间甲苯磺酰基)-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-18)的合成
[0194]
以
ⅸ‑
18(350mg,0.86mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体222mg,产率81.2%。1h nmr(300mhz,cdcl3)δ7.50(d,j=8.9hz,1h),7.38-7.24(m,4h),6.25(dd,j=8.9,2.8hz,1h),5.98(d,j=2.8hz,1h),3.74-3.66(m,5h),2.82(t,j=5.3hz,2h),2.30(s,3h).
13
c nmr(75mhz,cdcl3)δ158.61,139.28,139.22,139.02,133.63,128.93,127.69,127.57,124.47,114.92,103.10,99.08,55.29,43.82,38.46,21.33。
[0195]
实施例23
[0196]
1-((3,4-二氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-19)的合成
[0197][0198]
4-苄基-1-((3,4-二氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅸ‑
19)的合成
[0199]
以
ⅷ‑
1(300mg,1.18mmol)和3,4-二氟苯磺酰氯(
ⅲ‑
19)(276mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体424mg,产率78.6%。1h nmr(300mhz,cdcl3)δ7.55(d,j=8.8hz,1h),7.39-7.31(m,1h),7.30-7.20(m,4h),7.17-7.10(m,1h),6.88-6.80(m,2h),6.28(dd,j=8.9,2.6hz,1h),6.14(d,j=2.6hz,1h),4.25(s,2h),3.87(t,j=5.4hz,2h),3.70(s,3h),2.98(t,j=5.5hz,2h)。
[0200]
1-((3,4-二氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-19)的合成
[0201]
以
ⅸ‑
19(400mg,0.93mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体245mg,产率77.3%。1h nmr(300mhz,cdcl3)δ7.50(d,j=8.9hz,1h),7.43-7.35(m,1h),7.35-7.28(m,1h),7.25-7.15(m,1h),6.28(dd,j=9.0,2.8hz,1h),6.00(d,j=2.8hz,1h),3.81-3.73(m,5h),2.94(t,j=5.4hz,2h).
13
c nmr(75mhz,cdcl3)δ158.94,153.19(dd,1j
c-f
=255.7hz,2j
c-f
=12.5hz),150.03(dd,1j
c-f
=253.0hz,2j
c-f
=13.2hz),138.97,136.30(d,3j
c-f
=8.6hz),127.63,124.49(dd,2j
c-f
=7.4hz,3j
c-f
=4.0hz),118.14(d,2j
c-f
=18.2hz),117.20(dd,2j
c-f
=19.7hz,3j
c-f
=1.5hz),114.30,103.38,99.22,55.30,43.98,38.74。
[0202]
实施例24
[0203]
1-((2,6-二氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-20)的合成
[0204][0205]
4-苄基-1-((2,6-二氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅸ‑
20)的合成
[0206]
以
ⅷ‑
1(300mg,1.18mmol)和2,6-二氟苯磺酰氯(
ⅲ‑
20)(276mg,1.30mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体427mg,产率81.2%。1h nmr(300mhz,cdcl3)δ7.54-7.38(m,2h),7.27-7.17(m,3h),7.02-6.89(m,4h),6.22(dd,j=8.8,2.7hz,1h),6.14(d,j=2.7hz,1h),4.36(s,2h),3.97(t,j=5.0hz,2h),3.65(s,3h),3.27(t,j=5.0hz,2h)。
[0207]
1-((2,6-二氟苯基)磺酰基)-6-甲氧基-1,2,3,4-四氢喹喔啉(
ⅰ‑
b-20)的合成
[0208]
以
ⅸ‑
20(400mg,0.93mmol)为原料,操作过程同目标化合物
ⅰ‑
b-1,得白色固体242mg,产率76.6%。1h nmr(300mhz,cdcl3)δ7.58-7.47(m,1h),7.43(d,j=9.0hz,1h),7.01(t,j=8.5hz,2h),6.29(dd,j=9.0,2.8hz,1h),6.09(d,j=2.8hz,1h),3.99(br,1h),3.95(t,j=5.0hz,2h),3.76(s,3h),3.30(t,j=5.1hz,2h).
13
c nmr(75mhz,cdcl3)δ159.73(dd,1j
c-f
=258.3hz,3j
c-f
=3.9hz),158.22,138.17,134.77(t,3j
c-f
=10.9hz),125.72,118.04(t,2j
c-f
=16.3hz),115.05,113.27(d,2j
c-f
=23.7hz),113.23(d,2j
c-f
=23.7hz),103.17,99.64,55.28,44.15,39.95。
[0209]
实施例25
[0210]
1-((4-甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉-6-甲酸甲酯(
ⅰ‑
b-21)的合成
[0211][0212]
3-苄氨基-4-硝基苯甲酸甲酯(
ⅴ‑
2)的合成
[0213]
以3-氟-4-硝基苯甲酸甲酯(
ⅳ‑
2)(1.00g,5.02mmol)和苄胺(0.65g,6.03mmol)为原料,操作过程同化合物
ⅴ‑
1,得橙色固体1.21g,产率84.2%。1h nmr(300mhz,cdcl3)δ8.34(t,j=5.6hz,1h),8.24(d,j=8.9hz,1h),7.59(d,j=1.5hz,1h),7.41-7.30(m,5h),7.26(dd,j=8.9,1.7hz,1h),4.59(d,j=5.5hz,2h),3.91(s,3h).
[0214]
4-氨基-3-苄氨基苯甲酸甲酯(
ⅵ‑
2)的合成
[0215]
以
ⅴ‑
2(1.20g,4.19mmol)为原料,操作过程同化合物
ⅵ‑
1,得橙红色油状物0.75g,产率70.1%。产物未经进一步纯化,直接投下一步。1h nmr(300mhz,cdcl3)δ7.48(dd,j=8.0,1.8hz,1h),7.45-7.27(m,6h),6.71(d,j=8.0hz,1h),4.33(s,2h),3.85(s,3h),3.78(br,2h),3.41(s,1h)。
[0216]
4-苄基-2,3-二氧代-1,2,3,4-四氢喹喔啉-6-甲酸甲酯(
ⅶ‑
2)的合成
[0217]
以
ⅵ‑
2(1.00g,3.90mmol)和草酸二乙酯(11.40g,78.03mmol)为原料,操作过程同化合物
ⅶ‑
1,得灰白色粉末857mg,产率70.8%。产物未经进一步纯化,直接投下一步。
[0218]
4-苄基-1,2,3,4-四氢喹喔啉-6-甲酸甲酯(
ⅷ‑
2)的合成
[0219]
以
ⅶ‑
2(800mg,2.58mmol)和bh
3-thf络合物(6.45ml)为原料,操作过程同化合物
ⅷ‑
1,得黄色油状物490mg,产率67.3%。1h nmr(300mhz,cdcl3)δ7.36-7.21(m,7h),6.42(d,j=8.0hz,1h),4.42(s,2h),4.28(s,1h),3.77(s,3h),3.40(t,j=5.1hz,2h),3.22(t,j=5.1hz,2h)。
[0220]
4-苄基-1-((4-甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉-6-甲酸甲酯(
ⅸ‑
21)的合成
[0221]
以
ⅷ‑
2(330mg,1.17mmol)和4-甲氧基苯磺酰氯(
ⅲ‑
1)(266mg,1.29mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体280mg,产率53.0%。1h nmr(300mhz,cdcl3)δ7.79(d,j=8.4hz,1h),7.48(d,j=8.9hz,2h),7.36(dd,j=8.4,1.6hz,1h),7.29(d,j=1.4hz,1h),7.24-7.17(m,3h),6.90-6.78(m,4h),4.39(s,2h),3.89(t,j=5.0hz,2h),3.85(s,3h),3.84(s,3h),3.01(t,j=5.2hz,2h)。
[0222]
1-((4-甲氧基苯基)磺酰基)-1,2,3,4-四氢喹喔啉-6-甲酸甲酯(
ⅰ‑
b-21)的合成
[0223]
以
ⅸ‑
21(280mg,0.62mmol)为原料,操作过程同化合物
ⅰ‑
b-1,得白色固体68mg,产率30.4%。1h nmr(300mhz,cdcl3)δ7.75(d,j=8.6hz,1h),7.51(d,j=8.6hz,2h),7.34(dd,j=8.6,1.9hz,1h),7.17(d,j=2.0hz,1h),6.87(d,j=8.6hz,2h),3.88(s,3h),3.85-3.78(m,5h),2.96(t,j=5.1hz,2h).
13
c nmr(75mhz,cdcl3)δ167.02,163.23,137.27,130.92,129.33,127.77,126.01,125.60,118.26,115.89,114.34,55.61,52.12,43.75,38.81。
[0224]
实施例26
[0225]
1-对甲苯磺酰基-1,2,3,4-四氢喹喔啉-6-甲酸甲酯(
ⅰ‑
b-22)的合成
[0226][0227]
4-苄基-1-对甲苯磺酰基-1,2,3,4-四氢喹喔啉-6-甲酸甲酯(
ⅸ‑
22)的合成
[0228]
以
ⅷ‑
2(330mg,1.17mmol)和4-甲基苯磺酰氯(
ⅲ‑
4)(246mg,1.29mmol)为原料,操作过程同化合物
ⅸ‑
1,得白色固体259mg,产率60.8%。1h nmr(300mhz,cdcl3)δ7.78(d,j=8.4hz,1h),7.44(d,j=8.2hz,2h),7.36(dd,j=8.4,1.4hz,1h),7.31-7.27(m,1h),7.24-7.16(m,5h),6.89-6.79(m,2h),4.37(s,2h),3.88(t,j=5.1hz,2h),3.83(s,3h),2.97(t,j=5.2hz,2h),2.41(s,3h)。
[0229]
1-对甲苯磺酰基-1,2,3,4-四氢喹喔啉-6-甲酸甲酯(
ⅰ‑
b-22)的合成
[0230]
以
ⅸ‑
22(250mg,0.60mmol)为原料,操作过程同化合物
ⅰ‑
b-1,得白色固体69mg,产率35.4%。1h nmr(300mhz,cdcl3)δ7.75(d,j=8.6hz,1h),7.47(d,j=8.2hz,2h),7.35(dd,
j=8.6,1.9hz,1h),7.20(d,j=8.0hz,2h),7.17(d,j=2.0hz,1h),3.94(s,1h),3.88(s,3h),3.82(t,j=5.1hz,2h),3.00-2.91(m,2h),2.38(s,3h).
13
c nmr(75mhz,cdcl3)δ167.01,144.04,137.21,136.37,129.84,127.78,127.23,125.97,125.47,118.29,115.91,52.12,43.79,38.83,21.61。
[0231]
上述实施例中,产物可用氯化氢、溴化氢、硫酸、碳酸、草酸、柠檬酸、琥珀酸、酒石酸、磷酸、乳酸、丙酮酸、乙酸、马来酸、甲磺酸、苯磺酸、对甲苯磺酸或阿魏酸的任一种加成盐。
[0232]
下面是本发明所述的部分药理实验及结果:
[0233]
实验1:对肿瘤细胞的增殖抑制实验(mtt实验)
[0234]
测试本发明所述化合物对人慢性髓系白血病细胞(k562)、人肝癌细胞(hepg2)、人乳腺癌细胞(mcf-7)和人宫颈癌细胞(hela)的细胞增殖抑制活性。以上细胞株均由本实验室冻存和传代。取对数生长期的肿瘤细胞以4000~5000个/孔接种于96孔板,24h后加入不同浓度的目标化合物或对照药(选取化合物abt-751为阳性对照药),37℃、5%co2培养72h。每孔加入mtt溶液50μl(5mg/ml),继续培养4h后弃去培养基和mtt溶液。每孔加入100μl dmso溶液,震荡后用酶标仪在570nm波长处测其吸光度(od值),计算细胞抑制率:生长抑制率=(od对照-od实验)/(od对照-od空白)
×
100%(od对照、od实验及od空白分别表示各组的平均光吸收值),然后使用graphpad软件拟合化合物的ic
50
。
[0235]
实验结果如表1所示,结果显示部分化合物具有较强的增殖抑制活性。
[0236]
a:ic
50
﹤20μm;b:20《ic
50
《100μm;c:ic
50
》100μm
[0237][0238]
实验2:细胞周期实验
[0239]
测试本发明所述化合物对癌症细胞(hela)细胞周期的影响。将hela细胞以合适的浓度接种在6孔板上,37℃、5%co2下孵育24h,然后每孔分别加入不同浓度的化合物或阳性对照,37℃、5%co2下继续培养24h。收集细胞,离心,缓慢的垂直滴入到10ml预冷的70%(v/v)乙醇中,-20℃条件下固定48h。pbs洗涤,每个样品加入500μl的染色剂(50μg/ml的pi和100μg/ml的rnasea),4℃避光孵育1h,离心,除去染料,pbs洗涤,300目滤网过滤,使用流式细胞仪于580nm处检测。
[0240]
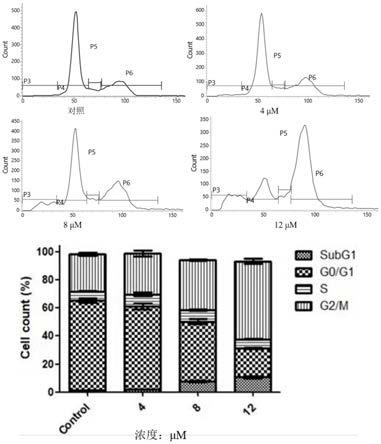
实验结果:结果显示化合物可以剂量依赖性地将细胞周期阻滞在g2/m期,如图1所
示。
[0241]
实验3:结合模式研究
[0242]
利用maestro11.5软件进行分子对接研究化合物与微管的结合模式。首先从pdb数据库中下载秋水仙碱与微管的共晶复合物(pdb:1sa0),通过蛋白质准备选项给蛋白加氢、去水、补充缺失的残基或片段、进行能量最小化。随后通过软件推荐的标准操作,利用受体网格生成选项生成网格。通过opls3力场对化合物加氢、生成3d结构、离子化和优化,然后利用glide docking中标准精确模式进行分子对接。
[0243]
实验结果
[0244]
分子对接结果显示四氢喹喔啉环占据秋水仙碱结合位点的一个疏水空腔,同时环上的nh与α微管蛋白thr179形成氢键作用,与磺酰基相连的苯环则占据β微管蛋白内的疏水口袋。化合物i-b-1与微管的对接图如图2所示。化合物i-b-21与微管的对接图如图3所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1