具有PI3Kδ/BTK双靶点活性的化合物及其制备方法和应用
具有pi3k
δ
/btk双靶点活性的化合物及其制备方法和应用
技术领域
1.本发明涉及小分子药物领域,具体地,本发明提供一种布鲁顿酪氨酸激酶(btk)和磷脂酰肌醇-3-激酶δ亚型(pi3kδ)双靶点抑制活性的化合物,以及此类化合物的合成和应用。
背景技术:
2.b细胞淋巴瘤是一种异质性的淋巴细胞增殖性疾病群,也是一种死亡程度相当高的恶性肿瘤,可以分为霍奇金淋巴瘤(hl)和非霍奇金淋巴瘤(nhl)两大类。hl通常发于淋巴结,具有reed-sternberg肿瘤细胞;nhl常发于结外淋巴组织,发病率普遍更高,包括套细胞淋巴瘤(mcl)、弥漫性大b细胞淋巴瘤(dlbcl)、慢性淋巴细胞白血病(cll)、滤泡性淋巴瘤(fl)、边缘区b细胞淋巴瘤(mzl)等。目前对b细胞淋巴瘤的常规治疗手段是放射、化学疗法。在美国nccn临床用药指南中指出,对b细胞淋巴瘤的一线治疗方案是r-chop疗法,即利妥昔单抗、环磷酰胺、阿霉素、长春新碱和泼尼松的联合用药。但是,对于老年患者或自身患有其他疾病的患者来说,这些疗法所带来的毒性他们难以耐受。
3.b细胞淋巴瘤的发病机制与b细胞受体(bcr)息息相关。在多种b细胞淋巴瘤中,bcr过度表达,bcr信号通路也过度活跃,导致b细胞正常的分化和凋亡过程被抑制,异常增殖过程被促进。因此,bcr信号通路对于多种肿瘤细胞的生长存活是至关重要的,针对该通路上的不同靶向药物可以抑制b细胞相关疾病的进程,包括脾酪氨酸激酶(syk)、布鲁顿酪氨酸激酶(btk)和磷脂酰肌醇-3-激酶(pi3k)等。
4.pi3k是一类脂质激酶,参与调控肿瘤发生发展相关的生理过程。目前,已有5款pi3k抑制剂被fda批准上市。2014年7月,首个选择性pi3kδ抑制剂idelalisib获fda批准上市,选择性是其它亚型的40倍以上,主要用于治疗复发性cll、fl或sll。但idelalisib有一个黑框警告,有肝毒性、严重腹泻、结肠炎、肺炎和肠道穿孔等严重副作用。鉴于idelalisib的严重不良反应,2017年9月,fda加速批准copanlisib的上市,用于治疗fl。copanlisib是pi3kα/δ抑制剂,治疗效果与idelalisib相似,安全性却有了很大提高。2018年10月获批上市的duvelisib是pi3kδ/γ选择性抑制剂,总缓解率可以达到78%。alpelisib为pi3kα抑制剂,选择性高,主要用于治疗pik3ca突变的晚期转移性乳腺癌,填补了pik3ca突变的乳腺癌患者治疗效果不佳的空白,且alpelisib与安慰剂组相比,生存期整整翻三倍。最新获批的pi3kδ/ck1ε双靶点抑制剂umbralisib更是被fda授予治疗fl/mzl的孤儿药资格。目前全球对于pi3k抑制剂的研究仍十分火热,但pi3k这个靶点存在很多复杂的机制,且每个亚型都有自己独特的功能,所以针对不同亚型的抑制剂是在通过不同机制来抑制肿瘤,毒性也是叠加的。因此,亚型选择性高的pi3k抑制剂在安全性方面会更有发展前景。
5.pi3kδ只在造血细胞中表达,且有研究表明,敲除pi3kδ的小鼠,b细胞功能受到严重损伤,因此pi3kδ是治疗b细胞淋巴瘤的有效靶点。同时,pi3kδ也与免疫性疾病相关,可以调节免疫阈值以及限制内源性微生物群的免疫力,有望用于治疗类风湿性关节炎、多发性硬化、阿尔兹海默症等免疫细胞相关疾病。较为瞩目的第二代pi3kδ抑制剂umbralisib近期
刚于美国上市,用于先前已接受治疗的mzl和fl患者。umbralisib的耐受性和安全性都更加良好,较少发生自身免疫性毒样。因此,第二代pi3k抑制剂都有更高的选择性,更大程度地减少因叠加毒性带来的副作用。
6.btk激酶可促进细胞增殖、抗体分泌、类开关重组和促炎性细胞因子的产生。目前全球共有5款已上市的btk抑制剂,除了血液系统肿瘤外,治疗胰腺癌、乳腺癌、自身免疫疾病等临床试验也正在进行。ibrutinib是首个成功上市的btk抑制剂,于2013年被fda批准,至今仍占据着btk抑制剂销售额第一的位置。随后上市的acalabrutinib和zanubrutinib都与ibrutinib结构相似,但脱靶副作用更小。最新在中国nmpa获批的orelabrutinib具有更高的选择性,目前临床试验也在继续开发它更多的适应症。
7.由于b细胞信号通路网络机制复杂,存在代偿性激活,多数复发性或难治性高风险的b细胞淋巴瘤患者通常不能从单药治疗中获得长期益处,容易出现耐药性及副作用。临床上一般会采用联合用药或者联合放化疗治疗的措施,提高安全性和疗效。虽然pi3k抑制剂和btk抑制剂都属于bcr信号通路且都针对b细胞淋巴瘤,但二者是相对独立的两条途径,抑制其中一个激酶对激活另一个激酶的影响不大,所以对pi3k和btk联合用药,既减少了信号通路中的代偿性激活,又可以更低的药物剂量同时抑制两个靶点,可能具有更高的疗效。目前已有关于pi3k及btk抑制剂联合应用的临床实验正在进行,例如copanlisib联合ibrutinib治疗复发性或难治性原发性中枢神经淋巴瘤(pcnsl)的研究,可以更快地达到更高的完全缓解率,并显著延长肿瘤复发时间,正处于ib/ii期。pi3k抑制剂umbralisib和btk抑制剂ibrutinib协同给药于cll/mcl肿瘤患者,结果显示耐受性良好。
8.然而,不同药物之间pk性质的差异(如药物半衰期、药物分布和药物-药物相互作用)使一些联合用药的应用受到限制,同时,多组分给药也可能存在代谢和耐药性等方面的问题。
技术实现要素:
9.本发明的目的是针对现有技术的不足,提供一种具有pi3kδ/btk双靶点活性的化合物及其药学上可用的盐、其合成方法及其在抑制b蛋白受体的药物中的应用。
10.本发明的目的是通过以下技术方案来实现的:一种具有pi3kδ/btk双靶点活性的化合物及其药学上可用的盐,具有如式a的结构:
[0011][0012]
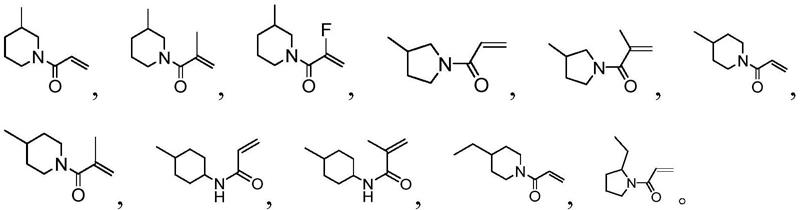
其中,r具有以下结构:
[0013][0014]
本发明同时提供一种具有pi3kδ/btk双靶点活性的化合物的制备方法,包括以下
步骤:
[0015]
第一步:3-碘-1h-吡唑并[3,4-d]嘧啶-4-胺和3-氟-4-甲氧基硼酸在碳酸钠和1,1'-双二苯基膦二茂铁二氯化钯作用下,在n-甲基吡咯烷酮和水的溶剂体系中生成b-1结构的化合物;
[0016]
第二步:加入3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-4-胺,三苯基氧膦和三苯基膦,加入n,n-二甲基甲酰胺溶解,氮气保护将其置于冰浴下,滴加偶氮二甲酸二异丙酯,得到b-2结构的化合物;
[0017]
第三步:中间体b-2与原料n-boc-保护的醇混合,加入三苯基膦tpp,冰浴下缓慢滴加偶氮二甲酸二异丙酯diad,室温搅拌反应,并用tlc监测反应进程。加水淬灭,二氯甲烷萃取,硅胶柱层析分离得到产物c-1;
[0018]
第四步:上述得到的c-1产物在稀盐酸中,脱除保护基,得c-2;
[0019]
第五步:中间体c-2与r5取代的丙烯酸进行缩合反应,得目标产物a。
[0020]
反应方程式如下:
[0021][0022]
其中,
[0023]
r3为以下结构:
[0024]
r4为以下结构:
[0025]
r5为h,f或甲基;
[0026]
r的结构定义同前面一致。
[0027]
本发明所述的一种具有pi3kδ/btk双靶点活性的化合物可以单独使用,也可以用常规的方法制备成药学上可接受的盐使用,所述药学上可接受的盐为盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硫酸氢盐、磷酸盐、乙酸盐、丙酸盐、丁酸盐、草酸盐、酒石酸盐、甲磺酸盐、对甲苯磺酸盐、富马酸盐、牛磺酸盐、柠檬酸盐、琥珀酸盐,或其混合盐。
[0028]
本发明还提供所述一种具有pi3kδ/btk双靶点活性的化合物及其在药学上可接受的盐在药学上的应用,该应用具体为:用于制备预防或治疗因pi3kδ/btk异常所引起的疾病的药物制剂。所述的疾病为淋巴瘤,包括慢性淋巴细胞白血病、b细胞淋巴瘤、套细胞淋巴瘤、淋巴浆细胞淋巴瘤、弥漫性大b细胞淋巴瘤、非霍奇金淋巴瘤、滤泡中心淋巴瘤、边缘区b细胞淋巴瘤,或者为自体免疫疾病,包括类风湿关节炎、系统性红斑狼疮、强直性脊柱炎、银
屑病,等。
[0029]
与现有技术相比,本发明具有如下优点:
[0030]
将两种抑制剂联合应用的主要优势在于可通过互补协同作用实现“1+1>2”的治疗效果,而双靶点抑制剂不仅可以保证药物的治疗效果,同时也通过减少给药剂量,降低了药物-药物相互作用的风险,可以进一步提高安全性,因而本发明提供的具有pi3kδ/btk双靶点活性的化合物可以在制备预防或治疗因b细胞受体异常所引起的疾病的药物制剂中广泛应用。
附图说明
[0031]
图1为化合物cxy20、cxy23及cxy27的血药浓度-时间曲线图。
具体实施方式
[0032]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0033]
实施例1n-(2-(1-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)乙基)-4-氯-5-氟苯基)丙烯酰胺
[0034]
第一步:3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-4-胺
[0035]
向反应瓶中依次加入3-碘-1h-吡唑并[3,4-d]嘧啶-4-胺(20g,77mmol),3-氟-4-甲氧基硼酸(33g,192mmol)和碳酸钠(16g,153mmol),用n-甲基吡咯烷酮和水5:1的溶剂(216ml)溶解,氮气保护加入1,1'-双二苯基膦二茂铁二氯化钯(3g,4mmol),升温至100℃反应8h。向反应液中加入2l的水加热搅拌30min,抽滤得到黑色粗产品。粗产品加入n,n-二甲基甲酰胺(400ml)加热至50℃打浆1h后冷却抽滤得到棕色产品,收率91%。1h nmr(500mhz,dmso)δ13.54(s,1h),8.21(s,1h),7.61
–
7.39(m,2h),7.33(d,j=8.6hz,1h),6.79(s,2h),3.91(s,3h);esi-ms:m/z=260.01[m+h]
+
.
[0036]
第二步:3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-4-三苯基磷酰胺
[0037]
向反应瓶中依次加入3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-4-胺(20g,77mmol),三苯基氧膦(21g,77mmol)和三苯基膦(30g,116mmol),加入无水n,n-二甲基甲酰胺(200ml)溶解,氮气保护将其置于冰浴下,缓慢滴加偶氮二甲酸二异丙酯(23ml,116mmol)。滴毕室温搅拌30min后加入乙酸乙酯(400ml
×
2)和水(400ml)萃取,合并有机相,饱和食盐水洗涤(400ml),无水硫酸钠干燥,过滤后浓缩溶剂得到粗产品。经硅胶柱层析分离,置于真空干燥箱中60℃烘24h,得到白色粉末状固体33g,收率83%。1h nmr(500mhz,cdcl3)δ8.62(d,j=12.9hz,1h),8.16(s,2h),7.86(dd,j=12.2,7.8hz,6h),7.57(t,j=7.3hz,3h),7.48(t,j=7.5hz,6h),7.06(t,j=8.6hz,1h),4.00(s,3h);esi-ms:m/z=520.16[m+h]
+
.
[0038][0039]
第三步:2-乙酰基-4-氯-5-氟苯基三氟甲磺酸酯
[0040]
向反应瓶中加入1-(5-氯-4-氟-2-羟基苯基)乙-1-酮(3g,16mmol),溶于无水二氯甲烷(30ml),再加入三乙胺(3ml,24mmol),将反应瓶置于冰浴下,缓慢滴加三氟甲磺酸酐(3ml,21mmol),室温下搅拌1h后,向其中加入二氯甲烷(100ml
×
2)和水(200ml)萃取分液,合并有机相,饱和食盐水(200ml)洗涤,有机相用无水硫酸钠干燥,过滤并浓缩溶剂,经硅胶柱层析分离产物,得到浅黄色液体5g,收率98%。1h nmr(500mhz,cdcl3)δ7.93(d,j=7.8hz,1h),7.21(d,j=8.3hz,1h),2.64(s,3h);esi-ms:m/z=321.01[m+h]
+
.
[0041]
第四步:2-氨基-4-氟-5-氯苯乙酮
[0042]
依次向反应瓶中加入2-乙酰基-4-氯-5-氟苯基三氟甲磺酸酯(1g,3mmol)和二苯亚胺(785μl,5mmol),用甲苯(8ml)溶解,再向反应管中依次加入碳酸铯(2g,5mmol)、1,1
’‑
联萘-2,2
’‑
双二苯膦(291mg,0.5mmol)及三(二亚苄基丙酮)二钯(286mg,0.3mmol),氮气保护,80℃反应8h后向反应液中缓慢加入2n盐酸溶液(20ml),升温至60℃继续加热搅拌1h后反应液经硅藻土过滤,滤液调ph=8-10后萃取分液,有机相用水硫酸钠干燥,经硅胶柱层析分离得到黄色固体150mg收率:27%,si-ms:m/z=210.04[m+na]
+
.
[0043]
第五步:1-(2
’‑
氨基-4
’‑
氟-5
’‑
氯-苯基)-1-乙醇
[0044]
向反应瓶中加入2-氨基-4-氟-5-氯苯乙酮(900mg,5mmol),溶于无水甲醇(9ml)中,将反应瓶置于冰浴下缓慢加入硼氢化钠(91mg,2mmol),室温反应1h后,加水淬灭反应,旋蒸除去甲醇溶剂,加入二氯甲烷(150ml
×
2)和水(100ml)萃取分液,合并有机相,无水硫酸钠干燥,过滤后浓缩溶剂,经硅胶柱层析纯化后得到白色固体901mg,收率99%。1h nmr(500mhz,cdcl3)δ7.06(d,j=8.0hz,1h),6.43(d,j=10.7hz,1h),4.85(q,j=6.6hz,1h),
4.52(d,j=178.5hz,2h),1.56(d,j=6.6hz,3h);esi-ms:m/z=212.04[m+na]
+
.
[0045]
第六步:2-(1-(叔丁基二甲硅烷氧基))-4-氯-5-氟苯胺
[0046]
向反应瓶中加入1-(2
’‑
氨基-4
’‑
氟-5
’‑
氯-苯基)-1-乙醇(900mg,5mmol),溶于无水二氯甲烷(15ml),加入咪唑(647mg,10mmol)及叔丁基二甲基氯硅烷(859mg,6mmol),室温下反应8h后。加入二氯甲烷(100ml
×
2)和水(100ml)萃取分液,合并有机相,饱和食盐水(200ml)洗涤,无水硫酸钠干燥有机层,浓缩溶剂,硅胶柱层析纯化产品,得无色透明油状物1g,收率97%。1h nmr(400mhz,cdcl3)δ6.95(d,j=8.1hz,1h),6.43(d,j=10.8hz,1h),4.80(q,j=6.5hz,1h),4.52(s,2h),1.51(d,j=6.6hz,3h),0.92(s,9h),0.12(s,3h),0.02(s,3h);esi-ms:m/z=304.12[m+h]
+
.
[0047]
第七步:n-(2-(1-(叔丁基二甲硅烷氧基))乙基)-4-氯-5-氟苯基)丙烯酰胺
[0048]
向反应瓶中加入n-(2-(1-(叔丁基二甲硅烷氧基))乙基)-4-氯-5-氟苯基)丙烯酰胺(1g,5mmol)、丙烯酸(459μl,7mmol),溶于无水二氯甲烷(30ml),再加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(2g,9mmol),冰浴下搅拌30min后,加入二氯甲烷(100ml
×
2)和水(100ml)萃取分液,合并有机相,饱和食盐水(200ml)洗涤,无水硫酸钠干燥有机层,浓缩溶剂,硅胶柱层析纯化产品,得无色透明油状物1g,收率74%。1h nmr(400mhz,cdcl3)δ9.77(s,1h),8.44(d,j=11.6hz,1h),7.05(d,j=7.7hz,1h),6.44(d,j=16.9hz,1h),6.21(dd,j=17.0,10.3hz,1h),5.83(d,j=10.4hz,1h),4.89(q,j=6.6hz,1h),1.52(d,j=6.6hz,3h),0.93(s,9h),0.17(s,3h),0.07(s,3h);esi-ms:m/z=358.13[m+h]
+
[0049]
第八步:n-(4-氯-5-氟-2-(1-羟乙基)苯基)丙烯酰胺
[0050]
向反应瓶中加入n-(2-(1-(叔丁基二甲硅烷氧基))乙基)-4-氯-5-氟苯基)丙烯酰胺(1g,3mmol),溶于无水四氢呋喃(10ml)中,冰浴下向瓶中滴加四丁基氟化铵的四氢呋喃溶液(3ml,32mmol),滴毕置于室温搅拌3h。浓缩除去四氢呋喃,加入乙酸乙酯(100ml
×
2)和水(100ml)萃取分液,合并有机相,用饱和食盐水(200ml)洗涤,无水硫酸钠干燥有机层,浓缩溶剂,硅胶柱层析纯化产品,得白色固体580mg,收率74%。1h nmr(400mhz,cdcl3)δ9.51(s,1h),8.28(d,j=11.4hz,1h),7.12(d,j=7.8hz,1h),6.38(d,j=16.1hz,1h),6.22(dd,j=17.0,10.2hz,1h),5.79(d,j=9.3hz,1h),4.95(q,j=6.4hz,1h),2.70(s,1h),1.57(d,j=6.7hz,3h);esi-ms:m/z=244.05[m+h]
+
.
[0051]
第九步:n-(4-氯-5-氟-2-(1-(3-(3-氟-4-甲氧基苯基)-4-((三苯基-15-亚膦基)氨基)-1h-吡唑并[3,4-d]嘧啶-1-基)乙基)苯基)丙烯酰胺
[0052]
向反应瓶中加入3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-4-三苯基磷酰胺(213mg,0.4mmol),n-(4-氯-5-氟-2-(1-羟乙基)苯基)丙烯酰胺(100mg,0.4mmol),三苯基膦(161mg,0.6mmol),溶于无水四氢呋喃(4ml)中,冰浴下缓慢滴加偶氮二甲酸二异丙酯(121μl,0.6mmol),室温搅拌20min后,加入适量水淬灭反应,旋蒸除去四氢呋喃,再加入二氯甲烷(100ml
×
2)和水(100ml)萃取分液,合并有机相,饱和食盐水(200ml)洗涤,无水硫酸钠干燥有机层,浓缩溶剂,硅胶柱层析纯化产品,得到白色固体190mg。esi-ms:m/z=745.19[m+h]
+
.
[0053]
第十步:n-(2-(1-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)乙基)-4-氯-5-氟苯基)丙烯酰胺
[0054]
向反应瓶中加入n-(4-氯-5-氟-2-(1-羟乙基)苯基)丙烯酰胺(190mg,0.3mmol),
冰醋酸(2ml,0.04mmol),再加入同体积比的水(2ml),加热至70℃反应5h后,加入饱和碳酸氢钠溶液,中和反应液,调至ph至中性,用二氯甲烷(100ml
×
2)和水(100ml)萃取分液,合并有机相,饱和食盐水(200ml)洗涤,无水硫酸钠干燥有机层,浓缩溶剂,硅胶柱层析纯化产品,得到白色粉末状固体90mg,收率72%。1h nmr(400mhz,cdcl3)δ12.07(s,1h),8.31(s,1h),7.77(d,j=10.8hz,1h),7.42(d,j=7.5hz,1h),7.36(d,j=11.6hz,1h),7.31(d,j=8.5hz,1h),7.03(t,j=8.5hz,1h),6.68(dd,j=17.0,10.2hz,1h),6.53(d,j=17.0hz,1h),6.40(q,j=7.2hz,1h),6.30(s,1h),5.96(s,1h),5.79(d,j=10.2hz,1h),4.05(q,j=7.1hz,1h),3.88(s,3h),1.98(d,j=4.2hz,3h);
13
c nmr(101mhz,cdcl3)δ164.11,156.70,152.90,150.43,149.88,147.26,146.96,141.44,136.04,130.52,127.19,126.53,125.53,125.08,123.24,116.70,115.27,115.08,113.42,113.10,97.09,55.34,51.03,18.57;esi-ms:m/z=485.12[m+h]
+
.
[0055]
实施例2 n-(2-(1-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)乙基)苯基)丙烯酰胺
[0056][0057]
第一步:1-(2-氨基苯基)乙醇
[0058]
参考实施例1第5步反应操作。1h nmr(500mhz,cdcl3)δ7.11(t,j=6.7hz,2h),6.75(t,j=7.5hz,1h),6.70(d,j=8.2hz,1h),4.95(q,j=6.6hz,1h),3.18(s,3h),1.61(d,j=6.6hz,3h).
[0059]
第二步:2-(1-((叔丁基二甲基甲硅烷基)氧基)乙基)苯胺
[0060]
参考实施例1第6步反应操作。1h nmr(400mhz,cdcl3)δ6.94(t,j=8.3hz,1h),6.84(d,j=7.4hz,1h),6.55(dd,j=14.2,7.6hz,2h),4.75(q,j=6.5hz,1h),1.41(d,j=6.6hz,3h),0.80(d,j=13.1hz,9h),0.14
–
0.09(m,3h),0.08
–
0.01(m,3h);esi-ms:m/z=252.17[m+h]
+
.
[0061]
第三步:n-(2-(1-((叔丁基二甲基甲硅烷基)氧基)乙基)苯基)丙烯酰胺
[0062]
参考实施例1第7步反应操作。1h nmr(500mhz,cdcl3)δ9.65(s,1h),8.42(d,j=8.1hz,1h),7.30(d,j=2.7hz,1h),7.02(d,j=6.1hz,2h),6.41(d,j=18.0hz,1h),6.23(dd,j=17.0,10.3hz,1h),5.76(d,j=11.4hz,1h),4.93(q,j=6.6hz,1h),1.51(d,j=
6.6hz,3h),0.91(s,9h),0.14(s,3h),0.02(s,3h);esi-ms:m/z=306.18[m+h]
+
.
[0063]
第四步:n-(2-(1-羟乙基)苯基)丙烯酰胺
[0064]
参考实施例1第8步反应操作。1h nmr(500mhz,cdcl3)δ9.40(s,1h),8.21(d,j=7.8hz,1h),7.30(d,j=8.4hz,1h),7.14(d,j=7.3hz,1h),7.08(t,j=7.4hz,1h),6.36(d,j=16.9hz,1h),6.25(dd,j=17.0,10.2hz,1h),5.74(d,j=10.3hz,1h),4.99(q,j=6.6hz,1h),3.06(s,1h),1.57(d,j=6.7hz,3h);esi-ms:m/z=214.07[m+na]
+
.
[0065]
第五步:n-(2-(1-(3-(3-氟-4-甲氧基苯基)-4-((三苯基-15-亚膦基)氨基)-1h-吡唑并[3,4-d]嘧啶-1-基)乙基)苯基)丙烯酰胺
[0066]
参考实施例1第9步反应操作。esi-ms:m/z=693.25[m+h]
+
.
[0067]
第六步:n-(2-(1-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)乙基)苯基)丙烯酰胺
[0068]
参考实施例1第10步反应操作。1h nmr(400mhz,cdcl3)δ11.73(s,1h),8.38(s,1h),7.82(d,j=7.8hz,1h),7.50(d,j=7.6hz,1h),7.41(d,j=11.7hz,1h),7.34(t,j=7.6hz,2h),7.19(t,j=7.3hz,1h),7.07(t,j=8.3hz,1h),6.71(dd,j=16.8,10.2hz,1h),6.59
–
6.49(m,2h),5.76(d,j=10.2hz,1h),3.92(s,3h),2.04(d,j=6.8hz,3h);
13
c nmr(101mhz,cdcl3)δ165.17,157.88,153.85,150.95,148.15,147.69,142.96,136.46,131.89,130.74,129.71,127.34,126.76,125.84,125.72,124.26,116.30,116.09,114.04,98.12,56.33,52.89,19.62;esi-ms:m/z=433.17[m+h]
+
.
[0069]
实施例3 n-(2-(1-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)乙基)苯基)甲基丙烯酰胺
[0070][0071]
参考实施例2的过程。1h nmr(400mhz,cdcl3)δ11.25(s,1h),8.40(s,1h),7.65(d,j=7.8hz,2h),7.49
–
7.41(m,2h),7.39(d,j=5.9hz,1h),7.36(s,1h),7.25
–
7.19(m,1h),7.08(t,j=8.3hz,1h),6.52(d,j=6.8hz,1h),6.29(s,1h),5.58(s,1h),4.97(dd,j=14.7,6.9hz,1h),3.93(s,2h),2.14(s,2h),2.08(s,2h);
13
c nmr(101mhz,cdcl3)δ165.17,157.88,153.85,150.95,148.15,147.69,142.96,136.46,131.89,130.74,129.71,127.34,126.76,125.84,125.72,124.26,116.30,116.09,114.04,98.12,56.33,52.89,29.73,19.62;esi-ms:m/z=447.09[m+h]
+
.
[0072]
实施例4 n-(3-(1-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)乙基)苯基)丙烯酰胺
[0073][0074]
参考实施例2的过程。1h nmr(400mhz,cdcl3)δ9.36(s,1h),8.13(s,1h),8.00(s,1h),7.26
–
7.16(m,2h),7.10(d,j=7.9hz,1h),7.01(s,1h),6.80(d,j=7.1hz,1h),6.34(s,2h),5.60(s,1h),5.44(q,j=6.6hz,1h),3.92(s,3h),1.86(d,j=4.8hz,3h);
13
c nmr(101mhz,cdcl3)δ177.07,164.22,159.42,158.05,155.17,153.26,149.43,141.70,139.22,135.88,131.48,129.22,127.30,126.79,126.27,121.65,119.76,117.34,113.97,100.40,59.11,56.26,22.10;esi-ms:m/z=433.06[m+h]
+
.
[0075]
实施例5 n-(3-(1-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)乙基)苯基)甲基丙烯酰胺
[0076][0077]
参考实施例2的过程。1h nmr(400mhz,cdcl3)δ8.29(s,1h),8.05(d,j=18.0hz,1h),7.80(s,1h),7.41(s,1h),7.23
–
7.03(m,2h),6.90(s,1h),5.80(s,2h),5.47(s,1h),5.43(s,1h),3.97(s,4h),2.03(s,4h),1.94(d,j=6.4hz,3h);
13
c nmr(101mhz,cdcl3)δ165.17,157.88,153.85,150.95,148.15,147.69,142.96,136.46,131.89,130.74,129.71,127.34,126.76,125.84,125.72,124.26,116.30,116.09,114.04,98.12,56.33,52.89,29.73,19.62;esi-ms:m/z=447.07[m+h]
+
.
[0078]
实施例6 1-(3-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)哌啶-1-基)丙-2-烯-1-酮
[0079][0080]
第一步:3-(3-(3-氟-4-甲氧基苯基)-4-((三苯基-l5-亚膦基)氨基)-1h-吡唑并[3,4-d]嘧啶-1-基)哌啶-1-羧酸叔丁酯
[0081]
向反应瓶中依次加入3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-4-三苯基磷酰胺(2g,3mmol),n-boc-3-羟基哌啶(2g,9mmol)和三苯基膦(2g,6mmol),加入无水四氢呋喃溶解原料,冰浴下缓慢滴加偶氮二甲酸二异丙酯(1ml,6mmol),室温搅拌30min。反应完全后加水淬灭反应液,旋蒸除去四氢呋喃,加入二氯甲烷(200ml
×
2)和水(200ml)萃取,合
并有机相,用饱和食盐水(300ml)洗涤,无水硫酸钠干燥,过滤后浓缩溶剂,再经过硅胶柱层析分离得到白色固体2g。收率:94%。m/z=703.16[m+h]
+
.
[0082]
第二步:1-(3-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)哌啶-1-基)丙-2-烯-1-酮
[0083]
向反应瓶中加入3-(3-(3-氟-4-甲氧基苯基)-4-((三苯基-l5-亚膦基)氨基)-1h-吡唑并[3,4-d]嘧啶-1-基)哌啶-1-羧酸叔丁酯(2g,3mmol),4m hcl的二氧六环溶液(3ml,13mmol),置于70℃加热反应5h。浓缩溶剂,加入甲基叔丁基醚打浆,抽滤,得类白色固体2g加入至反应瓶中,同时加入无水二氯甲烷(10ml),三乙胺(553μl,4mmol),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(766mg,4mmol),冰浴下缓慢滴加丙烯酸(180μl,2mmol),滴毕室温搅拌8h后,加入二氯甲烷(100ml
×
2)和水(100ml)萃取,合并有机相,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤后浓缩溶剂,经硅胶柱层析分离产物,得到白色固体156mg,收率30%。1h nmr(400mhz,cdcl3)δ8.34(d,j=24.5hz,1h),7.50
–
7.38(m,2h),7.13(t,j=8.4hz,1h),6.69
–
6.52(m,1h),6.30(dd,j=16.2,11.7hz,1h),5.79(s,2h),5.70(d,j=15.9hz,1h),4.90(s,1h),4.86
–
4.52(m,1h),4.12(dd,j=61.7,13.1hz,1h),3.97(s,3h),3.56(t,j=12.5hz,1h),2.89(t,j=11.7hz,1h),2.44
–
2.30(m,1h),2.26(s,1h),2.00(d,j=13.8hz,1h),1.72(d,j=1.8hz,1h);
13
c nmr(101mhz,cdcl3)δ165.75,157.75,155.72,155.58,153.89,151.42,148.58,143.22,128.16,127.59,124.44,116.49,116.30,113.97,98.39,56.40,50.02,45.94,42.17,25.29,23.92;esi-ms:m/z=397.17[m+h]
+
.
[0084]
实施例7 1-(3-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)哌啶-1-基)-2-甲基丙-2-烯-1-酮
[0085][0086]
参考实施例6的过程。1h nmr(400mhz,cdcl3)δ8.29(s,1h),7.41(dd,j=14.7,10.2hz,2h),7.11(t,j=8.4hz,1h),5.89(s,2h),5.15(s,1h),5.07(s,1h),4.83(s,1h),4.58(s,1h),4.09(d,j=71.0hz,1h),3.95(s,3h),3.52(s,1h),2.97(s 1h),2.31(s,1h),2.22(d,j=9.9hz,1h),2.00(s,1h),1.95(s,3h),1.69(s,1h);
13
c nmr(101mhz,cdcl3)δ171.49,157.90,155.77,153.87,151.40,148.50,143.19,140.40,126.02,124.44,116.59,116.30,115.48,113.95,98.41,56.39,53.39,45.55,41.34,26.96,20.58;esi-ms:m/z=411.19[m+h]
+
.
[0087]
实施例8 1-(3-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)哌啶-1-基)-2-氟丙-2烯-1-酮
[0088][0089]
参考实施例6的过程。1h nmr(400mhz,cdcl3)δ8.33(s,1h),7.44(dd,j=14.7,10.2hz,2h),7.13(t,j=8.4hz,1h),5.99(s,1h),5.26(d,j=3.3hz,1h),5.12(s,1h),4.98
–
4.85(m,1h),4.59(d,j=85.0hz,1h),3.97(s,3h),3.89(d,j=67.5hz,4h),3.34(d,j=95.9hz,1h),2.76(d,j=47.2hz,1h),2.42
–
2.30(m,1h),2.25(d,j=12.9hz,1h),2.02(d,j=14.5hz,2h),1.77(d,j=13.1hz,1h);
13
c nmr(101mhz,cdcl3)δ171.24,161.59,161.29,157.84,155.60,153.88,151.41,148.65,143.36,125.86,124.42,116.48,116.29,113.97,98.40,60.44,56.39,42.56,30.26,21.10,14.21;esi-ms:m/z=415.16[m+h]
+
.
[0090]
实施例9 1-(4-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)哌啶-1-基)丙-2-烯-1-酮
[0091][0092]
参考实施例6的过程。1h nmr(400mhz,cdcl3)δ8.27(s,1h),7.34(t,j=10.7hz,2h),7.04(t,j=8.4hz,1h),6.59
–
6.47(m,1h),6.21(d,j=16.8hz,1h),5.63(d,j=10.6hz,1h),4.95(dd,j=9.8,5.7hz,1h),4.74(d,j=11.5hz,1h),4.11(d,j=12.2hz,1h),3.88(s,3h),3.25(t,j=9.0hz,1h),2.84(t,j=12.1hz,1h),2.24(d,j=11.9hz,2h),2.02(d,j=10.5hz,2h);
13
c nmr(101mhz,cdcl3)δ174.77,165.51,158.00,155.67,153.85,151.36,148.48,146.57,143.03,127.74,124.43,116.44,113.99,98.46,56.38,53.85,45.01,41.25,31.77,31.07;esi-ms:m/z=397.09[m+h]
+
.
[0093]
实施例10 1-(4-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)哌啶-1-基)-2-甲基丙-2-烯-1-酮
[0094][0095]
参考实施例6的过程。1h nmr(400mhz,dmso)δ8.26(s,1h),7.75(d,j=6.1hz,1h),7.49(t,j=10.0hz,3h),7.36(t,j=8.6hz,1h),6.87(s,1h),5.68(s,1h),5.35(s,1h),4.78(s,1h),3.94(s,5h),2.53(s,6h),2.35(dd,j=19.1,9.3hz,3h),1.97(s,3h),1.89(s,4h);
13
c nmr(101mhz,dmso)δ168.28,158.61,155.82,154.10,153.24,150.81,147.96,
142.27,140.80,126.43,125.31,119.12,116.41,116.22,114.81,97.88,56.58,54.03,45.42,28.53,27.73,19.63;esi-ms:m/z=425.20[m+h]
+
.
[0096]
实施例11 1-(3-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)吡咯烷-1-基)丙-2-烯-1-酮
[0097][0098]
参考实施例6的过程。1h nmr(400mhz,cdcl3)δ8.37(d,j=2.8hz,1h),7.42(dt,j=14.3,7.1hz,2h),7.12(t,j=8.3hz,1h),6.43
–
6.41(m,1h),5.79
–
5.69(m,2h),5.57(dd,j=12.2,6.3hz,1h),4.14
–
4.08(m,1h),3.97(s,3h),3.79(d,j=9.1hz,1h),3.31
–
3.20(m,1h),2.74
–
2.51(m,2h);
13
c nmr(101mhz,cdcl3)δ164.63,157.83,155.97,154.60,153.86,151.37,148.71,143.48,128.33,128.11,124.46,116.43,113.93,98.66,56.40,55.63,50.59,31.52,29.62;esi-ms:m/z=405.05[m+na]
+
.
[0099]
实施例12 1-(3-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)吡咯烷-1-基)-2-甲基丙-2-烯-1-酮
[0100][0101]
参考实施例6的过程。1h nmr(400mhz,cdcl3)δ8.37(s,1h),7.41(t,j=16.0hz,2h),7.13(d,j=7.8hz,1h),5.64(d,j=27.7hz,2h),5.18(t,j=15.2hz,2h),3.97(s,3h),3.72(s,2h),3.28(s,1h),2.26(s,3h),1.97(d,j=15.2hz,5h);
13
c nmr(101mhz,cdcl3)δ171.04,157.76,155.94,154.55,142.10,141.41,139.09,124.44,122.07,116.72,116.40,115.27,113.98,98.62,56.39,52.56,44.70,44.12,26.01,19.94;esi-ms:m/z=397.09[m+h]
+
.
[0102]
实施例13 n-(4-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)环己基)丙烯酰胺
[0103][0104]
参考实施例6的过程。1h nmr(400mhz,dmso)δ8.24(s,1h),7.46(t,j=9.6hz,2h),7.34(t,j=8.5hz,1h),6.43(dd,j=16.9,10.2hz,1h),6.11(d,j=17.0hz,1h),5.58(d,j=10.0hz,1h),4.75(s,1h),3.98(s,1h),3.92(s,3h),2.51(s,4h),2.25(d,j=10.6hz,2h),1.89(s,2h);
13
c nmr(101mhz,dmso)δ164.58,158.62,155.93,153.98,153.18,150.75,
147.95,142.48,132.41,126.24,125.37,116.24,114.72,97.80,56.48,54.32,44.34,28.97,27.44;esi-ms:m/z=411.09[m+h]
+
.
[0105]
实施例14 n-(4-(4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)环己基)甲基丙烯酰胺
[0106][0107]
参考实施例6的过程。1h nmr(400mhz,dmso)δ8.26(s,1h),7.75(d,j=6.1hz,1h),7.49(t,j=10.0hz,3h),7.36(t,j=8.6hz,1h),6.87(s,1h),5.68(s,1h),5.35(s,1h),4.78(s,1h),3.94(s,5h),2.53(s,6h),2.35(dd,j=19.1,9.3hz,3h),1.97(s,3h),1.89(s,4h);
13
c nmr(101mhz,dmso)δ168.28,158.61,155.82,154.10,153.24,150.81,147.96,142.27,140.80,126.43,125.31,119.12,116.41,116.22,114.81,97.88,56.58,54.03,45.42,28.53,27.73,19.63;esi-ms:m/z=425.20[m+h]
+
.
[0108]
实施例15 1-(4-((4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)甲基)哌啶-1-基)prop-2烯-1-酮
[0109][0110]
参考实施例6的过程。1h nmr(400mhz,cdcl3)δ8.36(s,1h),7.55
–
7.39(m,2h),7.13(t,j=8.4hz,1h),6.56(dd,j=16.8,10.6hz,1h),6.24(d,j=16.8hz,1h),5.81(s,2h),5.66(d,j=10.5hz,1h),4.67(d,j=12.5hz,1h),4.34(d,j=7.0hz,2h),3.97(s,3h),3.03(t,j=12.1hz,1h),2.69
–
2.58(m,1h),2.34(s,2h),1.70(s,2h),1.37
–
1.27(m,2h);
13
c nmr(101mhz,cdcl3)δ165.43,157.88,156.00,154.80,151.42,148.52,143.13,127.85,127.52,124.44,116.54,114.00,98.16,56.40,51.94,45.62,41.82,36.86,30.47,29.35;esi-ms:m/z=411.09[m+h]
+
.
[0111]
实施例16 1-(2-((4-氨基-3-(3-氟-4-甲氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)甲基)吡咯烷-1-基)丙-2烯-1-酮
[0112][0113]
参考实施例6的过程。1h nmr(400mhz,cdcl3)δ8.30(d,j=8.4hz,1h),7.42
–
7.30(m,2h),7.05(dd,j=17.9,8.4hz,1h),6.61(dd,j=16.6,10.3hz,1h),6.38
–
6.31(m,2h),
5.74(d,j=10.4hz,1h),5.62(dd,j=8.8,3.5hz,1h),4.61(dd,j=15.4,5.5hz,1h),4.36(t,j=6.6hz,1h),3.90(d,j=3.8hz,3h),3.43(dd,j=7.9,5.1hz,1h),3.24(td,j=12.5,6.3hz,1h),2.51
–
2.45(m,1h),2.30(t,j=6.7hz,1h),2.20(s,2h),1.96(d,j=7.5hz,1h);
13
c nmr(101mhz,cdcl3)δ163.95,163.55,156.68,155.30,155.02,129.88,128.64,127.89,127.01,126.85,123.42,115.44,113.00,97.18,55.34,46.82,43.78,34.43,26.41,22.77;esi-ms:m/z=397.09[m+h]
+
.
[0114]
实施例17盐酸盐的制备(以实施例12的化合物为例)
[0115]
取化合物适量,溶解于乙醇中,室温下慢慢通入hcl气体至饱和。冰浴冷却,慢慢析出白色晶体,为化合物的盐酸盐。
[0116]
实施例18激酶抑制实验
[0117]
一、pi3kδ激酶抑制活性的测定
[0118]
pi3kδ激酶的抑制活性采用adp-glo方法检测:
[0119]
实验过程:各孔加入配制2.5μl的2倍终浓度的激酶溶液,1000rpm离心30s,振荡混匀后室温孵育10min。再加入2.5μl的2倍终浓度的atp和底物的混合溶液,离心30s,振荡混匀后室温开始反应。加入5μl adp-glo reagent,离心30s,振荡混匀后室温孵育180min。加入10μl kinase detection reagent,离心,振荡混匀后室温孵育30min。最后用酶标仪读取发光值rlu。
[0120]
二、btk激酶抑制活性的测定
[0121]
btk激酶的抑制活性采用mobility shift assay方法检测:
[0122]
实验过程:在各孔中加入10μl的2.5倍终浓度的激酶溶液,1000rpm离心30s,反应板振荡混匀后室温孵育10min。加入15μl的25/15倍终浓度的atp和底物的混合溶液,离心30s,振荡混匀后室温开始反应。加入30μl终止检测液停止激酶反应,1000rpm离心30s,振荡混匀。用酶标仪读取转化率。
[0123]
三、结果如下:
[0124]
表1.目标化合物对pi3kδ及btk激酶的抑制活性
[0125]
[0126][0127]
(注:na表示未考察活性;*表示阳性药已公布的活性数据,未实测)
[0128]
可以发现:该系列化合物对于pi3kδ的抑制活性普遍较好,最高可达到9.0nm,对于btk抑制活性最高也可达到19.5nm,其中化合物cxy20、cxy23及cxy27都具有不错的pi3kδ/btk激酶双重抑制活性。
[0129]
实施例19细胞水平抑制活性的测定
[0130]
细胞接种:向下旋转悬浮细胞,在培养基中重悬,然后用细胞计数器计数。在培养基中稀释细胞悬液至所需密度。根据培养皿图将100μl细胞接种到96孔培养皿中。medium only用作背景控制(min),37℃孵育过夜。
[0131]
样品配制:用dmso配制200
×
的溶液,用培养基稀释化合物至3倍终浓度。向细胞中加入50μl样品,37℃,5%co2孵育72h。
[0132]
结果测定:在测量前将实验板平衡到室温,每孔加入40μl在轨道摇床上混合内容物2min,诱导细胞裂解。室温孵育60min,酶标仪读取发光值。
[0133]
结果如下:
[0134]
表2.目标化合物20,23及27对肿瘤细胞的抑制活性
[0135][0136]
可见:虽然在激酶水平上化合物cxy20、cxy23及cxy27比阳性药物ibrutinib的抑制活性低(由表1可见,约低40倍以上),但本实验的细胞抑制活性却与阳性药相近,甚至更高。在mino细胞中,化合物cxy20、23未显示出较好的抑制活性,但化合物cxy27比单一阳性对照的效果略好;在jeko-1和h9两个细胞系中,化合物cxy27表现出优于阳性药单独给药及协同给药的抑制效果,其ic
50
分别为1.6μm和10.8μm。这说明我们设计的双靶点抑制剂确实存在着协同抑制两个靶点的作用。
[0137]
而化合物cxy20虽然具有较好的激酶抑制活性,但是细胞活性并不突出,可能是由于其理化性质不佳,透膜性不好引起的。因此,我们进一步考察目标化合物在大鼠体内的代谢情况。
[0138]
实施例20药物体内代谢性质的测定
[0139]
sprague-dawley雄性大鼠9只,分为3组,每组3只,给药前禁食8h以上。分别取化合物cxy20、23及27各10mg,加入dmso、hs15及生理盐水配制成1mg/ml的溶液。3组大鼠分别灌胃给予10mg/kg化合物(a-c组)。于给药前(t0)及给药后15min、30min、1h、2h、4h、6h、8h、12h、24h眼眶取血0.2~0.25ml,加入至含有20μl抗凝剂edta-2na的离心管中,在30min内离心(4000rpm,10min)后分离得到血浆,取50μl血浆储存于-20℃冰箱。
[0140]
样品处理及测定方法:将化合物20,23及27配制成1mg/ml的储备液,梯度稀释至浓度为1000、500、250、100、50、25、10、5、2.5ng/ml的工作液待用。50μl血浆样品中加入200μl含氯雷他定的色谱乙腈溶液,涡旋2-3min,离心(14000rpm,10min)后取200μl上清液于内衬管中,对所有血浆样品进行检测。
[0141]
色谱条件:进样体积:1μl;色谱柱型号:poroshell 120ec-c18(2.1
×
50mm,1.9μm);进样室温度:8℃;柱温箱温度:37℃;流动相a为水(0.1%甲酸水),流动相b为乙腈,流速为0.4ml/min,梯度洗脱。
[0142]
a、b、c三组样品分别制备一条标准曲线,同时分别制备低、中、高3个浓度(化合物浓度分别为5、100、500ng/ml)随行质控样品进行检测。最后根据标准曲线计算给药后大鼠
血浆样品中的待测药物浓度。药代动力学参数均使用phoenix winnonlin软件(version 6.3,pharsight inc.,usa)中非房室模型进行拟合计算。
[0143]
检测sd大鼠口服给药(dose:10mg/kg)后24h内待测化合物的血药浓度,取血时间分别为0.25,0.5,1,2,4,6,8,12,24h,再通过phoenix winnonlin软件计算药代动力学参数,结果如表3所示:
[0144]
表3.化合物cxy20、23及27的主要药代动力学参数
[0145][0146]
(*表示非同一次实验所测得的数据)
[0147]
通过检测化合物cxy20、23及27在大鼠体内的血药浓度,可以得到这些化合物的吸收、分布及消除的相关药动学性质。化合物cxy20、23和27在0.25~0.33h之间很快达到c
max
,峰值浓度分别为80.89
±
15.76,316.51
±
138.39,365.65
±
128.00ng
·
ml-1
,auc
0-∞
分别为175.13
±
79.73,393.48
±
77.98,551.42
±
262.85h
·
ng
·
ml-1
,表明化合物23和27的暴露水平普遍高于化合物20。化合物20,23及27的表观分布容积分别为675.97
±
635.07,166.56
±
12.97,161.03
±
135.33l
·
kg-1
,表明化合物20在体内分布范围较广。目标化合物的半衰期在4~6h之间,血浆清除率分别为64.12
±
23.13,26.03
±
4.68,22.07
±
12.73l
·
h-1
·
kg-1
。目标化合物的药代动力学参数都存在较大的个体差异。
[0148]
三个目标化合物在0.25~0.33h就很快达到峰值浓度,该结果与阳性药ibrutinib一致,说明这些化合物吸收速率很快,由此引发两点讨论:
①
吸收相的时间点设计太稀松,应再增加5min,45min的采样点,才可拟合出吸收相的曲线。
②
该类化合物本身的性质确实吸收很快,可以通过缓释剂型使药物释放更稳定。
[0149]
从药物吸收的角度来看,化合物27的暴露水平更高,且与阳性药ibrutinib相近。而化合物20的c
max
较低,吸收较差,鉴于其对激酶和细胞抑制活性较高,可以通过改变药物性质、改变药物剂型或改变给药方式等途径来增加该化合物的吸收,从而达到更好的药效,这将是后期我们可以进行研究的部分。从药物消除的角度来看,化合物27的消除速率比ibrutinib更慢。因此通过该单次给药实验,可以初步判断化合物27的暴露水平更高,消除速率更慢,具有更长的药物作用时间,具有进一步开发的潜力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1