一种靶向DDX24蛋白的水解靶向嵌合体及其应用
ala-tyr-gln-arg-ala短肽是利用细菌展示文库通过磁珠筛选技术和荧光激活细胞分选技术筛选获得,leu-thr(p)-phe-glu-his-tyr-trp-ala-gln-leu-thr-ser(p),(p为磷酸化修饰)为基于文献(hu, gilkes et al. 2007, cancer res 67(18): 8810-8817)的修饰序列,还涉及以上述氨基酸序列为基础的衍生序列或修饰序列。接头为以ahx为代表的包含6个碳原子的支链或非支链、环状或非环状、饱和或不饱和链的氨基酸连接部分,ala-leu-ala-pro-tyr-ile-pro为e3泛素连接酶vhl的配体。r2为细胞穿透肽。r2序列是arg
d-arg-arg
d-arg-arg
d-arg-arg-arg或arg-arg-arg-arg-arg-arg-arg-arg(argd指d构型精氨酸,arg指l构型精氨酸)等,还涉及以上述氨基酸序列为基础的不同位置arg的d构型或l构型变换序列。
6.本发明基于我们前期细菌表面展示文库筛选获得的靶向ddx24多肽分子thr-val-cys-thr-trp-tyr-cys-tyr-cys-ala-ala-tyr-gln-arg-ala及修饰序列leu-thr(p)-phe-glu-his-tyr-trp-ala-gln-leu-thr-ser(p),(p为磷酸化修饰),而开发的新型靶向ddx24蛋白的protac降解剂。该靶向肽利用连接基团连接e3泛素连接酶配体以及尾端连接细胞穿膜肽,通过靶向结合核仁蛋白ddx24,以剂量依赖性和时间依赖性的方式有效诱导各种癌细胞系中ddx24的降解,从而抑制肿瘤细胞增殖,动物活体实验亦表现出有效抑制肿瘤生长的作用。
附图说明
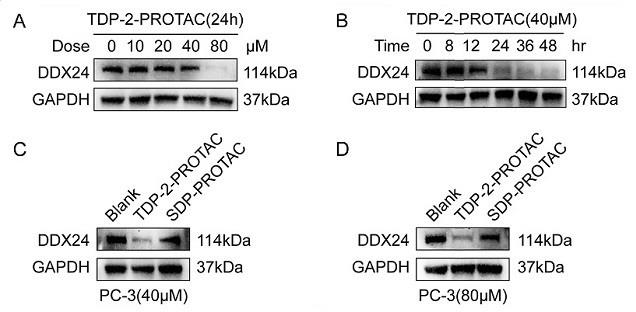
7.图1:a不同浓度tdp-2-protac多肽与pc-3细胞孵育24h后ddx24蛋白降解的免疫印迹结果;b相同浓度tdp-2-protac多肽与pc-3细胞孵育不同时间后ddx24蛋白降解的免疫印迹结果;c阴性对照、40μm tdp-2-protac和sdp-protac处理pc-3细胞24h后ddx24蛋白降解的免疫印迹结果;d阴性对照、80μm tdp-2-protac和sdp-protac处理pc-3细胞24h后蛋白降解的免疫印迹结果。
8.图2:a不同浓度tdp-2-protac多肽与ec109细胞孵育24h后ddx24蛋白降解的免疫印迹结果;b相同浓度tdp-2-protac多肽与ec109细胞孵育不同时间后ddx24蛋白降解的免疫印迹结果。
9.图3:pc-3细胞与pbs、fitc标记的不同多肽孵育24h后,多肽与ddx24抗体染色的免疫荧光共定位结果(比例尺20μm)。
10.图4:阴性对照、不同浓度tdp-2-protac和sdp-protac处理pc-3细胞24h后对细胞增殖的抑制情况。
11.图5:pc-3荷瘤鼠瘤内注射pbs和不同多肽后肿瘤生长情况及离体标本分析。a药物注射抑瘤治疗示意图;b不同处理组荷瘤鼠皮下瘤生长曲线图;c不同处理组荷瘤鼠第24天典型照片(箭头所示为肿瘤);d不同处理组治疗期间的荷瘤鼠体重曲线;e不同处理组解剖后具有代表性的肿瘤图像;f不同处理组移植瘤称重比较。
12.图6:不同处理组pc-3荷瘤鼠肿瘤的葡萄糖摄取差异。a不同处理组pc-3荷瘤鼠肿瘤
18
f-fdg pet/ct显像典型图(虚线圈所示为右后腿肿瘤)。tdp-2-protac组与其他组比较18f-fdg摄取指标suv(b)和ki(c)采用单因素方差分析具有统计学差异,* p 《 0.05,** p 《 0.01,*** p 《 0.001。
具体实施方式
13.为详细说明本发明的技术内容、构造特征、所实现目的及效果,以下结合实施方式详细予以说明,这并不限制本发明的保护范围。
14.本发明实施例为:针对目标蛋白水解靶向嵌合体(tdp-2-protac),设计两个对照多肽,分别是无e3泛素连接酶配体的单纯靶向结合ddx24多肽(tdp-2),无靶向ddx24能力的乱序protacd多肽(sdp-protac),多肽序列如下:1. thr-val-cys-thr-trp-tyr-cys-tyr-cys-ala-ala-tyr-gln-arg-ala-arg
d-arg-arg
d-arg-arg
d-arg-arg-arg (靶向肽,简称tdp-2);2. thr-val-cys-thr-trp-tyr-cys-tyr-cys-ala-ala-tyr-gln-arg-ala-ahx-ala-leu-ala-pro-tyr-ile-pro-arg
d-arg-arg
d-arg-arg
d-arg-arg-arg (实验肽,简称tdp-2-protac);3. trp-val-cys-ala-arg-ala-gln-tyr-ala-tyr-thr-cys-cys-thr-tyr-ahx-ala-leu-ala-pro-tyr-ile-pro-arg
d-arg-arg
d-arg-arg
d-arg-arg-arg (乱序肽,简称sdp-protac)其中序列(thr-val-cys-thr-trp-tyr-cys-tyr-cys-ala-ala-tyr-gln-arg-ala)是利用细菌展示文库通过磁珠筛选技术和荧光激活细胞分选技术筛选获得。ahx为linker,ala-leu-ala-pro-tyr-ile-pro为e3泛素连接酶配体vhl;arg
d-arg-arg
d-arg-arg
d-arg-arg-arg为细胞穿膜肽(argd指d构型精氨酸,arg指l构型精氨酸)。
15.具体实施方式1为了测试tdp-2-protac的效果,发明人对不同浓度该多肽在pc-3和ec109细胞中的作用进行实验测试。
16.具体实验方法如下:6孔板接种pc-3和ec109细胞24h,待融合度达80%后,每孔pc-3和ec109细胞中分别加入1ml含有浓度为0μm、10μm、20μm、40μm、80μm的tdp-2-protac多肽的rpmi 1640培养基,置于培养箱中孵育24h。
17.处理24h后,将每孔不同浓度多肽处理的肿瘤细胞裂解并进行蛋白免疫印迹分析以检测内源性ddx24的变化水平。
18.westernbolt实验结果如图1和图2所示,由图1a、图2a实验结果可知,tdp-2-protac多肽在pc-3细胞中以20μm浓度以下干预24h,ddx24蛋白与阴性对照相比,变化不明显。而40μm浓度干预24h后,ddx24蛋白即开始下调,而到浓度为80μm干预24h后,ddx24蛋白明显减弱。结果表明,tdp-2-protac多肽可能以浓度依赖性方式诱导前列腺癌(pc-3)和食管癌(ec109)细胞中ddx24蛋白的降解。
19.具体实施方式2为了测试protac多肽的效果,发明人分别用该多肽在pc-3和ec109细胞中作用不同时间来检测效果。
20.具体实验方法如下:6孔板接种pc-3和ec109细胞24h,待融合度达70%后,每孔pc-3和ec109细胞中分别加入1ml含有浓度为40μm的tdp-2-protac多肽的rpmi 1640培养基,分别干预0h、8h、12h、24h、36h、48h。
21.将每孔多肽处理不同时间的肿瘤细胞裂解并进行蛋白免疫印迹分析以检测内源性ddx24的变化水平。
22.westernbolt实验结果如图1和图2所示,由图1b、图2b实验结果可知,tdp-2-protac多肽处理pc-3和ec109细胞12h后ddx24蛋白开始下调,处理24h后明显减弱,48h最弱。结果表明,tdp-2-protac多肽可能以时间依赖性方式诱导前列腺癌(pc-3)和食管癌(ec109)细胞中ddx24蛋白的降解。
23.具体实施方式3为了测试protac多肽的靶向性,发明人分别用tdp-2-protac(实验肽)和sdp-protac(乱序肽)处理pc-3细胞来检测效果。
24.具体实验方法如下:6孔板接种pc-3细胞24h,待融合度达80%后,每孔pc-3细胞中分别加入1ml含有浓度为40μm、80μm的实验肽和乱序肽的rpmi 1640培养基,不含多肽的pc-3细胞作为阴性对照。
25.处理24h后,将每孔细胞裂解并进行蛋白免疫印迹分析以检测内源性ddx24的变化水平。
26.westernbolt实验结果如图1所示,由图1c、1d实验结果可知,相对于阴性对照,40μm、80μm 实验肽处理pc-3细胞24h后ddx24蛋白均下调,而乱序肽处理24h后ddx24蛋白无明显下调。结果表明,tdp-2-protac多肽能靶向诱导活细胞中ddx24蛋白的降解。
27.具体实施方式3为了测试protac多肽对pc-3细胞中ddx24的降解情况,发明人采用细胞免疫荧光(if)实验来检测ddx24蛋白的定位及变化水平。
28.具体实验方法如下:将处于对数生长期的pc-3细胞悬液5
×
104个/孔接种于8孔腔式载玻片(154534,赛默飞),第二天每孔分别加入100ul浓度为40um含tdp-2、tdp-2-protac(实验肽)和sdp-protac(乱序肽)多肽的培养基,pbs作为阴性对照,37℃孵育24h,吸弃培养基,37℃pbs溶液浸洗细胞 2 次,每次5 min。
29.37℃4%多聚甲醛300μl,固定20min。0.1%bsa/saponin免疫染色通透液(beyotime, p0095-500ml)浸洗2次,300ul/孔,每次5 min。
30.3%bsa/pbs溶液封闭30min。每孔滴加200μl的ddx24抗体(proteintech,15769-1-ap,1:100稀释),4℃湿盒内孵育过夜。吸弃ddx24一抗,使用0.1%bsa/saponin免疫染色通透液浸洗2次,每次5 min。
31.每孔滴加200μl的alexa fluor 555荧光二抗(bioss,bs-0295g-af555,1:300稀释),室温避光孵育1小时。pbs溶液浸洗2次,每次5 min。撬片后,每孔滴加8ul vectashield荧光封片剂(h-1200-10),盖上盖玻片。通过激光共聚焦显微镜观察并采集图像。
32.if实验结果如图3所示,由图3可知,ddx24蛋白主要定位于核仁,其次为细胞质。无e3泛素连接酶配体(vhl配体)的
fitc
tdp-2(绿色)多肽位于细胞质和核仁区,与ddx24抗体(红色)染色共定位,说明它能靶向结合ddx24蛋白,但无法降解ddx24;而
fitc
tdp-2-protac(实验肽)处理pc-3细胞后,核仁区绿色荧光信号消失,ddx24抗体染色亦无核仁荧光信号,提示ddx24蛋白可能被降解;
fitc
sdp-protac(乱序肽)亦未见核仁荧光信号,但ddx24抗体染色可见清晰的核仁红色荧光,提示乱序肽无法靶向结合细胞核的ddx24蛋白并使其降解。这些结果与我们的设计和期望一致,证明了使用tdp-2-protac引发ddx24降解的可行性。
33.为了测试protac多肽对pc-3细胞增殖的影响,发明人分别用tdp-2-protac(实验肽)和sdp-protac(乱序肽)处理pc-3细胞来检测效果。
34.具体实验方法如下:将处于对数生长期的pc-3细胞悬液接种96孔板(100ul/孔,2500个/孔),待细胞融合度达70%时,分别加入100ul/孔两种浓度(40μm和80μm)的实验肽和乱序肽,每种多肽复孔4个,不含多肽的pc-3细胞作为阴性对照,在培养箱中孵育0~72h。
35.利用cck-8(cell counting kit-8,ck04,dojindo)试剂盒和酶标仪测量450nm处的吸光度。然后依据试剂盒说明书计算细胞存活率(%)=[(as-ab)/(ac-ab)]
×
100,其中as=实验孔吸光度(含细胞、培养基、cck-8和待测多肽的孔的吸光度),ab=空白孔吸光度(含有培养基和cck-8的孔的吸光度),ac=对照孔吸光度(含有细胞,培养基和cck-8的孔的吸光度)。
[0036]
细胞增殖抑制实验结果如图4所示,由图4a实验结果可知,40μm实验肽与pc-3孵育24h后能抑制pc-3细胞的增殖,72h抑制最强,而乱序肽抑制能力相对实验肽弱;同样由图4b实验结果可知,80μm实验肽与pc-3孵育24h后能显著抑制pc-3细胞的增殖,72h抑制最强,乱序肽抑制能力相对实验肽弱。结果表明,实验肽能靶向诱导活细胞中ddx24蛋白的降解,进而抑制细胞的增殖。
[0037]
具体实施方式4pc-3荷瘤鼠protac多肽抑制肿瘤生长实验本实施例使用5-6周龄的雄性balb/c nu裸鼠,随机分为四组,分别是pbs组,
fitc
tdp-2组,
fitc
tdp-2-protac(实验肽)组,
fitc
sdp-protac(乱序肽)组,每组5只。
[0038]
pc-3细胞株皮下接种:将对数生长期的pc-3细胞常规胰酶消化、计数,调整细胞数为3
×
107cell/ml,在每只裸鼠右后腿皮下注射0.1ml细胞悬液。种瘤第5天后均能触及可见的皮下瘤。
[0039]
如图5a所示,第6天开始四组分别每隔3日瘤内注射60μl pbs,
fitc
tdp-2、
fitc
tdp-2-protac和
fitc
sdp-protac,多肽注射剂量为6mg/kg,注射体积为60μl。隔3天观察裸鼠状态及肿瘤生长情况,使用数字游标卡尺测量每只荷瘤鼠皮下瘤的大小,依据公式计算肿瘤近似体积=长径
×
短径2/2。
[0040]
体内抗肿瘤活性结果如图5所示,发现实验肽对pc-3肿瘤的生长具有抑制作用。如图5b所示,肿瘤内注射实验肽的裸鼠 (6mg/kg),肿瘤生长被抑制,生长较缓慢,而注射pbs、
fitc
tdp-2和乱序肽组均对肿瘤生长抑制作用较弱;如图5c所示不同处理组荷瘤鼠处死前(第24天)典型照片(箭头所示为肿瘤),实验肽处理的肿瘤相对较小;如图5d所示,治疗期间荷瘤鼠体重比较无统计学差异;如图5e、5f所示,第24天安乐死全部裸鼠,切除肿瘤并称重,可见实验肽处理组的肿瘤比其他组小,肿瘤称重结果与解剖的肿瘤大小结果一致,差异具有统计学意义。单因素方差分析(one-way anova)多组比较:平均值
±
标准误,n=5 ,*p<0.05,**p<0.01,***p<0.001。以上结果表明,瘤内注射实验肽可以降解瘤内ddx24蛋白的水平并明显抑制动物体内pc-3人源前列腺癌细胞的生长。
[0041]
活体水平评估pc-3荷瘤鼠肿瘤增殖的代谢差异如图6所示,在实验结束前1天采用
18
f-fdg pet/ct显像,评估肿瘤葡萄糖代谢水平来量化其增殖差异。如图6a所示,tdp-2-protac处理后,肿瘤
18
f-fdg 的放射性摄取较其他组低;如图6b所示,其相应的第30分钟suv值为(1.29
ꢀ±ꢀ
0.45),低于pbs组(2.48
ꢀ±ꢀ
0.24)(p 《 0.001)、tdp-2组(2.18
ꢀ±ꢀ
0.42)(p 《 0.01)和sdp-protac组(2.13
ꢀ±ꢀ
0.36)(p 《 0.05)。此外肿瘤中葡萄糖的摄取速率常数ki(图6c)分析显示,tdp-2-protac组的ki值低于pbs组、tdp-2组和sdp-protac组。以上结果
提示tdp-2-protac治疗可抑制pc-3人源前列腺癌的葡萄糖摄取,从而抑制肿瘤增殖。
[0042]
尽管发明人已用具体实施例来详细描述与说明了本发明,然而应意识到,在不违背本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中,包括属于本发明范围内的所有这些变化和修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1